ФАРМАЦЕВТИЧЕСКАЯ МИКРОБИОЛОГИЯ - В. А. Галынкин - 2015
ЧАСТЬ II. АНТИМИКРОБНЫЕ АГЕНТЫ
ГЛАВА 13. ПРИНЦИПЫ МЕТОДОВ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ АНТИБИОТИКОВ И ДРУГИХ ХИМИОТЕРАПЕВТИЧЕСКИХ ВЕЩЕСТВ
Антимикробной активностью препарата называют его способность убивать или задерживать рост микроорганизма. В связи с этим различают бактерицидное и бактериостатическое действие вещества. В отношении противогрибковых препаратов говорят о фунгицидной и фунгистатической активности [28].
Активность антибиотиков и других антимикробных препаратов определяют:
а) в процессе производства (активность продуцента, контроль качества продукта);
б) при изучении фармакокинетики препарата у животных или человека;
в) при выборе препарата для химиотерапии и ее контроле.
При этом антибиотик может присутствовать в культуральной жидкости, находиться в виде химически чистого вещества, иметь различные лекарственные формы или содержаться в биологических жидкостях (кровь, моча и др.). В каждом случае необходим правильный выбор методов. Традиционно используют микробиологические методы определения активности, наряду с ними существуют ферментные, иммунологические и хроматографические методы с использованием автоматизированной аппаратуры и компьютерной техники.
Каждый метод предусматривает использование стандартного вещества для сравнения или построения калибровочной кривой. Точность метода может быть достигнута выполнением необходимого числа повторных определений и статистической обработкой их результатов.
13.1 Микробиологические методы
Для количественного выражения биологической активности введено понятие единицы действия (ЕД). За единицу действия антибиотика принимают минимальное количество вещества, которое задерживает рост стандартного штамма микроорганизма в строго определенных условиях. ЕД — это активность строго
определенного весового количества вещества, принятого за эталон. Для большинства антибиотиков 1 ЕД соответствует 1 мкг вещества. В 1 мг натриевой соли бензилпенициллина содержится 1670 ЕД, окситетрациклина — 925 ЕД, нистатина — не менее 4000 ЕД. В качестве тест-культуры обычно используют непатогенный или условно-патогенный микроорганизм, проявляющий наибольшую чувствительность к данному веществу. Для оценки спектра действия антибиотика применяют различные микроорганизмы, в том числе и патогенные. Эти штаммы хранят в определенных условиях и постоянно контролируют по их морфологофизиологическим свойствам.
В качестве питательной среды, пригодной для большинства тест-культур, используют мясопептонный бульон или мясопептонный агар. Для выращивания дрожжей и грибов в эти среды добавляют 1% глюкозы или используют среду Сабуро. При определении активности методом диффузии в агар используют голодный агар для базисного слоя. Его состав: агарагар — 1,5-2,0 г, фосфатный буфер с pH 6,8-7,0-100 мл.
13.2 Определение активности антибиотиков методом серийных разведений
Метод серийного титрования может быть выполнен в разных объемах среды (от 1 до 10 мл), в асептичных условиях при использовании стерильных пипеток для каждого ингредиента реакции. Титрование можно проводить в плотных и жидких средах. При титровании в жидких средах в ряд пробирок наливают питательную среду в строго определенном объеме. В первую пробирку вносят определенное количество раствора антибиотика, перемешивают, затем определенный объем смеси из первой пробирки переносят во вторую, перемешивают и переносят то же количество смеси из второй в третью, и т. д. Из последней пробирки, содержащей антибиотик, такой же объем смеси выливают прочь, чтобы во всех пробирках объем жидкости был одинаков. Пробирка, не содержащая антибиотика, является контрольной. После этого во все пробирки, содержащие серийно разведенный антибиотик, и в контрольную пробирку вносят одинаковое количество взвеси тест-культуры. Штатив с пробирками встряхивают и ставят в термостат при 37°С на 18-20 часов.
Взвесь тест-микроба готовят на изотоническом (0,85%) растворе хлорида натрия при обязательном сравнении со стандартами мутности. При титровании антибактериальных антибиотиков микробная нагрузка обычно составляет 2,5х105 микробных клеток на 1 мл раствора антибиотика в питательном бульоне. При использовании в качестве тест-культуры дрожжей микробная нагрузка составляет 4 х106 клеток в 1 мл.
Метод серийных разведений в плотных средах отличается тем преимуществом, что микробы-загрязнители здесь легко выявляются и по существу не изменяют общих результатов титрования, тогда как на жидких средах весь опыт может оказаться безрезультатным из-за попадания в пробирки хотя бы единичных клеток посторонних устойчивых микроорганизмов. Этот метод используют также при работе с микроорганизмами, которые не растут на обычных жидких средах, например, микобактерии туберкулеза, которые выращивают на среде, содержащей свернутую сыворотку. Вначале готовят ряд серийных разведений антибиотика, а затем вносят по 1 мл каждого разведения в пробирку, содержащую 4 мл расплавленной и охлажденной до 45-50° агаризованной среды. Затем пробирки скашивают до застывания агара, а на поверхность плотной среды петлей засевают взвесь тест-микроба.
Для выявления бактерицидного действия препарата делают высев на свежую питательную среду из всех пробирок, где визуально не отмечен рост микроорганизма. Для стойких антимикробных веществ, которые адсорбируются на микробных клетках и препятствуют их росту даже в свежей питательной среде, применяют соответствующие нейтрализаторы.
13.3 Определение активности антибиотиков методом диффузии в агар
Этот метод точнее, чем метод серийных разведений, поэтому его чаще используют на практике. Однако методу диффузии присущи определенные недостатки. Критерии для оценки данных, полученных с быстрорастущими микроорганизмами, не применимы к медленнорастущим штаммам. Поэтому если в качестве тест-культуры необходимо использовать медленнорастущий микроорганизм, применяют метод разведений или условия испытания отрабатывают в специальных экспериментах. То же можно сказать и о медленнодиффундирующих антибиотиках.
В чашки Петри разливают питательный агар, смешанный с тест-культурой. Количество последней берут из расчета 20 млн. клеток на 1 мл среды. После застывания агара на его поверхность наносят цилиндры, в которые вносят по 0,1 мл испытуемого раствора антибиотика параллельно со стандартным раствором. Вместо цилиндров можно использовать лунки, которые делают в агаре с помощью специального приспособления. После этого чашки помещают в термостат при 37°С на 16-18 часов. По истечении этого времени измеряют размеры зон задержки роста тест-микроба.
Расчет активности антибиотика по размеру зон задержки может быть произведен на основании расчетных таблиц В. С. Дмитриевой (ГФ) или по стандартным кривым.
Определение чувствительности микробов к антибиотикам методом дисков проводят прежде всего для оценки эффективности антибиотиков в клинических условиях. Клинический материал или микробную культуру, выделенную от больного, засевают на поверхность питательного агара сплошным газоном, накладывают бумажные диски, пропитанные раствором антибиотика (используют коммерческие образцы, содержащие определенные концентрации). После инкубации при 37°С в течение времени, необходимого для роста выделенного возбудителя, определяют диаметр зоны торможения роста. Полученные величины сравнивают с размерами зон задержки роста, указанными в инструкциях, прилагаемых к дискам, после чего выделенные микроорганизмы относят к чувствительным, умеренно чувствительным или резистентным. Прежде чем предложить к реализации любой антимикробный препарат, производитель обязан определить спектр его активности по отношению к тысячам штаммов различных микроорганизмов, учитывая, что фармакокинетические свойства соединения должны поддерживать концентрации в сыворотке, в 2-4 раза превышающие минимальную ингибирующую концентрацию. При выделении конкретных возбудителей используют определенные наборы дисков (табл. 25).
Таблица 25. Наборы дисков для определения чувствительности некоторых микроорганизмов
Бактерии |
Диски с XTB |
Enterobacteriaceae и Acinetobacter spp. |
Амикацин, ампициллин, цефазолин, цефалотоксин, цефотаксим, гентамицин, тобрамицин, триметоприм- сульфаметоксазол, норфлоксацин |
Pseudomonas spp. иAcinetobacter spp. |
Амикацин, цефтазидим, гентамицин, мезлоциллин, тобрамицин, триметоприм- сульфаметоксазол, норфлоксацин |
Staphylococcus spp. |
Ампициллин, цефалотин, клиндамицин, эритромицин, гентамицин, оксациллин, бензилпенициллин, ванкомицин, триметоприм-сульфаметоксазол, норфлоксацин |
Enterococcus spp. |
Бензилпенициллин, ампициллин, ванкомицин, стрептомицин и гентамицин (синергидность действия), норфлоксацин |
Streptococcus spp. |
Бензилпенициллин, цефалотин, левомицетин, эритромицин, ванкомицин, норфлоксацин |
Haemophilus spp. |
Ампициллин, цефотаксим, цефуроксим, левомицетин, триметоприм-сульфаметоксазол |
13.4 Ферментные методы
13.4.1 Ускоренный метод определения чувствительности микроорганизма к антибиотику
В чашку Петри наливают 15 мл питательного агара. После застывания агара на него наносят смесь 4 мл такого же агара, 1 мл взвеси тест-культуры, приготовленной по стандарту 1 млрд. клеток в 1 мл, и 1 мл 0,2% водного раствора 2,6-дихлорфенолиндофенола (pH 7,2-7,3). Вместо тест-культуры можно использовать клинический материал. Затем на застывший агар ярко синего цвета наносят диски, пропитанные антибиотиками, и чашки ставят в термостат при 37°С. Через 2-4 часа учитывают результаты по диаметру синих зон отсутствия роста. Резистентные к антибиотику микробы восстанавливают краситель, обесцвечивая его или трансформируя в желтый цвет.
Данный краситель задерживает рост стафилококков, поэтому при работе с этим микроорганизмом раствор индикатора наливают на поверхность чашки в количестве 2-3 мл уже после выдерживания чашки с дисками в термостате. Избыток индикатора сливают через 5-7 мин. и учитывают результаты.
13.4.2 Определение способности микроорганизмов продуцировать β-лактамазу
Устойчивость микроорганизмов к пенициллину может быть связана с их способностью продуцировать фермент в лактамазу, инактивирующий этот антибиотик.
В чашку Петри вносят 0,5 мл суточной бульонной культуры стандартного штамма Staphyloccus aureus, чувствительного к пенициллину, и 20 мл расплавленного и охлажденного до 45°Cпитательного агара. Быстро перемешивают и оставляют до застывания агара. После этого в центр чашки на поверхность среды помещают бумажный диск, содержащий пенициллин. По радиусам к диску петлей подсевают исследуемые культуры. Посевы инкубируют при 37°C 24 часа. О способности бактерий продуцировать β-лактамазу судят по наличию роста стандартного штамма стафилококка вокруг исследуемой культуры.
13.4.3 Определение способности микроорганизмов продуцировать β-лактамазу
Тест на уреазу
Аминогликозидные антибиотики, являясь ингибиторами синтеза белка, угнетают образование уреазы Proteus mirabilis, используемого в качестве тест-организма. Питательную среду, содержащую мочевину, вносят в два ряда пробирок. В один ряд добавляют стандартный раствор испытуемого антибиотика в определенных концентрациях, в другой ряд — испытуемый раствор. Пробирки засевают Р. mirabilis и через 60-75 мин. инкубации измеряют pH с помощью потенциометра. Значения pH в пробирках, содержащих стандартный раствор, используют для построения стандартной кривой, которая служит для определения количества антибиотика в испытуемом растворе.
Тест на люциферазу
Метод основан на способности аминогликозидных антибиотиков угнетать образование АТФ микробными клетками. Люминесцентный метод определения АТФ в присутствии люциферазы отличается высокой чувствительностью. Бактериальную культуру вносят в пробирки, содержащие стандартный или испытуемый раствор антибиотика, инкубируют 90 мин., после чего определяют количество АТФ в специальном приборе люминометре.
13.4.4 Хроматографические методы
Высокоэффективная жидкостная хроматография (ВЭЖХ). Испытуемый раствор пропускают через хроматографическую колонку, заполненную носителем, представляющим собой мелкодисперсный гидрофобизированный сорбент. Гидрофобное покрытие носителя варьируется в зависимости от молекулярной массы разделяемой смеси.
При нанесении микроколичества испытуемого раствора амфифильные вещества сорбируются на поверхности частиц носителя и вытесняются с нее в градиенте апротонного растворителя (система вода — ацетонитрил). Вещества разделяются в соответствии со своим сродством к сорбенту (гидрофобностью).
Эффективность анализа определяется микронными размерами частиц носителя, так что время анализа не превышает 5-10 мин.
Раствор на выходе из колонки анализируется в проточном УФ-детекторе с одновременной записью. Положение пика выходящего вещества является его калибровочной характеристикой. Количество вещества в нанесенной пробе определяется автоматическим интегратором.
Преимуществами метода является высокая скорость определения, точность, специфичность и чувствительность.
Количественное определение тетрациклина методом ВЭЖХ
Готовят растворы испытуемого образца и стандартного препарата тетрациклина и хроматографируют их попеременно на жидкостном хроматографе с УФ-детектором, получая не менее 5 хроматограмм каждого раствора в строго определенном режиме температуры и скорости подвижной фазы. Количество тетрациклина в пробе вычисляют по формуле:
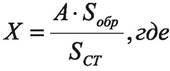
X — количество тетрациклина в испытуемом образце, в граммах;
Sобр — среднее значение площадей пиков тетрациклина, вычисленное из хроматограмм раствора испытуемого препарата;
SСТ — среднее значение площадей пиков тетрациклина, вычисленное из хроматограмм стандартного образца;
А — содержание тетрациклина в стандартном образце, в граммах.
13.4.5 Спектрофотометрические методы
Количественное определение ампициллина спектрофотометрическим методом основано на том, что ампициллин при нагревании в растворе СuSO4 образует окрашенный комплекс. Точную навеску образца антибиотика растворяют в буферном растворе сульфата меди и выдерживают на водяной бане при 80°С 30 мин., затем быстро охлаждают. Оптическую плотность раствора измеряют на спектрофотометре при длине волны 320 нм, используя в качестве раствора сравнения непрогретый буферный раствор препарата.
Параллельно измеряют оптическую плотность раствора стандартного образца ампициллина, обработанного таким же образом, как испытуемый препарат.
Содержание ампициллина в препарате в процентах (X) рассчитывают по формуле:
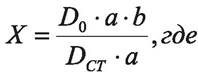
D0 — величина оптической плотности испытуемого раствора препарата;
DСТ — величина оптической плотности раствора стандартного образца;
а — навеска стандартного образца ампициллина, в граммах;
b — содержание ампициллина в стандартном образце, в процентах.
13.4.6 Иммунологические методы
Иммунологические методы основаны на использовании специфических антител, поэтому требуют длительной предварительной подготовки (получения антител путем иммунизации животных определенным антибиотиком). Вторым компонентом реакции является меченый препарат, аналогичный определяемому. Метка может быть радиоактивной, флуоресцирующей или ферментной, определяющей способ регистрации результатов анализа. Результат зависит от конкурентного связывания с антителами испытуемого препарата и меченого аналога: чем больше количество испытуемого препарата присутствует в смеси, тем меньшее количество меченого аналога будет связано с антителами. Антитела фиксируют в лунках планшета, куда последовательно вносят испытуемый раствор и тест-систему (меченый аналог и необходимый реагент-детектор). Достоинством иммунологических методов является их высокая специфичность и чувствительность.