ФАРМАЦЕВТИЧЕСКАЯ МИКРОБИОЛОГИЯ - В. А. Галынкин - 2015
ЧАСТЬ II. АНТИМИКРОБНЫЕ АГЕНТЫ
ГЛАВА 17. МЕТОДЫ ДЕЗИНФЕКЦИИ И ОЦЕНКА ЭФФЕКТИВНОСТИ ДЕЗИНФЕКТАНТОВ, АНТИСЕПТИКОВ И КОНСЕРВАНТОВ
17.1 Методы дезинфекции
Наши знания о свойствах возбудителей, способах их выведения из организма хозяина, участии тех или иных факторов в передаче заразного начала определяют и выбор метода дезинфекции — физический, химический или биологический (рис. 77) [28].
Рис. 77. Классификация методов и способов дезинфекции
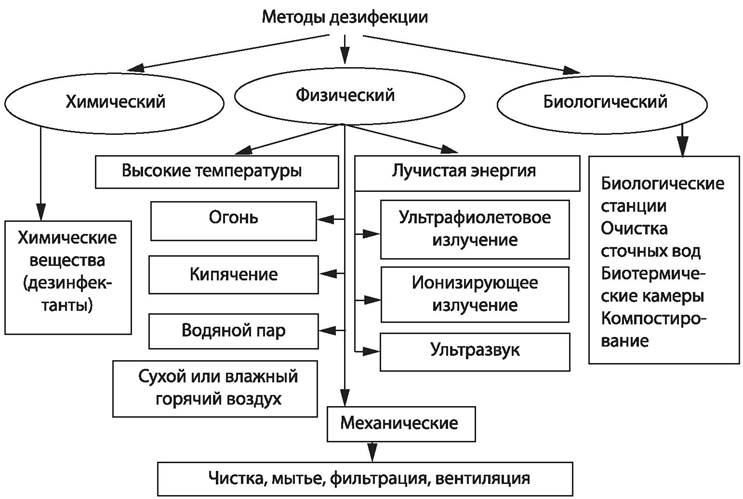
Физический метод предполагает использование таких дезинфекционных агентов, как механические, тепловые, лучистая энергия, радиоактивное излучение.
При механических способах дезинфекции обеспечивается, в основном, удаление, а не уничтожение микроорганизмов. К ним относятся: вытряхивание, выколачивание, чистка, мытье, фильтрация, вентиляция. Наиболее хороший эффект достигается при использовании пылесосов. Фильтрация, в частности, является одной из составных частей очистки водопроводной воды. Другой пример фильтрации — респиратор, который весьма эффективно защищает человека от микроорганизмов, находящихся в воздухе. Так, повязка из двух слоев марли задерживает до 74% микроорганизмов, из четырех — до 88%, а из шести — до 97%. К резкому снижению концентрации микрофлоры в воздухе приводит вентиляция. В то же время проветривание помещений через форточки, фрамуги, окна не может рассматриваться как надежное дезинфекционное мероприятие, так как скорость воздухообмена зависит от многих параметров, трудно поддающихся учету и регулированию (разница между температурой воздуха снаружи и в помещении, скорость движения атмосферного воздуха, величина и месторасположение окон и т. д.). В этой связи вентиляция (проветривание) помещений рассматривается как подсобная мера и используется в практике при условии достаточной продолжительности (не менее 30-60 мин).
Температурное воздействие. Гибель микроорганизмов под воздействием высоких температур связана с коагуляцией белка. Источниками тепла, которые могут применяться в качестве дезинфекционных агентов, являются огонь, вода, сухой или влажный горячий воздух, водяной пар.
Огонь как термический агент используется для уничтожения зараженных предметов, а также для их прокаливания. Сжиганию подвергаются малоценные предметы. В ряде случаев (при особо опасных инфекциях) сжиганию подвергаются трупы животных. Прокаливание в пламени предметов является обычным способом обеззараживания в лабораторной практике.
Пастеризация используется для уничтожения вегетативных форм микроорганизмов в различных пищевых продуктах путем прогревания до температуры 70-80°С в течение 30 мин.
С целью дезинфекции в качестве термического воздействия используется горячая вода, которая довольно быстро денатурирует белок микроорганизмов. При этом вегетативные формы возбудителей погибают уже при температуре воды +60°С. Ввиду качественных различий белков отдельных микроорганизмов сроки гибели для отдельных видов возбудителей при этой температуре колеблются в пределах 10-45 мин. С повышением температуры воды они, естественно, сокращаются, а при температуре 100°С все вегетативные формы микроорганизмов погибают моментально или через 1-2 мин.
Особое внимание следует обратить на дезинфекцию белья данным методом. Прогревание его водой не может происходить быстро в связи с затрудненным перемещением частиц воды внутри вещей. Прогревание в глубине идет за счет теплопроводности ткани белья. При плохой теплопроводности и высокой теплоемкости, которыми характеризуются ткани, процесс теплопередачи совершается очень медленно. Практически для обеспечения сплошного прогревания белья до температуры кипения белье следует кипятить не менее 30-90 мин. в зависимости от его количества и теплопроводности и теплоемкости тканей. Для ускорения прогревания белья оно должно перемешиваться, что успешно осуществляется в современных стиральных машинах. Дезинфекция белья кипячением является наиболее простым, эффективным и щадящим способом.
Сухой воздух, как и вода, нагревается путем конвекции, однако, в отличие от воды, его теплопроводность в 25 раз ниже. Каждая частица сухого воздуха несет в себе тепла в 4 раза меньше, чем вода. Поэтому прогревание предмета сухим горячим воздухом будет происходить очень медленно. При дезинфекции одежды, имеющей низкую теплопроводность и высокую теплоемкость, для достижения дезинфицирующего эффекта при применении сухого горячего воздуха требуется высокая температура (не менее 140°С) и длительный период времени. При этих условиях одежда может обугливаться. Сухой горячий воздух применяется для стерилизации медицинского инструментария, в микробиологической практике. Под воздействием горячего воздуха выше 100°С протоплазма микробной клетки обезвоживается и свертывается, что приводит к ее гибели. Свойства горячего воздуха используются в воздушных стерилизаторах для стерилизации ИМН и в воздушных камерах для дезинфекции вещей, а также при проглаживании разных тканей. Температура утюга, в зависимости от режима нагрева, достигает 200-300°С. Однако горячий воздух по эффективности уступает водяному пару, поскольку в основном оказывает поверхностное действие.
Влажный горячий воздух по сравнению с сухим обладает во много раз большей бактерицидностью. Это связано с действием тепла во влажной среде, а также с тем, что влажный горячий воздух несет в себе большой запас тепла за счет водяного пара, выделяющего скрытую теплоту парообразования при конденсации в вещах. В связи с этим влажный горячий воздух прогревает вещи быстрее и глубже, чем сухой.
Водяной пар — это газообразное состояние воды. Водяной пар с температурой 100°С и выше является одним из лучших обеззараживающих средств по надежности действия, поскольку имеет свойство проникать в глубь обеззараживаемых объектов. Степень обеззараживающего действия водяного пара зависит от его температуры, давления и степени насыщенности. Под воздействием водяного пара белки микробной клетки набухают и свертываются, в результате чего она гибнет. Свойства водяного пара используются в дезинфекционных камерах и паровых стерилизаторах. Испарение, переход воды из жидкого состояния в газообразное, происходит при любой температуре, но только на поверхности воды. При кипении переход воды в пар происходит во всем ее объеме. Для дезинфекции используется водяной пар, образующийся при кипении. Применение водяного пара в дезинфекционной практике основано на том, что он при превращении в воду выделяет большую скрытую теплоту парообразования. Пар чаще всего применяется при камерной дезинфекции. Камерное обеззараживание вещей как обязательное противоэпидемическое мероприятие предусматривается при ряде инфекционных болезней (туберкулез, чума, сибирская язва, холера, сыпной тиф, брюшной тиф и др.). Камерному обеззараживанию подвергают те вещи, которые по тем или иным причинам не могут быть обеззаражены кипячением, замачиванием в химических растворах различных дезинфектантов или другим путем (верхняя одежда, постельные принадлежности (матрас, подушка, одеяло) и другие объемные мягкие вещи).
Для обеззараживания вещей, взятых из квартиры больного для заключительной дезинфекции, и для санитарной обработки людей, контактировавших с больными, санитарно-эпидемиологическая служба располагает санитарными пропускниками, которые оснащены различными дезинфекционными камерами. При санитарной обработке людей их вещи также подлежат камерному обеззараживанию. Дезинфекционные камеры устанавливают в инфекционных и других ЛПУ. В них по мере необходимости, а также в целях профилактики подвергают дезинфекции верхнюю одежду, постельные принадлежности.
17.1.1 Паровой способ
Паровой способ обеззараживания и паровые камеры получили широкое распространение и постепенно вытеснили горячевоздушные камеры, которые используются теперь весьма ограниченно. Недостатком этого способа является практическая трудность использования паровоздушной смеси для обеззараживания меховых и кожаных изделий, так как температура, превышающая 80°С, и относительная влажность 80% и более приводят к порче кожи и меха. В настоящее время найдены более благоприятные сочетания температуры и относительной влажности, позволяющие без применения формалина обеспечить надежную дезинфекцию меховых и кожаных вещей. К отрицательным факторам паровоздушной смеси следует отнести также определенное увлажнение вещей, обеззараживаемых в камере. Однако данные недостатки по сравнению с теми положительными сторонами, которыми этот физический дезинфекционный агент обладает (простота эксплуатации дезинфекционных камер, экономичность, несложные мероприятия по технике безопасности, отсутствие токсикологических факторов и т. д.), незначительны.
Кожаные и меховые изделия, промышленное сырье (шерсть, щетина), любые носильные вещи, постельные принадлежности и другой мягкий инвентарь можно дезинфицировать в пароформалиновых камерах. Действующим агентом при дезинфекции пароформалиновым способом является паровоздушная смесь в сочетании с формальдегидом при температуре от 40° до 59°С. Использование формальдегида в сочетании с паром позволяет осуществлять дезинфекцию при более низких температурах, которые дают возможность обеззараживать без порчи кожаные, меховые и резиновые изделия. При пароформалиновой камерной дезинфекции на поры тканей оказывают дезинфицирующее воздействие пары формальдегида.
17.1.2 Ультрафиолетовое излучение
Бактерицидное действие солнечной энергии связано с ультрафиолетовыми лучами солнечного спектра. Наибольшей бактерицидностью обладают ультрафиолетовые лучи, имеющие длину волны в пределах 2500-2600 ангстремов. Бактерицидный эффект, скорее всего, связан с прямым фотохимическим действием ультрафиолетовых лучей на протоплазму клеток микроорганизмов. Бактерицидное действие зависит от длины волны, количества лучей, времени облучения, биологических особенностей микроорганизма и качественной характеристики среды, в которой находятся микроорганизмы. Опыты показывают, что после облучения воздуха ультрафиолетовыми лучами в течение более 30 мин. количество микрофлоры резко снижается.
Ультрафиолетовое излучение — это электромагнитные волны, длины которых находятся в интервале от 205 до 315 нм. Наибольшей бактерицидной активностью обладает излучение при длине волны 265 нм, вызывающее в большей степени фотохимические повреждения ДНК микробной клетки.
Результат воздействия ультрафиолетового излучения на микроорганизм зависит от видовой принадлежности последнего и от энергии излучения, поглощенной клеткой, т. е. от дозы облучения. Отношение энергии излучения к площади облучаемой поверхности обозначается как поверхностная бактерицидная доза (Hs); отношение энергии излучения к объему облучаемой среды обозначается как объемная бактерицидная доза (Нv).
17.1.3 Ионизирующее излучение
В отдельных случаях применяется ионизирующее излучение.
В мировой практике для ПСО ИМН широко используется ультразвук. Под воздействием ультразвука акустические потоки в замкнутом объеме образуют огромное число микропотоков раствора, которые обеспечивают многократное гидромеханическое воздействие на микроучастки обрабатываемой поверхности, проникая в труднодоступные места.
Эффект кавитации — непрерывного появления и захлопывания пузырьков в сочетании с термоударом — вызывает разрушение загрязнения на поверхности.
Полезным физическим явлением при ультразвуковой обработке поверхностей является дегазация, т. е. уменьшение в растворе содержания газа в растворенном состоянии и в виде пузырьков. При большой концентрации газовые пузырьки снижают качество обработки, так как мешают доступу раствора к участкам обрабатываемых поверхностей.
17.1.4 Биологический метод
Биологический метод находит применение на небольшой группе объектов. Примерами такой дезинфекции являются: фильтрация воды на водопроводных станциях (биологическая пленка, образующаяся на поверхности фильтра), обезвреживание сточных фекальных вод (биологические станции очистки сточных вод) и биотермический способ обезвреживания твердых органических отбросов (компостирование, биотермические камеры).
17.1.5 Химический метод
Чаще других для целей дезинфекции применяется химический метод, т. е. используются химические вещества — дезинфектанты.
Они должны обладать широким спектром действия; иметь микробоцидный эффект; хорошо растворяться в воде или образовывать с ней или воздухом стойкие активные суспензии, эмульсии, аэрозоли, туманы; обладать низкой токсичностью и низкой аллергенностью; сохранять активность в обеззараживаемой среде; не повреждать обрабатываемые объекты. Сырье, из которого изготовляют дезинфектанты, должно быть доступным, а сам дезинфектант — недорогим.
Более 35% химических средств дезинфекции относятся к группе ПАВ. Обладая рядом ценных качеств (малая токсикологическая и эколого-гигиеническая опасность, наличие моющих свойств, достаточная бактерицидная эффективность в отношении широкого спектра грамположительных и грамотрицательных бактерий и др.), такие ДС характеризуются недостаточной вирулицидной активностью, что ограничивает сферу их применения в современных условиях эпидемиологического неблагополучия по туберкулезу, гепатитам и т. п., а также существующей угрозы биотерроризма. Последнее обстоятельство представляется особенно важным в связи с применением споровых форм микробов (сибирская язва) в террористических целях.
17.2 Динамика дезинфекции
Процесс гибели микробных клеток, помещенных в среду с антимикробным агентом, может быть изображен графически (рис. 78).
Рис. 78. Динамика гибели микробных клеток в среде с дезинфектантом.
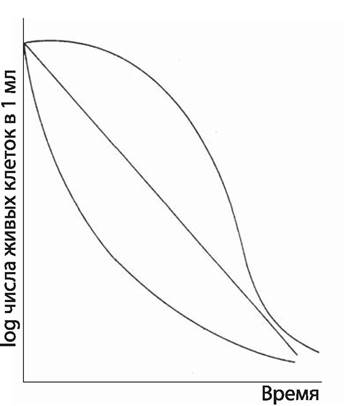
При этом возможна ситуация, когда процесс гибели будет подчиняться законам кинетики первого порядка (А) и эффективность дезинфекции можно оценить, используя константу:
![]()
где К — константа скорости гибели клеток; No — начальное число живых клеток; N — число живых клеток в момент времени 1.
Однако чаще наблюдаются случаи, когда график представляет сигмоидную кривую (В), отражающую гибель наименее устойчивой части популяции в начальный период, гибель основной части популяции, обладающей средним уровнем резистентности, в средний период и сохранение наиболее устойчивых клеток в конечной стадии эксперимента.
При высокой концентрации дезинфектанта происходит быстрая гибель основной части популяции в начальный период времени (С).
Генетическая неоднородность бактериальной популяции не позволяет использовать законы кинетики первого порядка для оценки эффективности дезинфектантов, однако методы, основанные на определении количества живых клеток или времени гибели популяции, дают вполне адекватные результаты. При этом необходимо учитывать влияние факторов внешней среды (температуры, pH, состава среды), а также микробную нагрузку (количество микробных клеток в определенном объеме).
17.3 Методы испытания антимикробной активности антисептиков и дезинфектантов
При испытании жидких форм определяют микробоцидную концентрацию антисептика при заданной экспозиции, спектр антимикробного действия и эффективность антисептика в приближенных к практике условиях [28]. Испытания проводят на стандартных тест-культурах следующих видов: Staphylococcus aureus, Escherichia coli, Enterococcus faecium, Pseudomonas aeruginosa, Proteus mirabilis, Candida albicans, Trichophyton mentagrophytes и Mycobacterium terrae.
M. terrae культивируют на среде Левенштейна — Иенсена, другие бактерии и грибы — на средах, рекомендованных для определения чувствительности к антибиотикам и исследования микробной контаминации лекарственных препаратов. Плотность микробной взвеси должна составлять 108 -1011 КОЕ/мл (КОЕ — колониеобразующая единица). Взвесь готовят на 0,5%-ном растворе натрия хлорида с нейтральным pH. Для опытов с белковой нагрузкой в суспензию добавляют 20% сыворотки крови или 0,2% альбумина.
Экспозицию устанавливают от 30 с до 5 мин. Для установления действующей в этот срок концентрации готовят растворы с содержанием антисептика 100, 75, 50, 25, 12%.
Параллельно проводят контрольный эксперимент по определению чувствительности тест-культуры к фенолу в концентрации 1, 0,5, 0,25, 0,125, 0,06%. В раствор антисептика вносят взвесь тест-культуры (на 1 мл раствора 0,1 мл взвеси.) По истечении экспозиции антисептик нейтрализуют и смесь высевают на стандартную для данного штамма среду. В качестве нейтрализатора используют вещество, инактивирующее определенный класс соединений или все классы антисептических препаратов. К последнему типу относится смесь, содержащая 3% твина-80 и по 0,1% сапонина, цистеина и гистидина.
При допуске новых препаратов в медицинскую практику ставят:
а) качественный суспензионный тест;
б) количественный суспензионный тест;
в) тест, приближенный к практике использования антисептика.
Качественный суспензионный тест ставят по описанному выше методу. Тест-культуры: St. aureus, Е. coli, Р. mirabilis, Р. aeruginosa, С. albicans. Плотность микробной суспензии должна соответствовать 108-109 КОЕ/мл. Срок инкубации культур после высева: для бактерий 48 час. при 37°C, для С. albicans — 72 час. при 20-25°C.
Для гигиенической антисептики препарат считается пригодным, если он угнетает рост всех тест штаммов при экспозиции 0,5-1 мин в допустимой по переносимости концентрации. Препарат, предназначенный для хирургической антисептики рук, должен угнетать рост всех тест-культур при экспозиции 3-5 мин.
Количественный суспензионный тест.
Тест-культуры — St. aureus, Е. coli; плотность взвеси 1-1,5 x 10»’ КОЕ/мл. Для каждой культуры готовят два ряда разведений антисептика: без белковой защиты и с добавлением 0,2% альбумина. Экспозиция препарата и культуры 0,5, 1 и 5 мин. Далее смесь нейтрализуют и высевают на питательный агар.
Активность препарата оценивают по степени снижения величины КОЕ/мл по сравнению с контролем (микробная взвесь без антисептика). Препараты для гигиенической антисептики должны снижать КОЕ/мл в рекомендуемой для применения концентрации при экспозиции 0,5-1 мин. не менее, чем в 105 раз, препараты для хирургической антисептики должны обеспечить такую же степень снижения КОЕ/мл за 3-5 мин.
Тест с условиями, приближенными к практическому применению, ставят на людях-добровольцах. На кожу кисти рук наносят взвесь Е. coli (1 x 1011 КОЕ/ мл), подсушивают 3 мин. на воздухе и протирают руки испытуемым раствором антисептика: для гигиенической антисептики 1 мин., используя 3 мл препарата, для хирургической — 5 мин. 2-3 раза, используя по 5 мл препарата. Далее делают смыв с рук жидкой питательной средой. В контроле
а) делают смыв, с контаминированных рук без обработки антисептиком,
б) руки обрабатывают 3 мл стандартного антисептика (изопропанола) дважды по 30 с, после чего делают смыв.
Разведения смывов (101, 10-2, 10-3) засевают на питательный агар и инкубируют при 37°С 48 час. Оценку эффективности испытуемого препарата проводят путем сравнения степени снижения количества тест-микроорганизма после обработки рук испытуемым и стандартным антисептиками.
Определение антимикробной активности антисептиков в мягких и твердых формах проводят на плотной питательной среде, засеянной тест-культурой. Образцы размещают на поверхности среды или в лунках, подобно тому, как это делают при испытании антибиотиков чашечным методом. Об активности препарата судят по диаметру зоны задержки роста вокруг образца в сравнении со стандартным препаратом.
Испытуемый препарат можно растворить или эмульгировать в жидкой среде (например, в буферном растворе с соответствующим эмульгатором) и определить его активность методами, описанными выше для жидких форм.
17.4 Определение эффективности консервантов лекарственных средств
Консерванты вводят в состав как стерильных, так и нестерильных лекарственных средств (табл. 32) для предотвращения роста микроорганизмов, попадающих в них во время технологического процесса, или при неоднократном употреблении [28]. Они не должны использоваться, чтобы замаскировать низкое качество производства. Учитывая возможность побочного действия, консерванты следует применять только при строгой необходимости. Требования к консервантам:
✵ широкий спектр антимикробной активности;
✵ быстрота биоцидного действия;
✵ отсутствие взаимодействия с компонентами лекарственного средства;
✵ стабильность;
✵ отсутствие раздражающего или токсического действия биоцида или продуктов его распада.
Однако немногие вещества отвечают этим идеальным требованиям. При использовании консерванта следует учитывать ряд факторов, влияющих на эффективность его действия: микробная нагрузка, температура, рН, состав лекарственного средства.
В мультифазной системе консервант распределяется неравномерно в соответствии с его гидрофильной или гидрофобной природой. Консервант может адсорбироваться на материале первичной упаковки, что снижает его активность. Концентрация летучих веществ (хлороформа) может снижаться при повторном открывании контейнера.
Все лекарственные препараты, в состав которых входят консерванты, разделяются на категории, представленные в таблице 33.
Таблица 33. Категории лекарственных препаратов, в состав которых входят консерванты
Категория |
Лекарственные препараты |
|
ГФ XII, ч. 1, ОФС 42-0069-07 USP 33 |
Европейская фармакопея 7.0 |
|
1 |
Инъекционные и другие парентеральные лекарственные препараты, включая эмульсии. Лекарственные препараты для введения в полость уха, носа (стерильные), офтальмологические средства, водорастворимые или приготовленные на водной основе |
Парентеральные, офтальмологические, внутриматочные и интрамаммарные лекарственные препараты |
2 |
Лекарственные препараты, применяемые местно, нестерильные лекарственные препараты для введения в полость носа, эмульсии, в том числе и на слизистые |
Лекарственные препараты для введения в полость уха, носа, лекарственные препараты, используемые в виде кожных аппликаций и для ингаляций |
3 |
Лекарственные препараты для приема внутрь, за исключением антацидов, водорастворимые или приготовленные на водной основе |
Лекарственные препараты для приема внутрь, ректального введения, для нанесения на слизистую оболочку рта |
4 |
Антацидные лекарственные препараты, приготовленные на водной основе |
- |
Таблица 34. Условия культивирования тест-микроорганизмов для приготовления инокулята
Тест-штамм |
Питательная среда* |
Температура инкубации |
Время инкубации |
Escherichia coli АТСС 8739 или АТСС 25922 Pseudomonas аeruginosa АТСС 9027 Staphylococcus aureus АТСС 6538 |
Соево-казеиновый агар или среда № 1 Соево-казеиновый бульон или среда № 8 |
(32,5 ± 2,5)°C |
18-24 ч |
Candida albicans АТСС 10231 (или NCTC 885-653) |
Агар Сабуро с глюкозой или среда № 2, жидкая среда Сабуро или соево-казеиновый бульон |
(22,5 ± 2,5)°C |
48 ч |
Aspergillus brasiliensis АТСС 16404 (или АТСС 9642) |
Агар Сабуро с глюкозой или среда № 2 |
(22,5 ± 2,5)°C |
6-10 сут |
* — допускается использование альтернативных жидких и агаризованных питательных сред отечественного и зарубежного производства.
Определение эффективности антимикробных консервантов в настоящее время выполняют в соответствии с ОФС 42-0069-07 «Определение эффективности антимикробных консервантов лекарственных средств» ГФ XII изд., ч. 1, с. 216-219.
Эффективность консервантов определяют в отношении определенных видов бактерий и грибов. В качестве тест-микроорганизмов используют виды бактерий и грибов, которые являются наиболее частыми контаминантами ЛС:
Escherichia coli АТСС 8739 (или АТСС 25922),
Pseudomonas aeruginosa АТСС 9027,
Staphylococcus aureus АТСС 6538,
Candida albicans АТСС 10231 (или NCTC 885653),
Aspergillus brasiliensis АТСС 16404 (или АТСС 9642).
Помимо перечисленных тест-штаммов можно использовать и другие микроорганизмы, которые должны быть типичными по культурально-морфологическим, тинкториальным и биохимическим свойствам. Набор тест-штаммов микроорганизмов может быть уменьшен или увеличен в зависимости от способа применения или состава испытуемого ЛП. Все тест-штаммы микроорганизмов, полученные из Государственных коллекций с сертификатом производителя в ампулах, на дисках или в другом виде следует восстанавливать способами, описанными в прилагаемых к тест-штаммам инструкциях или в соответствии с ГФ XII изд. ОФС «Микробиологическая чистота». Условия культивирования тест-штаммов для приготовления инокулята представлены в таблице 34.
Контроль ростовых свойств используемых питательных сред проводят в соответствии с ГФ XII изд. ОФС «Микробиологическая чистота».
При приготовлении инокулята суточные культуры тест-штаммов бактерий и C. albicans смывают с поверхности скошенного агара стерильным 0,9% раствором натрия хлорида. Концентрацию клеток бактерий доводят до 109 КОЕ/мл, а C. albicans — до 10 7 КОЕ/мл, используя стандартный образец мутности или инструментальные методы, в том числе турбодиметрический.
Для смыва конидий A. brasiliensis используют стерильный 0,9% раствор натрия хлорида, содержащий 0,05% твина-80. Количество конидий A. brasiliensis в 1 мл смыва определяют с помощью камеры Горяева или чашечным агаровым методом. Полученную взвесь разводят до концентрации 107 конидий в 1 мл.
Стандартизованные суспензии всех тестштаммов микроорганизмов разводят до концентрации 10-10 8 КОЕ/мл, а для препаратов 4 категории — 105-10 6 КОЕ/мл.
Для определения эффективности консервантов используют готовые ЛП в неповрежденной упаковке.
В 5 стерильных флаконов помещают достаточное количество испытуемого препарата. В каждый флакон вносят по 0,1 мл (но не менее 0,5% от объема исследуемого препарата) одного из приготовленных инокулятов тест-штаммов (Е. coli, Р. aeruginosa, S. aureus, C. albicans, A. brasiliensis) для получения концентрации 105-10 6 КОЕ в 1 мл или 1 г испытуемого образца и перемешивают.
Образцы лекарственных препаратов на твердой мазевой основе нагревают до температуры (47,5±2,5)°С. Смешивают инокулят каждой стандартизованной микробной суспензии с образцом препарата в течение не менее 1 минуты до достижения гомогенной эмульсии. Для улучшения смешивания можно добавить определенное (валидированное) количество стерильного поверхностно-активного вещества, например, твина-80, если оно не влияет на жизнеспособность микроорганизмов или на эффективность консерванта.
Фактическую исходную концентрацию бактерий и грибов в контаминированных образцах определяют сразу после контаминации. Для этого чашечным агаровым методом делают посев на соответствующие питательные среды (таблица 34), используя подходящие разведения для получения на чашке от 30 до 300 колоний бактерий и от 10 до 100 колоний грибов. Для этой цели также можно применять метод мембранной фильтрации при условии растворимости ЛП в водных растворителях или изопропилмиристате.
Контаминированные образцы препаратов выдерживают при температуре (22,5±2,5)°C в защищенном от света месте в течение определенного времени. Через 7, 14 и 28 сут. после инокуляции образцов препаратов 1 категории и через 14, 28 сут. препаратов 2 и 3 категорий определяют количество жизнеспособных микроорганизмов в 1 мл образца, делая высев на чашки Петри.
В случае необходимости в чашки с питательной средой или в соответствующее разведение лекарственного средства перед посевом вводят инактиватор (нейтрализатор) антимикробного действия определенного вещества, указанный в ОФС «Микробиологическая чистота».
Учет результатов испытания проводят после посева чашечным агаровым методом, определяя количество КОЕ/мл для каждого тест-штамма через указанные выше сроки инкубации контаминированного образца. Изменение количества микробных клеток по сравнению с исходной концентрацией в 1 мл выражают в десятичных логарифмах (lg). При оценке эффективности антимикробного действия консервантов увеличение КОЕ/мл не фиксируется, если последующее измерение не отличается от предыдущего более, чем на 50%. Антимикробные консерванты лекарственных средств считают эффективными, если наблюдают уменьшение количества клеток бактерий в соответствии с критериями, описанными в таблице 35.
В период с 7 до 14 сут. не должно наблюдаться увеличения числа бактерий. Количество клеток дрожжеподобных и плесневых грибов не должно увеличиваться на протяжении всего срока исследования для всех категорий лекарственных средств.
Таблица 35. Критерии оценки эффективности антимикробных консервантов лекарственных препаратов в отношении бактерий

Испытание проводят с использованием следующих питательных сред:
✵ Соево-казеиновый агар (Casein Soya Bean Digest agar)
Панкреатического гидролизата казеина |
15,0 г |
Папаинового гидролизата бобов сои |
5,0 г |
Натрия хлорида |
5,0 г |
Агара бактериологического |
15,0 г |
Воды очищенной |
1000 мл |
рН после стерилизации |
7,3±0,2 |
Альтернативная отечественная среда для выращивания аэробных бактерий — Среда № 1 для контроля микробной загрязненности
✵ Соево-казеиновый бульон (Casein Soya Bean Digest Broth)
Панкреатического гидролизата казеина |
17,0 г |
Папаинового гидролизата бобов сои |
3,0 г |
Натрия хлорида |
5,0 г |
Калия фосфата двузамещенного |
2,5 г |
Глюкозы моногидрата |
2,5 г |
Воды очищенной |
1000 мл |
рН после стерилизации |
7,3±0,2 |
Альтернативная отечественная среда для выращивания бактерий — Среда № 8 для контроля микробной загрязненности
✵ Бульон Сабуро (Sabouraud- 2% Dextrose Broth)
Пептона (мясного) |
5,0 г |
Пептона (казеинового) |
5,0 г |
Глюкозы моногидрата |
20,0 г |
Воды очищенной |
1000 мл |
рН после стерилизации |
5,6±0,2 |
Альтернативная отечественная среда для выращивания дрожжевых и плесневых грибов — Среда № 2 (агар Сабуро с глюкозой) для контроля микробной загрязненности
✵ Агар Сабуро с глюкозой (Sabouraud 4% Glucose Аgar)
Пептона (мясного или казеинового) |
10,0 г |
Глюкозы моногидрата |
40,0 г |
Агара бактериологического |
15,0 г |
Воды очищенной |
1000 мл |
рН после стерилизации |
5,6±0,2 |
Для предотвращения роста бактерий перед стерилизацией добавляют 50 мг хлорамфеникола (левомицетина) на 1 л среды или перед использованием добавляют 0,1 г натриевой соли бензилпенициллина и 0,1 г тетрациклина на 1 л среды в виде стерильных растворов.