ФАРМАЦЕВТИЧЕСКАЯ МИКРОБИОЛОГИЯ - В. А. Галынкин - 2015
ЧАСТЬ I. БИОЛОГИЯ МИКРООРГАНИЗМОВ
ГЛАВА 5. ВИРУСЫ
Вирусы существенно отличаются от других форм жизни своими размерами, строением генома и особенностями его воспроизводства.
Размеры вирусных частиц (вирионов) находятся в пределах 28-250 нм, их можно рассмотреть только с помощью электронного микроскопа. Вирион содержит только один тип нуклеиновых кислот — ДНК или РНК. Вирусы не способны строить свои структурные элементы (белки, нуклеиновые кислоты и др.) из компонентов питательной среды, они не способны расти на питательных средах, а для своего воспроизводства используют метаболические системы клетки хозяина (человека, животного, растения, бактерии), т. е. являются облигатными паразитами.
5.1 Структура вирусов
Вирусная частица (рис. 35) содержит генетический материал (ДНК или РНК), окруженный белковой оболочкой (капсидом) [24]. ДНК может образовывать кольцевые или линейные структуры. РНК представлена одно- или двухнитевыми молекулами, у некоторых вирусов может быть сегментированной. Преимущество сегментированного генома в том, что в дискретных фрагментах содержится информация, которую не способна обеспечить единая молекула. В зависимости от выполняемых функций однонитевые РНК подразделяют на две группы:
(1) РНК способна непосредственно транслировать генетическую информацию на рибосомы клетки-хозяина, т. е. выполнять функции иРНК, ее обозначают +РНК (плюс-нити РНК, позитивный геном).
(2) РНК вируса не способна функционировать как иРНК, а служит матрицей для образования +РНК, ее обозначают -РНК (минус-нити, негативный геном).
Ретровирусы содержат +РНК, на матрице которой фермент ревертаза (РНК-зависимая ДНК-полимераза) синтезирует ДНК-провирус, интегрирующий в клеточный геном.
Рис. 35. Схема строения вириона ВИЧ.
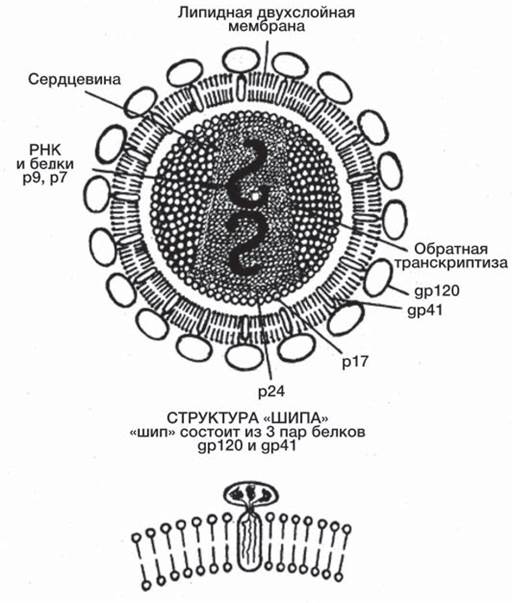
Капсид защищает геном от внешних воздействий, например, от действия нуклеаз клетки хозяина. На его поверхности располагаются системы распознавания рецепторов клетки хозяина и адсорбции на ее поверхности. Обычно это гликопротеиды, молекулы которых в виде ворсинок окружают вирион. Вирусы бактерий — бактериофаги часто имеют особые структуры, облегчающие их проникновение внутрь клетки. Некоторые вирусы в составе вириона имеют ферменты, участвующие в разрушении оболочки клетки хозяина (фаговый лизоцим) или в репликации его генома (например, вирус иммунодефицита человека содержит обратную транскриптазу). Капсид построен из идентичных белковых субчастиц — капсомеров. Субъединичная структура обеспечивает экономию генетического материала, а также самосборку вириона за счет нековалентных межмолекулярных взаимодействий подобно процессу кристаллизации. Кроме того, такая структура способствует освобождению генетического материала внутри клетки хозяина путем диссоциации нековалентно связанных субчастиц. Форма вириона определяется характером самосборки капсомеров и может быть кубической, спиральной или соединять несколько структурных компонентов (рис. 36). На поверхности белкового капсида многие вирусы млекопитающих имеют липопротеиновую оболочку, которая обычно образуется из мембраны клетки хозяина [12].
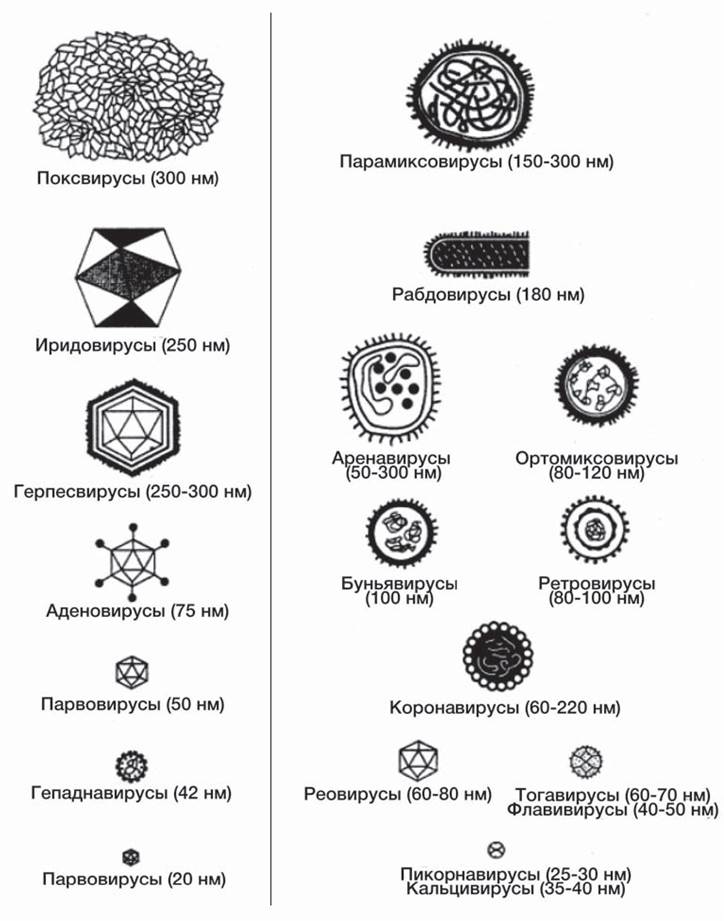
Рис. 36. Размеры и морфология основных возбудителей вирусных инфекций человека.
5.2 Взаимодействие вируса с клеткой хозяина
Вирус проникает в клетку хозяина и использует ее метаболические системы для своего воспроизводства и сохранения [4]. Этапы этих процессов различны у разных групп вирусов и окончательный результат может быть одним из следующих:
1. Размножение вируса и гибель клетки хозяина.
2. Размножение вируса и выход его из клетки без значительного повреждения последней.
3. Сохранение вируса в клетке в латентном состоянии, обычно в виде вирусной НК.
4. Внедрение вирусной НК в геном хозяина, в результате чего происходит мутация, например, возникновение раковых клеток.
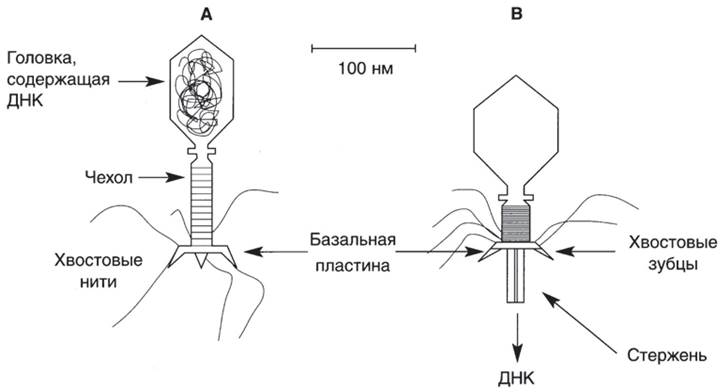
Бактериофаги (фаги) — это вирусы бактерий (прокариот). Их генетический материал содержится в головке, имеющей белковую оболочку (рис. 37). Хвостовые нити и зубцы предназначены для распознавания рецепторов на поверхности бактериальной клетки и адсорбции на ней. Распознавание специфично не только для вида бактерии, но и для штамма, что служит основой для фаготипирования бактерий (см. ниже). У некоторых фагов хвост имеет чехол, покрывающий стержень. После адсорбции фага на клетке чехол сокращается, проталкивая стержень внутрь. Через стержень фаговая НК проникает внутрь клетки. Процесс облегчается благодаря местному повреждению клеточной стенки фаговым лизоцимом. Таким сложным органом инфицирования обладают лишь некоторые фаги грамотрицательных бактерий. На клеточной стенке грамположительных бактерий имеются рецепторные участки, которые способствуют проникновению в клетку крупных молекул и бактериофагов. Чувствительное место для атаки — это пили, к которым фаги могут прикрепляться. Некоторые фаги впрыскивают в клетку свою НК, другие проникают интактными. По типу взаимодействия с бактериальной клеткой фаги подразделяют на вирулентные и умеренные.Вирулентные фаги размножаются внутри клетки. Созревшие частицы фага изнутри разрушают клеточную стенку и выходят наружу, клетка при этом погибает. Умеренные фаги также способны лизировать бактерии, однако, в большинстве клеток популяции они существуют в клетке в виде профага — фаговой НК, которая подобно плазмидам может интегрировать с хромосомой.
Рис. 37. Бактериофаг до (А) и после (В) сокращения чехла.
Литический цикл жизни вирулентного ДНК- геномного фага начинается с проникновения его ДНК в клетку и синтеза ранней иРНК (ранними называются молекулы, образующиеся до репликации вирусной НК). На матрице вирусной иРНК синтезируются ранние белки. Последние выключают синтез белков клетки хозяина, разрушают бактериальную ДНК и начинают синтез компонентов вирусной ДНК. После этого происходит репликация вирусной ДНК, синтез поздней иРНК и белков, необходимых для построения фаговых частиц (капсомеров головки и элементов хвоста) и лизоцима. Вновь синтезированные структурные единицы путем самосборки образуют зрелые фаговые частицы, покидающие клетку, оболочка которой разрушена лизоцимом. В одной микробной клетке может быть синтезировано до 100 фаговых частиц через 25 мин после инфекции.
Литическую активность вирулентного фага можно выявить в эксперименте, путем посева смеси суспензии фага и чувствительной к нему культуры на питательный агар в чашке Петри. На газоне бактериальной культуры появятся зоны лизиса в результате гибели части клеток под действием фага. Поскольку каждая зона лизиса (колония фага) инициирована одной фаговой частицей, метод позволяет определить их количество в исходной суспензии (метод титрования фага).
Лизогенными называют культуры, несущие умеренный фаг. Чтобы обнаружить явление лизогении, т. е. выход фага из клеток, требуется индикаторная культура, для которой данный фаг вирулентен. Лизогенную культуру смешивают с избытком бактерии-индикатора и высевают газоном на чашку. Наблюдают зоны лизиса индикаторной культуры под действием фага. В центре такой зоны находятся клетки лизогенной культуры. Основные стадии развития умеренных и вирулентных фагов представлены на рис. 38.
Рис. 38. Схема развития вирулентного (А) и умеренного (В) бактериофагов.
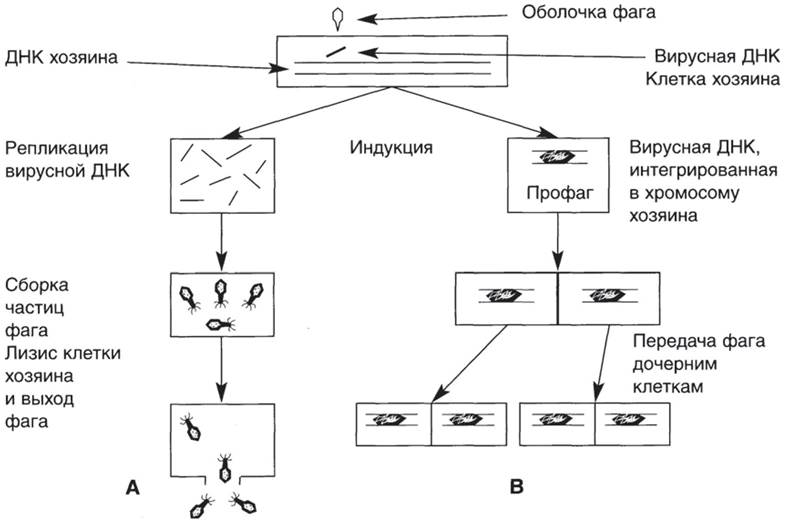
Интеграция фаговой НК с бактериальной хромосомой обеспечивает ее передачу дочерним клеткам. Лизогенные бактерии невосприимчивы к заражению теми фагами, которыми они лизогенизированы, а также близкородственными фагами. Эта невосприимчивость связана с образованием особого репрессора, препятствующего размножению фага. Этот же репрессор препятствует переходу профага в активное состояние и синтезу фаговых белков.
Спонтанно лизогенные бактерии лизируются редко (10-2-10-5в одной генерации). Частота лизиса зависит от внешних условий, например, состава питательной среды. Мутагены (ультрафиолетовые лучи, Н2 О2, митомицин С и др.) могут индуцировать массовое развитие зрелых фаговых частиц в клетках лизогенной культуры, связанное с нарушением механизма репрессии. Мутации также могут быть причиной перехода умеренного фага в вирулентное состояние. Такие мутанты оказываются устойчивыми к репрессору или утрачивают способность вызывать синтез репрессора в клетке.
Обычно лизогения — это весьма стабильное состояние, однако, некоторые клетки способны утрачивать фаг и вместе с этим резистентность к данному типу фага.
Лизогения — чрезвычайно распространенное явление: большая часть штаммов бактерий несет в себе НК одного или нескольких фагов, которая определяет
фенотипические показатели культуры (морфологические, культуральные, антигенные, токсигенные и др.). Это явление носит название фаговой конверсии.
Инфекционные фаги, продуцируемые лизогенной культурой, способны лизогенизировать другие штаммы данного вида бактерии (или близкородственных видов). При переходе из интегрированного с бактериальной хромосомой состояния в автономное геном фага может включить в свою структуру соседние гены нуклеоида клетки донора и перенести их в другую клетку (реципиент). Это явление носит название трансдукции. Путем трансдукции могут быть переданы многие важные признаки бактерий: резистентность к антибиотикам, вирулентность, токсигенность и др.
Практическое использование фагов. Фаги широко используются в генетической инженерии в качестве векторов — переносчиков генов в процессе создания рекомбинантных молекул ДНК. В медицине фаги назначают с профилактической и лечебной целью при дизентерии, брюшном тифе и других энтеральных заболеваниях, при гнойно-воспалительных процессах и дисбактериозе. Широко используют фаги в диагностике инфекционных заболеваний и идентификации микроорганизмов. Реакция нарастания титра специфичного фага указывает на присутствие соответствующего вида микроорганизма в объектах внешней среды (вода, пищевые продукты и т. п.). Метод фаготипирования позволяет установить биовар бактерии и тем самым выявить источник инфекции. Поскольку многие вещества, вызывающие индукцию профага и переход его в активное состояние, являются онкогенными, лизогенные культуры бактерий могут быть использованы для выявления потенциальных канцерогенов.
Размножение вирусов млекопитающих.
По сравнению с бактериофагом, литический цикл которого завершается в пределах 30 мин, вирусы млекопитающих размножаются медленно, в культуре ткани цикл репликации занимает от 4 до 24 час и включает стадии адсорбции, проникновения внутрь клетки и процесс образования зрелых вирусных частиц.
Адсорбция обусловлена двумя механизмами: неспецифическими (электростатическими и ван-дер- ваальсовыми силами) и специфическими, более прочными, представляющими собой взаимодействие рецепторов вируса с соответствующими рецепторами клетки по принципу биологического узнавания.
Проникновение вирусов млекопитающих внутрь клетки зависит от природы вируса. На поверхности вирионов многих групп вирусов, например, гриппа имеются особые шипы, содержащие нейраминидазу и гемагглютинин, которые участвуют в проникновении вириона в клетку. Вирусы оспы и герпеса поглощаются клеткой, как при фагоцитозе.
Депротеинизация (высвобождение вирусной НК) происходит с участием ферментов клетки хозяина.
Синтез вирусных НК и белков определяется природой вируса. У ДНК-геномных вирусов процесс начинается с синтеза ранней иРНК с участием РНК- полимеразы клетки хозяина или вириона. На матрице ранней РНК синтезируются ранние белки, необходимые для последующей репликации ДНК. Репликация также происходит под действием клеточных или вирусных ферментов. На матрице реплицирующейся ДНК происходит синтез поздних иРНК, которые направляют синтез белков вируса.
У РНК-геномных вирусов, содержащих +РНК, последняя транслируется на рибосомах клетки хозяина. Вирусная -РНК используется как матрица для построения с помощью РНК-зависимой РНК-полимеразы комплиментарной копии +РНК, которая функционирует как информационная.
Необходимым этапом жизненного цикла ретровирусов является интеграция его генома в форме ДНК-провируса в хромосому хозяина. Синтез ДНК- провируса на матрице вирусной +РНК происходит с участием РНК-зависимой ДНК-полимеразы (обратной транскриптазы). Интегрированная в одну из хромосом хозяина вирусная ДНК транскрибируется клеточной РНК-полимеразой. Ретровирусы часто являются онкогенными, поскольку включение их ДНК в геном клетки-хозяина вызывает ее перерождение. По этой же причине онкогенными могут быть и ДНК- геномные вирусы.
Самосборка вириона — это физико-химический процесс, в результате которого формируется капсид с встроенной в него НК. У вирусов, имеющих наружную оболочку, формирование вирионов происходит на клеточной мембране, компоненты которой входят в состав оболочки вируса (рис. 39).
Рис. 39. Схема сборки и выхода дочерних популяций вируса гриппа из зараженных клеток [24].
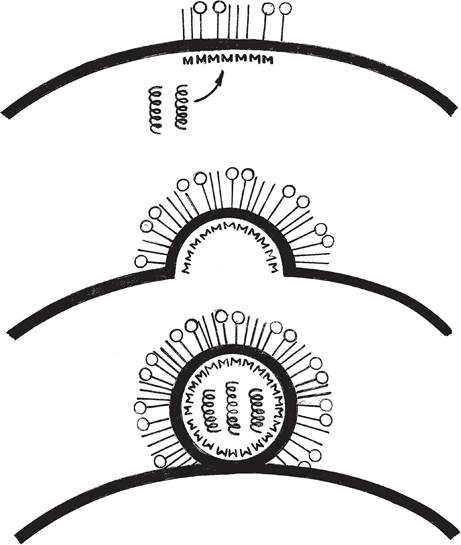
Выход вирионов у одних вирусов сопровождается гибелью клетки, у других — только частичным повреждением мембраны.
5.3 Культивирование вирусов
Культивирование вирусов в лабораторных условиях является необходимым этапом диагностики многих вирусных болезней, кроме того, оно необходимо для получения вакцинных препаратов. Поскольку вирусы являются облигатными паразитамми, они способны размножаться только в живых клетках, например, в культуре ткани (клетках тканей человека или животных, растущих на питательном субстрате, обычно в виде монослоя на плоской поверхности сосуда). Присутствие вирусов можно обнаружить по цитопатическому эффекту (ЦПЭ), т. е. разрушению монослоя клеток. Метод позволяет идентифицировать вирус, например, в клиническом материале, с помощью иммунной сыворотки. Специфическая сыворотка нейтрализует вирус, и ЦПЭ в ее присутствии не будет проявляться.
Вирусы выращивают также путем заражения лабораторных животных или эмбрионов птиц.
5.4 Действие химических и физических факторов на вирусы
Нагревание — наиболее эффективный способ уничтожения вирусов. Большинство вирусов, патогенных для человека, погибает при 60°С в течение 30 минут; однако вирус гепатита В выдерживает эту температуру в течение 4 часов. Вирусы выдерживают глубокое охлаждение и могут храниться при температуре от -40°С до -70°С. Высушивание губительно для некоторых вирусов, на других оно не действует. Ультрафиолетовое облучение инактивирует вирусы, повреждая их НК, что может быть использовано при изготовлении вирусных вакцин.
Вирусы, имеющие липидную оболочку, инактивируются органическими растворителями (хлороформом, эфиром); это явление используют при классификации вирусов. Многие химические дезинфектанты, используемые против бактерий (фенолы, спирты, ЧАС) малоэффективны против вирусов. Наиболее активны против вирусов: хлор, гипохлориты, йод, альдегиды и оксид этилена.
5.5 Принципы создания антивирусных препаратов
Для профилактики и лечения вирусных инфекций применяют иммунопрепараты и химиотерапевтические средства [25]. По спектру действия и клинической значимости препараты, применяемые для лечения вирусных заболеваний, подразделяют на следующие группы: этиотропные, иммуномодулирующие, патогенетические (направленные на борьбу с интоксикацией, обезвоживанием, поражениями органов, аллергическими реакциями, а также на профилактику бактериальных осложнений) и симптоматические (купирующие соответствующую симптоматику, например, головную боль, кашель). Симптоматическую и патогенетическую терапию проводят практически в 100% случаев, тогда как этиотропные химиотерапевтические средства применяют ограниченно. Причиной этого являются трудности создания препаратов, избирательно подавляющих репродукцию возбудителя и не затрагивающих процессы жизнедеятельности организма хозяина. Большинство ингибиторов вирусспецифических процессов, тесно связанных с клеточным метаболизмом, оказываются токсичными.
Тем не менее, определены этапы жизненного цикла некоторых вирусов, подавление которых мало влияет на клетки хозяина. Прежде всего, это адсорбция и проникновение вируса в клетку, депротеинизация НК и некоторые процессы, связанные с синтезом НК, трансляцией и сборкой вириона.
Антивирусные химиотерапевтические вещества отличаются узким спектром активности (в пределах одного вида или семейства), число их ограниченно (табл. 15).
Таблица 15. Спектр активности противовирусных препаратов, зарегистрированных в РФ
Препараты |
Показания к применению |
Адапромин |
Грипп А и В |
Азидотимидин |
Вич-инфекция, СПИД |
Амантадин Амбен |
Грипп А |
Аминокапроновая кислота |
Грипп А и В, респираторная вирусная инфекция |
Арбидол |
Герпес, опоясывающий лишай |
Ацикловир |
|
Видарабин |
|
Ганцикловир |
Герпес, цитомегилия |
Дейтифорин |
Грипп А, респираторная вирусная инфекция |
Идоксиуридин |
Герпес |
Марборан |
Оспа |
Оксолин |
Грипп, герпес, риновирусные инфекции |
Пандовир |
Герпес |
Ремантадин |
Грипп А |
Рибавирин |
Респираторная вирусная инфекция, гепатит С, лихорадка Ласса |
Теброфен Трифторидин |
Герпес, аденовирусные поражения глаз |
Тромантадин |
Герпес |
Флюреналь |
Герпетические и аденовирусные поражения глаз |
Фоскарнет |
Герпес, цитомегалия, гепатит В, ВИЧ- инфекция |
Хельпин |
Герпес, ветряная оспа |
Цитарабин |
Цитомегалия |
Амантадин, ремантадин — трициклические симметричные адамантамины активны против вирусов гриппа А и коревой краснухи. Эти вещества взаимо
действуют с белком М2 вируса, что приводит к блокаде слияния оболочки клетки и вируса и проникновения нуклеокапсида в цитоплазму. Кроме того, они блокируют первичную транскрипцию и активацию гемагглютинина. Препараты проявляют профилактическое действие при приеме до заражения и на ранних стадиях инфекции.
Видарабин (аденинарабинозид) — наименее токсичный и наиболее эффективный из аналогов пуринов, блокирует сборку ДНК, его интермедиат ингибирует вирусную ДНК-полимеразу. Применяют при лечении герпетических инфекций.
Цитозинарабинозид — аналог видарабина более токсичный, с меньшей избирательностью действия. Применяют при химиотерапии опухолей.
Галогенизированные производные дезоксиуридина — йодоксиуридин, трифторидин (трифтортимидин) фосфорилизуются вирусной тимидинкиназой и встраиваются в ДНК вируса, что приводит к образованию дефектных вирусных белков. Применяются местно при герпетических кератитах.
Аналоги нуклеозидов, избирательно активируемые вирусспецифической тимидинкиназой — ацикловир, фамцикловир, ганцикловир обладают избирательным действием на инфицированные вирусами клетки. Для активации необходимо их превращение в макроэргический трифосфат, который ингибирует вирусную ДНК-полимеразу. Первый этап фосфорилирования индуцирует вирусспецифическая тимидинкиназа. Нативная форма препаратов неактивна, поэтому они не влияют на синтез ДНК в незараженных клетках. Применяют при герпетических инфекциях, назначают внутрь, внутривенно и в виде глазной мази.
Ингибиторы обратной транскриптазы активны против ретровирусов, включая ВИЧ.
Зидовудин (азидотимидин), зальцитабин (дидезоксицитидин), диденозин (дидезоксиинозин), ставудин (дидегидродезокситимидин) действуют как конкурентные ингибиторы фермента, кроме того, прекращают элонгацию при синтезе белка на рибосомах. Обладают значительной токсичностью.
Ингибиторы протеаз — негидролизующиеся синтетические пептиды сакцинавир, ратонавир, индинавир конкурентно взаимодействуют с протеазами ВИЧ, в результате чего в ВИЧ-инфицированных клетках накапливаются нерасщепленные предшественники gag-полипротеина, проявляющие цитотоксическое действие. Используют в сочетании с ингибиторами обратной транскриптазы у ВИЧ-инфицированных больных.
Нуклеозидные аналоги широкого спектра
Рибавирин — аналог гуанозина, действует на РНК- и ДНК-геномные вирусы. Разрешен для лечения тяжелых респираторных инфекций у детей и других заболеваний. Вызывает побочные эффекты, включая подавление иммунитета.
Фоскарнет (тринатриевая соль фосфорномуравьиной кислоты) ингибирует активность обратной транскриптазы и всех ДНК-полимераз герпесвирусов и возбудителя гепатита В. Применяют для лечения герпетических инфекций.
N1 -метилизатин-β-тиосемикарбазон (метизазон, марборан) угнетает синтез поздних иРНК и поздних полисом у поксвирусов. Применяется для лечения оспы.
5.6 Устойчивость вирусов к химиотерапевтическим препаратам
Вирусам, как и всем живым существам, присуща способность адаптироваться к изменяющимся условиям внешней среды, в том числе и к действию биоцидов (рис. 40). Адаптация происходит как в результате селекции устойчивых штаммов, сформировавшихся в ходе предшествующей эволюции, так и в результате селективного отбора вновь возникающих штаммов. Преодоление развития резистентности в условиях клиники возможно при комбинированном применении препаратов с различными механизмами действия и при использовании препаратов, воздействующих на ранние этапы репродукции вируса. В настоящее время наблюдаются случаи развития резистентности к следующим препаратам.
Рис. 40. Этапы продукции вирусов — мишени для основных противовирусных препаратов.
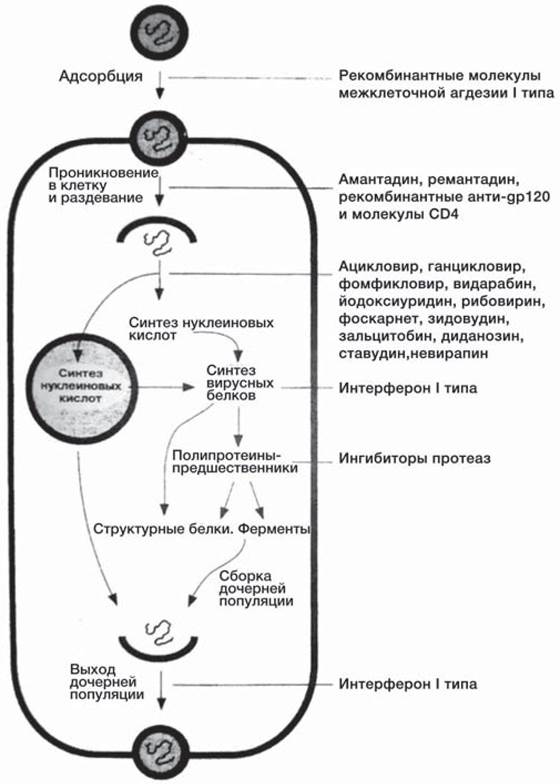
Ацикловир. Выделены устойчивые штаммы герпесвирусов, опасные для больных с иммунодефицитами. Резистентность обусловлена отсутствием тимидинкиназы или модификацией ее структуры, кроме того, мутацией генов, кодирующих ДНК- полимеразу, что делает ее устойчивой к действию ингибиторов.
Ганцикловир. Устойчивость связана с изменением структуры вирусной фосфотрансферазы и ДНК- полимеразы, приводящими к снижению уровня фосфорилирования препарата.
Зидовудин и невирапин. Устойчивость ВИЧ обусловлена мутацией генов, кодирующих обратную транскриптазу, что приводит к снижению аффинитета фермента к ингибитору.
К цитозинарабинозиду и рибавирину устойчивые штаммы не выявлены, что предположительно связано со способностью этих препаратов воздействовать на определенные этапы клеточного метаболизма, что объясняет причину широкого спектра их действия.
5.7 Интерфероны.
Интерфероны (ИФН, см. гл. 19) обладают универсально широким спектром антивирусной активности, поскольку действуют не на вирионы или их НК, а индуцируют антивирусное состояние клетки, стимулируя образование комплекса белков, блокирующих транскрипцию вирусной иРНК. ИФН не проникают в клетки, а взаимодействуют с мембранными рецепторами, индуцируя образование цАМФ, передающего сигнал на соответствующий оперон ДНК. Кроме того, ИФН активируют гены, кодирующие продукты с прямым антивирусным действием — протеинкиназы, нарушающие сборку белковой молекулы, и аденилатсинтетазы, продукт которых активирует эндонуклеазу, разрушающую вирусные иРНК. Гамма-ИФН активирует цитотоксические лимфоциты, естественные киллеры, моноциты, макрофаги, гранулоциты, способствующие уничтожению инфицированных клеток.
Медицинские препараты ИФН делятся на природные и рекомбинантные, их эффективность при различных заболеваниях указана в табл. 16.
Индукторы ИФН — это весьма разнородная по составу группа природных и синтетических соединений, способных вызывать в организме образование собственного (эндогенного) ИФН. Подобно ИФН они обладают универсально широким спектром противовирусной активности (табл. 17), а также иммуномодулирующим действием, которое определяет их эффективность при многих невирусных заболеваниях.
Таблица 16. Противовирусная активность препаратов ИФН
Типы ИФН |
Препараты |
Эффективны при заболеваниях |
Природные: |
||
α-ИФН |
Лейкоцитарный ИФН человека, эгиферон, |
Гепатиты В, С и Д, папилломавирусные заболевания, |
(альфа-фероны) |
виллферон, лейкинферон |
ВИЧ-инфекция, СПИД |
β-ИФН |
Фибробластный ИФН человека, ферон |
Гепатит С, герпес, папилломавирусные заболевания, |
(бета-фероны) |
ВИЧ-инфекция, СПИД, рассеянный склероз |
|
γ-ИФН (гаммафероны) Рекомбинантные: |
Иммунный ИФН человека (γ-ИФН) |
Гепатит В, папилломавирусные заболевания |
а2 В |
Интрон, инрек |
Гепатиты С и Д, герпес, папилломавирусные заболевания, ВИЧ-инфекция, СПИД |
а2 С |
Берофор |
Гепатит В, опоясывающий лишай, папилломавирусные заболевания |
β |
Рекомбинантные β-ИФН (бетафероны) |
Рассеянный склероз |
Таблица 17. Спектр противовирусной активности индукторов ИФН
Препарат |
Показания к применению |
Акриданоны (циклоферон, неовир) |
Грипп, энцефалиты, бешенство, ВИЧ-инфекция, СПИД |
Флюореноны (амиксин) |
Грипп, ОРВИ, герпес, гепатит А, энцефалиты, бешенство, рассеянный склероз |
Поли (И): поли (У) — амплиген |
ВИЧ-инфекция, СПИД |
Поли (Г): поли (Ц) — полигуацил |
Грипп, гепатит В, энцефалиты, бешенство |
Двухспиральные РНК (ларифан, ридостин) |
Грипп, ОРВИ, герпес, энцефалиты, бешенство |
Поли (А): поли (У) — полудан |
Герпетические поражения глаз |
Полифенолы (мегасин, кагоцел, саврац, рагосин, гозалидон) |
Грипп, ОРВИ, герпес, энцефалиты, бешенство, гепатиты, энтеровирусные инфекции |
5.8 Возбудители вирусных болезней человека
5.8.1 ДНК-содержащие вирусы
Герпесвирусы — икосаэдральный капсид, двухслойная внешняя оболочка, гликопротеиновые шипы, двухнитевая линейная ДНК. Вызывают острые и латентные инфекции (рецидивирующий герпес, ветряная оспа, опоясывающий лишай, инфекционный мононуклеоз, кератит, энцефалит и др.); обладают онкогенным потенциалом.
Паповавирусы — голый икосаэдральный капсид, двухнитевая циклическая ДНК. Вызывают папилломы и полиомы (бородавки, кондиломы, локальные гиперплазии эпителия, карцинома гортани и шейки матки).
Аденовирусы — голый икосаэдральный капсид, двухнитевая линейная ДНК. Вызывают фарингоконъюнктивиты, эпидемический кератоконъюнктивит, гастроэнтериты.
Поксвирусы — вирион кирпичеобразной формы, двухнитевая ДНК. Вызывают натуральную оспу, оспу коров, оспу обезьян и др.
Парвовирусы — голый икосаэдральный капсид, однонитевая ДНК. Вызывают апластический криз у детей.
Гепаднавирусы — икосаэдральный капсид с оболочкой, неполная (с разрывом одной цепи) кольцевая двухнитевая ДНК, в состав вириона входят прайменый белок и ДНК-полимераза. Для репликации необходим синтез вирус-индуцированной обратной транскриптазы, т. к. вирусная ДНК образуется на матрице РНК; в динамике процесса вирусная ДНК интегрирует в хромосому. Вызывают гепатит В.
5.8.2 РНК-содержащие вирусы
Ортомиксовирусы — сферический вирион содержит однонитевую сегментированную РНК. Вызывают грипп. У вирусов гриппа А и В геном содержит 13588 нуклеотидов и состоит из 8 сегментов, каждый из которых кодирует свой протеин. Основной белок вириона-М-протеин, локализуется на внутренней поверхности двухслойной липидной оболочки, с которой ассоциированы поверхностные гликопротеины - гемагглютинин и нейраминидаза, образующие шипы. Эти гликопротеины обладают антигенной специфичностью, которая способна варьировать часто в динамике одной эпидемической вспышки, что затрудняет вакцинопрофилактику гриппа.
Парамиксовирусы — сферический вирион, липопротеиновая оболочка содержит М-протеин, формирующий его внутренний слой, и поверхностные гемагглютинин, нейраминидазу и гликопротеид F, проявляющий гемолитическую цитотоксическую активность и ответственный за слияние с клеткой; геном
представлен линейной несегментированной молекулой РНК, связанный с мажорным белком. Вирион содержит РНК-зависимую РНК-полимеразу. Вызывают парагрипп, корь, эпидемический паротит и подострый склерозирующий панэнцефалит.
Пикорнавирусы — голые икосаэдрические вирионы, несегментированная молекула +РНК. Вызывают бессимптомные инфекции, менингиты, паралич (полиомиелит), миоперикардит, острые респираторные инфекции.
Рабдовирусы — вирион пулевидной формы со спиральной симметрией, двухслойная липидная оболочка, включающая внешние гликопротеиновые структуры; нуклеокапсид содержит однонитевую РНК, протеины сердцевины и транскриптазу. Вызывают бешенство, везикулярный стоматит и др.
Тогавирусы — икосаэдральный капсид, липидная оболочка с гликопротеиновыми шипами, содержащими гемагглютинин, однонитевая молекула +РНК. Вызывают энцефалиты, желтую лихорадку, лихорадку Денге, карельскую лихорадку, гепатит С, краснуху.
Буньявирусы — сферический вирион с тремя нуклеокапсидами, каждый из которых содержит три отдельных линейных сегмента -РНК и РНК-зависимую РНК-полимеразу. Оболочка липопротеиновая с гликопротеиновыми шипами, содержащими гемагглютинин. Вызывают лихорадки и энцефалиты.
Аденовирусы — округлые или полиморфные вирионы, однонитевая сегментированная молекула -РНК; вирионы содержат несколько типов как вирусных, так и заимствованных у хозяина рибонуклеопротеинов, выполняющих роль рибосом. Вызывают тяжелые геморрагические лихорадки, гриппоподобные заболевания, менингиты.
Филовирусы — палочковидные ветвящиеся вирионы, спиральный нуклеокапсид, -РНК. Вызывают тяжелые геморрагические лихорадки.
Коронавирусы — округлые или овальные вирионы, гликолипопротеиновая оболочка с характерными выростами (короной), нуклеокапсид спиральный, несегментированная +РНК. Вызывают острые гастроэнтериты и респираторные инфекции.
Калицивирусы — голый икосаэдральный капсид, несегментированная +РНК. Вызывают гастроэнтериты и гепатит Е.
Реовирусы — голый вирион, капсид квазисферический с икосаэдральной симметрией, геном фрагментарный, образован двухнитевой РНК, состоящей из 10-11 сегментов. Ортореовирусы вызывают лихорадки (колорадская, кемеровская и др.); ротавирусы - острые энтериты у детей.
Ретровирусы — сферический вирион, одетый липидной оболочкой, с гликопротеиновыми шипами, геном образован +РНК, состоящей из двух идентичных субъединиц. Характерная особенность - наличие в вирионе РНК-зависимой ДНК-полимеразы. Вызывают злокачественные заболевания; HTLV-1-Т-клеточные лимфомы и миелопатии; ВИЧ-1 и ВИЧ-2 — синдром приобретенного иммунодефицита (СПИД).
5.8.3 Неклассифицированные вирусы
Вирус гепатита В — дефектный (неспособный к самостоятельному размножению, нуждающийся в вирусах-помощниках), выделяемый только от пациентов, инфицированных вирусом гепатита В (ВГВ), его геном — однонитевая РНК не имеет гомологии с ДНК ВГВ, но оболочка включает антигены ВГВ.
Астровирусы — сферические вирионы, геном - однонитевая РНК. Вызывают диарейные инфекции у детей.
5.9 Вирусы — возбудители болезней растений
Вирусы — мельчайшие (субмикроскопические) возбудители болезней растений, животных и человека, не имеющие клеточного строения и способные размножаться только в живых клетках растения хозяина [20]. Зарегистрировано примерно 600 фитопатогенных вирусов; точное число указать трудно, так как некоторые вирусы представлены многими штаммами, иногда описываемыми как самостоятельные виды.
Все фитопатогенные вирусы объединены в 20 групп.
В настоящее время полагают, что вирусы — это самые простейшие формы жизни, не имеющие клеточную структуру и активизирующиеся при попадании в клетки восприимчивых организмов. Вирусы растений характеризуются следующими особенностями:
1. Размножаются только в организме хозяина или переносчика; на искусственных питательных средах не растут. Имеют своеобразный механизм размножения.
2. Клеточного строения не имеют: состоят из РНК — рибонуклеиновой кислоты (одно или двухцепочечной) или ДНК — дезоксирибонуклеиновой кислоты, окруженной обычно (но не всегда) белковой оболочкой.
3. Геном вирусов представлен только нуклеиновой кислотой, репродуцирующейся за счет ферментативной системы хозяина.
4. Нуклеиновая кислота ответственна за инфекционность, а белок осуществляет в основном защиту РНК.
Вирусы имеют палочковидную (ВТМ), нитевидную (Х-вирус картофеля, тристеза цитрусовых), сферическую (некроз табака) и бацилловидную (штриховатая мозаика пшеницы) формы. Размер вирусов составляет от 25 нанометров (нм) у вируса некроза табака, и до 2500 нм у тристезы цитрусовых 1-нм (нанометр) равен 10-9 = 0,001 мкм). По характеру воздействия на пораженный организм вирусы делят на две большие группы — вирусы мозаичного типа (мозаика) и вирусы желтушного типа (желтуха).
В результате заражения мозаичными вирусами изменяется окраска листьев, наблюдается чередование светло- и темно-зеленых, желтых, зеленых участков листьев, появление некротических пятен, штрихов, колец и др.
Источниками инфекции мозаичных вирусов могут быть сухие растительные остатки, семена, клубни, сорняки, почва и др.
Вредоносность вирусных заболеваний проявляется, главным образом, в снижении урожайности растений и ухудшении качества продукции. Особый вред вирусы наносят при выращивании семенного и посадочного материала. Поражение вирусами отрицательно влияет на пищевую и кормовую ценность продукции, пригодность её к промышленной переработке. Вирусы вызывают у растений стерильность и несовместимость, что отрицательно сказывается на работе селекционеров. У цветочных культур теряется декоративность, что наносит значительный экономический ущерб. Под действием вирусов теряются сортовая чистота, холодостойкость, зимостойкость, снижается всхожесть семян. В среднем размер убытков от развития вирусных болезней составляет примерно 20% общего экономического ущерба, обусловленного деятельностью всех групп возбудителей болезней и вредителей сельскохозяйственных культур.
5.9.1 Строение и размножение вирусов.
К вирусам неприменимы традиционные микробиологические методы исследования, поэтому долгое время об их строении, способах размножения, сохранения ничего не было известно. Только в 1935 г. американский вирусолог У. Стенли выделил из зараженных вирусом табачной мозаики (ВТМ) листьев табака белковый компонент, получив чистый кристаллический белок вируса. В 1937 г. англичане Ф. Боуден и Н. Пири установили, что кроме белка в состав вируса входит нуклеиновая кислота. Вирус табачной мозаики состоит из белка (95%) и нуклеиновой кислоты (5%).
Говоря о размере и строении вирусов, имеют в виду вирионы, или вирусные частицы. Размеры вирионов в большинстве случаев составляют 100...200 нм.
Форма вириона определяется способом ориентирования в пространстве нуклеиновой кислоты и строения белковой оболочки. Белок играет защитную роль, а также обеспечивает проникновение вируса в ткани растения-хозяина. Нуклеиновая кислота является носителем инфекционности и наследственных признаков.
Большинство вирусов растений содержит одноцепочечную линейную РНК, реже встречаются вирусы с двух цепочечными молекулами РНК, закрученными в спираль. Лишь немногие вирусы растений (вирус мозаики цветной капусты) имеют в своем составе ДНК.
Механизм размножения вирусов отличается от способов размножения других микроорганизмов. Фитопатогенные вирусы попадают в растительную клетку, например, при проколе ткани ротовыми органами насекомых-переносчиков или через мелкие ранки (без грубых повреждений клеток) при механической передаче. В клетках зараженного растения вирус репродуцируется путем синтеза отдельных молекул нуклеиновых кислот и белка и последующей сборки из них вирионов. Попав в клетку растений, нуклеиновая кислота вируса освобождается от белковой оболочки и, становясь матрицей, начинает управлять синтезом ферментов клетки растения в направлении, необходимом вирусу. Происходит её накопление за счет репликации цепочек нуклеиновых кислот из имеющихся в клетке, а затем синтезируемых клеткой нуклеотидов. Вирусный белок синтезируется на рибосомах клетки-хозяина. Впоследствии происходит объединение нуклеиновой кислоты и структурного белка с образованием вирионов.
Нередко вирионы агрегатируют друг с другом, образуя вирусные включения — кристаллы различной формы (кристаллы Ивановского), или, если вирионы соединяются с уплотнениями цитоплазмы, образуются включения в виде аморфных тел.
При вирусной инфекции имеет место облигатный тип паразитизма, причем его абсолютная форма. Патоген внедряется в генетический аппарат растений, изменяя его в сторону, необходимую для синтеза собственной ферментативной энергетической системы и впоследствии — соответствующих вирусных структур.
5.9.2 Симптомы вирусных болезней растений
По характеру проявления симптомы вирусных болезней можно разделить на 5 основных типов: 1. Угнетение роста; 2. Изменение окраски листьев, которые приобретают мозаичную расцветку; 3. Деформация органов; 4. Локальные некрозы; 5. Нарушение репродуктивных функций растений.
При одном и том же вирусном заболевании на растении обычно проявляется несколько типов симптомов. Симптомы вирусных заболеваний могут изменяться по мере развития патологического процесса.
5.9.3 Способы распространения фитопатогенных вирусов
Вирусы, вызывающие болезни растений, могут распространяться различными путями. Многие вирусы распространяются переносчиками (векторами), которые питаются или паразитируют на растении. Это главным образом насекомые, клещи, нематоды, грибы и паразитические цветковые растения (повилика). Лишь сравнительно небольшое количество фитопатогенных вирусов передается насекомыми с грызущим ротовым аппаратом — такая передача малоспецифична и имеет значение только для вирусов, способных сохраняться в соке больного растения.
В зависимости от особенностей передачи насекомыми вирусы делят на персистентные и неперсистентные. Персистентные вирусы сохраняются свою инфекционность в организме переносчика в течение нескольких дней, а иногда в течение всей жизни вектора. Неперсистентные вирусы могут быть переданы переносчиками в течение ограниченного промежутка времени, часто не более часа.
Вирусы могут передаваться контактно-механическим путем, т. е. при взаимоповреждающем контакте частей здорового и больного растения. Это происходит при соприкосновении надземных или подземных частей растений. Часть вирусов (около 20%) способна передаваться через семена. Некоторые вирусы плодовых и ягодных культур могут передаваться через пыльцу. У вегетативно размножаемых культур (картофель, земляника, тюльпан и др.) вирусы распространяются в основном с посадочным материалом. При различного рода прививках (трансплантации) происходит распространение вирусных болезней. Этим методом передаются все известные фитопатогенные вирусы. Единичные вирусы (вирус мозаики табака, вирус некроза табака) могут передаваться с растительными остатками, с почвой, с гидропонными растворами. Небольшое значение (для вирусов кормовых бобовых трав) имеет место распространения вирусов через стебли повилики.
5.9.4 Защита растений от вирусных болезней
1. Карантин растений — это система государственных мероприятий, направленных на предотвращение заноса с территории других стран карантинных возбудителей болезней растений (внешний карантин), а в случае проникновения — на локализацию их очагов (внутренний карантин).
2. Использование и получение оздоровленного от вирусов семенного и посадочного материала.
3. Селекционный метод — при этом стремятся вывести новые сорта, устойчивые не только к вирусу, но и к его переносчику.
4. Организационно-хозяйственные мероприятия — дезинфекция орудий труда в растворе формалина, перманганата калия, спирта, тепловая обработка. Регулярное визуальное обследование растений.
5.9.5 Вироиды — возбудители болезней растений
Вироиды как новый класс патогенов был открыт Т. Динером в 70-х годах XX в. К этой группе фитопатогенов относят вирусоподобные инфекционные агенты, которые не образуют характерных для вирусов нуклеопротеидных частиц. Они представляют собой только низкомолекулярную одноцепочную РНК, являющуюся носителем инфекционности и использующую для своей репликации биосинтетическую систему клетки растения-хозяина. Они характеризуются тем, что имеют только ковалентно замкнутую кольцевую РНК, имеющую крайне низкую молекулярную массу (2,5 х 104 — 15 х 104). Белковая оболочка отсутствует.
Наиболее характерные симптомы вироидозов: угнетение роста, уменьшение размеров растения и отдельных его органов (листьев, цветков, плодов), ослабление интенсивности окраски, хлороз листьев.
Вироиды распространяются с посадочным материалом, с семенами, передаются от растения к растению механическим путем. Так, вироид экзокортиса цитрусовых быстро распространяется при прививках. Вироиды характеризуются высокой инфекционностью, термостабильностью, стойкостью к воздействию различных химических соединений.
Основные симптомы вироидных болезней: угнетение роста растений или его отдельных органов, изменение окраски (хлороз, антоцианоз), деформация различных органов. Вироиды отличаются высокой инфекционностью, стойкостью к химическим и термическим воздействиям. Они распространяются с посадочным материалом, семенами, контактно-механическим путем. К основным методам диагностики вироидов относят визуальную диагностику, метод растений-индикаторов, электронную микроскопию, метод гель- электрофореза, метод ДНК-зондов. Защита растений от вироидных болезней сходна с защитой их от вирусных патогенов.
Именно благодаря высокой обоюдной организации грибов и растений их взаимодействия носят широкий характер. По разным оценкам, известно от 120 тыс. до 250 тыс. видов грибов, и среди них свыше 8 000 видов фитопатогенных, тогда как среди бактерий известно только около 200 фитопатогенных видов.
Агробактерии способствуют развитию различных опухолей у растений. Образование опухолей вызывается онкогенной плазмидой, передающейся агробактериями в растительные клетки. Эти бактерии вызывают у растений образование корончатых галлов опухолей. После развития опухоли агробактерии в тканях обычно отсутствуют. Передача возбудителей бактериозов происходит через зараженные семена, остатки больных растений, почву, воду, воздух, путем переноса насекомыми, моллюсками, нематодами. Бактерии проникают в растения через устьица, нектарники и другие части растений, а также даже через небольшие повреждения.
5.10 Прионы
Прионы как инфекционные агенты
Прионы — это гликопротеины, которые способны индуцировать в нормальном клеточном белке конформационный переход в конформер с инфекционной активностью (рис. 41) [26]. Источником нормального белка является сама клетка, в которой постоянная экспрессия гена PRNP создает пул белка PrPc — нормального компонента клеточных мембран. Контакт с инфекционным прионом PrPsc (sc — скрепи) вызывает переход нормального белка в конформационное состояние PrPsc. Этот переход осуществляется в период посттрансляционного процессинга предобразованного нормального клеточного белка.
Рис. 41. Схема заражения прионами, диссеминация прионов в организме и стадии инфекционного процесса в центральной нервной системе (В — В-лимфоциты; ФДК — фолликулярные дендритные клетки [7].
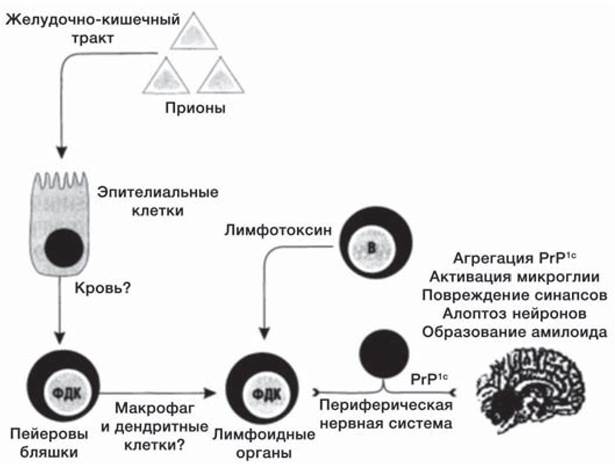
Нормальный белок PrPc локализуется в цитоплазматической мембране и участвует в функционировании сигнальных систем клеток, в частности нейронов, и предположительно в биогенезе и развитии нервной системы. Его конформационная модификация вызывает нарушение этих процессов. Кроме того, конформеры индуцируют апоптоз инфицированных клеток и генерируют нейротоксические полипептиды, предположительно образующие поры в нейронах и связывающие нуклеиновые кислоты, а также блокируют репликацию митохондрий, вызывая их дегенерацию. Последнее лежит в основе многих неврологических заболеваний.
Заболевания, вызываемые прионами, характеризуются поражением центральной нервной системы: болезнь Крейцфельда-Якоба, синдром Гертсманна-
Штреуссера-Шейннера, семейная смертельная бессонница, куру, скрепи овец и коз, трансмиссивная губчатая энцефалопатия коров и др. Источником инфекции являются ткани больного организма. Заражение человека возможно алиментарным путем, а также при использовании лекарственных препаратов, полученных из тканей больных животных, или недостаточно обезвреженных медицинских инструментов. У коров и овец инфекционные агенты передаются через корма, содержащие ткани погибших животных.
Для заболеваний, вызванных прионами, характерен очень длительный инкубационный период. Развитие инфекции тесно связано с функциями генома и жизнедеятельностью клеток, обеспечивающих накопление белка PrPsc и постепенное прогрессирующее развитие симптомов, которое может затягиваться на месяцы и годы.
Для прионных заболеваний характерно практически полное отсутствие иммунного ответа в связи с высокой консервативностью первичной структуры белка; эти инфекции не реагируют на иммуномодулирующую терапию, хотя делаются попытки получить иммунопрепараты, воздействующие на отдельные этапы формирования конформированных белков.
Прионы в фармацевтической практике
Прионы представляют собой индивидуальные белки с молекулярной массой от 20 до 30 кДа при длине полипептидной цепи около 254 аминокислотных остатков. Они фильтруются через фильтры с диаметром пор 25-50 нм.
Прионы стабильны при температуре 90 °С в течение 30 мин., инактивируются только при автоклавировании при 135°С в течение 30 мин. Однако описаны случаи инфицирования при применении автоклавированного медицинского инструмента (стоматологического, отоларингологического, нейрохирургического). Прионы резистентны к воздействию химических агентов (глутаровый альдегид, формальдегид, β-пропиолактон, этанол, толуол, ксилол), нуклеазам, УФ и ионизирующей радиации. Менее резистентны к ацетону, натрия гидроксиду, ионным детергентам типа натрия додецилсульфата, фенолу, хлороформу, сильным окислителям, этиленоксиду, протеазам.
Прионы имеют ограниченный спектр хозяев, но способны адаптироваться к новому хозяину, т. е. преодолевать межвидовые барьеры.
Опасность распространения прионных заболеваний представляет серьезную проблему для фармацевтической деятельности, включая контроль поставщиков животного сырья (недопущение получения сырья из регионов, где наблюдались случаи трансмиссивной губчатой энцефалопатии крупного рогатого скота) и выбор способа стерилизации. Для термостабильного медицинского оборудования, загрязненного материалом, содержащим прионы, ВОЗ рекомендует погружение в раствор натрия гидроксида (1 н) или натрия гипохлорита (20000 ppm активного хлора) на 1 час с последующим автоклавированием, очисткой и обычной стерилизацией.
Методы контроля полноты инактивации прионов трудоемки, длительны и дорогостоящи, они предусматривают заражение животных инфицированной тканью, подвергнутой воздействию биоцида, и математический расчет концентрации биоцида и времени, необходимых для инактивации приона. Поэтому на практике необходимо строго соблюдать регламентированный режим обработки, гарантирующий качество стерилизации.
Заключение
Вирусы отличаются от других форм жизни по следующим признакам:
— размеры от 28 до 250 нм;
— наличие одного типа НК — ДНК или РНК;
— облигатный паразитизм.
Вирусы паразитируют на клетках бактерий (бактериофаги), растений, животных и человека, вызывая различные заболевания. Ретровирусы содержат +РНК, на матрице которой фермент обратная транскриптаза синтезирует ДНК-провирус, интегрирующий в геном клетки и вызывающий ее перерождение.
Внешняя оболочка вируса — капсид состоит из белковых субъединиц — капсомеров.
Вирулентные бактериофаги вызывают лизис клеток, умеренные фаги существуют в клетке в виде профага — фаговой НК, которая входит в состав генома бактериальной клетки.
Вирусы выращивают в культуре ткани или путем заражения животных или эмбрионов птиц.
Создание противовирусных препаратов направлено на подавление этапов жизненного цикла вирусов, не затрагивающих клетки хозяина: адсорбция, проникновение вирусов в клетку, функционирование вирусной НК.
Интерфероны — это белки, которые обладают универсально широким спектром противовирусной активности.
Прионы — инфекционные гликопротеины, вызывают поражение ЦНС, передаются алиментарным путем или через инфицированные материалы и инструменты. Прионы исключительно устойчивы к стерилизующим агентам.