МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ II - А. В. ПИНЕВИЧ - 2007
ГЛАВА 12. ФОТОТРОФИЯ
Хлорофилловое зерно — тот фокус, та точка в мировом пространстве, где солнечный луч, превращаясь в химическую энергию, становится источником всей жизни на земле.
К. А. Тимирязев. Наука и демократия (Москва, 1920)
Приступая к обсуждению темы, посвященной фототрофии, мы должны четко разграничить два понятия — «фотосинтез» и «фототрофия». В первом случае речь идет о комплексной ассимиляции световой энергии и неорганического углерода с использованием неорганического донора электронов; для обозначения такого типа питания существует более точный термин «фотолитоавтотрофия». Во втором случае подразумевается только энергетическая составляющая метаболизма, связанного с ассимиляцией световой энергии.
Особенность фототрофных биотрансформаторов заключается в том, что они преобразуют физический энергоноситель (кванты электромагнитного поля) в электрохимический энергоноситель (Рmf). В отличие от лимитированных ресурсов химического субстрата, от которых зависит хемотрофия, свет представляет собой практически неисчерпаемый абиогенный источник энергии. Именно он обеспечивает первичную продукцию в основании пищевой пирамиды.
При фототрофии электромагнитная энергия предварительно преобразуется в химическую. Уникальность этого способа ассимиляции энергии заключается в том, что в результате фотофизического процесса (поглощения квантов света и миграции возбужденного состояния между пигментными молекулами) образуется возобновляемый субстрат — возбужденный хлорофилл. При его окислении с помощью электрон-транспортной цепи создается Рmf.
Электрон-транспортная цепь, участвующая в фототрофии, бывает двух типов. В одном случае она «циклическая», т. е. замкнута в кольцо. Ей не нужны экзогенные доноры электронов, и она не синтезирует восстановитель. В другом случае электрон-транспортная цепь «нециклическая». Она окисляет экзогенный донор электронов и образует восстановитель, который используется для конструктивных процессов. В обоих случаях в состав электрон-транспортной цепи входят цитохром bc1(b6f)-комплекс и хинонный пул. В отличие от хемотрофии при фототрофии хинон восстанавливается не дегидрогеназами, которые окисляют органические или неорганические субстраты, а получает электроны от активированного светом пигмента — хлорофилла.
Для того, чтобы воспользоваться донорными свойствами возбужденного хлорофилла, помимо цитохром bс1(b6f)-комплекса необходима система, состоящая из фоторецепторов, переносчиков электронов и ряда кофакторов.
Таким образом, хотя фотосинтетический аппарат и является светозависимым электрогенератором, функционально он эквивалентен дыхательной цепи. В обоих случаях Pmfсоздается цитохром bc1(b6f)-комплексом. Более того, фототрофию можно рассматривать как вариант дыхательной хемотрофии, когда возобновляемым донором электронов является хлорофилл.
Способность к фототрофии проявляют представители пяти фил филогенетического домена Bacteria:
— зеленые нитчатые бактерии (фила BVI Chloroflexi);
— цианобактерии (фила ВХ Cyanobacteria);
— зеленые одноклеточные бактерии (фила BXI Chlorobi);
— пурпурные бактерии (фила ВХII Proteobacteria);
— гелиобактерии (фила ВХIII Firmicutes).
Они неравноценно представлены в биосфере как в отношении биоразнообразия, так и в отношении занимаемых ниш, общей численности и временной динамики развития.
Археи не способны к фототрофии. Тем не менее, у некоторых представителей филы АII Euryarchaeota при энергетическом стрессе адаптивно синтезируется светозависимый биотрансформатор — бактериородопсин. Он действует по тому же принципу, что и обычный фотосинтетический аппарат — преобразует экзогенный физический энергоноситель (кванты электромагнитного поля) в эндогенный электрохимический энергоноситель (Pmf). Однако этот биотрансформатор имеет другую молекулярную природу по сравнению с фотосинтетическим аппаратом и отличается от последнего по механизму действия.
12.1. Два способа ассимиляции световой энергии
Для преобразования световой энергии в Pmf существуют два типа мембранных биотрансформаторов. Оба используют эффект спонтанной релаксации возбужденных светом фоторецепторных систем.
В первом случае биотрансформатором является молекула хромопротеина — интегрального белка, с которым ковалентно связана молекула каротиноида. До недавнего времени считалось, что этот механизм имеется только у некоторых представителей домена Archaea. Однако сейчас выяснилось, что он встречается и у бактерий. Молекула каротинопротеина (бактериородопсина у архей и протеородопсина у бактерий) поглощает квант видимого света и преобразует полученную свободную энергию в Pmf. Это значит, что она совмещает две функции — фоторецептора и электрогенератора.
Во втором случае биотрансформатором является мультиполипептидный фотосинтетический аппарат. Он состоит из хромопротеинов и/или белков, нековалентно связывающих пигмент, а также бесцветных полипептидов и небелковых кофакторов. Данный механизм уникален для филогенетического домена Bacteria. Его специфика в том, что функции фоторецептора и электрогенератора выполняют разные структуры.
Функцию фоторецептора выполняет интегральный или периферический светособирающий комплекс (англ. light harvesting complex, LHC). Его второе название — светособирающая антенна (англ. light harvesting antenna). Это мультимолекулярный агрегат, состоящий из пигментов, ковалентно или нековалентно связанных со специализированными белками, или апопротеинами.
Функцию электрогенератора выполняют две соединенные последовательно друг с другом электрон-транспортные цепи. Одна из них расположена внутри интегральной частицы — реакционного центра (англ. reaction centre, RC). Другая представляет собой цитохром bc1(b6f)-комплекс.
12.2. Два типа светового питания
Существуют два типа светового питания — истинная фототрофия и квази-фототрофия.
Истинная фототрофия. При истинной фототрофии метаболические потребности бактерии полностью удовлетворяются путем ассимиляции световой энергии, и биогенез фотосинтетического аппарата сопряжен с клеточным ростом.
В ответ на изменение интенсивности света и/или его спектрального состава клетки «фотоакклиматизируются». Смысл фотоакклиматизации (англ. photoacclimation) заключается в том, чтобы с помощью регуляторных механизмов, действующих на транскрипционном, трансляционном и посттрансляционном уровне, так перестроить фотосинтетический аппарат, чтобы в новых условиях светового питания сделать фототрофию максимально эффективной.
Фотосинтетический аппарат, как правило, выявляется на ультраструктурном уровне — по присутствию в клетке IСМ и эпимембранных частиц, например, фикобилисом или хлоросом (см. ниже). На спектрах поглощения интактных клеток, клеточных гомогенатов и пигментных экстрактов регистрируются характерные максимумы хлорофилла, а также каротиноидов и других вспомогательных фотосинтетических пигментов. Рост облигатных фототрофов замедляется при недостатке света и прекращается в темноте. На слабом свету и в темноте для получения ограниченного количества энергии расходуются фосфагены — АТФ и (Ф)n, а также запасные полигликозиды. У штаммов, способных к факультативной хемотрофии, темновой рост за счет экзогенных (почти всегда органических) субстратов потенциально не ограничен. Фототрофия сочетается с углеродной автотрофией, реже — с углеродной гетеротрофией, и во многих случаях — с диазотрофией.
Квази-фототрофия. Этот тип светового питания наблюдается у некоторых хемогетеротрофных бактерий, а также у экстремально галофильных архей в условиях энергетического стресса, когда они по той или иной причине не могут создавать Рmf посредством аэробного дыхания.
Ингибирование дыхания может быть вызвано либо дефицитом донора электронов (субстратное голодание у бактерий), либо дефицитом акцептора электронов
(аноксия у архей). В обоих случаях образуется «портативный» фотосинтетический аппарат. С его помощью прокариоты получают немного энергии, используемой для репарационных процессов и для поддержания осмотического дисбаланса с окружающей средой, а также для сохранения минимального пула метаболитов вплоть до того момента, когда снова создадутся условия для хемотрофного роста.
Фотосинтетический аппарат у квази-фототрофных бактерий слабо выражен, и его трудно зарегистрировать с помощью стандартных морфологических и физиолого-биохимических методов (например, удельное содержание бактериохлорофилла а на два порядка меньше по сравнению с истинной фототрофией).
Независимо от интенсивности и спектрального состава света антенные комплексы квази-фототрофных бактерий сохраняют один и тот же состав, и у них не наблюдается явление фотоакклиматизации. При квази-фототрофии клетки не растут, а только сохраняют жизнеспособность. Наконец, квази-фототрофия никогда не сочетается с автотрофией по углероду (т. е. не бывает «квази-фотосинтеза»).
12.3. Оксигенная фототрофия и аноксигенная фототрофия
Обычно говорят о двух типах фототрофии — оксигенной и аноксигенной. Такое подразделение формально учитывает, входит ли в число побочных продуктов нециклической электрон-транспортной цепи молекулярный кислород. Однако на самом деле речь идет о глубоких различиях в молекулярной организации фотосинтетического аппарата.
Оксигенная фототрофия. При оксигенной (греч. oxis — кислый и genea — рождение; образующий кислород) фототрофии донором электронов для нециклической электрон-транспортной цепи служит Н2О, и побочным продуктом является О2.
Оксигенная фототрофия свойственна всем представителям филы ВХ Cyanobacteria (и только им).
Аноксигенная фототрофия. При аноксигенной (греч. аn — не, oxis — кислый и genea — рождение; не образующий кислород) фототрофии донорами электронов для нециклической электрон-транспортной цепи служат разнообразные органические или неорганические вещества. Однако вода никогда не входит в их число, поскольку в геномах аноксигенных фототрофных бактерий отсутствует ген psbO, который кодирует главный компонент кислородвыделяющего комплекса — марганецстабилизирующий белок.
Аноксигенные фототрофы имеются в филах BVI Chloroflexi, BXI Chlorobi, BXII Proteobacteria и BXIII Firmicutes.
Эволюционная связь между оксигенной фототрофией и аноксигенной фототрофией. Об эволюционной связи между двумя формами фототрофии или разными вариантами аноксигенной фототрофии можно судить по наличию (или отсутствию) гомологии апопротеинов в реакционных центрах или светособирающих антеннах.
Реакционные центры очень консервативны, что облегчает реконструкцию их эволюционной истории. Показано, что апопротеины реакционного центра первой фотосистемы (ФСI) у представителей филы ВХ Cyanobacteria гомологичны апопротеинам реакционного центра у представителей филы BXI Chlorobi и филы BXIII Firmicutes. Сходным образом, апопротеины реакционного центра второй фотосистемы (ФСII) у представителей филы ВХ Cyanobacteria гомологичны апопротеинам реакционного центра у представителей филы ВVI Chloroflexiи филы ВХII Рroteobacteria. Для объяснения этих фактов предложены гипотетические сценарии эволюции фотосинтетического аппарата (см. ниже).
Цианобактерии обладают разнообразными светособирающими антеннами, которые не гомологичны друг другу, а также не гомологичны светособирающим антеннам аноксигенных фототрофных бактерий, которые, в свою очередь, не гомологичны друг другу. Это свидетельствует об их независимом эволюционном происхождении (см. ниже).
12.4. Парадоксы фототрофии
Наша планета находится в относительной близости от Солнца, и световой поток на дневной поверхности достигает 1017 квант • с-1• см_2. Однако ассимиляция, казалось бы, столь богатого и легкодоступного источника энергии не проходит гладко и сопровождается рядом негативных явлений.
«Теневые» стороны фототрофии. Прежде всего, изобилие света даже на открытом месте только кажущееся (см. раздел 12.7.1). Из-за ультрадного (дневного), циркадного (суточного) или сезонного колебания, а также из-за экранирования абиотическими материалами и биологическими конкурентами доступность солнечного света для конкретного потребителя может резко сокращаться.
Кроме того, сама по себе фототрофия имеет несколько «теневых» сторон.
Во-первых, зависимость от света является критическим фактором выживания для облигатных фототрофов, поскольку в темноте они погибают, когда истощаются запасные субстраты.
Во-вторых, на биосинтез фотосинтетического аппарата затрачивается много конструктивного материала, и он лимитирован внешними ресурсами макро- и микроэлементов (в особенности азота и железа).
Втретьих, под воздействием света фотосинтетические пигменты переходят в возбужденное состояние, которое лишь частично дезактивируется путем создания Pmf. Альтернативной ловушкой для избыточной энергии служит молекулярный кислород. В результате его восстановления образуются такие реактивные соединения, как синглетный кислород и гидроксильный радикал. Они атакуют внутриклеточные мишени и вызывают окислительный стресс, что может привести к повреждению микроорганизма и даже к его гибели.
Вопреки всем этим негативным явлениям, фототрофные бактерии очень широко распространены в современной биосфере.
Оксигенные фототрофные бактерии, или цианобактерии встречаются в большинстве ниш и часто образуют гиперпопуляции — цветения.
В отличие от них, аноксигенные фототрофные бактерии приурочены в основном к анаэробным нишам, хотя пурпурные несерные бактерии, которые являются факультативными анаэробами, достаточно широко распространены. По замечанию голландского микробиолога Корнелиса Ван Ниля (С. van Niel), «Они присутствуют почти в любом образце почвы или воды с мелководья». Однако даже в стоячей воде, где интенсивно разлагаются органические остатки, популяции аноксигенных фототрофных бактерий обычно не видны невооруженным глазом. Небольшие цветения пурпурных и зеленых серных бактерий встречаются в анаэробных зонах рек,
канав и прудов, а также в стоячей воде лесов и ботанических садов. Но в основном они развиваются в зоне хемоклина озер, где в летне-осенний период скапливается сероводород.
Что же касается облигатных анаэробов, то они находят для себя анаэробные микрониши, даже находясь в аэробном макроокружении. Например, гелиобактерии впервые были выделены из почвы у подножия ствола клена в штате Индиана (США).
Специфика отношения аноксигенных фототрофных бактерий к молекулярному кислороду. Причина облигатного или факультативного анаэробиоза аноксигенных фототрофных бактерий заключается в том, что молекулярный кислород специфически регулирует биогенез их фотосинтетического аппарата.
Молекулярный механизм этого явления сложен, и многое в нем еще не ясно. Установлено, что при низком парциальном давлении кислорода у пурпурных бактерий повышается уровень транскрипции двух фотосинтетических оперонов — puf (гены полипептидов реакционного центра и внутренней антенны LHI, а также гены, отвечающие за сборку этих структур) и рис (структурные и регуляторные гены периферической антенны LHII). На примере Rhodobacter sp. показано, что с промоторными участками генов в первом из этих оперонов связываются белки РРВР (от англ. puf promoter-binding protein), которые при высоком парциальном давлении кислорода действуют как репрессоры транскрипции. Прочность связи РРВР с промотором зависит от уровня фосфорилирования этих белков, а тот, в свою очередь, контролируется двухкомпонентной сигнальной системой RegB/RegA (мембранная киназа в качестве сенсора и цитоплазматическая киназа в качестве регулятора ответа).
Таким образом, в присутствии кислорода биогенез аноксигенного фотосинтетического аппарата блокируется. После трех последовательных делений его размер сокращается почти на порядок. Клетки начинают испытывать энергетический стресс, и вынуждены переключаться на альтернативную хемотрофную энергетику. Адаптивный переход на хемолитотрофию (за счет водорода или монооксида углерода) встречается исключительно редко. Обычно же встает проблема доступности органического субстрата-энергоносителя, который может быть экзогенным или эндогенным.
Факультативно аэробные аноксигенные фототрофные бактерии — зеленые нитчатые бактерии из филы ВVI Chloroflexi и пурпурные несерные бактерии из филы ВХII Proteobacteria — наделены транспортными системами, которые позволяют им использовать экзогенные органические субстраты и неограниченно долго расти за счет аэробного дыхания. При этом они депигментируются. С уменьшением парциального давления кислорода биогенез фотосинтетического аппарата возобновляется.
Как отметил еще Эрвин Эсмарх (Е. von Esmarch), который в 1886 г. получил первую чистую культуру Rhodospirillum, rubrum из трупа мыши, разложившегося в сосуде с водопроводной водой, по мере врастания в желатиновые пластины желтовато-серые колонии этой факультативно хемотрофной бактерии приобретают насыщенный винный цвет.
Репрессия биогенеза фотосинтетических комплексов при высоком парциальном давлении кислорода физиологически целесообразна. Во-первых, на свету для пигментированных клеток высок риск окислительного стресса. Во-вторых, при дыхании нет смысла расходовать энергию на биогенез фотосинтетического аппарата. Однако если парциальное давление кислорода опускается ниже порогового уровня, биогенез фотосинтетического аппарата дерепрессируется даже в темноте.
Облигатно анаэробные аноксигенные фототрофные бактерии — одноклеточные зеленые бактерии из филы ВХI Chlorobi и гелиобактерии из филы ВХIII Firmicutes — не обладают системами для импорта органики и поэтому являются строгими автотрофами. Естественно, что эти бактерии погибают после истощения своих внутренних питательных ресурсов.
12.5. Из истории изучения фототрофии
Только бактерии и произошедшие от них фототрофные органеллы-пластиды обладают хлорофильными фоторецепторами, которые позволяют им ассимилировать световую энергию. Следовательно, фототрофия — это, по сути, бактериальный феномен. Однако впервые он был изучен не на культурах бактерий, а на высших растениях. Кроме того, вначале предметом исследований была не фототрофия, а основанный на ней путь автотрофной ассимиляции углерода (фотосинтез).
Способность растений накапливать на свету органические вещества была открыта в конце XVIII — начале XIX вв., однако сам термин «фотосинтез» (греч. phos — свет, synthesis — соединение частей) был предложен американским физиологом Чарльзом Барнсом (С. R. Barnes) только в 1893 г. Еще через четыре года Вильгельм Пфеффер обозначил ассимиляцию диоксида углерода термином «автотрофия».
О том, что растение продуктивно взаимодействует своими листьями с солнечным светом, догадывались еще первооткрыватели фотосинтеза — англичанин Пристли (J.Pristley) и голландец Инген-Хуз (J. Ingen-Housz).
В 1817 г. французские химики Пельтье (Р. J. Peletier) и Каванту (J. В. Caventou) выделили из листьев зеленый пигмент и назвали его хлорофиллом (от греч. chloros — зеленый и phyllon— лист).
Мысль о том, что растение преобразует поглощенную энергию в химический потенциал, впервые высказали в 1847 г. немецкие физики Майер (R. Мауег) и фон Гельмгольц (Н. vonHelmholtz). В 1875 г. К. А. Тимирязев с помощью химического микроанализа доказал, что максимальное выделение кислорода и максимальное накопление крахмала наблюдаются в красных лучах, т. е. в той спектральной области, где хлорофилл сильнее всего поглощает видимый свет. Это означало, что фотосинтез подчиняется первому началу термодинамики, или закону сохранения энергии.
Американский биохимик Рабен (S. Ruben) в 1943 г. предположил, что при фотосинтезе неорганический фосфат включается в состав органических соединений. Через пять лет его соотечественники Гест (Н. Gest) и Кэмен (М.Kamen) доказали это в опытах на зеленой водоросли Chlorella pyrenoidosa и пурпурной бактерии Rhodospirillum rubrum, используя радиоизотоп 32Р. Другой американец, Френкель (A. Frenkel) обнаружил в 1954 г. феномен синтеза АТФ из АДФ и неорганического фосфата на свету, или фотофосфорилирование.
Концепция фототрофии приобрела завершенный вид в начале 1960-х годов, когда Питер Митчел разработал теорию хемиосмотического сопряжения электрон-транспортных процессов с фосфорилированием АДФ. Одно из следствий этой теории гласило, что при фототрофии электромагнитная энергия первично ассимилируется не в форме АТФ или другого фосфагена, а в форме трансмембранного электрохимического потенциала — Pmf (см. раздел 10.4).
До конца XIX в. световое питание считалось уникальным свойством зеленых растений. В свою очередь, фотосинтез не мыслили без выделения кислорода. Это предубеждение не развеялось даже после того, как 1880-е годы Энгельман (Т. Engelmann) обнаружил, что пурпурные бактерии проявляют положительный фототаксис. До начала XX в. этих аноксигенных фототрофов принимали запигментированных хемотрофов. Даже гениальный первооткрыватель хемосинтеза С. Н. Виноградский, который наряду с бесцветными серными бактериями описал их пурпурных аналогов, «проглядел» феномен аноксигенной фототрофии.
Первое свидетельство того, что пурпурные бактерии не выделяют кислород и могут ассимилировать органические соединения на свету, получил Молиш (Н. Моlish) в 1907 г. В середине 1920-х годов Будер (Л.Вибег) окончательно доказал, что фотосинтез возможен без выделения кислорода.
В начале 1930-х годов Ван Ниль предложил унифицированную теорию фотосинтеза, согласно которой диоксид углерода восстанавливается «активным водородом» (Н+/е-), образующимся при светозависимом окислении воды:
Н2O + n х hv —> Н+/e- + ОН,
СO2 + 4[Н+/е-] —> (-НСОН-) + Н2O,
где (-НСОН-) означает повторяющуюся группировку в молекуле углевода.
То, что для восстановления углекислоты помимо донора электронов требуется АТФ, установил Френкель в начале 1950-х годов.
После открытия фотофосфорилирования потеряло смысл противопоставление «растительного» оксигенного фотосинтеза и «бактериального» аноксигенного фотосинтеза. Однако цианобактерий до конца 1960-х годов продолжали объединять с водорослями лишь на том основании, что те и другие при фотосинтезе образуют кислород.
Ван Ниль и ученые, разделявшие его взгляды, недооценивали биоэнергетику как главный аспект фотосинтеза. Кроме того, разницу между оксигенным и аноксигенным фотосинтезом они видели в судьбе гидроксильного радикала ОН- (его считали продуктом одноэлектронного окисления Н2O, хотя на самом деле вода окисляется при помощи четырехэлектронного механизма; см. раздел 12.7.4). Считалось, что при оксигенном фотосинтезе гидроксильный радикал превращается в воду и кислород под воздействием каталазы (4OH —> 2Н2O + O2), тогда как при аноксигенном фотосинтезе он восстанавливается пероксидазой до воды за счет вспомогательных неорганических или органических доноров электронов (2OН + DН2 —> 2Н2O + D).
Хотя Ван Ниль ошибся, приняв воду за универсального донора электронов при фототрофии, он вывел правильное cуммарное уравнение:
СO2 + 2Н2D + n х hv —>—> (-НСОН-) + 2D+ Н2O,
где Н2D и D соответственно обозначают восстановленную и окисленную формы донора электронов.
В частном случае, при оксигенном фотосинтезе, восстановителем служит гидрид кислорода (Н2O):
СO2 + Н2O + n x hv —>—> (-НСОН-) + O2.
Во второй половине XX в. сложилось представление о двух фазах фотосинтеза. В первой, световой фазе, энергия квантов улавливается пигментными системами и преобразуется в химическую «ассимилирующую силу» (англ. assimilatory power) — свободную энергию АТФ и низкопотенциального донора электронов, в частности НАДФН. Во второй, темновой фазе, ассимилирующая сила используется для восстановления фосфоглицерата (продукта ферментативной реакции акцептирования
СО2). Продукты восстановления, триозы, превращаются в гексозы, а те — в запасные полигликозиды.
Со временем выяснилось, что истинный характер процессов, протекающих на световой стадии фотосинтеза, не соответствует ее названию. В частности, регенерация АТФ (фосфорилирование) и регенерация НАДФН (НАДФ: донор-оксидо-редуктазная реакция) — это индифферентные к свету энзиматические процессы. Кроме того, оказалось, что восстановительный пентозофосфатный путь, или цикл Кельвина-Бенсона-Бэссема (см. раздел 13.2.5), который представляет собой систему ферментативных реакций, обеспечивающих автотрофный биосинтез триоз и регенерацию акцептора СО2 (1,5-рибулозобисфосфата), не уникален для фототрофов. Многие хемолитотрофы, которые извлекают ассимилирующую силу из реакций окисления неорганических субстратов, также используют этот цикл в своем конструктивном метаболизме.
12.6. Фотосинтетические пигменты
Физической основой фототрофии служат хромофоры (греч. chroma — краска и phoreo — носить) — небольшие органические молекулы, которые благодаря резонансному строению своих внешних электронных оболочек интенсивно поглощают свет в интервале длин волн 300-1200 нм и поэтому ярко окрашены.
Хромофоры действуют в составе фотосинтетического аппарата не автономно, а совместно с полипептидами, которые называются «апопротеинами» — по аналогии с белковой частью ферментов (греч. аро — из и protos — важнейший, в данном случае — протеин; состоящий из белка).
В результате взаимодействия хромофоров и апопротеинов образуются либо хромопротеины, либо пигмент-белковые комплексы. В хромопротеине между хромофором и апопротеином существует ковалентная связь. В пигмент-белковом комплексе хромофор связан с апопротеином нековалентно.
Использование одного и того же термина «апопротеин» применительно к пигментам фототрофов и дегидрогеназам хемотрофов, неслучайно. Специфические ферменты позволяют хемотрофам расти на элективных химических средах. Точно так же специфические пигменты позволяют фототрофам адаптироваться к элективным участкам солнечного спектра. В обоих случаях возникает конкуренция за энергию, что приводит к доминированию более приспособленных членов микробиоты над менее приспособленными.
Апопротеины фотосинтетических пигментов принадлежат к нескольким гетерологичным молекулярным семействам. Структура апопротеина в большей степени, чем тип хромофора, определяет организацию фотосинтетического аппарата.
В ходе эволюции сайты для связывания хромофоров подвергались жесткому селекционному давлению, что привело к образованию нескольких типов консервативных пигмент-белковых комплексов и хромопротеинов.
Разнообразие хромофоров. Хромофоры не только принадлежат к разным классам химических соединений, но и представлены набором молекулярных гомологов и изомеров.
По своей химической природе хромофоры подразделяются на три группы:
— металпорфиноиды (хлорофиллы и хлорофилподобные пигменты);
— полиизопреноиды (каротиноиды);
— линейные тетрапирролы (фикобилины).
Молекулы хлорофиллов и хлорофилподобных пигментов обладают резонансной тетрапиррольной структурой и содержат четыре лиганда для атома металла (Mg или Zn). Благодаря этому они сильно поглощают свет в синей и красной частях спектра, соответственно при длине волны 350-450 и 650-750 нм. Каротиноиды обладают резонансной полиеновой структурой, и их абсорбционный максимум лежит в сине-зеленой части спектра при длине волны 350-500 нм. Фикобилины обладают резонансной тетрапиррольной структурой, что позволяет им поглощать свет с длиной волны 500-650 нм.
Хлорофиллы и хлорофилподобные пигменты образуют с апопротеинами пигмент-белковые комплексы, стабилизированные ионными, координационными и гидрофобными связями, а также ближними силами Ван-дер-Ваальса; особую роль играют остатки His. Каротиноидные хромофоры могут связываться с апопротеином двумя способами — нековалентно (через остатки His) и ковалентно (через остатки Lys); во втором случае образуются интегральные хромопротеины — каротинопротеины. Фикобилиновые хромофоры ковалентно связываются с апопротеинами (через остатки Cys), в результате чего образуются растворимые хромопротеины — фикобилипротеины.
Наиболее распространены тройственные хлорофилл-каротиноид-белковые комплексы. Как правило, они гидрофобны и являются интегральными компонентами СМ или ICM.
12.6.1. Хлорофиллы и хлорофилподобные пигменты
Эти металпорфиноиды в функциональном отношении уникальны, поскольку некоторые из них в возбужденном состоянии передают электроны электрон-транс- портной цепи, следствием чего становится запасание энергии в форме Pmf.
Строение хлорофиллов. Химическая структура хлорофилла а была установлена в 1910-е годы немецким химиком Рихардом Вильштеттером (R. Willstàtter, Нобелевская премия по химии, 1915 г.).
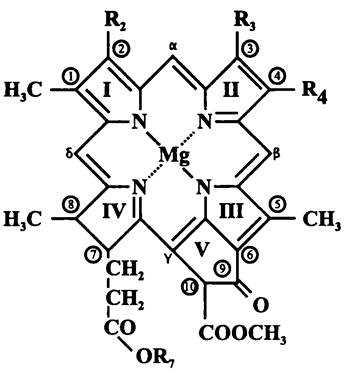
В настоящее время обнаружены одиннадцать хлорофиллов (табл. 13 и рис. 131). Они принадлежат к общему молекулярному семейству, хотя по традиции хлорофиллы цианобактерий и пластид называют собственно хлорофиллами, а хлорофиллы аноксигенных фототрофных бактерий — «бактериохлорофиллами».
Хлорофиллы образуются в генеральном пути биосинтеза порфиноидов (см. раздел 15.3) и являются производными хлорофиллиновой кислоты. Ее порфириновое ядро состоит из пиррольных колец I — IV, связанных между собой в макроцикл с помощью метинильных мостиков (-СН=), которые обозначаются как α, β, y и δ. Сложный эфир хлорофиллиновой кислоты называется феофитином. Если хлорофиллиновая кислота двухосновная, то первый спирт присоединяется к пропио- нильному остатку при пиррольном кольце IV, а второй — к карбоксилу при циклопентановом кольце V. Первый спирт содержит полиизопреноидный радикал -С15- фарнезил, С20-геранилгеранил, С20-фитодиенил или алкильный радикал стеарил. Вторым спиртом всегда является метанол. Если хлорофиллиновая кислота одноосновная (в случае бактериохлорофиллов с, d и е), то сложноэфирная группировка при кольце V отсутствует. Феофитин с хелатированным атомом металла (Mg или Zn) — это и есть хлорофилл. Буквенные обозначения (а, b и т. д.) отражают хронологическую последовательность описания разных молекулярных форм хлорофиллов.
Таблица 13. Структурные и оптические особенности магний-порфиноидов фототрофных бактерий
Mg-порфиноид |
R2 |
R3 |
R4 |
R5 |
R7 |
δ |
max(HM)* |
Хлорофилл |
|||||||
Бактериохло- рофилл а** |
-СО-СН3 |
-СН3 |
-С2Н5 |
Фитил, геранилгеранил |
-Н |
350, 750 |
|
Бактериохло- рофилл b |
-СО-СН3 |
-СН3 |
=СН-СН3 |
— |
Фитил, фитадиенил |
-Н |
350, 800 |
Бактериохло- рофилл с*** |
-СНОН- -СН3 |
СН3 |
-С2Н5, -С3Н7, -С4Н9 |
-СН3 С2Н5 |
Фарнезил, стеарил |
-СН3 |
425,650 |
Бактериохло- рофилл d*** |
-СНОН- СН3 |
СН3 -С3Н7, |
-С2H5, -С2Н5 -С4Н9 -С5Н11 |
-СН3 |
Фарнезил |
-Н |
425, 650 |
Бактериохло- рофилл е*** |
-СНОН- СН3 |
-CHO |
-С2Н5, -С3Н7, -С4Н9 |
-С2Н5 |
Фарнезил |
-СН3 |
425, 650 |
Бактериохлорофилл g |
-СН=СН2 |
-СН3 |
=СН-СН3 |
— |
Геранилгеранил |
-Н |
375, 770 |
Хлорофилл а |
-СН=СН2 |
-СН3 |
-С2Н5 |
— |
Фитил |
-Н |
430, 662 |
Хлорофилл a2 |
-CH=CH2 |
-СН3 |
-CH=CH2 |
— |
Фитил |
-Н |
450, 675 |
Хлорофилл b |
-CH=CH2 |
-CHO |
-С2Н5 |
— |
Фитил |
-Н |
457, 646 |
Хлорофилл b2 |
-CH=CH2 |
-CHO |
-CH=CH2 |
— |
Фитил |
-Н |
475, 650 |
Хлорофилл d |
-CHO |
-СН3 |
-С2Н5 |
— |
Фитил |
-Н |
400, 455, 697 |
Протохлорофиллид * * * * |
|||||||
2,4-дивинил-протохлорофиллид |
-CH=CH2 |
-СН3 |
-CH=CH2 |
-Н |
-Н |
438, 625 |
|
Хлорофилл c1 |
-CH=CH2 |
-СН3 |
-С2Н5 |
— |
-Н |
-H |
446, 628 |
Хлорофилл c2 |
-CH=CH2 |
-СН3 |
-CH=CH2 |
— |
-Н |
-H |
450, 630 |
* — в ацетоновом или эфирном экстракте (для хлорофиллов a2 и b2 — in situ); ** — Zn- порфиноид в случае Acidiphilium rubrum; *** — в положении 10 атом Н; **** — в положении 7:8 двойная связь, в положении 7 акрил -СН=СН-СООН.
Рис. 131. Общая формула хлорофиллов. I — IV — пиррольные кольца; V — циклопентановое кольцо; а — б — метинильные мостики; 1 — 10 — атомы углерода, к которым присоединены боковые радикалы; R2-R4 и R7 — боковые радикалы.
Главные и вспомогательные хлорофиллы. В зависимости от выполняемой ими функции хлорофиллы подразделяются на главные и вспомогательные.
Главные хлорофиллы входят в состав реакционных центров, вспомогательные — в состав светособирающих комплексов.
Известны шесть главных хлорофиллов — хлорофилл а, хлорофилл d, бактериохлорофилл а, Zn-содержащий бактериохлорофилл а, бактериохлорофилл b и бактериохлорофилл g.
В середине 40-х годов XX в. Мэнинг (W.M.Manning) сообщил о том, что в талломах красных водорослей содержится «хлорофилл d», якобы отличающийся по структуре и спектральным свойствам от хлорофиллов а-с. В дальнейшем выяснилось, что это был артефактный продукт, образующийся из хлорофилла а в ходе его выделения. Настоящий хлорфилл d имеется только у цианобактерии Acaryochloris marina, что было доказано с помощью точных физико-химических методов.
Цинксодержащий бактериохлорофилл а был обнаружен во второй половине 1990-х годов у обитателей шахтных сточных вод — ацидофильных аэробных фототрофных бактерий Acidiphilium rubrum и Acidisphaera rubrifaciens.
Вспомогательных хлорофиллов и хлорофилподобных пигментов также несколько. У аноксигенных пурпурных и аэробных фототрофных бактерий один и тот же бактериохлорофилл (а или и) входит в качестве главного хлорофилла в реакционный центр, а в качестве вспомогательного хлорофилла — в светособирающий комплекс. Аноксигенные гелиобактерии не обладают вспомогательными хлорофиллами и светособирающими комплексами; у них имеется только антенна реакционного центра, содержащая бактериохлорофилл g. В отличие от них аноксигенные зеленые бактерии содержат вспомогательные бактериохлорофиллы с, d или е (табл. 13).
Большинство цианобактерий в нормальных физиологических условиях не образует вспомогательных хлорофиллов. Однако при стрессах, вызванных ярким светом или голоданием по железу, у них появляются минорные антенны, в состав которых входит хлорофилл а. У цианобактерий-прохлорофитов обнаружено несколько вспомогательных магнийпорфиноидов:
— хлорофилл 6;
— 2,4-дивинил-хлорофилл а (хлорофилл а2);
— 2,4-дивинил-хлорофилл b (хлорофилл b2);
— хлорофилл d;
— хлорофилподобные Mg-тетрапирролы (дивинил-протохлорофиллид, хлорофилл c1 и хлорофилл с2).
Фотофизика и фотохимия хлорофиллов. Внешняя электронная сфера порфиринового кольца содержит систему конъюгированных двойных связей, образованных делокализованными п-электронами. Поглощение света в синей части спектра обеспечивается резонансной порфириновой структурой, в то время как близкое ему по интенсивности поглощение в красной части спектра связано с присутствием лигандированного катиона магния.
В квантовой химии энергетическое (основное или возбужденное) состояние молекулы выражается «индексом мультиплетности» по формуле: 2 х |Σспиновых чисел| + 1. В невозбужденной пигментной молекуле, содержащей резонансную систему из четного количества делокализован-
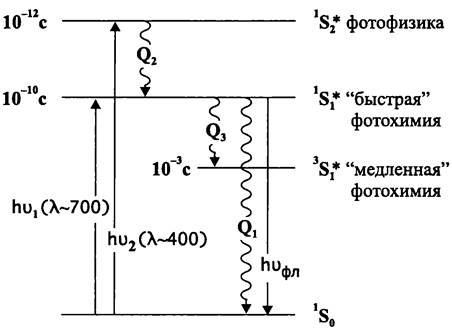
ных р-электронов, сумма спиновых чисел равна нулю, и индекс мультиплетности равен единице (2 x 0 + 1 = 1). Это состояние называется «синглетным» (лат. singularis — одинарный). В молекуле хлорофилла или каротиноида основное состояние является синглетным и обозначается как 1S0 (от англ. state — состояние).
При поглощении кванта видимого света (в случае хлорофилла это «красный» или «синий» квант, что соответствует двум главным максимумам на спектре этого пигмента — 700 и 400 нм) электрон переходит на более высокие свободные орбитали. Поскольку ориентация его спина при этом не изменяется, возникают соответственно первое и второе возбужденные синглетные состояния, которые обозначаются, как и (рис. 132). «Время жизни» электрона в состоянии 1S2* составляет примерно 10-12 с. При очень плотной упаковке пигментов электронные облака индивидуальных молекул частично перекрываются, и возбужденное состояние передаются между ними путем так называемой «внутрисистемной», или синглет-синглетной конверсии:
пигментn(1S*2) + пигментn+1 (1S0) —> пигментn(1S0) + пигментn+1(1S*2).
Рис. 132. Энергетические состояния пигментной молекулы. 1S0 — основное синглетное состояние; 1*S1 и 1S*2 — первое и второе возбужденные синглетные состояния; 3S*1 — возбужденное триплетное состояние; Q1 — Qз — рассеивание энергии в виде тепла; hvфл — рассеивание энергии в виде кванта флуоресценции.
В результате этого энергия направленно мигрирует по антенне и примерно через 10-10 с попадает в реакционный центр.
При избытке короткоживущих возбужденных состояний 1часть энергии рассеивается в виде тепла, и пигмент переходит в более долгоживущее возбужденное состояние 1S*1. Находясь в нем, хлорофилл реакционного центра может вступить в фотохимическую реакцию в качестве донора электронов. В этом и заключается его продуктивная функция при фототрофии.
В качестве альтернативы хлорофилл непродуктивно рассеивает избыточную энергию в тепло или отдает ее путем высвечивания кванта флуоресценции (hvфл).
При накоплении состояний 1S*1электрон может переходить на более низкую орбиталь путем «межсистемной», или синглет-триплетной конверсии (с обращением спина). В этом возбужденном состоянии сумма спиновых чисел равна единице, и индекс мультиплетности равен трем (2 x 1 + 1 = 3). Это состояние называется «триплетным» (лат. triplex — тройной) и обозначается как 3S*1. Время жизни пигмента в нем особенно велико (10-3 с). Это позволяет хлорофиллу взаимодействовать с диффундирующими молекулами, например, молекулярным кислородом (в основном состоянии кислород триплетен):
3хлорофилл* + 3О2 —> 1Хлорофилл + 1О2.
В результате этого кислород активируется, что служит одной из причин окислительного стресса (см. III том учебника).
12.6.2. Каротиноиды
Наряду с хлорофиллами любой фотосинетический аппарат обязательно содержит каротиноиды (греч. caroton — морковь и eidos — подобие; как пигменты у моркови). Они бесцветны или имеют желто-красную окраску разного оттенка при максимуме поглощения 450-470 нм.
Эти полиеновые соединения распространены универсально. Помимо выполнения антенной функции окрашенные каротиноиды служат фактором защиты от окислительного стресса. Это важно для всех аэробных организмов и тем более важно для оксигенных фототрофов, поскольку они сами образуют кислород. Поэтому мутации, блокирующие образование окрашенных каротиноидов из бесцветных предшественников, у оксигенных фототрофов летальны.
Строение каротиноидов. Химическую структуру каротиноидов расшифровали в 1930-е годы швейцарский биохимик Пауль Каррер (Р. Karrer, Нобелевская премия по химии, 1937 г.) и австрийский химик Рихард Кун (R. Kuhn, Нобелевская премия по химии, 1938 г.). Основу молекулы каротиноида составляет изопреновая группа — изомер метилбутадиена (изопрена) с двойной связью, перемещенной в среднее положение:
СН2=С(СН3)-СН=СН2 —> -СН2-С(СН3)=СН-СН2-.
Таким образом, каротиноиды представляют собой отдельную группу полиизопреноидов (см. раздел 15.2). Большинство из них относится к октапреноидам (восемь изопреновых единиц, т. е. 40 атомов углерода). Помимо этого, встречаются «апокаротиноиды» с укороченным углеродным скелетом, а также «гомокаротиноиды», или высшие каротиноиды, которые содержат более восьми изопреновых единиц. Окрашенные каротиноиды имеют систему сопряженных двойных связей, и чем она протяженнее, тем интенсивнее окраска пигмента.
Каротиноиды подразделяют на две основные группы. Каротины (от лат. саго — мякоть) — это ациклические, терминально моноциклические и терминально бициклические полиизопреноиды. Ксантофиллы (греч. xanthos— желтый, phyllon — лист) представляют собой кислородсодержащие производные каротинов, в которых имеются эпокси (-O-), гидрокси (-ОН), кето (-СО-), метокси (-ОСН3) или формильные (-СНО) группы.
С40-каротиноиды синтезируются путем сшивания двух С20-предшественников способом «голова к голове» и в основном имеют trans-конфигурацию. Углеродные атомы нумеруются, начиная с обоих концов молекулы по направлению к ее 15:15' центру (рис. 133).
Рис. 133. Примеры каротиноидов у аноксигеных и оксигенных фототрофных бактерий.
![]() -концевые группы (см. в тексте).
-концевые группы (см. в тексте).
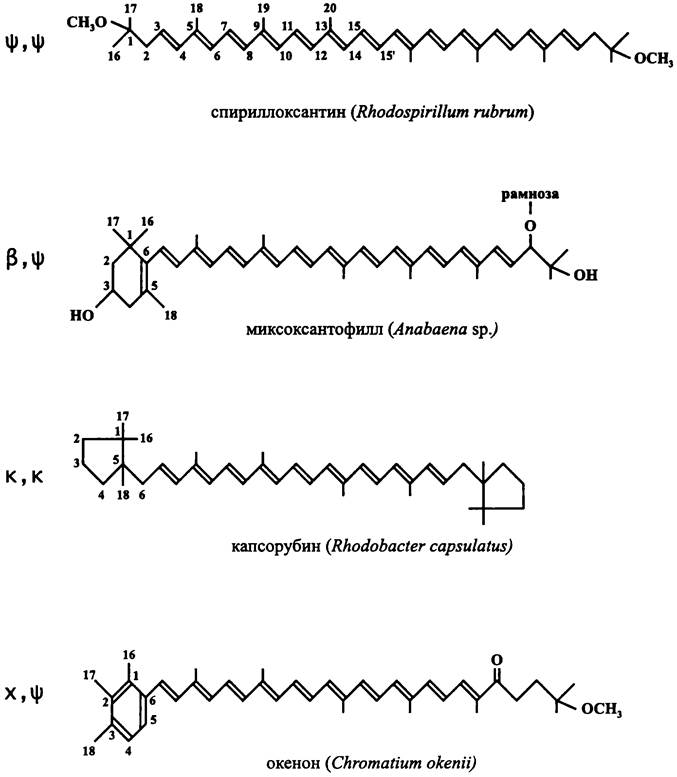
Различают ациклические каротиноиды (![]() каротиноиды») и циклические каротиноиды. Последние содержат концевые циклогексеновые кольца с двойной связью в положении 5:6 («β-каротиноиды») или 4:5 (« ε -каротиноиды»); циклопентановые кольца («к-каротиноиды»); арильные кольца с метильными заместителями в положениях 1,2,5 (
каротиноиды») и циклические каротиноиды. Последние содержат концевые циклогексеновые кольца с двойной связью в положении 5:6 («β-каротиноиды») или 4:5 (« ε -каротиноиды»); циклопентановые кольца («к-каротиноиды»); арильные кольца с метильными заместителями в положениях 1,2,5 (![]() каротиноиды») или 1,2,3 (
каротиноиды») или 1,2,3 (![]() каротиноиды»).
каротиноиды»).
В настоящее время известно до 700 каротиноидов. Некоторые группы фототрофных бактерий содержат специфический набор каротиноидов. В частности, пурпурные бактерии образуют только ациклические каротиноиды. Цианобактерии синтезируют уникальные гликозилированные каротиноиды — миксоксантофилл и осциллоксантин, а также кетокаротиноиды — кантаксантин и эхиненон.
На рис. 133 приводятся примеры каротиноидов у аноксигенных и оксигенных фототрофных бактерий.
Фотофизика каротиноидов. От возбужденной молекулы каротиноида энергия путем синглет-синглетной конверсии (см. выше) передается хлорофиллу, находящемуся в основном состоянии:
1каротиноид + hv —> 1каротиноид*, 1каротиноид* + 1хлорофилл —> 1каротиноид + 1хлорофилл*.
Гарантией эффективности этого процесса служит тесное пространственное расположение молекул каротиноида и хлорофилла. Как следствие, их электронные облака частично перекрываются и попадают в резонанс. Соседние молекулы хлорофилла обмениваются возбужденным синглетным состоянием за 10-12 с. Энергия возбуждения мигрирует по антенне и достигает реакционного центра, где происходят первичные фотохимические процессы.
12.6.3. Фикобилины
Эти хромофоры близки по строению к тетрапиррольным пигментам животного происхождения — биливердину и билирубину, которые образуются при катаболизме гема эритроцитов и входят в состав желчи (греч. phycos — морская трава и лат. bilis — желчь). Фикобилины имеются только у цианобактерий и пластид водорослей из классов Cryptophyceae, Glaucocystophyceae и Rhodophyceae. Описаны четыре группы фикобилинов — фикоцианобилины, фикоэритробилины, фикоуробилины и фикобиливиолины.
Апопротеины фикобилинов — это слабокислые гидрофильные белки, по структуре сходные с глобинами. Они состоят из гомологичных субъединиц α и β (15 и 17 кДа). Билиновые хромофоры присоединяются к апопротеинам через тиоэфирные мостики, которые образуются между винильными радикалами при пиррольных кольцах I и/или IV и сульфогидрильными группами остатков Cys (рис. 134). Положения цистеинильных сайтов оптимизированы в процессе эволюции и высококонсервативны.
Хромопротеины, обладающие фикобилиновыми хромофорами, называются фи- кобилипротеинами. Высокое относительное содержание фикобилипротеинов обеспечивает специфическую окраску клеток цианобактерий. В частности, багряный цвет объясняется накоплением фикоэритрина (греч. phykos — морская трава и erythros — красный), а голубой — фикоцианина (греч. phycos — морская трава, kyaneos — синий).
Рис. 134. Фикобилиновый хромофор, связанный ковалентной связью с отстатком цистеина. I — IV — пиррольные кольца.
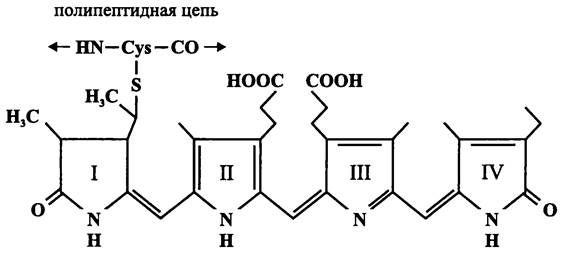
Помимо фикоэритрина и фикоцианина существуют еще семь вариантов фикобилипротеинов, которые различаются своими апопротеинами и хромофорными группами (аллофикоцианин, аллофикоцианин В и др.). Набор хромофоров, их локализация в полипептидной цепи, а также взаимодействие белковых субъединиц определяют спектральные свойства конкретной фикобилипротеиновой светособирающей антенны.
12.7. Светособирающие антенны и реакционные центры
Светособирающие антенны могут состоять или из пигмент-белковых комплексов, или из хромопротеинов. Пигмент реакционного центра всегда находится в комплексе с белком.
Выше мы уже говорили о том, что светособирающие антенны преобразуют энергию квантов света в возбужденное состояние электронных облаков. От периферии антенны возбужденное состояние мигрирует к ее центральной части (кору), а оттуда — к реакционному центру.
Получив возбужденное состояние от светособирающей антенны, реакционный центр его дезактивирует. Это осуществляется путем фотохимической окислительновосстановительной реакции, в которой первичный донор (активированный антенной хлорофилл) отдает электрон первичному акцептору. От первичного акцептора электроны передаются по цепи переносчиков к терминальному акцептору, который расположен на противоположной стороне реакционного центра. Восстановленный терминальный акцептор покидает реакционный центр и переходит в билипидный слой мембраны или в цитоплазму.
Существуют два типа терминальных акцепторов. В первом случае терминальным акцептором служит хинон; он непосредственно окисляется цитохром bc1(b6f)- комплексом, в результате чего создается Рmf (см. раздел 10.4.6). Во втором случае терминальным акцептором служит ферредоксин. Через посредников, роль которых выполняют пиридиннуклеотиды НАД(Ф), он передает электроны цитохром bс1(b6f)-комплексу. Ферредоксин также может быть использован в качестве восстановителя в конструктивных процессах.
12.7.1. Светособирающие антенны
Для чего фототрофам понадобились светособирающие антенны? Субъективный опыт обманчиво подсказывает нам, что на земной поверхности более чем достаточно света. Будь так на самом деле, хлорофилл реакционного центра самостоятельно поглощал бы кванты света, переходил в возбужденное состояние и, находясь в нем, выступал бы в роли восстановителя. Однако это происходит только при очень сильном искусственном освещении (>105 лк), которое разрушительно воздействует на фотосинтетический аппарат. При естественном освещении (<104 лк) такой процесс возможен, но маловероятен.
Сказанное можно подтвердить несложным расчетом на примере оксигенного фотосинтетического аппарата.
Частота актов поглощения квантов света молекулой пигмента (п) равна:
n = 4 • 10-21αNhv
где α = 2,3ε (ε — молярный коэффициент экстинкции), Nhv — величина светового потока (квант • с-1 • см-2).
При ярком дневном освещении световой поток (Nhv) не превышает 1017квант • с-1 • см-2. Значение коэффициента α для хлорофилла α составляет 3 • 104. Таким образом, согласно приведенной формуле, молекула хлорофилла за одну секунду может поглотить только 12 квантов.
Еще в 1930-е годы Эмерсон (R.Emerson) экспериментально установил, что при 25°С элементарная фотосинтетическая реакция (2Н2О —> 4Н+ + 4е- + О2) занимает по времени 2 • 10-2 с. Поскольку для переноса одного электрона по электрон-транспортной цепи реакционные центры ФСI и ФСII поглощают каждый по одному кванту, на образование одной молекулы кислорода уходит 8 (4 x 2) квантов. Следовательно, для элементарной фотосинтетической реакции нужно, чтобы за 2 • 10-2 с были поглощены 8 квантов (т. е. 400 квантов с-1). Напомним, что одна молекула хлорофилла поглощает всего 12 квантов в секунду. Таким образом, транспорт электронов только в том случае не будет лимитироваться светом, если в фоторецепторном акте примет участие светособирающая антенна, размер которой составляет как минимум 35 молекул хлорофилла (400:12).
С размером антенны неразрывно связано понятие «размер фотосинтетической единицы» (англ. photosynthetic unit size, PSU size). Так обозначается количество молекул антенного пигмента, в первую очередь антенного хлорофилла, которое приходится на молекулу хлорофилла, выполняющего роль первичного донора в реакционном центре. У разных фототрофов эта величина составляет от нескольких десятков до нескольких десятков тысяч.
Светособирающие антенны поглощают кванты света длиной волны 400-700 нм и энергией 1-3,5 эВ. Возбужденное синглетное состояние (см. рис. 139) мигрирует по антенне путем синглет-синглетного переноса и достигает хлорофилла реакционного центра через 10-10 с.
Тип реакционного центра и тип светособирающей антенны служат критерием биоразнообразия фототрофных бактерий и определяют нишу, которую они занимают.
Тип светособирающей антенны зависит от многих факторов:
— первичной и вторичной структуры апопротеина;
— профиля гидропатичности полипептидной цепи (ее взаимодействия с билипид- ным слоем мембраны, в зависимости от этого различают интегральные и периферические антенны);
— позиции сайтов для связывания хромофоров;
— структуры хромофора;
— способа сборки антенны из отдельных субъединиц;
— расположения антенны относительно реакционного центра;
— связи антенны с СМ или ICM;
— ориентации надмембранной антенны относительно цитоплазматического компартмента;
— способности антенны адаптивно изменять свой состав при фотоакклиматизации.
Если антенна структурно совмещается с реакционным центром, ее называют «антенной реакционного центра» (англ. core antenna). Во всех остальных случаях антенна и реакционный центр обособлены друг от друга, и тогда антенна называется светособирающим комплексом (англ. light-harvesting complex, LHC).
Светособирающий комплекс подразделяется на внутреннюю антенну (англ. internal antenna) и периферическую антенну (англ. peripheral antenna). Внутренняя антенна занимает проксимальное положение по отношению к реакционному центру и имеет постоянный состав. Периферическая антенна занимает дистальное положение по отношению к реакционному центру и может изменять свое строение при фотоакклиматизации, когда клетка приспосабливается к использованию света другой интенсивности и/или другого спектрального состава. В некоторых случаях она даже обладает механической подвижностью в плоскости мембраны, что позволяет
ей реориентироваться по отношению к реакционному центру (феномен так называемой «мобильной антенны»).
12.7.2. Реакционные центры
Когда хлорофилл реакционного центра переходит в возбужденное состояние, он становится сильным восстановителем и спонтанно окисляется. Электрон передается по градиенту потенциальной энергии через цепь переносчиков к терминальному акцептору. В результате пополняется мембранный или цитоплазматический пул восстановителя, соответственно хинона или ферредоксина.
Окисленный первичный донор является сильным окислителем. Возникшая в нем электронная вакансия заполняется электроном, поступающим от цитохром bc1(b6f)- комплекса или от неорганического субстрата, который используется в качестве экзогенного донора электронов. В обоих случаях электрон передается по градиенту потенциальной энергии.
Как показал молекулярно-генетический анализ фототрофных бактерий и пластид, реакционные центры эволюционно консервативны. Все их известные варианты сводятся к двум основным типам — RCI и RCII (табл. 14).
Реакционный центр RCI-типа. Этот реакционный центр также называют реакционным центром [FenSn]-типа, поскольку терминальным акцептором электронов в нем служит железосерный кластер.
RCI используется в качестве единственного реакционного центра одноклеточными зелеными бактериями (фила BXI Chlorobi) и гелиобактериями (фила ВХIII Firmicutes). Кроме того, RCI входит в состав ФСI у оксигенных фототрофов — цианобактерий (фила ВХ Cyanobacteria) и произошедших от них пластид.
Строение RCI было реконструировано в середине 1990-х годов на основе результатов рентген-структурного анализа; модельным объектом послужила одноклеточная цианобактерия Synechococcus sp. РСС 6301.
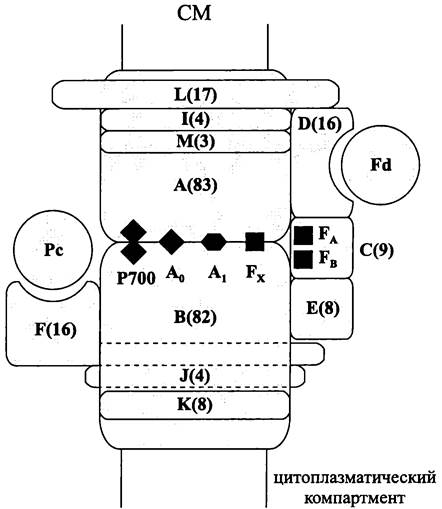
RCI образован двумя гомологичными «тяжелыми» (80 кДа) полипептидами, которые произошли от одного эволюционного предшественника. Партнеры в таком «гетеродимере» состоят из одиннадцати трансмембранных доменов каждый.
Первичным донором электронов служат две кооперированные молекулы хлорофилла, или «димер первичного донора». Терминальным акцептором является «связанный», или входящий в состав реакционного центра ферредоксин. Экзоплазматическая сторона RCI имеет высокий (+500 мВ), а цитоплазматическая сторона низкий (-500 мВ) редокс-потенциал.
Помимо двух-четырех специализированных молекул хлорофилла, участвующих в окислительно-восстановительных реакциях, RCI содержит разное количество (до ста) молекул антенного хлорофилла. Функцию апопротеинов антенны реакционного центра выполняют шесть N-концевых доменов у обоих партнеров гетеродимера.
Реакционный центр RCII-типа. Его еще называют реакционным центром Q-типа, поскольку терминальным акцептором электронов в данном случае служит хинон.
RCII используется в качестве единственного реакционного центра нитчатыми зелеными бактериями (фила ВVI Chloroflexi), а также пурпурными и квази-фототрофными бактериями (фила ВХII Proteobacteria). Кроме того, RCII входит в состав ФСII у оксигенных фототрофов — цианобактерий (фила ВХ Cyanobacteria) и произошедших от них пластид.
Таблица 14. Реакционные центры, фотосистемы и их апопротеины
Фила |
Реакционный центр |
Фотосистема |
Апопротеин |
|||||
Реакционного центра |
Антенны реакционного центра |
|||||||
_I II |
I II |
I II |
I II |
|||||
Аноксигенные бактерии |
||||||||
BVI Chloroflexi |
— |
RCII |
— |
GbRC* |
— |
L/M** |
— |
— |
BXI Сhlorobi |
RCI |
— |
PSC*** |
(PscA)2 |
— |
(PscA)2 |
||
ВХII Proteobacteria |
RCII |
PbRC**** |
L/M |
|||||
ВХIII Firmicutes |
RCI |
— |
psh***** |
— |
(PshA)2 |
— |
(PshA)2 |
— |
Оксигенные бактерии |
||||||||
ВХ Cyanobacteria |
RCI |
RCII |
PSI |
PSII |
PsaA/PsaB |
D1/D2 |
PsaA/PsaB |
СР43/CP47 |
* — комплекс реакционного центра нитчатых зеленых бактерий (от англ. green filamentous bacteria reaction centre complex); ** — легкая (от англ. light) и средняя (от англ. medium) субъединицы; *** — фотосистема одноклеточных зеленых бактерий (от англ. photosystem of Chlorobium)] **** — комплекс реакционного центра пурпурных бактерий (от англ. purplebacteria reaction centre complex); ***** — фотосистема гелиобактерий (от англ. photosystem of heliobacteria).
Строение RCII было реконструировано в середине 1980-х годов на основе результатов рентген-структурного анализа; модельным объектом послужила содержащая бактериохлорофилл b пурпурная несерная бактерия Rhodopseudomonas viridis.
RCII образован двумя гомологичными «легкими» (40 кДа) полипептидами, которые произошли от одного эволюционного предшественника. Партнеры в таком «гетеродимере» состоят из пяти трансмембранных доменов каждый.
Первичным донором электронов служат две кооперированные молекулы хлорофилла, или «димер первичного донора». Терминальным акцептором является хинон. Экзоплазматическая сторона RCI имеет высокий (от +500 до +1000 мВ), а цитоплазматическая сторона низкий (-100 мВ) редокс-потенциал.
У зеленых нитчатых и пурпурных бактерий гетеродимер RCII лишен светособирающих хлорофиллов, и их единственная фотосистема не обладает антенной реакционного центра. У оксигенных фототрофов роль апопротеинов антенны реакционного центра ФСП выполняют две дополнительные субъединицы, каждая из которых состоит из шести трансмембранных доменов и связывает до двадцати молекул хлорофилла.
Филогения реакционных центров. В результате молекулярного секвенирования установлено, что субъединицы гетеродимера L/M (реакционный центр нитчатых зеленых, пурпурных и квази-фототрофных бактерий) гомологичны субъединицам гетеродимера D1/D2 (реакционный центр ФСII).
В свою очередь, субъединицы D1/D2 и субъединицы антенны реакционного центра ФСII гомологичны соответственно пяти С-концевым и шести N-концевым доменам гетеродимера RCI.
Предполагается, что в ходе эволюции архаичная субъединица, имевшая 11 (5+6) трансмембранных доменов, фрагментировалась на субъединицу из пяти доменов и субъединицу из шести доменов. Первая из них дала начало субъединицам L/М и D1/D2, а вторая — субъединице антенны реакционного центра ФСII. Таким образом, все реакционные центры связаны между собой общим эволюционным происхождением.
12.7.3. Аноксигенная фототрофия
Аноксигенные фототрофные бактерии принадлежат к четырем филам (BVI Chloroflexi, BXI Chlorobi, ВХII Proteobacteria и ВХIII Firmicutes).
Одни из них содержат реакционный центр RCI-типа, другие — RCII-типа. Эти реакционные центры обслуживаются разнообразными антеннами, которые состоят из интегральных или периферических хлорофилл-каротиноид-белковых комплексов.
Размер фотосинтетической единицы у аноксигенных фототрофов варьирует от нескольких десятков (у гелиобактерий и некоторых пурпурных бактерий) до нескольких десятков тысяч (у некоторых зеленых бактерий). В первом случае мы имеем дело со «светолюбивыми», а во втором случае — с «теневыносливыми» микроорганизмами, которые заселяют разные этажи эуфотической зоны водоемов.
12.7.3.1. Пурпурные бактерии, квази-фототрофные бактерии (фила ВХII Proteobacteria) и нитчатые зеленые бактерии (фила ВVI Chloroflexi)
У пурпурных и квази-фототрофных бактерий фотосинтетический аппарат чаще всего входит в состав модульных элементов ICM — хроматофоров сферической, трубчатой, пластинчатой или дисковидной формы (см. I том учебника). Некоторые виды (например, Rhodospirillum tenue) хроматофоров не образуют, и их фотосинтетический аппарат сосредоточен в СМ. Светособрающие антенные комплексы пурпурных бактерий только интегральные.
Нитчатые зеленые бактерии, за редкими исключениями, не образуют ICM, и их фотосинтетический аппарат входит в состав СМ. Помимо интегральной антенны они содержат периферическую антенну — хлоросому (не имеют хлоросом только Heliothrix oregonensis и Roseiflexus castenholzii).
Реакционный центр. У перечисленных бактерий он принадлежит к RCII-типу, выполняет роль цитохром: хинон-оксидоредуктазы и состоит из трех субъединиц, каждая из которых представлена единственной копией:
— L (от англ. light — легкий);
— М (от англ. medium — средний);
— Н (от англ. heavy — тяжелый).
Субъединицы L (18 кДа; ген pufL) и М (21 кДа; ген pufМ) содержат по пять трансмембранных α-спиралей. Субъединица Н (17 кДа; ген puhA) названа «тяжелой» из-за самой высокой электрофоретической подвижности, хотя в действительности из трех субъединиц она наименьшая и состоит из единственной трансмембранной α-спирали, а также из цитоплазматического С-концевого домена, который кэппирует цитоплазматические домены L/M-субъединиц.
Гетеродимер субъединиц L/М связывает десять кофакторов, а именно:
— четыре молекулы бактериохлорофилла α или b;
— две молекулы бактериофеофитина α или b;
— две молекулы убихинона-10 или менахинона-8;
— атом негеминового железа, лигандированный остатками His и выполняющий структурную роль;
— молекулу каротиноида (моно-сis-спириллоксантина), защищающую реакционный центр от фотоокисления.
У пурпурных бактерий существуют два варианта RCII. В одном из них (у Rhodobacter sphaeroides) донором электрона служит растворимый цитохром с (рис. 135, А). В другом (Thermochromatium tepidum или Blastochloris viridis) донор электрона — это полуинтегральный тетрагемовый цитохром с (рис. 135, Б).
Рис. 135. Реакционный центр пурпурных бактерий (по: Пиневич, Аверина, 2002). А — комплекс из трех субъединиц; Б — комплекс из четырех субъединиц; L, М и Н — субъединицы реакционного центра; гем с х 4—тетрагемовый цитохром с; Р870 — первичный донор; ВL-бактериохлорофилл активной ветви; Вм-бактериохлорофилл неактивной ветви; РhL-бактериофеофитин активной ветви; Рhм-бактериофеофитин неактивной ветви; QA-«первичный» хинон; Qв — «вторичный» хинон; Fе — атом железа; — хинон, связывающий реакционный центр с хинонным пулом; с552 — растворимый цитохром с.
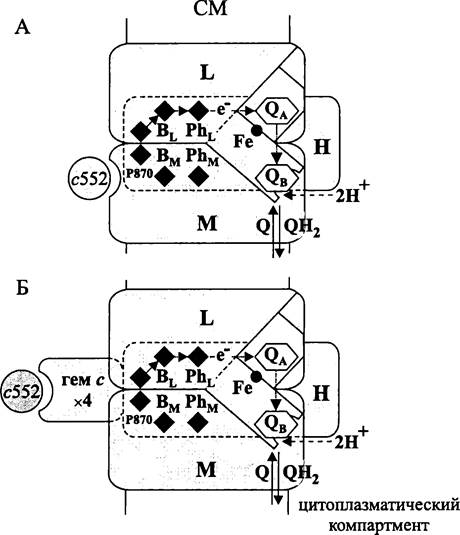
По данным рентген-кристаллографии препаратов RCII, полученных из хроматофоров В. viridis, гетеродимер L/M обладает билатеральной квази-симметрией, ориентируется перпендикулярно к поверхности мембраны и связывает две ветви кофакторов-переносчиков. Физиологически активна только та из них, которая приурочена к L-субъединице.
Две из четырех молекул бактериохлорофилла лежат на оси симметрии гетеродимера L/M у экзоплазматической поверхности мембраны. Благодаря своему близкому взаимному расположению они образуют кооперативную резонансную структуру, или «димер». Это первичный донор — Р870* (от англ. pigment — пигмент). Цифра обозначает положение плеча у главного максимума на спекте поглощения (в нм). После окисления первичного донора плечо исчезает и вновь появляется при заполнении электронной вакансии.
Третья молекула бактериохлорофилла BL(от англ. bacteriochlorophyll и left — левый) входит в состав физиологически активной левой ветви. Она выполняет роль промежуточного акцептора и за 10-12 с получает электрон от возбужденного димера Р870* (-750 мВ). Окисленный первичный донор Р870+ (+480 мВ) за 3 • 10-7 с заполняет свою электронную вакансию электроном, полученным либо от «растворимого» моногемового цитохрома с552 (с2) с редокс-потенциалом +400 мВ, либо от тетрагемового цитохрома с (редокс-потенциалы соответственно -60, +20, +320 и +380 мВ). Первый из них связан с экзоплазматическим доменом М-субъединицы нековалентно, второй — ковалентно через тиоэфирный мостик.
Восстановленный акцептор BL через 2 • 10-11с передает электрон первичному акцептору — бактериофеофитину PhL (-400 мВ). Тот, в свою очередь, за 2 • 10-10 с восстанавливает молекулу «первичного» хинона Qa, которая взаимодействует с М- субъединицей (-110 мВ). Наконец, Qa через 10-4 с передает электрон «вторичному» хинону Qb, который связан с L-субъединицей и выполняет роль терминального акцептора (-10 мВ). После повторного восстановления Qb он протонируется через водный канал, сообщающийся с цитоплазматическим компартментом, теряет сродство к реакционному центру и переходит в хинонный пул (см. раздел 10.4.6). Освободившееся место занимает одна из молекул окисленного хинона.
На примере R. sphaeroid.es показано, что два реакционных центра RCII образуют функциональный суперкомплекс с цитохром bc1-комплексом и одной молекулой цитохрома c2.
Антенные комплексы. Реакционный центр пурпурных и квази-фототрофных бактерий получает энергию от интегральных светособирающих комплексов — проксимального LHI и дистального LHII.
Комплекс LHI окружает реакционный центр. За исключением некоторых мутантов, его присутствие обязательно. Комплекс LHII расположен с внешней стороны комплекса LHI и передает ему поглощенную энергию. У некоторых пурпурных бактерий, например, Rhodospirillum rubrum, он отсутствует. Молекулярное строение антенных комплексов у пурпурных бактерий изучено для видов, содержащих бактериохлорофилл а (870-890 нм). Сведения для Rhodopseudomonas viridis и других видов, содержащих бактериохлорофилл b (1020 нм), ограниченны и противоречивы.
Проксимальный комплекс LHI обозначается как В870 (от англ, bulk — преобладающий). Цифра соответствует положению (в нм) главного «дальнего» красного максимума на спектре поглощения. Апопротеины этого комплекса — взаимно гомологичные полипептиды α (6,5 кДа; ген pufA) и β (5,5 кДа; ген pufB). Они состоят из 50-60 аминокислотных остатков и образуют по одному интегральному домену. Гетеродимер αβ содержит две молекулы бактериохлорофилла α (870 нм) и две молекулы каротиноида (рис. 136, А). Сайтами для связывания обоих пигментов служат консервативные остатки His-32 (α) и His-38 (β). Шесть гетеродимеров образуют разомкнутое кольцо, что позволяет молекулам хинона перемещаться между реакционным центром и цитохром bc1-комплексом (рис. 136, Б).
Рис. 136. Светособирающая антенна пурпурных бактерий. А — интеграция антенны в мембрану (в разрезе); Б — организация фотосинтетической единицы (в плоскости мембраны); LНI и LНII — проксимальная и периферическая антенны; α и β — апопротеины; RС— реакционный центр; bс — цитохром bс-комплекс; Бхл — бактериохлорофилл.
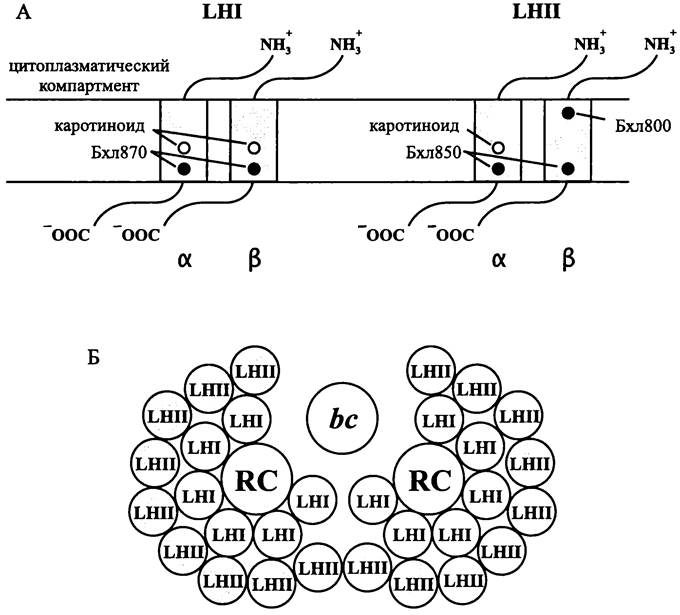
Периферический комплекс LHII обозначается как В800-850. Цифры соответствуют положению (в нм) двух главных «дальних» красных максимумов на спектре по-
глощения. Апопротеины этого комплекса — взаимно гомологичные полипептиды α (6,5 кДа; ген рисА) и β (5,5 кДа; ген рисВ). Гетеродимер αβ связывает две молекулы бактериохлорофилла α (850 нм), одну молекулу бактериохлорофилла α (800 нм) и одну молекулу каротиноида (рис. 136, А).
На один гексамер комплекса LНСI у R. capsulatus приходится восемь-девять комплексов LНСII (рис. 136, Б). Конкретное соотношение варьирует у разных пурпурных бактерий, кроме того, у одного и того же штамма оно зависит от интенсивности света — на ярком свету уменьшается относительная доля комплекса LНСII.
Реакционный центр нитчатых зеленых бактерий получает энергию от интегральных антенных комплексов, работающих в сочетании с перферической антенной — хлоросомой (см. ниже).
12.7.3.2. Одноклеточные зеленые бактерии (фила BXI Chlorobi) и гелиобактерии (фила BXIII Firvnicutes)
Эти бактерии никогда не образуют ICM, и их фотосинтетический аппарат содержится в СМ. Подобно нитчатым зеленым бактериям, одноклеточные зеленые бактерии содержат антенны двух типов — интегральную и периферическую (хлоросому). Гелиобактерии не обладают светособирающим комплексом, и обходятся только одной антенной реакционного центра (см. раздел 12.7.1).
Реакционный центр. У одноклеточных зеленых бактерий реакционный центр принадлежит к RCI-типу и образован гомодимером «тяжелых» интегральных полипептидов PscA молекулярной массой 80 кДа (рис. 137, А). Каждый из них состоит из одиннадцати трансмембранных доменов и связывает до двадцати молекул бактериохлорофилла и до трех молекул каротиноида. Первичный донор Р840* (-1000 мВ) представлен «димером» бактериохлорофилла α. Редокс-потенциал пары Р840+/Р800 составляет +500 мВ. Предполагаемый первичный акцептор — это этерифицированный фарнезолом хлорофилл α (хлорофилл α663). Промежуточными переносчиками электронов служат от одного до трех [Fe4S4]-центров. Вопрос о том, входит ли в число кофакторов реакционного центра, связанный хинон, остается дискуссионным. Роль терминального акцептора электронов выполняет периферическая субъединица PscB — связанный ферредоксин, обладающий двумя [Fе4S4]-центрами. Он гомологичен субъединице PsaC, которая у цианобактерий и пластид входит в состав ФСI (см. ниже). В качестве донора электронов для Р840+ (+1100 мВ) используется парная субъединица PscC — амфипатический цитохром cz (20 кДа).
Рис. 137. Реакционные центры одноклеточных зеленых бактерий (А) и гелиобактерий (Б). РsсА и РshА — интегральные субъединицы; Р840 и Р798 — первичные доноры; СhI — хлорофилл а; Сhо — 4-гидроксиэтил-хлорофилл а; [Fe4S4] — железо-серный кластер; РsсС — цитохром с; РsсВ — терминальный акцептор (растворимый ферредоксин); РsсD — периферическая субъединица, лишенная простетической группы.
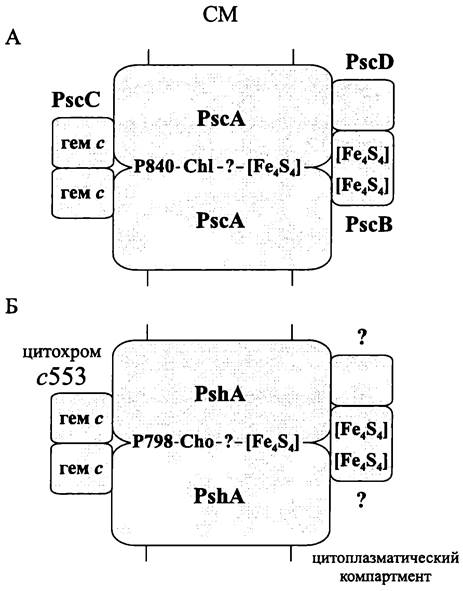
Реакционный центр гелиобактерий (рис. 137, Б) образован гомодимером тяжелых интегральных полипептидов PshA (80 кДа). Оба состоят из одиннадцати трансмембранных доменов и связывают по шестнадцать молекул бактериохлорофилла g. Первичный донор Р798* (-1000 мВ) представлен «димером» бактериохлорофилла g. Редокс-потенциал пары Р798+/Р798 составляет +500 мВ. Наиболее вероятным первичным акцептором является 4-гидроксиэтил-хлорофилл α. Промежуточными переносчиками, как и у одноклеточных зеленых бактерий, являются один-три [Fe4S4]- центра. Роль терминального акцептора электронов, скорее всего, выполняет «связанный» ферредоксин, содержащий два [Fe4S4]-центра. В качестве донора электронов для Р798+ (+110 мВ) используется амфипатический липопротеин — цитохром с553. На один реакционный центр приходятся не менее двух его молекул. Пул молекул цитохрома с553 состоит из нескольких форм с редокс-потенциалами от -90 до +215 мВ. У Heliobacillus mobilis молекулярные массы двух форм цитохрома с553 составляют 18 и 50 кДа. В свою очередь, у Heliobacterium gestii выявлены три формы цитохрома с553 молекулярными массами 18, 32 и 42 кДа. Гены низкомолекулярной формы цитохрома с553 у двух этих видов взаимно гомологичны.
Антенные комплексы. Реакционный центр одноклеточных зеленых бактерий получает энергию от системы интегральных и периферических антенн. Периферическая антенна, хлоросома, у одноклеточных зеленых бактерий охарактеризована лучше, чем у нитчатых Chloroflexi.
Хлоросома представляет собой компартмент высотой 12-60, шириной 25-100 и длиной 25-250 нм, прикрепленный к внутренней поверхности СМ (рис. 138). Она окружена однослойной неунитарной мембраной толщиной 2-3 нм, состоящей из моногалактозил-диглицерида. Внутри она заполнена агрегатами пигмент-белкового комплекса В750, содержащего бактериохлорофилл с, d или е (некоторые виды, например, Chlorobium vibrioforme одновременно содержат бактериохлорофиллы с и d).
Белковые субъединицы комплекса В750 имеют молекулярную массу 5,5 кДа и связывают по семь молекул бактериохлорофилла. Субъединицы объединяются в гексамеры размером 5x10 нм, гексамеры — в продольно лежащие «стержни» (англ. rod) диаметром 5-10 нм и числом 10-30.
Рис. 138. Хлоросома. В750 — периферическая антенна; В800 — промежуточная антенна; В808 — проксимальная антенна; RC — реакционный центр; FMO — белок FMO; Бхл — бактериохлорофилл.
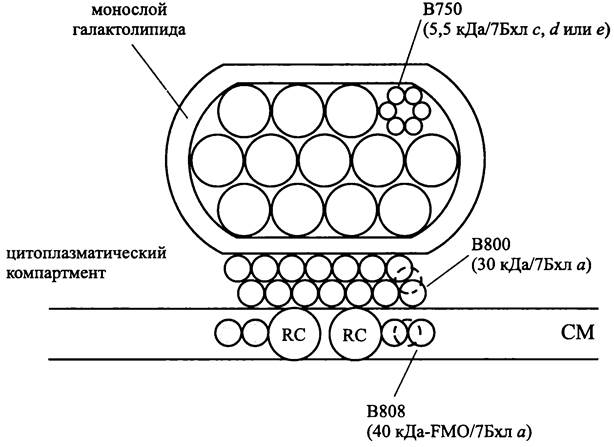
Всего в состав хлоросомы может входить до 104 молекул бактериохлорофилла. Каждая хлоросома взаимодействует с 5-10 реакционными центрами.
Размер хлоросомы не изменяется в онтогенезе, хотя варьирует у разных видов. Количество хлоросом, от нескольких десятков до двух-трех сотен на клетку, находится в обратной зависимости от интенсивности освещения.
Интегральная антенна одноклеточных зеленых бактерий состоит из тримеров белка молекулярной массой 40 кДа, который связывает по семь молекул бактериохлорофилла α (В808). Это так называемый «белок FMO» (от первых букв фамилий его первооткрывателей — R. Е. Fenna, В. W. Matthews и J. М. Olson).
В основании хлоросомы располагается так называемая базальная пластинка (англ, baseplate) толщиной 5-6 нм. Она имеет паракристаллическое строение и состоит из гидрофильного белка молекулярной массой 30 кДа, связывающего семь молекул бактериохлорофилла α (В800).
Базальная пластинка выполняет роль посредника, а возможно и распределителя энергии между хлоросомой и интегральными антеннами, связанными с отдельными реакционными центрами.
12.7.4. Оксигенная фоторофия
Главный прорыв в изучении оксигенной фототрофии был совершен только после освоения методов культивирования цианобактерий, получения их мутантов и разработки для них систем генетической рекомбинации. До этого с целью изучения молекулярных основ оксигенной фототрофии использовали изолированные хлоропласты.
В 1937 г. американский биохимик Робин Хилл (R. Hill) открыл химическую реакцию, позднее названную в честь него «реакцией Хилла». Она происходит на свету при условии, что в инкубационную среду, не содержащую никаких других доноров электронов кроме воды, вносится искусственный акцептор электронов (например, Fe3+). Побочным продуктом реакции Хилла является молекулярный кислород:
Н2О + А —> АН2 + 1/2О2.
Детали сложных физических и биохимических процессов, скрывающихся за этим простым уравнением, прояснились только через 20 лет. На протяжении 1950-1960 гг. были идентифицированы промежуточные переносчики электронов от воды к искусственному акцептору и установлена последовательность их взаимодействия. Важнейшим шагом вперед стало открытие цепи окислительно-восстановительных реакций, протекающих согласно так называемой «Z-схеме» (см. рис. 139). В интактных клетках акцептором электронов при светозависимом окислении воды служит НАДФ, восстановленная форма которого используется при ассимиляции СО2.
В конце 1950-х годов группа американских исследователей под руководством Эмерсона обнаружила парадоксальный эффект — вызывающий слабую реакцию Хилла «дальний» красный свет (![]() 700 нм) усиливает фотосинтетическую эффективность действия «ближнего» красного света (
700 нм) усиливает фотосинтетическую эффективность действия «ближнего» красного света (![]() 700 нм). Тщательно изучив это явление, Хилл и Бендал (R. Bendall) в 1960 г. предположили, что у оксигенных фототрофов существуют две сопряженные фотохимические реакции, которые катализируются соответственно «коротковолновой» и «длинноволновой» фотосистемами. Общее уравнение оксигенного фотосинтеза выглядит следующим образом:
700 нм). Тщательно изучив это явление, Хилл и Бендал (R. Bendall) в 1960 г. предположили, что у оксигенных фототрофов существуют две сопряженные фотохимические реакции, которые катализируются соответственно «коротковолновой» и «длинноволновой» фотосистемами. Общее уравнение оксигенного фотосинтеза выглядит следующим образом:
СО2 + 2Н2О + 4hv1 + 4hv2 —> [СН2О] + Н2О + О2.
Рис. 139. Электрон-транспортная цепь оксигенных фототрофных бактерий. PSI — первая фотосистема; PSII — вторая фотосистема; Р700* и Р680*—возбужденные первичные доноры; Р700+ и Р680+—окисленные первичные доноры; А0, A1, Fx, FAи FB — переносчики электрона в первой фотосистеме; Fd — растворимый ферредоксин; Ph, QAи QB-переносчики электрона во второй фотосистеме; Fe— «структурный» атом железа; Мn — марганцевый кластер кислородвыделяющего комплекса; Yz —остаток Туг-161, PQ — пластохинонный пул; bL, bн, f и R— простетические группы цитохром b6f- комплекса; с553 — растворимый цитохром с.
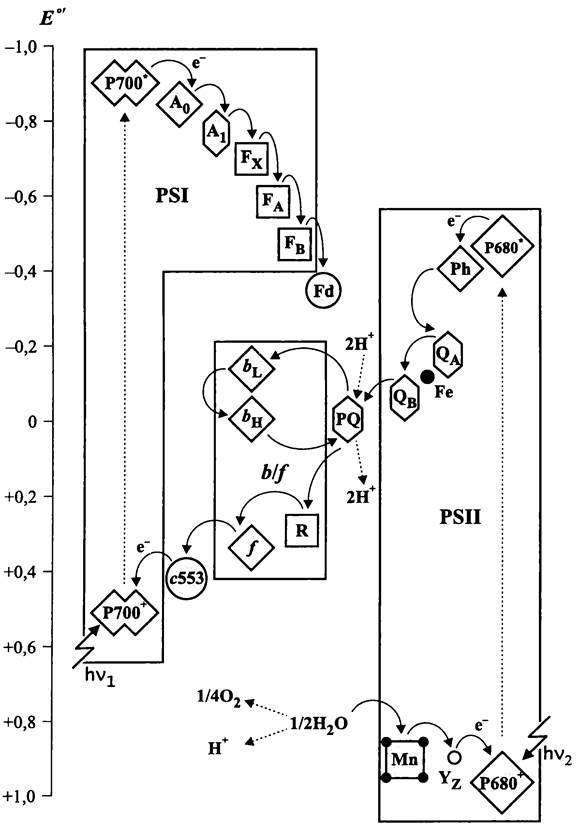
Исследования, проведенные в начале 1960-х годов на красной водоросли Porphyridium cruentum, показали, что «дальний» красный свет (![]() ~700 нм) активирует редокс-систему, окисляющую цитохром f. В то же время «ближний» красный свет i
~700 нм) активирует редокс-систему, окисляющую цитохром f. В то же время «ближний» красный свет i![]() ~680 нм) используется редокс-системой, которая восстанавливает цитохром f. Позднее эти редокс-системы получили название фотосистем (ФС) I и II. Путем их фракционирования было показано, что «дальний» красный свет действительно вызывает реакции, происходящие в ФСI, а «ближний» красный свет — в ФСII.
~680 нм) используется редокс-системой, которая восстанавливает цитохром f. Позднее эти редокс-системы получили название фотосистем (ФС) I и II. Путем их фракционирования было показано, что «дальний» красный свет действительно вызывает реакции, происходящие в ФСI, а «ближний» красный свет — в ФСII.
В середине 1970-х годов сложилось представление о том, что после поглощения «ближних» красных квантов электроны передаются внутри ФСII от компонента Y компоненту Q, а для регенерации компонента Y используются электроны, полученные при ферментативном окислении воды. Компонент Q через цепь переносчиков, одним из которых является цитохром f, передает электроны компоненту Р700, входящему в состав ФСI. В свою очередь, после поглощения «дальних» красных квантов электроны передаются внутри ФСI от компонента Р700 компоненту X, который используется для восстановления НАДФ.
Первая фотосистема. ФСI работает по принципу светозависимой цитохром c6 (пластоцианин): ферредоксин-оксидоредуктазы. Иными словами, она переносит электроны от донора (цитохрома b6 или пластоцианина), связанного с экзоплаз- матической поверхностью мембраны, к акцептору (ферредоксину), который взаимодействует с цитоплазматической поверхностью.
ФСI очень консервативна — у разных цианобактерий аминокислотные последовательности ее интегральных полипептидов гомологичны на 75%. Как уже отмечалось, по внутреннему строению она сходна с реакционными центрами одноклеточных зеленых бактерий и гелиобактерий.
ФСI имеет молекулярную массу 340 кДа. Этот интегральный пигмент-белковый комплекс состоит из одиннадцати полипептидов, ~100 молекул антенного хлорофилла α и 10-25 молекул β-каротина.
В состав ФС1 входят шесть переносчиков электронов (рис. 140):
— первичный донор Р700 (от англ. pigment), «димер» из двух близко расположенных молекул хлорофилла а или хлорофилла d;
— первичный акцептор A0 (от англ. acceptor), «мономерная» молекула хлорофилла а;
— промежуточный акцептор А1, молекула филлохинона;
— вторичные акцепторы Fx, Fa и FB (от англ. ferredoxin), [Fе4S4]-кластеры.
Минимальной функциональной единицей является монокомплекс ФСI, хотя in situ они объединяются в тримеры.
Во второй половине 1990-х годов немецкий исследователь Петра Фромме (Р. Fromme) получила кристаллические препараты ФСI одноклеточной цианобактерии Synechococcus sp., что позволило реконструировать ее трехмерную модель с уровнем разрешения 3,5Ä.
Выяснилось, что каркас ФСI образован гетеродимером «больших» субъединиц — РsаА и РsаВ (83 и 82,4 кДа). Каждая из них состоит из одиннадцати трансмембранных петель, причем десятая петля содержит консервативные His-сайты, от которых зависит расположение первичного донора Р700* (-750 мВ). Гетеродимер РsаА/РsаВ связывает первый из трех вторичных акцепторов (Fх), а также первичный и промежуточный акцепторы А0 и А1 (рис. 140).
Рис. 140. Первая фотосистема. А и В — гетеродимер интегральных субъединиц; С, D, Е, F, I, J, К, L и М — вспомогательные субъединицы; Р700 — первичный донор; А0, А1 и Fх — переносчики электрона; FA и FB — простетические группы терминального акцептора; Еd — растворимый ферредоксин; Рс — пластоцианин. В скобках — Мr (кДа).
ФСI снабжен собственной антенной реакционного центра, в состав которой входят до ста молекул хлорофилла α (в случае A. marina вместо них используется примерно равное количество молекул хлорофилла d). Помимо хлорофилла, антенна реакционного центра ФСI содержит 14 молекул β-каротина, тогда как во внутренних и периферических антеннах преобладают ксантофиллы.
В состав ФСI дополнительно входят малые субъединицы C-F (8-16 кДа). Периферические субъединицы PsaC, PsaD и PsaE расположены на цитоплазматической поверхности. Субъединица PsaC связывает [Fе4S4]-кластеры FA/FB, в то время как субъединица PsaD образует докинг-площадку для ферредоксина. Субъединица PsaE, скорее всего, отвечает за ориентацию субъединиц PsaC и PsaD по отношению к гетеродимеру PsaA/PsaB. Четвертая малая субъединица PsaF расположена на эк-
зоплазматической стороне мембраны и образует докинг-площадку для цитохрома c6 или медьсодержащего переносчика — пластоцианина.
К числу компонентов ФСI также относятся пять малых гидрофобных полипептидов— Psal (4 кДа), PsaJ (4 кДа), PsaK (8 кДа), PsaL (17 кДа) и PsaM (3 кДа). Они стабилизируют структуру всего комплекса и отвечают за его агрегацию в тримеры.
Реакционный центр ФСI специфически возбуждается «дальним» красным светом (>700 нм), после чего передает электроны переносчикам, расположенным на цитоплазматической поверхности мембраны. В свою очередь, вакансию в акцепторном участке ФСI (редокс-потенциал пары Р700+/Р700 составляет +500 мВ) заполняет электрон, поступающий от цитохром b6-комплекса через переносчики, расположенные на экзоплазматической поверхности.
Вторая фотосистема. Реакционный центр ФСII специфически возбуждается «ближним» красным светом (<680 нм) и в этом состоянии становится донором электронов для цитохром b6f-комплекса. Иными словами, он действует как Н2О: пластохинон-оксидоредуктаза. Эта светозависимая ферментная система передает электроны от кислородвыделяющего комплекса, расположенного на экзоплазматической стороне мембраны, пластохинону на цитоплазматической стороне.
ФСII состоит из двух компонентов — реакционного центра и кислородвыделяющего комплекса.
Пространственную модель ФСII построил англичанин Джеймс Барбер (J. Barber) в 1999 г. на основе результатов лазерной спектрофотометрии и электронной кристаллографии препаратов, выделенных из фотогетеротрофного штамма одноклеточной цианобактерии Synechocystis sp. РСС 6803. Для сравнения использовались ранее полученные данные рентген-диффрактометрии реакционных центров, изолированных из Blastochloris viridis и других пурпурных бактерий.
ФСII цианобактерий in situ существует в виде мономера или димера. Мономерный комплекс образован интегральными и периферическими белками PsbA-W, каждый из которых содержит от одной до шести интрамембранных петель (рис. 141). Каркас ФСН состоит из гетеродимера гомологичных полипептидов PsbA (38 кДа) и PsbD (39,4 кДа). Они обозначаются как D1 и D2 (от англ, diffuse), поскольку при SDS-электрофорезе образуют размытые полосы. Эти полипептиды содержат по пять трансмембранных петель и сообща связывают четыре простетические группы, переносящие электроны:
— первичный донор Р680 (от англ. pigment), «мономерную» молекулу хлорофила α;
— первичный акцептор Ph (от англ. pheophytin), феофитин α;
— вторичные акцепторы QA и Qв (от англ. quinone), две молекулы менахинона.
Помимо первичного донора Р680, в состав ядра ФСII входит квази-симметричный ему «мономер» хлорофилла α. К центральным молекулам хлорофилла α добавляются еще две квази-симметричные им молекулы, причем одна играет роль промежуточного акцептора, получающего электроны от возбужденной молекулы первичного донора Р680*. В ядре ФСП обнаружены еще две периферические молекулы хлорофилла а, функция которых не установлена.
Роль посредника между катион-радикалом первичного донора Р680+- и кислородвыделяющим комплексом выполняет аминокислотный остаток Туг-161 (Yz), входящий в состав полипептидной субъединицы PsbA. Функцию марганецсвязывающего белка также выполняет эта субъединица (рис. 141).
Рис. 141. Вторая фотосистема. А и D — гетеродимер интегральных субъединиц; С и В — субъединицы кор-антенны; Е и F — вспомогательные субъединицы; Р, О и Q — субъединицы кислородвыделяющего комплекса; Мn — марганцевый кластер кислородвыделяющего комплекса; Уz —остаток Туг-161; Р680 — первичный донор; Рh, QA и Qв — переносчики электрона; Fе — атом железа. В скобках — Мг (кДа).
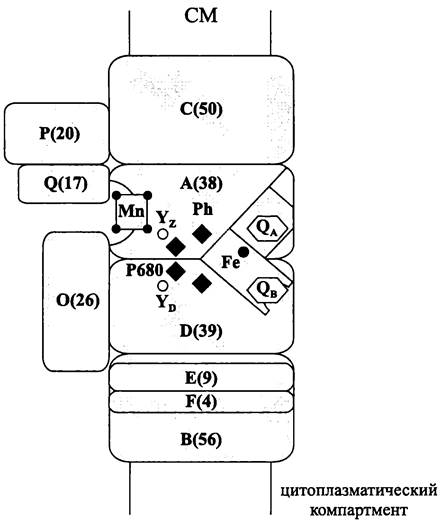
Лигандами для первичного донора Р680 служат два аминокислотных остатка: His-198, входящий в состав субъединицы PsbA, и His-197, входящий в состав субъединицы PsbB. Аминокислотный остаток Тгр-253 (Yd), входящий в состав субъединицы PsbB, переносит электрон от первичного акцептора Ph к хинону QA. Взаимодействие между «первичным» хиноном QA и «вторичным» хиноном Qb обеспечивается катионом негеминового железа Fe2+, который связан с субъединицей PsbA.
Антенна реакционного центра ФСII состоит из гидрофобных полипептидов PsbC (50 кДа) и PsbB (56 кДа), у каждого из которых по шесть трансмембранных петель. Поскольку «кажущаяся», т. е. определенная с помощью электрофореза, масса этих полипептидов равна 43 и 47 кДа, их обозначают как СР43 и СР47 (от англ. chlorophyll protein). Эти полипептиды связывают по 20-25 молекул хлорофилла а и по четыре-пять молекул β-каротина. Помимо того, что субъединица PsbB является частью антенны реакционного центра ФСII, она дополнительно взаимодействует с полипептидом PsbO, который стабилизирует марганцевый кластер кислородвыделяющего комплекса. Антенная субъединица PsbC также бифункциональна и заодно заякоривает ФСII в билипидном слое.
Помимо полипептидов PsbAD и PsbCB, в состав ФСII входят интегральные субъединицы PsbE и PsbF (апоцитохромы 5559), а также несколько полипептидов, локализованных на экзоплазматической поверхности мембраны. Из них особенно важна субъединица PsbO (26,5 кДа), или марганецстабилизирующий белок (англ. manganese stabilizing protein, MSP). От него зависит работа кислородвыделяющего комплекса, хотя сам он непосредственно не участвует в окислении воды.
В состав ФСII дополнительно входит цитохром с550 и набор низкомолекулярных полипептидов, в частности субъединицы PsbH-N, PsbR, PsbT и PsbW (<10 кДа). У цианобактерии Synechocystis sp. РСС 6803 интегральный полипептид PsbJ (4кДа) обеспечивает сборку и стабильность ФСII. Функция остальных субъединиц пока еще не установлена.
Кислородвыделяющий комплекс. С энзимологической точки зрения ФСII представляет собой частный случай дегидрогеназной системы. В качестве донора электронов она использует воду, а в качестве акцептора электронов цитохром bс1(b6f)-комплекс, т. е. это Н2О-дегидрогеназа.
Данный фермент уникален, поскольку в живой природе не существует других механизмов для окисления воды, а у фототрофов не бывает других светозависимых дегидрогеназ.
При дегидрировании воды в качестве побочного продукта образуется молекулярный кислород:
2Н2O —> 4Н+ + 4е- + O2, что имеет сразу несколько глобальных биологических последствий.
Во-первых, молекулярный кислород используется в энергетическом метаболизме аэробно дышащими прокариотами и митохондриями в качестве субстрата для терминальных редуктаз. Его ресурсы в верхних слоях земной коры и поверхностном слое водоемов богаче по сравнению с другими акцепторами электронов.
Во-вторых, в ходе оксигеназных реакций один или два атома кислорода присоединяются к органическим молекулам, образуя их окисленные производные, которые играют ключевую роль в энергетическом и/или конструктивном метаболизме. Примерами служит окисление метана в метанол метанотрофными бактериями (см. раздел 11.4.4.2) и образование ксантофиллов из каротинов (см. раздел 15.2.2).
Втретьих, молекулярный кислород выступает в качестве сигнальной молекулы — хемоэффектора при аэротаксисе бактерий и архей, а также в качестве регулятора биогенеза фотосинтетического аппарата у пурпурных и зеленых аноксигенных бактерий (см. раздел 12.4).
Вчетвертых, молекулярный кислород является фактором окислительного стресса у всех живых организмов. По образному выражению американского бактериолога Волка (C.P.Wolk), «Цианобактерии за 2,2 млрд лет замусорили нашу планету токсичным побочным продуктом фотозависимого окисления воды». Однако этот мусор послужил одним из важнейших факторов органической эволюции. В современную геохронологическую эпоху он обеспечивает квази-стационарное состояние биосферы и жизнедеятельность облигатно аэробных организмов, в том числе человека.
Окисление воды оксигенными фототрофами, совместно с рибулозобисфосфат-карбоксилазной реакцией у автотрофов по углероду и нитрогеназной реакцией у диазотрофов — это «три кита», на которых держится современная биосфера.
Н2O-дегидрогеназную реакцию способны осуществлять только представители филы ВХ Cyanobacteria и их эволюционные родственники — пластиды. Окончательное объяснение механизма окисления воды входит в число важнейших задач физико-химической биологии. Расшифровка структуры марганцевого кластера кислородвыделяющего комплекса откроет перспективы для регулирования фотосинтеза и позволит создать искусственные аналоги биологических систем, трансформирующих световую энергию в химическую.
Функциональным ядром кислородвыделяющего комплекса (англ. oxygen-evolving complex, ОЕС) является марганцевый кластер с лигандной сферой, в состав которой входят анионы СI- и катионы Са2+. Другим ключевым компонентом ОЕС служит
консервативный аминокислотный остаток Туг-161 (Yz), входящий в состав полипептидной субъединицы PsbA. Он участвует в переносе электронов от воды к катион- радикалу первичного донора Р680+.
Дегидрогеназная реакция окисления воды уникальна, поскольку для того, чтобы она произошла, необходимо фотохимическим путем накопить четыре окислительных эквивалента. Затем две молекулы воды теряют сразу четыре электрона с образованием связи кислород-кислород:
RCII/OEC + 4hv —> (RCII + 4е-) + ОЕС4+,
ОЕС4+ + 2Н2O —> OEC + 4Н+ + O2.
Источником энергии для окисления воды служит неферментативная реакция, связанная с превращением возбужденного первичного донора 1P680* в катион-радикал Р680+. Сильные электрон-акцепторные свойства этой молекулы (редокс-потенциал пары Р680+•/Р680 составляет +1000 мВ) позволяют использовать воду в качестве донора электронов, хотя она очень устойчива к окислению (редокс-потенциал пары Н2O/O2 равен +820 мВ).
Механизм окисления воды был расшифрован на основе классических опытов французского биохимика Пьера Жолио (Р. Joliot). В 1960-е годы он установил, что зеленые водоросли и изолированные хлоропласты выделяют кислород в ответ на каждую четвертую по счету вспышку света. Согласно теоретической модели, названной по имени предложившего ее американского биохимика Биссела Кока (В. Кок), «часами Кока», для выделения одной молекулы кислорода ФСII должна поглотить подряд четыре кванта света, четыре раза перейти в возбужденное состояние и четыре раза передать электрон цитохром b6f-комплексу. При этом ОЕС накапливает четыре окислительных эквивалента. Поочередно сменяющие друг друга редокс-состояния ОЕС обозначаются как S0— S4(от англ. state — состояние).
Смена S-состояний обеспечивается разделением зарядов между первичным донором (хлорофиллом 1P680*) и первичным акцептором (феофитином Ph). Этот фотохимический акт необратим, поскольку электрон сразу же переходит от первичного акцептора к вторичным акцепторам Qa/Qb- Вакансия в молекуле первичного донора (Р680+) заполняется электроном, поступающим от редокс-активного остатка Туг-161 (Yz), который входит в состав полипетидной цепи субъединицы PsbA. Этот посредник использует в качестве восстановителя комплекс ОЕС, а тот, в свою очередь, получает электроны от молекулы воды. Таким образом, ОЕС осуществляет серийное восстановление Р680+• по схеме «один электрон на один поглощенный фотон», используя в качестве промежуточного переносчика катион-радикал Y+z•.
Каталитический центр ОЕС представляет собой четырехатомный марганцевый кластер, или двойной «димер» (рис. 142). На протяжении Sn-цикла в нем происходят четыре последовательных редокс-перехода (рис. 143):
S0 —> S1(3 • 10-5с) —> S2(10-4с) —> S3(3 • 10-4с) —> S4(10-3с).
Рис. 142. Марганцевый кластер кислородвыделяющего комплекса.
Рис. 143. Светозависимые редокс-превращения марганцевого кластера кислородвыделяющего комплекса, или S-цикл. S0—S4 — стадии цикла. Рамкой (стадия S3) обозначено радикальное состояние атома кислорода в оксо-мостике.
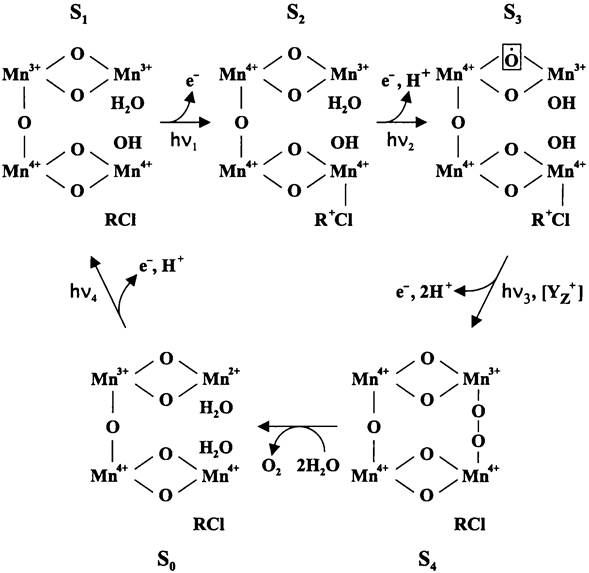
S0— это максимально восстановленное, а S4— максимально окисленное состояние (цифровые индексы промежуточных состояний S1— S3указывают на количество положительных зарядов).
Эволюционное происхождение ОЕС неизвестно; трудно допустить, что реакционный центр ФСII и система накопления положительного заряда S0 —> S4 одновременно появились у предка оксигенных фототрофных бактерий. Высказываются предположения, что Р680+- вначале получал
электроны от более сильного восстановителя, например, пероксида водорода. В пользу этого говорит структурное сходство между двухатомным активным центром марганецсодержащих каталаз и половиной четырехатомного марганцевого кластера ОЕС.
Светособирающие антенны. Как мы уже говорили, при аноксигенной фототрофии в состав фотосинтетического аппарата входит реакционный центр какого- либо одного типа в комбинации с различными светособирающими антеннами. При оксигенной фототрофии используется не один, а два взаимодействующих реакционных центра в комбинации с различными светособирающими антеннами.
Периферическая антенна цианобактерий называется фикобилисомой, сокращенно ФБС (англ. phycobilisome, PBS). Цианобактерии-прохлорофиты содержат либо только интегральные антенны (например, Prochlorothrix hollandica), либо интегральные антенны в сочетании с ФБС (например, A. marina).
ФБС представляет собой частицу размером 12 x 32 — 24 x 70 нм, которая образует параллельные ряды на цитоплазматической поверхности тилакоидов (ICM цианобактерий). ФБС имеет молекулярную массу 7 • 103-104 кДа и состоит из модулей первого порядка — тримеров (αβ)3, второго порядка — гексамеров 2(αβ)3 и третьего порядка — цилиндров [αβ)3]4 и стержней [2(αβ)3]2-6. Типичная ФБС подразделяется на два морфологических домена — ядро из двух-трех цилиндров и периферическую часть из шести стержней (рис. 144). Цилиндр образуется из четырех тримеров аллофикоцианина. В свою очередь, стержень представляет собой агрегат из двух-шести гексамеров. Проксимальные гексамеры всегда содержат длинноволновую форму фикоцианина, в то время как дистальные гексамеры у разных объектов состоят из фикоэритрина, фикоэритроцианина или «коротковолновой» (<645 нм) формы фикоцианина. Упорядоченное геометрическое расположение этих пигментов способствует тому, что энергия направленно мигрирует от молекул с более коротковолновым максимумом поглощения к молекулам с более длинноволновым максимумом:
фикоэритрин (560 нм) —> фикоэритроцианин (575 нм) —> фикоцианин (645 нм) —> аллофикоцианин (660 нм) —> хлорофилл α (680 нм).
Рис. 144. Фикобилисома. ФСI и ФСII — фотосистемы; α и β — апопротеины.
Состав стержней ФБС изменяется путем фотоакклиматизации, при которой используются три стратегии:
— общая для фототрофов «экстенсивная» стратегия (размер антенны находится в обратной зависимости от величины светового потока, т. е. стержни укорачиваются на ярком, и удлинняются на слабом свету);
— свойственная многим оксигенным фототрофам «кинетическая» стратегия (с помощью протеинкиназной системы, разрыхляющей связь ФБС с мембраной, антенна вступает в сопряжение с той фотосистемой, которая в данный момент больше нуждается в энергии);
— уникальная «цветовая» стратегия, или комплементарная хроматическая адаптация (изменяется состав периферической части ФБС, что обеспечивает поглощение квантов доминирующей цветовой группы, т. е. при избытке красных квантов синтезируется фикоцианин, а при избытке зеленых квантов — фикоэритрин).
Помимо α- и β-субъединиц в состав ФБС входят бесцветные линкерные полипептиды (англ. link — связь) молекулярной массой 10-40 кДа. Стержневые линкеры LR (от англ. rod — стержень) обеспечивают сборку гексамеров и их объединение друг с другом; входящие в состав ядра линкеры Lc (от англ. core) — сборку тримеров; линкеры LRc — прикрепление стержней к ядру. Наряду с бесцветными линкерами существует минорный высокомолекулярный линкер АрсЕ (120 кДа). Этот хромопротеин отвечает за агрегацию тримеров кора в цилиндры и ассоциацию кора с «димером» ФСII, в связи с чем его обозначают как линкер Lсм (от англ. core-membrane). Линкер АрсЕ имеет мультидоменный состав и обладает сложной пространственной конфигурацией. В него входят: а) петлевой домен, погруженный в ядро ФСII; б) фикобилипротеиновый домен, встроенный в тример кора; в) три линкерных домена, прикрепляющие соседние тримеры кора друг к другу; г) три плечевых домена, один из которых соединяет вместе тримеры цилиндра, а два других связывают между собой отдельные цилиндры. Линкер Lсм служит терминальным каналом, по которому до 75% энергии, поглощенной ФБС, передается ФСII.
У одноклеточной цианобактерии Gloeobacter violaceus, принадлежащей к наиболее архаичной ветви эволюционного древа Cyanobacteria, обнаружены уникальные ФБС цилиндрической формы. Они расположены на внутренней поверхности СМ и состоят из пучка стержней, по восемь-десять гексамеров каждый.
Некоторые прохлорофиты (в частности, A. marina) также содержат нестандартные ФБС. Субъединицы фикоцианина и аллофикоцианина (22-58 кДа) объединены в гетерогексамеры. Агрегат из четырех гексамеров образует тороидальную «мини- ФБС» размером 1,3x26 нм (103 кДа).
В отличие от собственно цианобактерий, у которых имеется только один хлорофилл-хлорофилл а, прохлорофиты содержат хотя бы один вспомогательный хлорофилл. При этом фикобилипротеины у них либо отсутствуют, либо образуются в очень небольшом количестве.
К группе прохлорофитов, которые морфологически не отличаются от собственно цианобактерий, относятся три одноклеточных вида (Prochloron didemni, Prochlorococcus marinus и A. marina) и два нитчатых вида (Prochlorothrix hollandica и «Р. scandica»). Фотосистемы прохлорофитов и собственно цианобактерий имеют идентичное строение. Главными антенными пигментами является хлорофилл а или d (A. marina). В состав интегральной антенны помимо хлорофиллов а и b могут входить хлорофиллы а2 и b2, а также хлорофилл a-подобный пигмент. Некоторые прохлорофиты содержат интегральный хлорофилл d-белковый комплекс в сочетании с ФБС (A. marina).
Прохлорофитов поначалу считали эволюционными предшественниками хлоропластов. В дальнейшем выяснилось, что апопротеины их хлорофилл α/β-белковых комплексов гомологичны апо- протеинам хлорофилл α-содержащей антенны СР43', образующейся у цианобактерий при голодании по железу, а те апопротеины, в свою очередь, гомологичны пластидным субъединицам РsbСВ. Получается, что хлорофилл α/β-белковые комплексы прохлорофитов и хлоропластов дивергиро- вали от антенных апопротеинов ФСIIцианобактерий.
Р. marinus —это единственный оксигенный фототроф, светособирающими пигментами у которого являются хлорофиллы α2 и b2. Кроме того, он образует хлорофилл с-подобный пигмент, а также фикоэритрин (который в качестве главного хромофора содержит фикоуробилин-подобный тетрапиррол). Прохлорококки, живущие в верхнем и нижнем этажах эуфотической зоны на глубине до 250 м, сильно различаются по относительному содержанию антенных пигментов. В частности, соотношение хлорофилл α2: b2 у них варьирует в пределах 1-10. У разных штаммов прохлорококков при фотоакклиматизации изменяется не только пигментный, но и полипептидный состав светособирающей антенны. Экотипы, адаптированные к слабой освещенности, содержат семь генов, кодирующих разные апопротеины, а экотипы, адаптированные к сильной освещенности, только один такой ген.
12.7.5. Факультативно аноксигенная фототрофия
Так называется адаптивный переход цианобактерий от оксигенной к аноксиген- ной фототрофии. Он связан с обратимой инактивацией кислородвыделяющего комплекса и использованием вместо воды альтернативного донора электронов, чаще всего сульфида.
Факультативно аноксигенную фототрофию открыл в 1975 г. американский микробиолог Ричард Кастенхольц (R. W. Саstenholz). Вначале это явление рассматривали как реликтовый процесс и считали, что оно отражает промежуточный этап эволюции фотосинтетических систем — от аноксигенной фототрофии к оксигенной. Однако в дальнейшем выяснилось, что такой сценарий не согласуется с истинной филогенией фототрофных бактерий. Факультативно аноксигенные цианобактерии — это не реликтовые формы с архаичными реакционными центрами и светособирающими антеннами, а резистентные к сульфиду «модернизированные» штаммы. Они обладают специализированной ферментной системой, которая использует сульфид в качестве донора электронов для ФОII.
У большинства цианобактерий инактивация ФСII приводит к подавлению светозависимого метаболизма. Однако некоторые штаммы могут использовать альтернативные доноры электронов, для окисления которых не требуется участие ФСII. В результате этого они переходят на аноксигенную фототрофию, при которой функционирует только ФСI, а донором электронов служит сульфид. Помимо сульфида донорами электронов могут быть другие соединения серы, в частности димеркаптопропанол.
Сульфид ингибирует оксигенную фототрофию, непосредственно воздействуя на ОЕС. Анион HS- не способен пассивно проходить через СМ, однако сероводород, находящийся с ним в химическом равновесии, беспрепятственно достигает свои мишени. Хотя первопричиной факультативно аноксигенной фототрофии служит ингибирование ФСII, все дальнейшее развитие событий можно рассматривать как нормальный физиологический процесс, связанный с адаптивным переходом на использование сульфида в качестве альтернативного донора электронов.
В отличие от большинства живых организмов, некоторые штаммы цианобактерий не только переносят сульфидный стресс, но и могут утилизировать этот токсичный агент. В одних случаях активность ФСII подавляется полностью, но ФСI не затрагивается, и вместе с ней начинают функционировать белковые факторы, индуцированные сульфидом. В других случаях, даже при высоком содержании сульфида в окружающей среде, аноксигенная фототрофия сочетается с оксигенной.
Наиболее известный пример факультативно аноксигенной цианобактерии — это «Oscillatoria limnetica», выделенная из обогащенного сульфидом гиполимниона оз. Солар-Лейк на Синайском полуострове. Она может использовать сульфид в качестве донора электронов и образовывать побочный метаболический продукт, элементную серу, которая в виде глобул откладывается на поверхности клетки. Сульфид окисляется флавопротеином — сульфид: пластохинон-оксидоредуктазой (англ. sulfide: plastoquinone oxidoreductase, SOR). Этот фермент имеет молекулярную массу 57 кДа и активен в мембраносвязанной форме. Электроны от сульфида поступают в электрон-транспортную цепь на уровне хинонного пула и цитохром b6f-комплекса.
Помимо «О. limnetica», факультативно аноксигенная фототрофия выявлена у нитчатых цианобактерий родов Lyngbya и Phormidium, у одноклеточной цианобактерии р. Synechocystis, а также у нитчатого прохлорофита Р. hollandica.
Способность цианобактерий к факультативно аноксигенной фототрофии позволяет им доминировать в весенне-летний период в мелких эвтрофицированных озерах регионов с теплым климатом, когда в гиполимнионе активно протекает анаэробная деструкция органики. В осенне-зимний период «О. limnetica» снова переходит к оксигенной фототрофии, что наряду с сезонной сукцессией обитателей водоема обеспечивает круглогодичное развитие этой цианобактерии.
12.7.6. Квази-фототрофия
Термин «квази-фототрофия» (англ. quasi-phototrophy) ввел в 1993 г. американский бактериолог Ховард Гест.
В настоящее время этот адаптивный механизм, служащий для ассимиляции световой энергии, обнаружен у некоторых хемотрофных бактерий и архей.
Напомним, что для большинства фототрофных бактерий свет служит главным энергоносителем, хотя все они используют в качестве энергоносителя запасные вещества, а некоторые способны к факультативной хемотрофии.
У квази-фототрофов соотношение фототрофии и хемотрофии изменяется на противоположное, и главным способом ассимиляции энергии становится хемотрофия.
12.7.6.1. Квази-фототрофные бактерии
В первую очередь к ним относятся так называемые «аэробные аноксигенные фототрофные бактерии» (англ. aerobic anoxygenic phototrophic bacteria; APB). Они представлены двумя морскими (Erythrobacter sp. и Roseobacter sp.) и шестью пресноводными (Acidiphilium sp., Erythromicrobium sp., Erythromonas sp., Porphyrobacter sp., Roseococcus sp. и Sandaracinobacter sp.) видами. Все они принадлежат к филе ВХII Proteobacteria.
«Аэробными» этих бактерий называют потому, что у них фотосинтетический аппарат образуется только в аэробных условиях, тогда как у большинства аноксигенных фототрофных бактерий биогенез пигмент-белковых комплексов в присутствии молекулярного кислорода подавлен (см. раздел 12.4). Вторым условием биогенеза фотосинтетического аппарата у АРВ служит попеременное нахождение на свету и в темноте. Наконец, в отличие от большинства аноксигенных фототрофных бактерий, электрон-транспортная цепь у АРВ работает только в аэробных условиях.
Переход к фототрофии у АРВ представляет собой сложно регулируемый процесс. Поскольку в норме они живут за счет катаболизма углеводов и аминокислот,
поводом для смены энергетической стратегии, по-видимому, служит истощение этих питательных субстратов.
Кроме АРВ к числу квази-фототрофных бактерий относятся «фотосинтетические клубеньковые бактерии» — представители р. Bradyrhizobium. Они вступают в эндоцитобиотические ассоциации с тропическими бобовыми растениями родов Aeschynomene, Sesbania и др. В отличие от тривиальных клубеньковых бактерий, живущих на корнях травянистых бобовых, они поселяются в железках, расположенных в нижней части деревянистого стебля.
До сих пор неизвестно, в чем заключается физиологический смысл квази-фото- трофии у фотосинтетических клубеньковых бактерий. Можно предположить, что это связано с необходимостью в ускоренной регенерации АТФ для такого энергоемкого процесса, как диазотрофия.
Фотосинтетический аппарат, образующийся у АРВ и фотосинтетических клубеньковых бактерий, по морфологии и молекулярному строению не отличается от фотосинтетического аппарата аноксигенных фототрофных бактерий из классов «Alphaproteobacteria», «Betaproteobacteria» и «Gammaproteobacteria». Его основные компоненты (антенный комплекс LHCI/LHCII, реакционный центр RCII-типа, электрон-транспортная цепь и АТФ-синтаза) содержатся в везикулярных модулях ICM — хроматофорах.
Особый случай бактериальной квази-фототрофии связан с использованием однокомпонентной протонной помпы — протеородопсина (см. раздел 10.4.2).
12.7.6.2. Квази-фототрофные археи
Помимо квази-фототрофных бактерий, способностью к квази-фототрофии обладают экстремально галофильные археи из филы АII Euryarchaeota (см. раздел 10.4.1). Однако, в отличие от аэробных фототрофных бактерий и фотосинтетических клубеньковых бактерий, они используют не трехкомпонентный фотосинтетический аппарат (состоящий из антенны, реакционного центра и электрон-транспортной цепи), а мономолекулярный светозависимый протонофор — бактериородопсин.
Механизм создания Pmf у экстремально галофильных архей исследован на мембранных везикулах, липосомах с имплантированным в них бактериородопсином и других моделях. Установлено, что импульсное освещение клеток, помещенных в буферный раствор, сопровождается фосфорилированием.
Хотя утилитарное значение квази-фототрофии для экстремально галофильных архей в природных местообитаниях не доказано, можно предположить, что они (как и квази-фототрофные бактерии) используют адаптивную биоэнергетическую стратегию — переходят на альтернативный энергоноситель. Однако в данном случае специфика квази-фототрофии состоит в том, что она вызвана не истощением питательных субстратов, а недостатком кислорода, т. е. дыхательная цепь инактивируется в акцепторном, а не донорном участке.
Экстремально галофильные археи живут в хорошо прогреваемых гипергалинных водоемах, где содержание растворенного кислорода подвержено сезонным колебаниям и в жаркое время года снижается до минимального уровня. Поскольку у них, за немногими исключениями, отсутствуют механизмы анаэробного дыхания и брожения, квази-фототрофия становится основным способом выживания при энергетическом стрессе.
12.7.6.3. Квази-фототрофия во «второй биосфере»
Тема «второй биосферы» (см. I том учебника) зазвучала по-новому после того, как в 1999 г. В. В. Юрков (V. V. Yurkov) и Джеймс Битти (J. Т. Beatty) выделили из гидротермального источника, расположенного на глубине до 2 км на склоне подводного хребта Хуан де Фука в северо-восточной части Тихого океана, новую бактерию Citromicrobium bathyomarinum.
Инфракрасное излучение, или геотермальный свет![]() 850 нм) активирует антенный комплекс этой бактерии, который содержит бактериохлорофилл α. Однако кванты электромагнитного поля используются здесь в качестве второстепенного энергоносителя, а главным остаются органические субстраты.
850 нм) активирует антенный комплекс этой бактерии, который содержит бактериохлорофилл α. Однако кванты электромагнитного поля используются здесь в качестве второстепенного энергоносителя, а главным остаются органические субстраты.
Конструктивный метаболизм С. bathyomarinum относится к хемоорганотрофному или факультативно фотогетеротрофному типу. Таким образом, эта бактерия, подобно хемолитотрофам «второй биосферы» может непосредственно использовать внутреннюю энергию Земли.
* * *
Завершая на этом тему фототрофии, мы должны подчеркнуть три важнейших обстоятельства, касающихся значения данного процесса для жизни на Земле, роли прокариотов в качестве его биологических носителей и истинного разнообразия его молекулярных механизмов:
— по своей биоэнергетической сути фототрофия есть исключительно «бактериальное» свойство, ядерные клетки приобрели его вместе с цианобактериальными симбионтами;
— фототрофия это не поздний продукт органической эволюции, а архаический процесс, появившийся у древнейших цианобактерий, которые, по-видимому, были среди пионеров органической жизни;
— фототрофия осуществляется при помощи фотосинтетического аппарата не одного, а нескольких молекулярных типов; наиболее распространенный и самый известный из них, оксигенный фотосинтетический аппарат, должен рассматриваться лишь как primus inter pares (лат. — первый среди равных).