МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ III - А. В. ПИНЕВИЧ - 2009
ГЛАВА 17. ОНТОГЕНЕЗ
17.3. Клеточный рост
Общим термином «рост» в микробиологии обозначают два разных процесса — рост культур (англ. culture growth; см. главу 21), отражающий увеличение биомассы клеточной популяции, и клеточный рост (англ. cell growth), который происходит на уровне отдельной клетки. В обоих случаях наряду с термином «рост» используется более емкий термин «развитие», под которым имеется в виду совокупность процессов роста и размножения.
Понятие «клеточный рост», в свою очередь, имеет неоднозначное объяснение. Обычно делается упор на увеличение биомассы, вопреки тому, что данный параметр не всегда отражает клеточный рост.
Истинный смысл клеточного роста следует искать в репликативной природе этого феномена, когда новые структуры образуются в дополнение к уже имеющимся структурам или за счет увеличения размера этих структур. Причем речь идет не о любых, а только о незаменимых структурах, необходимых для поддержания жизнеспособности клетки.
Таким образом, клеточный рост можно определить, как подготовку к размножению путем увеличения числа и/или объема незаменимых клеточных структур. Понятно, что одним из последствий роста будет увеличение биомассы.
Из понятия «клеточный рост» исключаются ситуации, когда при отсутствии поступления извне одного из биогенных элементов, например, связанного азота, бак-
терии перестают размножаться, однако в избытке накапливают запасные полимеры (в данном случае полиглюкозиды).
Не относится к росту и такая ситуация, когда клетка утяжеляется путем образования наружных покровов, например, чехла или капсулы, а также приобретает дополнительный вес за счет биоминерализации (см. I том учебника).
Кроме того, клеточный рост следует отличать от обновления (англ. turnover), под которым подразумевается замена старой структуры на новую, а также от репарации (англ. repair), когда в старой структуре избирательно устраняется нанесенное ей повреждение.
Как правило, клеточный рост предшествует делению, перед которым биомасса удваивается. Исключением служит размножение путем дробления, когда клетки делятся в отсутствии роста (см. раздел 17.4).
Различают два типа клеточного роста — сбалансированный и несбалансированный.
При сбалансированном клеточном росте (англ. balanced cell growth) клеточные структуры реплицируются в одинаковом темпе. За определенное время содержание хромосомной ДНК, мембранных липидов и белков, рибосом, молекулярных шаперонов и растворимых ферментов, а также масса ригидного слоя клеточной стенки увеличиваются в одинаковое число раз. Поэтому при сбалансированном росте состав клетки остается постоянным.
При несбалансированном клеточном росте (англ. unbalanced cell growth) разные субклеточные структуры реплицируются с неодинаковой скоростью, в результате чего между ними возникает количественная диспропорция. Например, в клетке может односторонне измениться содержание рибосом или интрацитоплазматических мембран. Несбалансированный рост обычно вызывается общим стрессом, наступающим при неравномерном истощении питательных субстратов (см. главу 19). Он также может быть результатом попадания микроорганизма в новые трофические условия (англ. nutritional shift), в частности при резкой смене природной ниши, а также при переносе на другую питательную среду.
Скорость клеточного роста. Для асинхронной популяции скорость клеточного роста (англ. growth rate) определяется по усредненному изменению линейных размеров или усредненному изменению содержания незаменимых компонентов - ДНК и РНК за единицу времени. Чем выше скорость роста, тем меньше время генерации, которое измеряется отрезком времени от деления до деления, или числом делений за единицу времени.
Между временем генерации R (сокр. англ. reproduction — размножение), которое измеряется числом удвоений ч-1, и средним объемом клетки Vr существует соотношение:
VR = Vu X 2R,
где Vu (англ. unit volume — «единица объема») — константа, равная среднему объему клетки при R = 0.
Легко вычислить, что при малом времени генерации (~20 мин) средний объем клетки в восемь раз больше, чем при большом времени генерации (>100 мин).
В свою очередь, между временем генерации и средней длиной клетки Lr существует соотношение:
LR = LU X 2(R/3),
где Lu (англ. unit length — «единица длины») — константа, равная средней длине клетки при R — 0.
Таким образом, длина клетки меньше зависит от скорости роста, чем ее объем.
Клеточный рост и размер клетки. Хотя общим показателем клеточного роста является удвоение массы, более удобным для анализа количественным парамет-
ром служат линейные размеры. Ясно, что размер клетки не случаен и — в пределах нормы реакции генотипа — отражает гомеостаз на разных фазах онтогенеза при конкретных условиях окружающей среды.
Каким же образом прокариотная клетка контролирует свой размер, и как он связан с клеточным циклом?
Предварительный ответ на этот вопрос был получен еще в конце 1950-х гг. представителями Копенгагенской микробиологической школы Маалойе (О. Maalpe), Кьельдгардом (N. О. Kjeldgaard) и Шехтером (М. Schaechter). Из результатов их опытов вытекало, что решающее влияние на размер клетки оказывает ее трофический статус, т. е. доступность питательных субстратов. Проще сказать, на богатой среде клетки имеют больший размер и растут быстрее, чем на бедной.
В частности, клетки В. subtilis, сохраняющие относительно постоянный диаметр, на богатой среде вырастают примерно в два раза длиннее, чем в условиях ограниченного питания. На богатой среде размер клеток Е. coli и S. entérica серовар Typhimurium изменяется в сторону увеличения обоих линейных параметров — длины и диаметра. При менее благоприятных условиях питания размер клетки стабилизируется (в случае В. subtilis это происходит, когда время генерации превышает 60 мин).
Логика этого явления очевидна. Быстро растущие клетки должны разместить в своем цитоплазматическом компартмекте больше рибосом. Подсчитано, что массовая доля рибосом в быстро растущих клетках (время генерации ~20 мин) в три раза больше, чем в медленно растущих клетках (время генерации >100 мин). При этом число бездействующих рибосом и незаряженных тРНК сводится к минимуму, т. е. рибосомы все время работают с полной нагрузкой, что позволяет с максимальной скоростью утилизировать имеющиеся в распоряжении аминокислоты.
Быстро растущие клетки также содержат больше ДНК, чем клетки, растущие с меньшей скоростью. При росте на богатой среде на хромосоме образуется несколько репликационных вилок (см. разделы 16.4.1.1 и 17.1.1), т. е. клетки, по существу, являются полиплоидными. Иными словами, размер растущей бактерии пропорционален содержанию в ней ДНК.
В то же время быстро растущие бактерии имеют и более короткое время генерации, т. е. чаще делятся. Но при этом они сохраняют большой размер. Такое возможно, если информация о скорости роста сообщается органелле цитокинеза, или дивисоме (см. раздел 17.4.3).
Основу дивисомы составляет сократимое кольцо, образованное белком FtsZ. Поэтому вполне естественно, что сборка протофиламентов FtsZ служит мишенью для белковых блокаторов цитокинеза.
В частности, при SOS-ответе синтезируется белок SulA; он связывается с белком FtsZ и блокирует образование Z-кольца, пока повреждение ДНК не будет исправлено (см. разделы 17.4.1 и 19.1). В свою очередь, белок MinC блокирует «незаконную» сборку Z-колец на полюсах клетки (см. раздел 17.4.1).
Как оказалось, блокирование сборки Z-кольца позволяет решать и такую сложную задачу, как координация размера клетки со скоростью роста.
В 2007 г. группа американских микробиологов под руководством Петры Левин (Р. A. Levin) выяснила природу регуляторной связи между трофическим статусом клетки (который, как мы уже знаем, влияет на скорость клеточного роста и размер клетки) и образованием Z-кольца, т. е. частотой делений. Оказалось, что в случае В. subtilis роль посредника играет один из ферментов, участвующих в ассимиляции глюкозы — при высоком уровне этого субстрата он становится блокатором сборки Z-кольца.
Значительная часть экзогенной глюкозы используется при биосинтезе липотейхоевой кислоты, одного из важнейших компонентов клеточной оболочки грамположительных бактерий (см. I том учебника). Точнее сказать, глюкоза включается в состав глюколипидного «якоря» липотейхоевой кислоты — диглюкозил-диацилглицерола (англ. diglucosyldiacyl glycerol, DiGlcDAG). Катализатором этой реакции служит УДФ-глюкозилтрансфераза UgtP (сокр. англ. uridine diphosphate-glucose transferase).
Вначале с помощью глюкокиназы Glk (сокр. англ. glucokinase) глюкоза превращается в глюкозо-6-фосфат. Затем под воздействием фосфоглюкомутазы PgcA (сокр. англ. phosphoglucomutase) глюкозо-6-фосфат превращается в глюкозо-1-фосфат. Наконец, глюкозо-1-фосфат-уридилтрансфераза GtaB (сокр. англ. glucose-1- phosphate-uridyltransferase) превращает глюкозо-1-фосфат в активированную форму глюкозы — УДФ-глюкозу, которая включается в состав диглюкозил-диацилглицерола:

Хотя мутанты по генам рgсА, gtaB и ugtP образуют на богатой питательной среде более короткие клетки, чем дикий тип, оказалось, что для регуляции длины достаточно только белка UgtP совместно с его субстратом, УДФ-глюкозой. Иными словами, под контролем UgtP быстро растущие клетки делятся, имея большую длину, чем клетки, растущие медленно.
Установлено, что белок UgtP активируется при увеличении содержания УДФ- глюкозы на богатой питательной среде и ингибирует сборку Z-кольца, ослабляя взаимодействие между протофиламентами белка FtsZ. В результате этого деление откладывается до момента, когда клетка достигает массы, «критической» для данной скорости роста.
Поскольку трансфераза UgtP не универсальна (в частности, Е. coli ею не обладает), предполагается, что дивисома может реагировать на другие индикаторы метаболического статуса, например, на скорость биогенеза рибосом.
17.3.1. Рост палочковидных и сферических клеток
Клеточный цикл бактерий сопровождается морфогенезом — морфологическими превращениями, неразрывно связанными с процессами роста. Они наиболее выражены в условиях стресса; например, при переходе от экспоненциальной фазы (рост с постоянной скоростью) к стационарной фазе (отсутствие роста) палочковидные клетки часто приобретают сферическую форму. Более сложные морфогенетические процессы происходят на протяжении мультиморфного клеточного цикла (см. раздел 17.1), особенно когда образуются покоящиеся резистентные клетки (см. раздел 17.5.2).
Как известно, форма бактерий задается в первую очередь экзоскелетом, роль которого играет муреиновый саккулус (см. I том учебника).
Блоки-мономеры муреина (дисахарид-пенгапептиды) синтезируются в цитоплазме с помощью продуктов генов mur, связываются с липофильным переносчиком (ундекапренилфосфатом), образуя липид II, который с помощью транслоказы RodA переносится на наружную поверхность СМ. Там они полимеризуются в линейные цепи, которые, в свою очередь, соединяются друг с другом олигопептидными мостиками. Обе реакции, гликозилтрансферазную и транспептидазную, одновременно катализируют пенициллинсвязывающие белки (англ. penicillin binding protein, РВР).
Саккулус грамположительных бактерий состоит из многих слоев и обновляется путем перемещения новых цепей муреина к поверхности клетки. Однослойный саккулус грамотрицательных бактерий растет в результате замещения одной цепи в акцепторном триплете тремя цепями донорного триплета, так что за каждую генерацию муреин обновляется примерно на 50% (см. I том учебника).
Если форма клетки определяется формой муреинового саккулуса, то за его собственную форму и рост отвечает семейство пенициллинсвязывающих белков.
Высокомолекулярные РВР класса A (PBPlabc) и класса В (PBP2ab, РВРЗ и РВРН) обладают гликозилтрансферазной и/или транспептидазной активностью. Они катализируют образование новых пептидогликановых цепей, а также их интеграцию в саккулус.
Низкомолекулярные пенициллинсвязывающие белки РВР4-7, АmрС, АmрН и DacD обладают DD-карбоксипептидазной активностью (удаляют терминальный остаток D-аланина) или эндопептидазной активностью (разрезают пептидные мостики).
РВР, относящиеся к классу А, представляют собой бифункциональные гликозил- трансферазы/транспептидазы, участвующие в синтезе и латерального, и септального муреина. Они играют роль общего регулятора морфогенеза (у дефектных по ним мутантов нарушается координация между удлинением клетки и септированием).
РВР из класса В выполняют две взаимно дополняющие функции. Так, РВР2а и РВРН отвечают за латеральный рост и, соответственно, за удлинение клетки (дефектные по ним rod-мутанты имеют сферическую форму). В свою очередь, РВР2b и РВР3 образуют септовый муреин (дефектные по ним fts-мутанты принимают нитевидную форму).
В отличие от высокомолекулярных РВР1-3, низкомолекулярные РВР (англ. low molecular weight, LMW), прежде всего DD-карбоксипептидаза РВР5, муреина не синтезируют, а только модифицируют его структуру, что оказывает вторичное влияние на морфогенетические процессы.
Помимо саккулуса, за рост и форму клетки отвечают тейхоевые кислоты — ковалентно связанная с муреином стеночная тейхоевая кислота (англ. wall teichoic acid, WTA) и интегрированная в СМ липотейхоевая кислота (англ, lipoteichoic acid, LTA) (см. I том учебника). В случае В. subtilis биосинтез и экспорт WTA обеспечивают продукты генов tagABDEFGHO и гена mnaА.
Рост палочковидных бактерий. При росте палочковидной клетки, характерным примером которой служит В. subtilis, она сначала удлиняется, не изменяя своего диаметра. По достижении двойной длины на клеточном экваторе формируется септа, в результате расслоения которой появляются две одинаковые дочерние клетки; длина каждой из них равна длине материнской клетки перед началом роста (см. рис. 228).
Рост и морфогенез палочковидных клеток описываются моделью, которая была разработана в 1990-е гг. и известна как «модель двух конкурирующих сайтов» (англ.
two-competing-sites model). Согласно ей, клетка динамически сохраняет палочковидную форму, поочередно используя два способа образования муреина — латеральный биосинтез и септа-специфичный биосинтез. Соответственно, для канонического примера В. subtilis известны два типа мутантов — нитчатый (fts; сокр. англ. filamentous thermo-sensitive) и округлый (rod; сокр. англ. round).
При росте палочковидной клетки в длину муреиновый саккулус надстраивается в цилиндрической части клетки за счет диффузной интеркаляции новых гликановых цепей и образования между ними новых поперечных сшивок. Затем продольный рост прекращается, и клетка переключается на локальный синтез септового муреина.
Наряду с белками РВР2а и РВРН за синтез латерального муреина отвечают спиралевидные филаменты цитоскелетных белков-гомологов актина — МrеВ, МrеВН и МЫ (рис. 226). Считается, что они играют роль перманентного или временно разбираемого каркаса для сборки компонентов мультиферментного биосинтетического комплекса, в первую очередь состоящего из белка РВР2а. Латеральное встраивание муреина осуществляется по спиральной траектории, повторяющей расположение филаментов белков МrеВ, МrеВН и МЫ.
Рис. 226. Комплекс латерального роста В. subtilis. Объяснение в тексте.
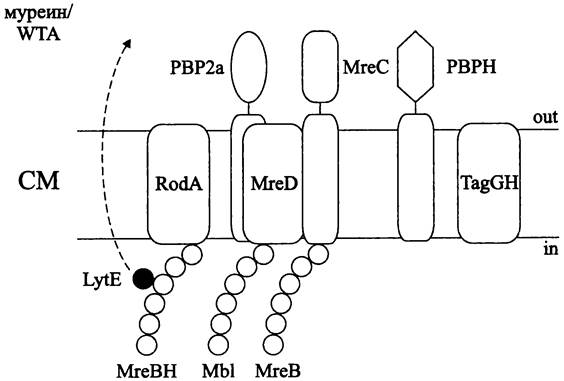
Дополнительное участие в регуляции роста палочковидных клеток в длину и поддержании их формы принимают транслоказа липида II — белок RodA (сокр. англ. round; соответствующие мутанты имеют сферическую форму). Еще одними участниками «комплекса латерального роста» являются мембранные белки МrеС и MreD. Они служат структурными посредниками между спиральными филаментами белков МгеВ/МЫ и комплексом муреин/WTA (напомним, что за биосинтез и экспорт WTA отвечают продукты генов tag, в частности белки TagGH).
Наконец, филаменты белка МrеВН ориентируют секрецию автолизина LytE. Воз-
действие этой гидролазы на ковалентные связи в муреине позволяет саккулусу увеличиваться в размере (рис. 226).
В то время как экспоненциально растущие клетки В. subtilis имеют относительно постоянную толщину, при изменении скорости роста изменяется и диаметр клетки — он относительно больше при быстром росте.
По-видимому, механизм, обеспечивающий рост и форму муреинового саккулуса, воспринимает информацию о скорости роста. Как это происходит, точно неизвестно; по некоторым данным, в регуляции диаметра клетки участвуют низкомолекулярные РВР, в частности D, D-карбоксипептидаза РВР5.
Правило сохранения постоянного диаметра распространяется не на все варианты палочковидных клеток. В частности, рост клетки Е. coli в длину сопровождается увеличением ее диаметра. В данном случае, помимо фазы синтеза латерального муреина и фазы синтеза септового муреина, наблюдается отдельная фаза — не чувствительная к пенициллину (сокр. англ. РВР3-independent/penicillin-insensitive peptidoglycan synthesis; PIPS). В ходе нее на полюсах дочерних клеток образуется метаболически инертный муреин. Возможно, что именно он служит ограничителем диаметра.
Рост сферических бактерий. В настоящее время кокки рассматриваются как результат эволюционного изменения палочек — вопреки ранним наивным представлениям о первичности сферического морфотипа. Иными словами, они не могут расти в длину из-за отсутствия РВР2, и поэтому их рост осуществляется только «септовым» способом, с помощью РВР3.
У бактерий сферической формы зоны роста распределяются равномерно. В данном случае полюса неразличимы (хотя с равным основанием можно сказать, что поверхность таких клеток представляет собой как бы сплошной полюс).
17.3.2. Полярный рост и поляризация клетки
В отличие от латерального роста палочковидных бактерий и равномерного роста бактерий округлой формы, полярный рост (англ. polar growth) представляет собой образование протуберанца на поверхности клетки или удлинение одного из ее концов. В обоих случаях надстраивается локальный участок клеточной оболочки.
Следует различать полярный рост стебелька, полярный рост простеки и полярный рост гифы, или апикальный рост.
Полярный рост стебелька. Напомним, что стебелек является придатком пери- плазматического компартмента (см. раздел 17.1.4), и поэтому его рост не сопряжен с репликацией компонентов цитоплазматического компартмента.
Образование стебелька регулируется клеточным циклом, а его длина совместно определяется внутренними и внешними сигналами. В частности, голодание по фосфору, который чаще всего лимитирует развитие природных популяций бактерий, стимулирует рост стебелька в длину.
Биогенез стебелька находится под контролем альтернативного сигма-фактора σ54, который образуется при общем стрессе (см. раздел 18.1) и отвечает за экспрессию ~30 генов стебелькового регулона. Рецепция и процессинг внешнего сигнала осуществляется хемосенсорной системой (см. раздел 18.4.1.1), состоящей из гисти- динкиназы ShkA, гистидин-фосфотрансферазы ShpA и регулятора ответа ТасА.
По мере роста стебелька С. crescentus прикрепительный диск дистанцируется от тела клетки. Однако так бывает далеко не всегда. В частности, Asticcacaulis bipros- thecum образует две симметрично расположенные латеральные простеки, а прикрепительный диск находится непосредственно на теле клетки.
Полярный рост простеки. Как мы уже отмечали, простека (англ. prostheca; oт греч. prostecomai — приростать к чему-либо) принципиально отличается от стебелька. Это не придаток периплазматического компартмента, а цельный вырост клетки (см. раздел 17.1.4).
В полярном росте простеки принимают участие компоненты систем, обеспечивающих латеральный рост палочковидных клеток — пенициллинсвязывающий белок РВР2а и транслоказа липида II RodA (см. раздел 17.3.1), однако каким образом модифицируется их активность, еще неизвестно. Кроме того, рост простеки происходит при участии цитоскелетного белка МгеВ, обеспечивающего «несферическую» форму клетки (см. I том учебника).
Ригидность простеки дополнительно обеспечивается регулярно расположенными поперечными кольцами (англ. crossband), которые состоят из септового муреина. Их образование контролируется белком деления FtsZ (см. раздел 17.4.2).
Апикальный рост. Отдельным примером полярного роста служит апикальный рост (от лат. apex — кончик), или рост верхушечной части цилиндрической клетки, характерный для мицелиальных актинобактерий. В данном случае особью является гифа (греч. hyphe — паутина; не путать с простекой гифомикробов) — агрегат из сильно вытянутых цилиндрических клеток, которые удерживаются вместе нерас- слоенными поперечными стенками.
По характеру своего роста и развития высшие актинобактерии, в частности стрептомицеты, резко отличаются от других бактерий. В то же время они внешне напоминают мицелиальные грибы, и поэтому их долго называли «актиномицетами». В обоих случаях в результате апикального роста (англ. apical growth) и ветвления гиф образуется мицелий — субстратный при благоприятных условиях и воздушный в условиях стресса.
При истощении питательных ресурсов вегетативный мицелий был бы «прикован» к локальному участку твердого субстрата. В таких условиях, чтобы обеспечить себе дальнейшее развитие, актинобактерии образуют новый тип мицелия — воздушный. Он приподнимается над субстратом и поверхностью колонии.
Образование воздушного мицелия имеет, главным образом, репродуктивный смысл — на нем образуются цисты-споры, биологические свойства и расположение которых способствуют передислокации в новые места обитания и ниши (см. также разделы 17.1 и 17.5.2.1).
Гифы актинобактерий растут в апикальной зоне протяженностью ~20 мкм. Зона ветвления с апикальным ростом ветвей расположена на протяжении следующих 100 мкм. Еще дальше расположены старые гифы, которые не ветвятся и не растут.
Суть апикального роста актинобактерий заключается в том, что муреиновый саккулус достраивается только на конусовидном конце гифы; в остальной, трубчатой части он инертен. После того, как апикальная клетка отделяется септой, субапикальная клетка может расти только путем закладки боковой ветви.
Ведущая роль в апикальном росте приписывается гипотетическому «апикальному комплексу». Наиболее вероятными кандидатами в его состав служат ферментативные РВР-белки (см. I том учебника). С их помощью синтезируется максимально эластичный муреин, в результате чего гифа под воздействием тургорного давления растягивается в продольном направлении. Дополнительное участие в характерном морфогенезе стрептомицетов могут принимать еще не идентифицированные цитоскелетные белки (по аналогии с белками МrеВ и СrеБ, которые детерминируют, соответственно, палочковидную и спиралевидную форму бактериальной клетки; см. I том учебника).
Первым идентифицированным компонентом апикального комплекса S. coelicolor стал белок DivIVASC. Он гомологичен белку DivIVА, который определяет экваториальную закладку кольца деления в клетках В. subtilis (в качестве фиксатора белков МinCD на полюсах; см. раздел 17.4.1), а также обеспечивает образование «аксиальной нити» при спорообразовании (в качестве аналога центриолей; см. раздел 17.5.2.2). Мутанты, дефектные по этому белку, обладают слабым апикальным ростом, а суперэкспрессия гена divIVASC стимулирует ветвление. В отличие от своего гомолога, белок DivIVASC не участвует в делении и сегрегации хромосом — ДНК реплицируется не в апикальной зоне, а во внутренних участках гиф, причем сестринские хромосомы доставляются в апикальные участки и боковые ветви с помощью системы РагАВ (см. раздел 16.4.2.1).
Гифы воздушного мицелия, апикально растущие за пределы зоны трофического стресса, преодолевают поверхностное натяжение на границе раздела вода-воздух, а затем успешно переносят водный стресс благодаря гидрофобным свойствам своей поверхности. С этой целью у стрептомицетов, в частности у S. coelicolor, адаптивно синтезируются гидрофобные белки, аналогичные гидрофобинам мицелиальных грибов.
Гидрофобины (англ. hydrorophobin, НFB) представляют собой небольшие, сильно гидрофобные и исключительно стабильные белки. Гидрофобины (в частности, НFBII гифомицета Trichoderma reesii) состоят из α-спирали и «корзинки» из четырех антипараллельных β-цепей, стабилизированных четырьмя внутримолекулярными дисульфидными мостиками. Они секретируются в виде мономеров, но активно агрегируют с образованием амилоидоподобных фибрилл.
Гидрофобины — это многофункциональные природные детергенты. Они снижают поверхностное натяжение на границе раздела вода-воздух, защищают воздушные гифы и споры от обезвоживания, способствуют адгезии к гидрофобным поверхностям, стабилизируют плодовое тело и определяют вирулентность некоторых патогенных грибов.
При росте воздушных гиф Streptomyces spp. синтезируются три типа гидрофобинов — родлины, шаплины и SapB.
Родлины RdlAB (сокр. англ. rodlin; от rod — стрежень) образуют параллельные палочковидные структуры шириной 8 -10 нм на поверхности воздушных гиф и спор. Спектр их функциональных свойств еще не выяснен, однако показано, что они способствуют адгезии к гидрофобным поверхностям.
Центральная роль в образовании воздушных гиф и адгезивности принадлежит шаплинам А-Н (англ. chaplin; от S. coelicolor hydrophobic aerial protein), которые взаимодействуют с родлинами на поверхности воздушных гиф. При дефекте от одного до четырех из восьми генов, кодирующих шаплины, подавляется образование воздушных гиф и спор. Шаплины обладают исключительно высокой детергентной активностью и снижают поверхностное натяжение с 72 до 26 мДж • м-2.
Третий гидрофобии, SapB (сокр. англ. spore associated protein В) усиливает действие шаплинов.
Поляризация клетки. Феномен поляризации клетки, центральная часть которой имеет цилиндрическую форму, связан с существованием двух полусферических полюсов. Такое различие в геометрической кривизне оболочки приводит к неоднородности физико-химических свойств ее отдельных участков и, как следствие, к анизотропному распределению генетических, метаболических и регуляторных функций. Например, кардиолипин (см. I том учебника) сосредоточен преимущественно на полюсах, кривизна которых термодинамически более выгодна для размещения кластеров этого фосфолипида. В свою очередь, с кардиолипином ассоциированы специфические белки, в частности, интегральный мембранный белок РrоР (сокр. англ. proline), который импортирует осмопротекторы, родственные пролину.
Комплекс контрастных изменений, связанных с поляризацией, затрагивает либо только старый полюс (существовавший до деления), либо оба полюса- старый и новый (образованный после деления).
Наиболее характерным морфологическим выражением поляризации клетки служит образование жгутиков на старом полюсе, число которых может быть очень большим (у рекордсмена, археота Pyrococcus furiosus их ~50 в одном пучке).
При дифференциации швермеров С. crescentus на старом полюсе удаляются фимбрии и жгутик, а на их месте образуется стебелек (см. раздел 17.1.4).
Listeria monocytogenes передвигается в цитоплазме хозяйской клетки за счет полимеризации актиновых микрофиламентов на старом полюсе (см. I том учебника, а также раздел 20.3.5 настоящего тома).
Клетки Bradyrhizobium japonicum прикрепляются старым полюсом к корневому волоску бобового макросимбионта с помощью микрофибрилл, в состав которых входит лектин BJ38; на новом полюсе находится капсула и сосредоточены рецепторы бобового агглютинина (см. раздел 20.3.3). В свою очередь, жгутик Pseudomonas aeruginosa образуется на новом полюсе, а адгезионные фимбрии — на старом полюсе; с их помощью бактерия сначала прикрепляется к эпителиальным клеткам трахеи, а затем их прободает. Наконец, хеморецепторный комплекс Е. coli расположен на обоих клеточных полюсах.
На молекулярном уровне поляризация клетки выражается в обогащении полюсов специфическими белками. Такой эффект может быть достигнут;
— первичным включением белка в состав полюса;
— вторичным перераспределением белка в пользу полюса;
— таргетингом «полюсного» белка в сайт деления;
— осцилляцией белка между двумя полюсами.
Первичное включение белка в состав полюса. Простейшим способом, с помощью которого белок может занять место на полюсе клетки, является первичный таргетинг. Именно так, независимо от секреции, оказывается на полюсе белок IscA, отвечающий за полимеризацию актина у Shigella flexneri. В свою очередь, за счет локализованной секреции на полюсе Streptococcus pyogenes сосредоточивается один из факторов вирулентности этой бактерии, белок PrtF.
Вторичное перераспределение белка в пользу полюса. Перераспределение белка в пользу полюса может произойти двумя способами.
В первом случае белок пассивно вытесняется в полярную область по мере латерального роста оболочки. Характерным примером служит полимеризатор актина ActА (см. I том учебника), который заякорен в муреиновом саккулусе L. monocytogenes.
Во втором случае белок активно транспортируется по направлению к полюсу по продольно ориентированной сети микрофиламентов многофункционального белка МrеВ (который, наряду с этим, способствует расхождению сестринских хромосом и определяет палочковидную форму клетки; см. разделы 16.4.2.1 и 17.3.1).
В частности, белок МгеВ обеспечивает таргетинг гистидинкиназ РlеС и DivJ, которые детерминируют, соответственно, жгутиковый и стебельковый полюсы С. crescentus (см. раздел 17.1.4 и рис. 224).
Каким образом регулируется анизотропное распределение этих регуляторных белков? По одному из предположений, непосредственно после деления на новом полюсе появляется специфический маркер, или организующий центр (англ, organizational center). Одним из его компонентов служит белок TipN, контролирующий топографию белка МrеВ, а через него — полярность клетки. Белок МrеВ, в свою очередь, обеспечивает размещение гистидинкиназ Р1еС и DivJ на «правильных» полюсах.
Другим фактором полярной локализации гистидинкиназ (по крайней мере, РlеС) является белок PodJ, который существует в двух формах. «Длинная» мембраносвязанная форма (PodJL) образуется в стебельковой клетке и фиксирует гистидинкиназу Р1еС на апикальном, или бывшем новом полюсе. «Короткая» форма (PodJs) является продуктом протеолиза «длинной» формы в ходе клеточного деления и дифференциации швермера. Таким образом, поляризация клетки непосредственно связана с процессингом белка PodJ.
Таргетинг «полюсного» белка в сайт деления. Как уже отмечалось, при росте в длину палочковидных бактерий, например, В. subtilis и Е. coli, новый муреин встраивается по бокам клетки, а полюсы, сформированные при предшествующем делении, остаются относительно инертными в плане роста. Однако они не инертны в морфогенетическом отношении, поскольку служат организующими центрами, где скапливаются «полюсные» белки.
Полюсные белки предварительно локализуются в области формирующейся септы. Характерным примером служат хеморецепторы Тар, Таг, Trg и Tsr (см. раздел 18.4.1), которые в быстро растущих культурах Е. coli образуют неподвижные кластеры, расположенные на 1/4 и 3/4 длины продольной оси клетки. После двух раундов деления они окончательно оказываются на полюсе, и позднее к ним подключаются другие хемотаксисные белки.
Полюсный белок TipN (сокр. англ. tip — кончик) вначале привлекается в сайт деления и некоторое время остается на новом полюсе, но, когда клетка вновь приступает к размножению, он покидает «стареющий» полюс и перемещается на экватор. В качестве белка-индикатора полюса TipN продольно ориентирует микрофиламенты белка МгеВ, а также определяет нормальное положение жгутика.
Осцилляция белка между двумя полюсами. В данном случае мы сталкиваемся с динамичной полярностью клетки, когда белки или белковые комплексы осциллируют, т. е. попеременно скапливаются то на одном, то на другом полюсе.
Хорошо известным примером осциллирующих белков являются компоненты Min-системы Е. coli (белки MinCDE). Их перемещение между полюсами определяет экваториальное положение Z-кольца деления (см. раздел 17.4.1).
Осцилляция белков между клеточными полюсами обеспечивает смену направления движения у миксобактерии Myxococcus xanthus.
Клетки М. xanthus представляют собой гибкие палочки, которые в поисках пищи осуществляют групповое скольжение по влажной поверхности субстрата (см. 1 том учебника). В отсутствие стресса скольжение индивидуальной клетки прекращается каждые 7-8 мин, после чего возобновляется в прежнем или противоположном направлении. Во втором случае передний полюс становится задним, а задний полюс — передним. При наступлении голодания начинает преобладать поступательное движение к центрам агрегации. В результате этого монослойные биопленки собираются в многослойные массы, которые дифференцируются с образованием плодовых тел, наполненных миксоспорами (см. раздел 17.5.2.1).
Скольжение М. xanthus бывает двух типов — социальное (англ. social gliding, S) и индивидуально-поисковое (англ. adventurous gliding, А). При этом используются разные локомоторные системы-механизм «тяни» и механизм «толкай» (рис. 227), которые кодируются разными группами генов. Естественно, что локомоторные системы разнонаправленного действия не могут одновременно работать на одном и том же полюсе.
Рис. 227. Механизм смены полярности двигательных систем у Мухо- соссus xanthus. Тfр — фимбрии IV типа; NIs — секреторные поры; Tgl и CglB — липопротеины наружной мембраны; МаsК — тирозинкиназа; MglA • ГTФ — активная форма белка, блокирующего реверсию скольжения; FrzЕ~Р — регулятор ответа хемосенсорной системы. Пунктирные линии — слизь; пунктирные стрелки — направление секреции; черные треугольники — активная форма NIs; белые треугольники — неактивная форма NIs; контурная стрелка — направление скольжения; сплошные стрелки — активация; тупые стрелки — ингибрование.
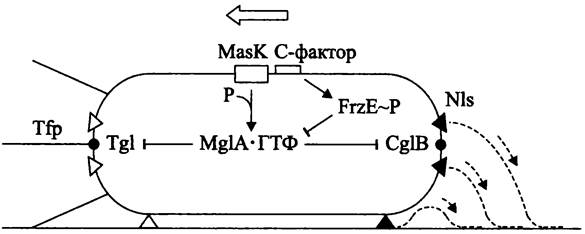
При социальном S-скольжении (механизм «тяни») клетки движутся рывками в тесной группе- рое. Рывок, или твитчинг происходит в результате резкого втягивания фимбрий IV типа, которые расположены на переднем полюсе клетки (англ. type IV pili, Tfp; см. I том учебника). Взаимная координация твитчинга отдельных клеток осуществляется с помощью липополисахаридного О-антигена, а также за счет образования внеклеточного матрикса — он соединяет соседние клетки и образован фибриллами диаметром 10-30 нм, которые состоят наполовину из белка, наполовину из полисахарида. Социальное скольжение происходит только, когда в рое поддерживаются межклеточные контакты. Оно включает в себя: (1) сборку Tfp-фимбрий на одном из полюсов; (2) прикрепление Tfp-фимбрий к внеклеточному матриксу соседа и более тесный контакт клеток, обеспечиваемый на уровне О-антигена; (3) рывок за счет втягивания Tfp-фимбрий. Регулярная смена направления S-скольжения связана со сменой полюсов, на которых образуются Tfp-фимбрии.
Индивидуально-поисковое А-скольжение (механизм «толкай») наблюдается у клеток-разведчиков, которые периодически покидают рой. Оно происходит без участия Tfp-фимбрий и основано на выделении гидрофильной слизи сквозь отверстия структур, которые напоминают сопла-форсунки и сконцентрированы на обоих полюсах клетки (англ. nozzle-like structure, Nls). Каждая Nls представляет собой пору, проходящую через ригидный слой клеточной стенки и ОМ и содержащую компоненты секреторной системы I — выделительные порины ТоIВ, TolR и TolQ (см. I том учебника). Хотя Nls постоянно присутствуют на обоих полюсах клетки, в момент движения они функционируют только на заднем полюсе, т. е. изменение направления связано со сменой полярности секреции слизи.
Изменение направления движения при использовании той или иной локомоторной системы (за счет смены полярности ее расположения) осуществляется с помощью регуляторного каскада, в котором участвуют С-фактор, хемосенсорная Frz-система и белок MglA. С-фактор служит средством внутрипопуляционной коммуникации и, в качестве белкового феромона, вызывает «чувство кворума» (см. раздел 18.4.2). Он синтезируется роем при метаболическом стрессе и воздействует на клетки извне, в результате чего повышается уровень фосфорилирования белка FruA (сокр. англ. fruiting — образование плодового тела). В свою очередь, FruA~P взаимодействует с хемосенсорной Frz-системой (сокр. англ. frizzy — вертящийся; Frz-белки влияют на смену направления движения).
Хемосенсорная Frz-система регулирует частоту реверсий, происходящих при скольжении. Frz- белки гомологичны хемотаксисным белкам энтеробактерий (см. I том учебника и раздел 18.4.1.1 настоящего тома). В частности, гетеродимерный белок FrzCD является гомологом гомодимерного метилакцепторного белка МСР, хотя, в отличие от последнего, он содержит только С-концевой сигнальный домен и локализуется в цитоплазме. Метилирование белка FrzCD стимулируется белком FruA~P. В свою очередь, под воздействием белка FrzCD-СНз автофосфорилируется белок FrzE, который является гибридным гомологом гистидинкиназы CheA и генератора ответа CheY (отметим также, что гетеродимер FrzAB гомологичен белку CheW — «адаптеру» между МСР и CheA, а белки FrzFG гомологичны, соответственно, метилтрансферазе CheR и метилэстеразе CheB, которые обеспечивают сенсорную алаптацию).
Белок MglA (сокр. англ. Myxococcus gliding) выполняет роль негативного регулятора реверсий. Он превращается в активную ГТФ-связанную форму MglA-ГТФ с помощью мембранной тиро- зинкиназы MasK (обратная связь обеспечивается его собственной ГТФазной активностью). ГТФ- связанная форма белка MglA подавляет смену полярности А- и S-систем, вызывая демонтаж Tfp- фимбрий или блокируя секрецию слизи. В первом случае мишенью MglA-ГТФ является липопротеин Tgl, а во втором случае — липопротеин CglB; оба они входят в состав ОМ. В свою очередь, негативным регулятором MglA-ГТФ служит белок FrzE~P (рис. 227).