МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ III - А. В. ПИНЕВИЧ - 2009
ГЛАВА 19. ЭКОЛОГИЧЕСКИЕ СТРЕССЫ
Hardly any question in Natural History is more vague and difficult to decide than what forms within any large group ought to be considered as the highest; for all are excellently adapted to their conditions of life.
(В Естественной Истории вряд ли найдется более туманный и сложный вопрос, чем тот, какую форму в любой крупной группе считать самой совершенной, ибо все они превосходно адаптированы к условиям существования).
С. Darwin. On the Various Contrivances by Which British and Foreign Orchids are Fertilised by Insects, and on the Good Effects of Intercrossing (London, 1862).
Прокариоты довольно часто попадают в неблагоприятные условия окружающей среды, которые создаются либо постепенно, либо очень быстро. В обоих случаях экстремальное воздействие абиотических факторов вызывает экологический стресс (англ. environmental stress — стресс, вызванный окружающей средой) с адаптационным ответом, зависящим от типа и интенсивности стрессора.
Микробиологический термин «экологический стресс» обычно заменяют его усеченным вариантом — «стресс», хотя он калькирует термин, используемый в физиологии животных и медицине.
Классический термин «стресс» (англ. stress — нажим), предложенный в середине 1930-х гг. канадским физиологом Гансом Селье (H.Selye), означает состояние неспецифического напряжения в животном организме, выражающееся в морфофизиологических изменениях ряда органов, особенно эндокринных желез, которые находятся под контролем гипофиза. Комплекс таких изменений носит характер «генерализированного адаптационного синдрома», состоящего из трех последовательных стадий: стадии тревоги, стадии резистентности и стадии истощения. Например, при продолжительном воздействии такого стрессора, как холод, в цитоплазме клеток коры надпочечников уменьшается, затем резко увеличивается, а потом опять убывает пул предшественников стероидных гомонов.
Специфика стресса у прокариотов. Широкое распространение и произвольное истолкование термина «стресс» привело к размыванию его первоначального смысла, и он стал применяться по отношению к любым организмам, подвергнутым экстремальному воздействию. В бактериологии термин «стресс» впервые прозвучал
в середине 1970-х гг. — вопреки очевидному соображению, что адаптацию у прокариотов нельзя описывать категориями, отражающими адаптационные процессы в животном организме с его сложной тканево/органной структурой и нейро гуморальной регуляцией. Тем не менее, использование термина «стресс» по отношению к прокариотам в какой-то мере оправданно. Особенно это касается тех случаев, когда реакция на разные стрессоры носит неспецифический и генерализированный характер (примерами служат ответы, которые контролируются регулонами RpoS, SOS, Hsp и GSP; см. разделы 18.1.2 и 18.1.3). Они связаны с приобретением неспецифической резистентности к разнообразным повреждающим факторам за счет индукции регулонов и стимулонов, отвечающих за ответы на воздействие специфических стрессоров.
Одновременно с неудачно позаимствованным термином «стресс» и в качестве его синонима бактериологи стати использовать менее конкретный термин «шок» (англ. shock — букв,удар; шок как физиологическое состояние), которым в физиологии животных обозначается общая реакция организма на экстремальное внешнее воздействие.
В дальнейшем мы будем пользоваться обоими терминами, следуя предпочтениям, сложившимся в научной литературе.
Опираясь на сведения о регуляторных системах, приведенные в предыдущей главе, мы рассмотрим особенности ответа, когда — в зависимости от типа и интенсивности стрессора -он осуществляется на (пост)транскрипционном, метаболическом или поведенческом уровне.
Классификация стрессов у прокариотов. Хотя общепринятой непротиворечивой классификации стрессов у прокариотов не существует, их можно подразделить на две основные группы:
— цитоплазматические стрессы, когда стрессор влияет на процессы в цитоплазматическом компартменте;
— периплазматический стресс, когда мишенью для стрессора служит периплазматический компартмент, а также ограничивающие его слои клеточной оболочки (СМ и ОМ; см. I том учебника).
В свою очередь, к цитоплазматическим стрессам относятся:
— «общие» стрессы (вызывающие SOS- или RpoS-ответ);
— «частные» физические стрессы (термические стрессы; водный, осмотический, гидростатический и радиационный стрессы);
— «частные» химические стрессы (окислительный стресс и pH-стресс, токсический шок).
Следует иметь в виду, что разные стрессоры могут воздействовать на одну и ту же мишень, а один и тот же стрессор — на разные мишени, причем ответы при стрессах могут перекрываться. Кроме того, в природных нишах бактерии, как правило, сталкиваются с несколькими стрессорами, действующими одновременно или один за другим; в этом случае вместо моностресса происходит мультистресс (например, холодовой шок часто сочетается с окислительным стрессом и т. д.).
19.1. Цитоплазматические стрессы
Хотя при цитоплазматических стрессах мишенью для стрессора служат «интимные» внутренние структуры, характер адаптационного ответа, или его цена, выражающаяся в количестве активируемых и репрессируемых генов, может существенно различаться.
Стрессы, вызывающие SOS-ответ или RpoS-ответ, непосредственно связаны с изменением состояния незаменимых информационных систем — в первую очередь, репликационных, транскрипционных и трансляционных. Неудивительно, что адаптационные ответы при таких общих стрессах контролируются на уровне регулонов, содержащих множество генов и оперонов. Кроме того, ответы при общих стрессах взаимодействуют с ответами при частных стрессах.
Про RроS-ответ мы уже говорили в разделе 18.1.2, а SOS-ответ обсуждался дважды — в разделе 16.5.1.4 (содержащем сведения о рекомбинационной репарации) и разделе 18.1.2 (посвященном регулонам). Поэтому мы не станем возвращаться к этим «общим» стрессам, а перейдем к «частным» физическим стрессам, которые могут быть термическими (тепловой шок и холодовой шок) и нетермическими (водный, осмотический, гидростатический и радиационный стрессы).
19.1.1. Термические стрессы
Температура является глобальным физическим фактором, который оказывает множественное и неоднозначное воздействие на живые системы. С ростом температуры увеличивается текучесть липидного слоя (что повышает проницаемость мембран и вносит хаос во взаимодействие мембранных белков); дестабилизируется вторичная структура ДНК и РНК; нарушается правильная укладка полипептидных цепей и т. д. В свою очередь, при понижении температуры в липидном слое образуются кристаллические домены (что приводит к сегрегации мембранных белковых комплексов); стабилизируется вторичная структура ДНК и РНК (что снижает эффективность репликации, транскрипции и трансляции); уменьшается кинетическая активность ферментов и переносчиков и т. д.
При физиологических температурах мембраны поддерживаются в жидкостнокристаллическом состоянии с помощью механизма гомеовязкостной адаптации, т. е. путем варьирования жирнокислотного состава фосфолипидов (см. I том учебника). В свою очередь, термоадаптация (не)ферментативных белков зависит от их устойчивости к денатурации. Кроме того, термоадаптация связана с общим паттерном трансляции, а также с адаптивным синтезом специфических белков, соответственно, белков теплового и холодового шока. Наконец, термоадаптация достигается неспецифическим путем с помощью систем, обеспечивающих ответы при других стрессах.
В зависимости от способности расти при низкой температуре, прокариоты подразделяются на психрофилов (оптимальная температура роста <15° С, максимальная < 20° С) и холодотолерантных психротрофов (максимальная температура роста 20-40°С); те и другие могут расти при 0°С, а в отдельных случаях даже при — 12°С. Рост при умеренной температуре характерен для мезофилов (10-50°С). Наконец, адаптированные к высокой температуре прокариоты подразделяются на термофилов (оптимум роста при ~ 60°С), экстремальных термофилов (~ 80°С) и гипертермофилов (~ 100°С).
Тепловой шок. Повышение температуры (например, в полностью перемешиваемых полимиктических водоемах) вызывает тепловой шок. На стратегии и тактике соответствующего адаптационного ответа мы уже останавливались в I томе учебника, а также в разделе 18.1.2 настоящего тома, где, в частности, шла речь о регулоне Hsp. К ранее сказанному добавим, что ответ при тепловом шоке может перекрываться с ответами, свойственными для других стрессов. В качестве примера назовем гипертермофильных архей.
У гипертермофильных архей ответ при тепловом шоке имеет ряд специфических особенностей. Прежде всего, у них отсутствуют «канонические» шапероны DnaJ/DnaK/GrpE. Кроме того, их главный шаперонин, или термосома (Hsp70) характеризуется более высоким уровнем гомологии с эукариотным шаперонином TF55/CCT, чем с бактериальным шаперонином GroEL/GroES. Наконец, у них отсутствуют АТФ-зависимые протеазы СlрА и HflB (FtsH), а протеаза Lon сильно модифицирована. Тем не менее, АТФ-зависимый протеолиз у архей протекает без участия «эукариотного» убиквитина и контролируется непосредственно на уровне активности фермента. Другой особенностью ответа гипертермофилов служит образование уникальных осмопротекторов (см. раздел 19.1.3). Например, у Pyrococcus furiosus концентрация ди-миоинозитол-1,17-фосфата возрастает в 20 раз при увеличении температуры с 95° до 101° С, т. е. это в большей степени термопротектор, чем осмопротектор. Считается, что осмопротекторы гипертермофилов придают клеткам дополнительную устойчивость при высокой температуре.
Холодовой шок. Понижение температуры вызывает холодовой шок, например, при выходе Е. coli из пищеварительного тракта или при искусственном охлаждении продуктов питания (в случае психротрофного патогена Listeria monocytogenes). Ответ на охлаждение достигается за счет поддержки отрицательной суперспирали- зации ДНК и процессивной структуры мРНК; посредством гомеовязкостной адаптации; путем поддержания нативного состояния макромолекул и их комплексов; с помощью эндогенных или экзогенных осмопротекторов, а также благодаря синтезу белков холодового шока.
В ходе адаптационного ответа начинают синтезироваться холод-индуцированные белки (англ. coldinduced protein, СlР), тогда как выработка большинства других белков подавляется. Набор CIP различается у отдельных бактерий (L. monocytogenes — 12; Е. coli — 18; Lactobacillus lactis — 22; В. subtilis — 37 вариантов), и они подразделяются на две группы.
Белки первой группы, или белки холодового шока (англ. cold-shock protein; Csp) практически не синтезируются при оптимальной температуре, однако при холодовом шоке их выход составляет >10% объема трансляции (до 106 молекул на клетку).
Белки второй группы относятся к числу конститутивных; при холодовом шоке их синтез усиливается меньше, чем на порядок, т. е. не столь драматически. К их числу относятся: ДНК-изгибающий белок H-NS; ДНК-гираза GyrA; фактор рекомбинации RecA; факторы инициации и терминации транскрипции IF-2 и NusA; рибонуклеаза PNP (участвующая в деградации мРНК); фактор RbfA (связывающийся с 30S-субъединицей рибосомы) и ряд других.
Белки холодового шока у бактерий. Гены белков холодового шока имеются у многих грамотрицательных и грамположительных бактерий, хотя они распространены не универсально (например, их нет у Helicobacter pylori и Mycoplasma genitalium). В случае Е. coli семейство Csp состоит из девяти взаимно гомологичных белков CspA-I; гены четырех из них (cspА, cspB, cspG и cspl) индуцируются при холодовом шоке, но регулируются порознь. Остальные гены экспрессируются либо конститутивно, либо только при голодании (cspD).
Csp представляют собой небольшие (~7 кДа) анионные белки, состоящие из пяти антипараллельных β-цепей, образующих бочковидную структуру. Характерной особенностью cspA-мРНК служит необычно длинный 5'-концевой нетранслируемый участок (5'-UTR), содержащий высококонсервативную последовательность из 11 нуклеотидов, или холодовой бокс (англ. cold box). Кроме того, cspA-мРНК крайне нестабильна — при оптимальной температуре роста время ее «полужизни» составляет 12 с. При холодовом шоке оно увеличивается до 20 мин за счет стабильной вторичной структуры 5'-UTR.
Считается, что роль сенсоров при холодовом шоке (так же, как и при тепловом шоке) играют рибосомы, которые до момента полной адаптации транслируют только csp-мРНК. Холодовой бокс служит сайтом торможения транскрипции, однако при холодовом шоке РНК-полимераза каким-то образом его обходит. Синтез csp-мРНК стимулируется за счет расположенного рядом с ее геном особого down- stream-бокса (DB), который способствует инициации транскрипции, связываясь с 16S рРНК. Перепроизводство белка CspA предотвращается им самим с помощью механизма аттенуации (см. раздел 16.7.1.3).
Белки CspA (Е. coli) и CspB (В. subtilis) содержат высококонсервативные последовательности, позволяющие связываться с разнообразными мРНК. Предполагается, что они играют роль шаперонов для мРНК и устраняют неправильный фол- динг полинуклеотидной цепи в виде дополнительных спаренных участков вторичной структуры, возникающих при понижении температуры. При связывании мРНК с белками Csp она «выпрямляется», что способствует инициации трансляции. Хотя при охлаждении значительная часть рибосом диссоциирует на субъединицы, неповрежденные рибосомы транслируют csp-мРНК, а остальные реконструируются с помощью фактора RbfA (см. выше).
Белки холодового шока у архей. В большинстве секвенированных геномов архей, в особенности (гипер)термофилов, гомологи генов csp не обнаружены. В то же время, благодаря растущему интересу к археям, адаптированным к существованию в низкотемпературных нишах, удалось выявить несколько форм, синтезирующих Csp-белки, которые гомологичны бактериальным Csp-белкам. Из представителей филы AI Crenarchaeota это Crenarchaeum symbiosum; среди представителей филы АН Euryarchaeota — стенопсихрофил (от греч. sténos — узкий; т. е. ограниченно приспособленный к росту при низкой температуре) Methanogenium frigidum, температурный максимум роста которого равен 18°С, а также мезофилы Haloarcula marismortui, Halobacterium sp. NRC-1 и Haloferax volcanii.
19.1.2. Водный стресс
Водный стресс, или стресс, вызванный водным матриксом (англ. water matric stress) происходит при высушивании вегетативных клеток в атмосферном воздухе с потерей до 99% воды. Способность в вегетативном состоянии переносить водный стресс особо важна для обитателей засохшей или аридной почвы, в частности для Deinococcus radiodurans и Nostoc spp. Она также имеет исключительно важное эпидемиологическое значение; примерами служат возбудители госпитальных инфекций Acinetobacter baumanii и Bukrholderiacepacia, а также Mycobacterium tuberculosis, до 120 суток не теряющая жизнеспособности в сухой пыли.
Выдерживать почти полное обезвоживание способны ангидробионты (англ. anhydrobiote) из числа растений и животных; наиболее известны «воскресающее» плауновидное Selaginella lepidophylla, почвенная нематода Ditylenchus dipsaci, тихоходка Adoribiotus coronifer и галофильный рачок Artemia salina. Кроме того, способность сохраняться на воздухе присуща специализированным покоящимся онтогенетическим стадиям микро- и макроорганизмов — например, макроцистам миксомицета Dictyostelium sp., а также спорам и семенам растений или эндоспорам и цистам прокариотов (в двух последних случаях содержание воды составляет, соответственно, 28-50% и 60%, так что к ангидробионтным формам эти дифференцированные клетки не относятся).
Остаточных ~10% воды при глубоком обезвоживании недостаточно для образования сольватной оболочки (например, при нормальной гидратации, когда содержание воды в цитоплазме составляет ~70%, на молекулу фосфолипида приходятся 10-12 молекул воды), что делает невозможным ферментативные реакции и, соответственно, клеточный рост. Дело в том, что из-за уменьшения степени гидратации изменяется конформация ферментов в составе электрон-транспортных цепей и ферментов конструктивного метаболизма; от этого и из-за накопления свободных радикалов вышеуказанные белки денатурируются. Обезвоживание вызывает мутационные повреждения ДНК в результате окисления, алкилирования, образования поперечных сшивок и депуринизации. Наконец, при удалении воды возрастает плотность упаковки мембранных липидов, что усиливает ван-дер-ваальсово взаимодействие их боковых цепей и повышает температуру фазового перехода мембраны — из жидкостно-кристаллического состояния она переходит в гель, что нарушает ее нормальные функции, в частности избирательную проницаемость.
Ответ при водном стрессе перекрывается с ответом при осмотическом шоке и голодании, поскольку их регуляцию обеспечивают альтернативные сигма-факторы (в частности, σS Е. coli и σВ. subtilis).
Характерным элементом ответа при водном стрессе служит накопление до 20% дисахаридов — сахарозы и, особенно, трегалозы (см. раздел 18.1.2 и рис. 272). Гены, кодирующие синтазу трегалозы OtsBA, контролируются мастер-регулятором RpoS (σS). В отличие от редуцирующих сахаров, трегалоза не вступает в реакцию Меллара (L.-C. Maillard), которая происходит между альдегидными группами и первичными аминами нуклеиновых кислот или аминогруппами белков с образованием шиффова основания, последующие перестройки которого приводят к деградации белков до меланоидных продуктов. Кроме того, трегалоза образует аморфные «стекла», в которых иммобилизуются белки и другие макромолекулы, что сохраняет их в нативной конформации. Наконец, вместо воды трегалоза вступает в водородные связи с мембранными липидами, что поддерживает их в жидкостно-кристаллическом состоянии.
При водном стрессе клетка теряет воду; сходный процесс происходит при гипоосмотическом шоке (см. ниже), однако это разные формы стресса. В первом случае клетка окружена атмосферным воздухом, а во втором случае находится в водном растворе, хотя и при пониженном химическом потенциале воды. Тем не менее, гипоосмотический шок можно рассматривать как начальную стадию водного стресса.
19.1.3. Осмотический шок
Поскольку биомембраны пропускают воду, но задерживают осмотически активные вещества, цитоплазма прокариотной клетки чаще всего гиперосмотична, что обеспечивает нормальный тургор, необходимый для роста и деления; реже она находится в изоосмотическом состоянии с окружающей средой.
При добавлении водорастворимого вещества к химически чистой воде оно замещает ее молекулы, т. е. уменьшает молярную долю воды (NW) в системе. В свою очередь, от молярной доли воды зависит ее химический потенциал (μw) и такая термодинамическая величина, как активность воды (aw)> приблизительно соответствующая относительной влажности. Наконец, с активностью воды связано осмотическое давление (II):
II ~ -RТ ln aw.
При гипоосмотическом шоке присутствие в цитоплазме «непроникающих» осмолитиков (осмотически активных веществ) вызывает поступление воды в клетку. При гиперосмотическом шоке бактерии находятся в растворе осмолитика, который не может проникнуть в цитоплазму; в соответствии с доннановым равновесием, вода выходит из клетки до тех пор, пока не сравняются ее активности в двух компартментах — цитоплазматическом и экзоплазматическом. В конечном счете, баланс между внутренним и внешним осмотическим давлением зависит от пула осмолитиков эндогенной или экзогенной природы.
При резком повышении осмомолярности наружной среды через несколько миллисекунд вода начинает перемещаться по осмотическому градиенту, что приводит к уменьшению тургора, а затем к плазмолизу (уменьшению объема цитоплазмы); последствием этих изменений становится гиперосмотический шок. В свою очередь, резкое снижение осмомолярности, обычно из-за опреснения, вызывает такие проявления гипоосмотического шока, как повышение тургора и растяжение СМ.
Гиперосмотический шок. Гиперосмотический шок связан с пребыванием в среде с высоким осмотическим давлением, обычно за счет присутствия соли в высокой концентрации.
Различают организмы, временно испытывающие гиперосмотический шок, и организмы, постоянно адаптированные к среде с высокой соленостью. Во втором случае речь идет о гапотолерантных формах, а также о галофилах, которые оптимально растут в данных условиях. Галофилы подразделяются на экстремальных (20-30% соли, обычно NaCl), умеренных (5-20%) и слабых (2- 5%). К числу экстремальных галофилов относятся археи из класса Halobacteria и из семейства Methanosarcinaceae, а также бактерии Ectothiorhodospira halochloris и Actinopolysporn halophila. Отдельный случай — это облигатные экстремальные галофилы, которые лизируются при понижении концентрации соли.
Адаптация при осмотическом шоке достигается на конститутивном уровне, когда клетки содержат белки с высоким относительным содержанием анионных аминокислот, а также на индуцибельном уровне, путем создания осмотического баланса между клеткой и окружающей средой.
При гиперосмотическом шоке используются две стратегии осмоадаптации. Первая, которая образно называется «соль в цитоплазме» (англ. salt-in-cytoplasm; salt inside), заключается в том, чтобы компенсировать наружное осмотическое давление за счет импорта ионов К+ и Сl- до равновесной концентрации с ионами Na+ и Сl- (или НСО-3) в окружающей среде. Она свойственна только трем группам облигатных экстремальных галофилов — археям из класса Halobacteria, археям из семейства Methanosarcinaceae и бактериям из семейства Haloanaerobiaceae. В данном случае оболочка клетки и содержимое цитоплазматического компартмента стабильны только в среде с высоким осмотическим давлением, и поэтому при гипоосмотическом шоке адаптация невозможна.
Вторая стратегия, под образным названием «соль снаружи» (англ. salt-out), заключается в том, чтобы не дать соли проникнуть в цитоплазму; при этом осмотический баланс поддерживается за счет накопления органических осмолитиков, которые клетка синтезирует самостоятельно или импортирует из окружающей среды. К данной стратегии прибегает большинство прокариотов. Адаптивный ответ, наиболее изученный на примере Е. coli, протекает в две фазы.
В первой фазе проникшие в цитоплазму ионы Na+быстро удаляются Na+/H+- антипортером, и взамен них при помощи высокоаффинного транспортера KdpA по-
глощаются катионы К+. Индукция гена kdpA, входящего в состав оперона kdpFABC, происходит под воздействием транскрипционного фактора KdpE из двухкомпонентной сигнальной системы KdpD/KdpE. Сенсор KdpD реагирует на сигнал о повышении наружной осмомолярности. Его природа не выяснена; теоретически, это могут быть тургор, эластическое состояние СМ, внутренняя/наружная осмомолярность или ионная сила, концентрация специфических растворенных веществ и т. д. Накопление катионов К+ в цитоплазме компенсируется усиленным синтезом противоиона — глутамата.
Во второй фазе ответа синтезируются или импортируются органические осмолитики, или осмопротекторы (англ. osmoprotector). Поскольку их присутствие в цитоплазме даже в высокой концентрации не вредит жизнедеятельности, они имеют второе название — биосовместимые растворенные вещества (англ. compatible solutes). Сведения о распространении осмопротекторов у прокариотов представлены в таблице 33.
Таблица 33. Распространение осмопротекторов у прокариотов
Фила |
Осмопротектор |
|||||
Глицинбетаин |
Глутамат |
Глюкозилглицерол |
Пролин |
Трегалоза |
Эктоин |
|
АII Euryarchaeota |
+ |
+ |
- |
- |
- |
- |
ВХ Cyanobacteria |
+ |
- |
+ |
- |
+ |
- |
BXII Proteobactcria |
+ |
+ |
- |
+ |
+ |
+ |
BXIII Firmicutes |
+ |
+ |
- |
+ |
+ |
+ |
BXIV Actinobacteria |
- |
+ |
- |
+ |
+ |
+ |
Примечание: данные по другим филам отсутствуют.
Осмопротекторы бактерий (рис. 272). Бактериальные осмопротекторы образуют узкую группу аминокислот, сахаров и полиолов, а также их производных. Они электронейтральны и представляют собой либо незаряженные молекулы, либо цвиттерионы. Среди них наиболее известны глицинбетаин (N- карбоксиметил-N, N, N-триметиламин), глутамат, глюкозилглицерол, пролин, трегалюза (1-O-α-D-глюкопиранозил-α-D-глюкопиранозид) и эктоин (2-метил-1,2,5,6- тетрагидропиридин-4-карбоновая кислота).
Рис. 272. Осмопротекторы бактерий.
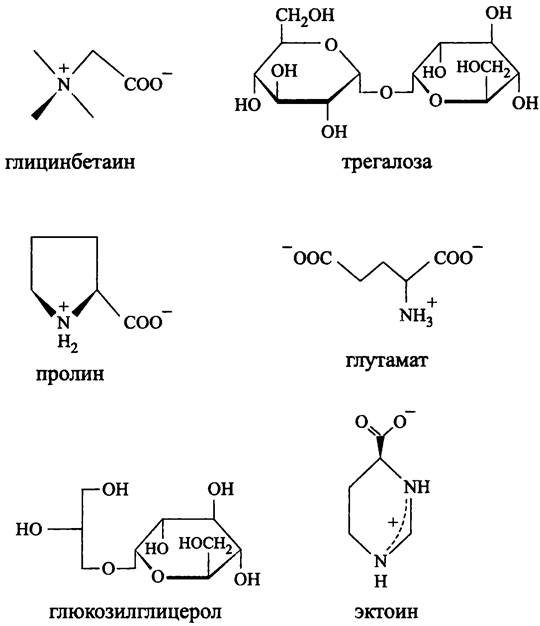
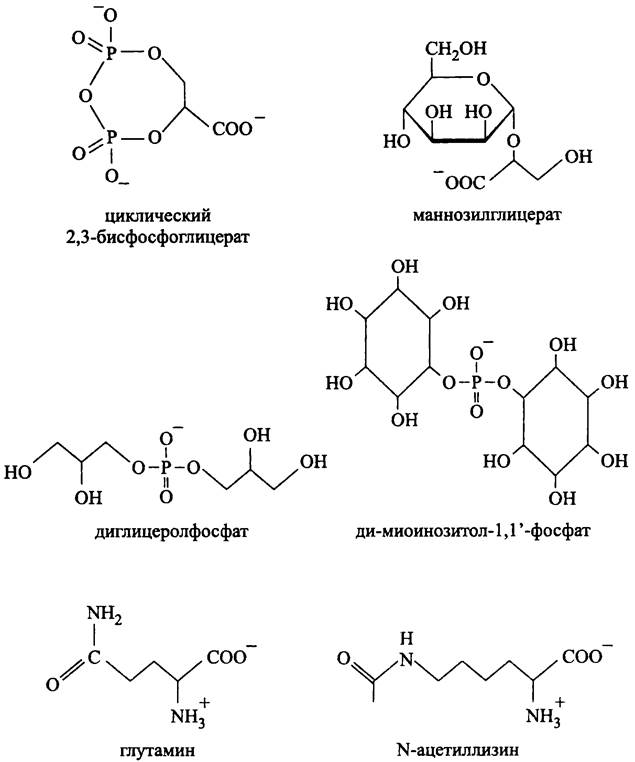
Осмопротекторы архей (рис. 273). Хотя осмопротекторы архей по структуре напоминают осмопротекторы бактерий, большинство из них несет отрицательный заряд, что связано с присутствием карбоксильных, фосфорильных или сульфонильных групп; предполагается, что это позволяет компенсировать заряд катионов К+, которых обычно много в цитоплазме архей. К ним относятся циклический 2,3- бисфосфоглицерат, маннозилглицерат, диглицеролфосфат и ди-миоинозитол-1,1'- фосфат (последний также накапливается при тепловом шоке; см. выше). Трегалоза, тривиальный осмопротектор мезофильных бактерий, у архей встречается крайне редко; примерами служат Pyrobaculum aerophilum, и Thermoproteustenax.
Рис. 273. Осмопротекторы архей.
Механизм действия осмопротекторов и способы их накопления. Осмотическое давление, создаваемое осмопротекторами, уравновешивает осмотическое давление окружающей среды и способствует тургору. Кроме того, осмопротекторы защищают внутриклеточные структуры от повреждений, вызываемых изменением ионной силы и активности воды.
Защитная роль осмопротекторов находит объяснение в рамках теории вытеснения сопутствующего растворенного вещества (англ. excluded co-solute theory). Согласно ей, в трехкомпонентной системе «вода/белок/сопутствующее растворенное вещество» последнее оказывает стабилизирующее воздействие на белок, так как держится на некотором удалении от него, обеспечивая его преимущественную гидратацию. Хотя это состояние термодинамически не выгодно, оно может стать еще более невыгодным, если белок изменит свою конформацию, что создаст дополнительные домены для вытеснения сопутствующего растворенного вещества. В итоге система стремится к поддержанию нативного состояния белка. Сопутствующие растворенные вещества подразделяются на космотропов (англ. kosmotrope; от греч. kosrnos — порядок и trope — изменяться в сторону чего- либо; букв, — стремящиеся к порядку), которые поддерживают структуру сольватной оболочки, и хаотропов (англ. chaotrope), которые ее разрушают. Осмопротекторы относятся к космотропам.
Биосинтез осмопротекторов происходит в результате индукции σS-зависимых оперонов, в частности оперона otsBA (сокр. англ. osmoregulated tregalose synthesis).
Наряду с образованием эндогенных осмопротекторов, бактерии могут импортировать экзогенные осмопротекторы, поступающие в окружающую среду из разрушенных или травмированных клеток других организмов. В частности, основными продуцентами глицинбетаина служат фототрофные бактерии, а хемогетеротрофные бактерии используют чужой глицинбетаин. Известны три системы импорта осмопротекторов — РrоР (транспортер пролина Е. coli), BetP (транспортер глицинбетаина
Corynebacterium glutamicum) и ОрuА (транспортер глицинбетаина Lactococcus lactis). Помимо роли осморегуляторов, они выполняют роль осмосенсоров.
Для облегчения импорта осмопротекторов преимущественно синтезируются осмопорины большего эксклюзивного диаметра — ОmрF.
Тримеры поринов «общего назначения», или осмопоринов ОmрС и ОmрF образуют гидрофильные каналы в ОМ и участвуют в осмоадаптации, а также обеспечивают устойчивость к токсикантам. ОmF-каналы имеют больший эксклюзивный диаметр.
Тонкий контроль за составом поринов осуществляется на посттранскрипционном уровне с помощью двухкомпонентной сигнальной системы ЕnvZ/ОmрR. Сенсорная гистидинкиназа EnvZ фосфорилирует регулятор ОmрR. ОmрR~Р подавляет транскрипцию гена малой РНК МicС и активирует транскрипцию гена малой РНК МicF (см. раздел 18.2.2). В свою очередь, эти малые РНК негативно контролируют трансляцию мРНК поринов ОmрС и ОmрF.
Гипоосмотический шок. В природных условиях гипоосмотический шок случается чаще, чем гиперосмотический, и связан с резким опреснением экологической ниши, например, в результате обильных дождей. При снижении внешней осмомо- лярности вода начинает поступать в клетку, что приводит к увеличению объема цитоплазмы и растяжению СМ. В ответ клетка начинает быстро избавляться от осмопротекторов. Предполагается, что центральная роль принадлежит механочувствительным каналам MscLMS (сокр. англ. mechanosensitive channel), соответственно, большого, среднего и малого размера, которые реагируют на растяжение СМ.
Наряду с выводом осмопротекторов из цитоплазмы, грамотрицательные бактерии пускают в ход механизмы адаптации, создающие осмотическую «подушку». В частности, в ОМ начинают доминировать осмопорины меньшего эксклюзивного диаметра—ОmрС (см. раздел 18.2.2), что способствует увеличению осмомолярности периплазматического компартмента.
Вторым способом повышения осмомолярности периплазматического компартмента служит накопление в нем специфических осмопротекторов, молекулы которых не проходят через пориновые каналы. Некоторые из них содержат анионные заместители, благодаря чему могут обеспечивать доннаново равновесие на уровне ОМ.
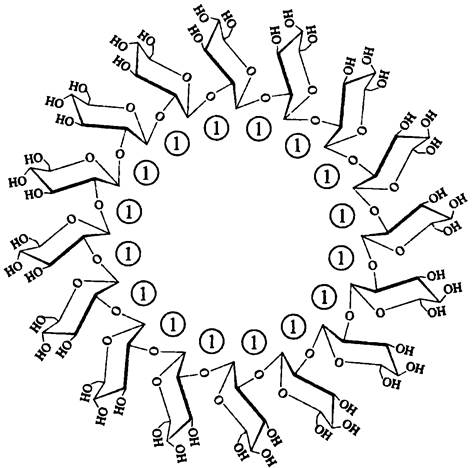
В качестве периплазматических осмопротекторов представители филы ВХII Ртоteobacteria используют осморегулируемые периплазматичехкие глюканы (англ. osmoregulatedperiplasmic glucan, OPG). Это линейные разветвленные или циклизированные олигосахариды, состоящие из 5- 24 мономеров глюкозы, которые соединены α- или β-гликозидными связями — примером служит 16-мерный циклический β-1,2- глюкан; его синтезируют представители сем. Rhizobiaceae (рис. 274).
Рис. 274. Осморегулируемый периплазматический 16-мерный глюкан Rhizobiaceae. Цифрой 1 обозначены β-1,2-гликозидные связи.
Синтез OPG в клетках Е. coli осуществляют продукты оперона mdoGH. Амфипатическая глюкозилтрансфераза MdoH (97 кДа) образует олигосахарид из УДФ-глюкозы и одновременно экспортирует его в периплазму; периферический белок MdoH (56 кДа), по-видимому, отвечает за синтез разветвленного полимера. В некоторых случаях к боковым мономерам глюкозы дополнительно присоединяется фосфоглицерол — продукт обновления мембранных фосфолипидов; поэтому OPG вначале называли мембраногенными олигосахаридами (англ. membrane derived oligosaccharide, MDO). В качестве полярных группировок также используются сукцинильные остатки. Роль трансферазы, соответственно, выполняют амфипатический белок MdoB и интегральный белок MdoC.
Концентрация OPG изменяется в обратной зависимости от осмомолярности наружной среды и лежит в пределах 0,5-5% сухого веса клеток. При гипоосмотическом шоке синтез OPGстимулируется; при повышении наружной осмомолярности они не разрушаются, а распределяются между дочерними клетками до оптимальной концентрации.
19.1.4. Гидростатический стресс
При погружении на каждые 10 м гидростатическое давление увеличивается на 1 атм. В Мировом океане, глубина которого достигает 11 км, оно варьирует в пределах 1-3 порядков. При ~100 атм нарушаются фолдинг белков, экспрессия генов и клеточное деление; под высоким давлением мембраны переходят из жидкостнокристаллического состояния в состояние геля. Поэтому значительное перемещение в глубину водного столба воспринимается бактериями как стресс и требует от них адаптационного ответа. Гидростатический стресс обычно сопровождается холодовым шоком, поскольку средняя температура в глубине составляет ~ 5°С (обитатели глубоководных гидротерм, напротив, дополнительно испытывают тепловой шок).
Вертикальное перемещение бактерий происходит по четырем основным причинам: (1) за счет апвеллинга (перемешивания водных слоев); (2) в результате прикрепления к седиментирующим или всплывающим частицам детрита; (3) «на плечах» суточно мигрирующих миктофид (светящиеся анчоусы) или млекопитающих-ныряльщиков (киты); (4) при ассоциации с разными стадиями развития беспозвоночных (криль). Наряду с бактериями, испытывающими стресс при эпизодических перепадах давления, существуют формы, постоянно адаптированные к высокому давлению. Рост барочувствительных бактерий снижается по мере увеличения давления от 1 до 400 атм, баротолерантные бактерии хорошо растут во всем указанном диапазоне, а для барофилов (от греч. бале — тяжелый), или пьезофилов (от греч. pieso — давить) оптимум давления составляет ~ 400 атм (40 МПа).
Поскольку высокое давление воздействует на мембраны так же, как низкая температура, при гидростатическом стрессе используется механизм гомеовязкостной адаптации, и липиды обогащаются остатками ненасыщенных жирных кислот. Одновременно с этим синтезируется ряд индуцибельных белков, в том числе «барофильных» ферментов. Наконец, накапливаются осмопротекторы (см. раздел 19.1.3), которые оказывают общее стабилизирующее воздействие.
Примером адаптационного ответа на высокое давление служит дифференциальный синтез поринов ОmрН и ОmрL у Photobacterium sр. SS9. При повышении давления от 1 до 300 атм позитивно регулируется промотор гена оmрН, в результате чего содержание более «пропускного» порина ОmрН увеличивается на порядок; напротив, при низком давлении доминирует порин ОmpL. Предполагается, что при низком давлении сенсор ТохR, расположенный в СМ димеризуется и с помощью регулятора ТохS активирует транскрипцию гена оmрL, одновременно с этим подавляя транскрипцию гена оmрН. При высоком давлении комплекс ТохК/ТохS распадается, и транскрипция гена оmрН дерепрессируется.
19.1.5. Радиационный стресс
Ультрафиолетовое излучение и более коротковолновая ионизирующая радиация вызывают биоповреждения, которые предотвращаются или исправляются адаптационными механизмами.
Важнейшим источником природной радиации служит Солнце, хотя потенциально разрушительна относительно узкая часть солнечного спектра — ультрафиолетовое излучение <400 нм, причем и оно ослабляется озоновым экраном, пылевыми загрязнениями атмосферы, а также облачным покровом. Фоновой природной радиацией являются космические лучи (3 •10-2 рад • год-1) и локальное излучение радионуклидов скальных пород. Суммарная мощность антропогенных источников в десятки раз меньше, хотя в локальных участках она может флуктуировать до очень высоких значений.
Радиационный стресс связан с задержкой роста, в частности, из-за нарушения репликации при повреждении ДНК. В этом случае центральную роль в контроле адаптации играют регулон стационарной фазы RроS и регулон SOS-ответа (см. разделы 16.5.1.4 и 18.1.2). Основной мишенью для радиационного стрессора служит ДНК. В частности, это касается ультрафиолетового света, спектр действия которого совпадает со спектром поглощения нуклеиновых кислот. В то время как при облучении ультрафиолетовым светом образуются пиримидиновые димеры, которые устраняются с помощью фотореактивации (см. раздел 16.5.1.1), под воздействием ионизирующей радиации образуются двухцепочечные разрывы ДНК и свободные радикалы, вызывающие химическую модификацию азотистых оснований и сахарофосфатного скелета. Для исправления таких глубоких дефектов используются специальные репарационные системы, удаляющие поврежденный участок ДНК (см. разделы 16.5.1.2 и 16.5.1.4).
Чемпионом по эффективности репарационных систем является радиоустойчивая бактерия Deinococcus radiodurans, которая сохраняет жизнеспособность при дозе ультрафиолетового излучения до 500 Дж • м-2 или гамма-излучения до 1,5 • 104 Гр, что почти на два порядка выше дозы, смертельной для большинства бактерий, в частности Е. coli. В последнее время установлено, что в плане радиоустойчивости D. radiodurans не уникален; подобным свойством обладают, например, актинобактерия Rubrobacter radiotolemns и археот Thermococcus gammatolerans.
Вышеуказанные дозы радиации вызывают множественные (до нескольких сотен), трудно репарируемые двухцепочечные разрывы ДНК. Однако D. radiodurans справляется с этой проблемой благодаря мультикопийности (n = 10) обеих хромосом, а также с помощью комплекса высокоэффективных репарационных систем.
Мощные источники излучения не встречаются в природных нишах, и можно предположить, что высокая радиоустойчивость является побочным проявлением повышенной способности противостоять другим стрессорам, которые, как и радиация, повреждают ДНК. В частности, D. radiodurans способен на протяжении 2 лет переносить водный стресс (при относительной влажности 5%), а также холодовой шок.
19.1.6. Окислительный стресс
Молекулярный кислород является одним из важнейших абиотических факторов. Его роль неоднозначна и может быть, как позитивной, так и негативной; во втором случае это существование не благодаря кислороду, а вопреки нему.
Напомним о важнейших функциях кислорода в живых системах.
Акцептор электронов для дыхательной цепи. Аэробно дышащие, а также факультативно анаэробные бактерии и археи используют кислород в качестве терминального акцептора электронов для дыхательной цепи. Глобальный ресурс кислорода практически неограничен; кроме того, его убыль постоянно восполняют оксигенные фототрофы.
Цитохромоксидаза (кислородредуктаза), расположенная в конце дыхательной цепи, осуществляет четырехэлектронное восстановление молекулы кислорода: O2 + 4Н+/4е- —> 2Н2O. Попутно она создает Рmf, выполняя, наряду с цитохром b/с-комплексом, роль мембранного биотрансформатора (см. II том учебника).
Облигатно дышащие аэробы не могут заменить кислород другим терминальным акцептором, и, когда он присутствует в субоптимальном количестве, скорость аэробного дыхания снижается, а при недостатке кислорода наступает энергетический стресс.
Косубстрат оксигеназных реакций. Если при оксидазной реакции кислород акцептирует электроны, полученные от субстрата, то при оксигеназной реакции атом или молекула кислорода присоединяются к субстрату. Катализаторами оксигеназных реакций служат, соответственно, моно- и диоксигеназа.
В физиологическом плане действие оксигеназ бывает либо продуктивным, либо контрпродуктивным.
Примером продуктивной оксигеназы служит метанмонооксигеназа, которая катализирует ключевую реакцию углеродной хемолнтотрофии у метанотрофных бактерий (см. II том учебника):
СН4 + O2 + DН2 —> СН3ОН + D + Н2O,
где DН2 —донор электронов, чаще всего НАДН.
В свою очередь, катализатором контрпродуктивной оксигеназной реакции служит рибулоз- обисфосфаткарбоксилаза-оксигеназа (RuBisСО); ее действие лежит в основе фото- и хемодыхания (см. II том учебника):
рибулозо-1,5-бисфосфат + O2 —> 3-фосфоглицерат + 2-фосфогликолат.
Регулятор транскрипции. Приведем два примера регуляторной роли молекулярного кислорода. У факультативно анаэробных бактерий кислород участвует в адаптивном переходе от анаэробного дыхания к аэробному, влияя на транскрипцию с помощью однокомпонентного глобального регулятора FNR (см. раздел 18.3.1.2). В свою очередь, у аноксигенных фототрофных бактерий кислород блокирует биогенез фотосинтетического аппарата (см. раздел 18.3.1.1).
Хемоэффектор. Кислород является наиболее сильным хемоэффектором, регулирующим подвижность и миграционное поведение прокариотов. Роль сенсора при аэротаксисе выполняет дыхательная цепь (см. раздел 18.4.1.3).
Фактор окислительного стресса. Большинство экосистем существует там, где парциальное давление кислорода составляет ~20 кПа. При такой концентрации он вызывает негативные явления, от которых зависят физиологические процессы прокариотов и, в конечном счете, их жизнеспособность. Среди этих явлений особо выделяется окислительный стресс, причиной которого служит образование и накопление активных форм кислорода.
19.1.6.1. Механизм окислительного стресса
Окислительный стресс (англ. oxidative stress) — это комплекс сублетальных изменений, вызванных преобладанием прооксидантов (окислительных реагентов) над антиоксидантами (восстановительными реагентами). При нем повышается концентрация свободных радикалов, запускающих цепь неконтролируемых реакций, в результате которых повреждаются ключевые биомолекулы — нуклеиновые кислоты, ферменты и мембранные липиды. Поскольку в основе окислительного стресса лежат превращения свободных радикалов, его также называют свободнорадикальным стрессом (англ. free radical stress).
Первичными агентами окислительного стресса служат активные формы кислорода. Они либо представляют собой свободные радикалы, либо участвуют в образовании свободнорадикальных органических молекул.
Активные формы кислорода. Что такое «активные формы» кислорода (англ. reactive oxygen species, ROS), и какое отношение к их образованию имеют живые организмы?
Молекулярный кислород, будучи в термодинамическом отношении сильным окислителем, слабо реагирует с другими веществами при физиологической температуре, а также в отсутствии катализаторов, в том числе, ферментов. Иными словами, и присоединение кислорода к субстрату, и восстановление кислорода электронами, полученными от субстрата, маловероятны.
Дело в том, что спонтанное присоединение молекулярного кислорода к субстрату находится под спиновым запретом.
Из общей химии известно, что атом кислорода имеет электронную конфигурацию ls22s22p4, а молекула кислорода — электронную конфигурацию σ2SσS2σ2Pп4п*2. Поскольку разрыхляющие п- орбитали (обозначаются как п*; не принимают участие в образовании ковалентной связи) занимают два электрона с одинаково ориентированными спинами, невозбужденная молекула кислорода триплетна (3О2). Напомним, что каждую ковалентную связь в синглетном субстрате (* субстрат) образуют электроны с взаимно противоположными спинами. Триплетный кислород не может присоединиться к синглетному субстрату, поскольку для образования новых химических связей требуются две пары электронов с взаимно противоположными спинами.
Существуют два способа преодолеть спиновый запрет. С одной стороны, можно активировать кислород, обратив спин одного из электронов на разрыхляющих п-орбиталях (3О2 —>1О2*). С другой стороны, можно активировать субстрат, обратив спин одного из спаренных электронов, образующих ковалентную связь (4субстрат —> 3 субстрат*)- В обоих случаях придется затратить энергию, причем при активации субстрата ковалентная связь разрывается, и он распадается на свободные радикалы.
Сделаться спонтанным акцептором электронов молекулярному кислороду, в свою очередь, мешают другие запреты.
В частности, восстановление кислорода до молекулы воды четырьмя электронами (О2 + 4е-/4Н+ —> 2Н2О) маловероятно, несмотря на высокий стандартный редокс-потенциал пары О2/2Н2О (4-1200 мВ).
В свою очередь, восстановление кислорода до пероксида двумя электронами (О2 + 2е- + 2Н+ —> Н2О2) требует высокой энергии активации, а поэтому при физиологической температуре и в отсутствии катализаторов оно не происходит.
Наконец, для восстановления кислорода до супероксидного анион-радикала одним электроном (О2 + е- —> О2-) нужен сильный донор, поскольку редокс-потенциал пары O2/O2-составляет -190 мВ, а такому условию отвечают лишь немногие молекулярные компоненты живой клетки. В частности, неактивированный кислород не может окислять нуклеиновые кислоты, белки, липиды и углеводы.
Поэтому практически все неферментативные реакции с участием молекулярного кислорода связаны с его активацией и переходом в возбужденное синглетное состояние (1О2*) или другие ROS.
Важнейшими представителями ROS являются:
— синглетный молекулярный кислород 1О2*);
— супероксидный анион-радикал (О-•) или его протонированная форма, свободный гидропероксидный радикал (НО2-);
— пероксидный анион (О2-2) или его протонированная форма, пероксид водорода (Н2О2);
— свободный гидроксильный радикал (ОН-).
При окислительном стрессе важнейшими молекулярными мишенями становятся нуклеиновые кислоты, белки и липиды. В частности, ROS модифицирует азотистые
основания и сахарофосфатный скелет ДНК, в результате чего происходят точечные мутации, и в полинуклеотидной цепи появляются разрывы. При окислительном повреждении белков в полипептидной цепи образуются патологические сшивки типа. Cys-Cys и Туг-Туг, и она разрывается с образованием карбонильных производных со структурой R1-CO-NH-R2. В свою очередь, с помощью ROS липиды окисляются в несколько стадий с промежуточным образованием свободных радикалов. Наконец, супероксидный анион-радикал окисляет [FenSn]-кластеры, которые служат кофакторами ферментов или переносчиками электронов в реакциях энергетического и конструктивного метаболизма.
Таким образом, окислительный стресс вызывает множественное повреждение биомолекул. Ниже мы убедимся в том, что негативный эффект усиливается в присутствии свободного железа, когда благодаря взаимным превращениям ROS образуется синглетный кислород, а также свободный гидроксильный радикал.
Источники образования активных форм кислорода. Первым источником образования ROS служат мембранные редокс-системы. В частности, светозависимые электрон-транспортные цепи восстанавливают не только свои физиологические акцепторы (ферредоксины или хиноны), но и молекулярный кислород, который превращается в супероксидный анион-радикал. Супероксид может также образовываться в донорном участке дыхательной цепи путем автоокисления флавиновых дегидрогеназ.
Вторым источником образования ROS становятся растворимые субстраты, например, полифенолы. Эндогенные полифенолы являются продуктами побочных реакций генерального метаболизма. Они автоокисляются молекулярным кислородом, который превращается в супероксидный анион-радикал.
Третий источник образования ROS -это электромагнитное излучение. Жесткое электромагнитное излучение (y-кванты,![]() = 3 • 10-4 - 3 • 10-2 нм, и рентгеновы лучи,
= 3 • 10-4 - 3 • 10-2 нм, и рентгеновы лучи, ![]() = 3 • 10-2 -10 нм) вызывает фотолиз воды с образованием свободного гидроксильного радикала:
= 3 • 10-2 -10 нм) вызывает фотолиз воды с образованием свободного гидроксильного радикала:
2Н2О + n х hv —> Н2 + 2OН•.
При воздействии на пероксид водорода более мягкого электромагнитного излучения (УФ,![]() = 10-400 нм) также образуется свободный гидроксильный радикал:
= 10-400 нм) также образуется свободный гидроксильный радикал:
Н2О2 + n х lrv —> 2ОН•.
Особая роль при образовании ROS принадлежит еще более мягкому электромагнитному излучению — видимому свету (![]() = 400-700 нм).
= 400-700 нм).
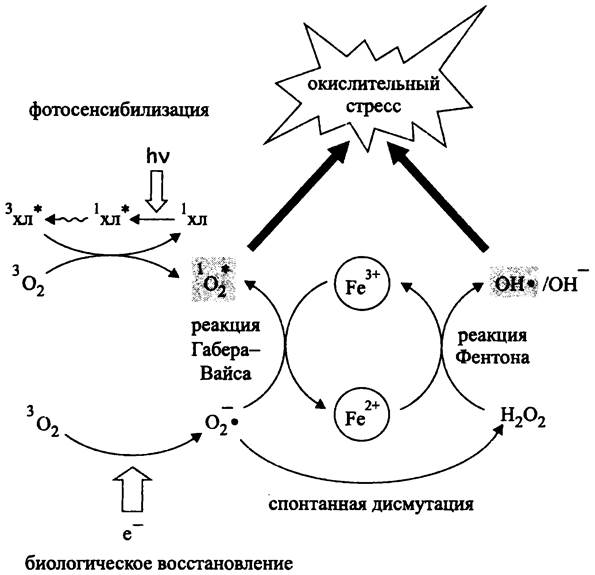
В результате поглощения его квантов эндогенными или экзогенными пигментами биологические структуры вовлекаются в реакции с участием синглетного кислорода (рис. 275), что приводит к фотоповреждению (англ. photodamage).
Рис. 275. Механизм окислительного стресса. Объяснение в тексте.
Фотоповреждение фотосинтетического аппарата связано с цепными реакциями образования перекисей, поскольку ROS атакуют остатки полиненасыщенных жирных кислот в мембранных липидах. После инициации эти реакции приобретают автокаталитический характер, что вызвало бы летальное повреждение, если бы на пути деструктивного процесса не было эндогенных антиоксидантов, в частности каротиноидов.
Поглотив квант видимого или ближнего инфракрасного света, антенный (бактерио)хлорофилл переходит в возбужденное синглетное состояние:
1(бактерио)хлорофилл + hv —> 1(бактерио) хлорофилл *.
Если избыточная свободная энергия (бактерио)хлорофилла не успевает преобразоваться в химический потенциал терминального акцептора электронов в реакционном центре, что происходит при накоплении возбужденных синглетных состояний пигмента, электрон переселяется на более низкий энергетический подуровень. При этом ориентация спина изменяется (см. II том учебника). В результате пигмент переходит из возбужденного синглетного состояния в возбужденное триплетное состояние (рис. 275):
1(бактерио)хлорофилл * —> 3(бактерио)хлорофилл *.
Возбужденное триплетное состояние «живет» в миллиард раз дольше возбужденного синглетного состояния, соответственно ~ 10-3 и ~ 10-12 с, что позволяет пигменту перейти от резонансных межмолекулярных взаимодействий к диффузионным. Иными словами, в триплетном состоянии пигмент успевает прореагировать с растворимыми субстратами, например, невозбужденным триплетным кислородом. В роли фотосенсибилизатора часто выступает (бактерио)хлорофилл:
3(бактерио)хлорофилл* + 3О2 —> 1 (бактерио)хлорофилл + 1O2*.
Универсальной биологической защитой от повреждающего воздействия синглетного кислорода служат окрашенные каротиноиды (см. II том учебника). При оксигенной фототрофии их присутствие абсолютно необходимо: помимо того, что цианобактерии и пластиды являются аэробами, они сами образуют молекулярный кислород. Неудивительно, что у них, в отличие от аноксигенных фототрофных бактерий, мутации по генам биосинтеза окрашенных каротиноидов летальны.
Защита с помощью каротиноидов, прежде всего, связана с тем, что они расположены очень близко (<1 нм) от фотосенсибилизатора-(бактерио) хлорофилла, что позволяет им дезактивировать его возбужденное синглетное состояние:
1(бактерио)хлорофилл* + 1каротиноид —> 1(бактерио)хлорофилл + 1каротиноид*.
В свою очередь, возбужденное синглетное состояние каротиноида спонтанно дезактивируется путем теплового рассеивания избыточной энергии, и он возвращается в основное синглетное состояние:
1каротиноид* —> 1каротиноид + Q, где Q — теплота.
Помимо этого, каротиноиды могут дезактивировать возбужденное триплетное состояние (бактерио) хлорофилла, а также возбужденное синглетное состояние кислорода. В обоих случаях они переходят в возбужденное триплетное состояние, а затем возвращаются в основное синглетное состояние:
3 (бактерио) хлорофилл* + каротиноид —> 1(бактерио)хлорофилл + 3каротиноид*.
3 каротиноид* —> 1каротиноид + Q,
а также
1O2* + 1каротиноид —> 3О2 + 3каротиноид*,
3каротиноид* —> 1каротиноид + Q.
Итак, источником ROS служит нормальный метаболизм, когда поступившая в клетку энергия по той или иной причине не может быть полностью утилизирована, или когда магистральные процессы с участием кислорода сопровождаются побочными реакциями. Другим источником ROS могут быть внешние воздействия — жесткие излучения (см. выше) или агрессивные химические реагенты, например, пероксинитрит.
Пероксинитрит образуется при спонтанной реакции супероксидного анион-радикала с оксидом азота N0, одним из промежуточных продуктов денитрификации (см. II том учебника):
O2-• + NO —> ONOO-.
При физиологических условиях пероксинитрит ведет себя как очень сильный и стабильный окислитель. Он вызывает перекисное окисление липидов, а продуктом его спонтанного разложения становится синглетный кислород.
Таким образом, последствия накопления NO станут летальными, если его своевременно не удалять. Для этого, в частности, используется ферментативное восстановление NO до N2O с помощью NO-редуктазы, что успешно делают денитрифицирующие бактерии.
Синглетный кислород. Это очень сильный и нестабильный окислитель (в водном растворе время его «жизни» ~2 • 10-6 с). Он способен взаимодействовать с разнообразными химическими соединениями, передавая им свою избыточную энергию и/или реагируя с ними. Синглетный кислород- это нуклеофил (т. е. он имеет избирательное сродство к тем участкам молекул, которые обладают повышенной электронной плотностью). Он активно вступает в оксигеназные реакции, повреждающие клетку за счет образования перекисных и гидроперекисных соединений с кратными и, что еще важнее, конъюгированными двойными связями (что характерно для азотистых оснований, аминокислот с боковыми алициклическими радикалами, ненасыщенных жирных кислот и т. д.). Синглетный кислород очень опасен, поскольку не существует ферментов, которые смогли бы его обезвредить.
Супероксидный анион-радикал. Как мы уже отмечали, характерная черта окислительного стресса состоит в том, что ROS возникают не только под прямым воздействием абиотических факторов окружающей среды, например, электромагнитного излучения, но могут быть побочными продуктами генеральных метаболических путей. Прежде всего, это касается супероксидного анион-радикала, который образуется электрон-транспортной цепью при фототрофии и аэробном дыхании.
В частности, при оксигенной фототрофии молекулярный кислород восстанавливается в акцепторном участке ФСI до О2-. Донором электрона служат промежуточный переносчик реакционного центра (FB) и восстановленный ферредоксин (Fdred). Этот спонтанный процесс называется реакцией Мелера.
На уровне дыхательной цепи кислород восстанавливается до супероксидного анион-радикала с помощью автоксидабельных коэнзимов, входящих в состав дегидрогеназ.
Примером бактерий, в большом количестве образующих супероксидный анион-радикал в качестве побочного продукта метаболизма, служат паразитические микоплазмы. Геном микоплазм (600-800 т. п. н.) — один из минимальных прокариотных геномов, и набор генов домашнего хозяйства у них резко ограничен. В частности, поэтому они лишены цикла Кребса и электрон-транспортной цепи.
Биоэнергетика микоплазм основана на гликолизе и субстратзависимом фосфорилировании АДФ, тогда как Рmfсоздается вторично с помощью протонтранслоцирующей АТФазы, которая гидролизует АТФ. У представителей рода Ureaplasma отсутствует и гликолитический путь. Они ассимилируют энергию уникальным способом — за счет гидролиза мочевины (цитоплазма защелачивается в результате протонирования аммиака, что создает Pmf). Микоплазмы рег енерируют НАД с помощью мембранной или растворимой НАДН-оксидазы, которая использует в качестве кофактора ФАД. Электроны передаются кислороду, в результате чего образуется супероксидный анион-радикал.
Микоплазмы лишены клеточной стенки. Их мембранные адгезины (см. I том учебника) взаимодействуют с поверхностными рецепторами эукариотной клетки, в результате чего бактериальная и эукариотная мембраны вступают в тесный контакт. ROS, накопившиеся в ходе жизнедеятельности микоплазм, прежде всего гидроксильный радикал, вызывают окислительное повреждение плазматической мембраны клетки хозяина и дезорганизуют взаимодействующий с ней цитоскелет. В этом заключается основная причина патогенности микоплазм.
Помимо электрон-транспортных цепей, источником супероксидного анион-радикала служит спонтанное окисление флавинов, катехолов и других растворимых органических субстратов.
Супероксидный анион-радикал относительно безвреден, поскольку в нейтральной среде он не проявляет окислительных свойств и даже может восстанавливать Fe3+и катионы других металлов переходной валентности. Тем не менее, косвенно он очень опасен, поскольку его непротонированная форма (О2) и протонированная форма (гидропероксидный свободный радикал НO2) спонтанно дисмутируют с образованием пероксида водорода Н2О2 и синглетного кислорода 1O2*:
2O2-• + 2Н+ —> Н2O2 + 1О2*,
2НO2• —> Н2O2 + 1O*2.
Кроме того, супероксидный анион-радикал совместно с пероксидом водорода участвует в реакции Габера-Вайса (см. ниже), продуктами которой являются синглетный кислород и опаснейшая форма ROS — свободный гидроксильный радикал.
Биологический механизм, который препятствует накоплению синглетного кислорода и других ROS, основан на действии трех ферментов: супероксиддисмутазы, каталазы и пероксидазы (см. ниже). Центральное место среди них принадлежит супероксиддисмутазе. В отличие от спонтанной дисмутации супероксида, продуктом аналогичной ферментативной реакции становится триплетный кислород:
2O-2 + 2H+ —> Н2O2 + 3O2.
Пероксид водорода. Это побочный продукт аэробного метаболизма на уровне мембранных или растворимых окислительно-восстановительных систем. При pH, близком к нейтральному, пероксид водорода находится в недиссоциированной форме и беспрепятственно проходит через мембраны.
У бактерий двухэлектронное восстановление кислорода происходит довольно редко. У них пероксид водорода образуется, главным образом, при дисмутации супероксида — продукта одноэлектронного восстановления кислорода.
Подобно супероксидному анион-радикалу, пероксид водорода относительно безвреден, хотя он обладает сильнее выраженными окислительными свойствами и атакует катионы металлов переходной валентности, а также ряд биомолекул. Но пероксид водорода потенциально опасен, поскольку вместе с супероксидным анион- радикалом участвует в реакции Габера - Вайса (см. ниже).
Пероксид водорода восстанавливается до воды с помощью пероксидазы или каталазы (см. ниже).
Гидроксильный радикал. Он очень нестабилен (время жизни <10-9 с) и обладает исключительно высокой окислительной способностью (редокс-потенциал пары ОН/ОН- равен +2,7 В), что позволяет атаковать любые биомолекулы. В живых системах гидроксильный радикал вызывает множественные неспецифические повреждения, поскольку он отрывает водород от углеродного скелета молекулы- мишени (реакция дегидрирования); присоединяется по двойным связям или к ароматическим кольцам (реакция эпоксидирования); переносит электрон к акцептору (миграция свободного радикала).
В итоге образуются вторичные свободные радикалы, вызывающие деструкцию ключевых биомолекул.
В живой природе нет прямой защиты от гидроксильного радикала. Поэтому, наряду с синглетным кислородом, это один из наиболее токсичных химических реагентов. «Утешает» лишь то, что гидроксильный радикал наносит повреждения там, где образуется (он практически мгновенно вступает в реакцию, успевая диффундировать на расстояние не более 5-10 своих молекулярных радиусов).
Роль железа в образовании активных форм кислорода. В кислой среде закисное железо (Fe2+) устойчиво. Напротив, при повышении pH оно окисляется многими химическими реагентами, особенно в аэробных условиях.
Поскольку pH цитоплазмы близок к нейтральному, неконтролируемое окисление свободного или хелатированного двухвалентного железа может навредить клетке и даже привести ее к гибели.
Как уже отмечалось, самый опасный представитель ROS — это свободный гидроксильный радикал. Он образуется в реакции Фентона (J. Fenton) (рис. 275). Окислителем двухвалентного железа служит пероксид водорода:
Fe2+ + Н2O2 —> Fe3+ + ОН• + ОН-.
Образовавшийся катион окисного железа (Fe3+) вступает в реакцию с супероксидным анион-радикалом, который выполняет роль восстановителя:
Fe3+ + O2- —> Fe2+ + 1O2*.
Суммарное уравнение двух приведенных реакций называется реакцией Габера- Вайса (F. Haber, J. Weiss) (рис. 275):
Н2O2 + О-2• —> ОН• + ОН- + 1О*2.
Таким образом, продуктами реакции Габера-Вайса одновременно являются две формы ROS: свободный гидроксильный радикал и синглетный кислород.
Прочие факторы окислительного стресса. Очень активным стрессовым агентом служит озон (О3). В результате его восстановительного распада образуются свободные радикалы гидропероксида и гидроксила:
О3 + DH2 —> HО2• + ОH• + D.
Кроме того, озон может присоединяться к органическим молекулам с образованием озонидов, т. е. циклических пероксидов R1-[(СН-СН)>О3]-R2, которые быстро превращаются в альдегиды или во вторичные свободные радикалы R1-CH(O•) и R2- СН(ОО•).
Еще один важный агент окислительного стресса — это анион гипохлорита СIO-. Он синтезируется миелопероксидазой нейтрофилов из пероксида водорода и аниона СI-. Бактерицидность гипохлорита объясняется его способностью взаимодействовать с супероксидным анион-радикалом с образованием свободного гидроксильного радикала:
СIO- + Н+ + О2-• —> ОН• + СI- + 3O2.
Гипохлорит также взаимодействует с катионом Fe2+, в результате чего образуется свободный гидроксильный радикал:
СIO- + Н+ + Fe2+—> ОН• + С I- + Fe3+.
Таким образом, окислительный стресс представляет собой комплексный биологический и химический феномен, зависящий от ряда эндогенных процессов и абиотических факторов.
19.1.6.2. Защитный ответ при окислительном стрессе
Наилучший и самый простой способ защиты — превентивный: не допустить накопления ROS. Эту функцию выполняют конститутивные ферменты — супероксид- дисмутазы, пероксидазы и каталазы. Они устраняют наиболее распространенные агенты окислительного стресса, которые служат предшественниками остальных ROS и запускают разветвленные цепи свободнорадикальных превращений.
В качестве примера можно привести устранение диоксида азота; иначе это реакционноспособное соединение превращается в пероксинитрит. При распаде последнего образуется синглетный кислород (см. выше). Моноксид азота устраняется окислительным путем; например, NO-диоксигеназа Е. coli превращает его в анион нитрата (NO+O2 —>NO-3). В свою очередь, восстановительное устранение моноксида азота осуществляется с помощью флавогемоглобина — белка с глобинным модулем (содержащим гем В) и редуктазным модулем (имеющим сайты для связывания ФАДН2 или НАДФН). Этот защитный белок имеется, в частности, у В. subtilis.
Иногда превентивный способ защиты по той или иной причине оказывается неэффективным, и происходит накопление ROS. В этом случае в дело вступают регуляторные системы, запускающие адаптивные механизмы, с помощью которых удаляются ранее образованные и вновь возникающие ROS.
Защита на основе регуляторных систем. Для предотвращения последствий окислительного стресса бактерии используют ряд глобальных регуляторных систем.
Роль регулона RpoS. Регулон RpoS активируется при переходе в стационарную фазу и/или при голодании (см. раздел 18.1.2). Продуктом экспрессии гена rpoS служит сигма-фактор σS, который контролирует гены, ответственные за устойчивость бактерий к разным стрессовым воздействиям. В частности, crs позитивно контролирует экспрессию генов katE(кодирует пероксидазу НРII), katG (кодирует пероксидазу HPI) и gorА (кодирует глутатионредуктазу).
Реализация RpoS-зависимых программ при голодании или переходе в стационарную фазу сопровождается комплексными изменениями метаболизма. Этот тип адаптации требует значительных энергетических и конструктивных затрат на биосинтез нового ферментного аппарата. Поэтому растущие культуры защищаются от последствий окислительного стресса с помощью глобальных регуляторов OxyR, SoxR/SoxS, Fur и DtxR.
Роль белка OxyR. Ген oxyR входит в состав регулона oxyR и активируется при накоплении пероксида водорода. Его продукт, белок OxyR представляет собой тетрамер идентичных субъединиц и существует в альтернативных формах: активной окисленной и неактивной восстановленной. Они взаимопревращаются путем окисления/восстановления сульфгидрильных групп аминокислотных остатков Cys- 99 и Cys-208. В результате восстановления белка OxyR он инактивируется и блокирует промоторы. Процесс (дез)активации белка OxyR схематически изображен на рис. 276.
Рис. 276. (Дез)активация белка OxyR. Cys-SS-Cys - активная (окисленная) форма белка OxyR; Cys-SH — неактивная (восстановленная) форма белка OxyR; Gr-SH — восстановленный глутаредоксин А; GSH — восстановленный глутатион.
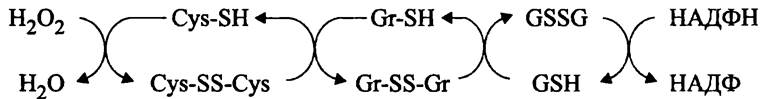
Однокомпонентная регуляторная система OxyR, в частности, влияет на экспрессию гена пероксидазы (katG), гена алкил: гидропероксид-оксидоредуктазы (ahpFC), гена глутаредоксина А (grxА) и гена антисмысловой РНК, участвующей в посттранскрипционной регуляции (oxyS).
Роль системы SoxR/SoxS. Хотя при окислительном стрессе бактерии избавляются от супероксида с помощью конститутивной супероксиддисмутазы, для защиты самых уязвимых мишеней, к числу которых относятся [FenSn]-кластеры, используется особый адаптационный механизм.
При накоплении супероксида и других ROS активируется регулон soxR/soxS. Он кодирует двухкомпонентную сигнальную систему, состоящую из белков SoxR/SoxS. Роль сенсора выполняет белок SoxR. В ответ на его накопление активируются до 50 генов, в частности ген супероксиддисмутазы. Продукты их экспрессии удаляют супероксид, а также репарируют вызванные им повреждения.
Гомодимерный белок SoxR (Мг субъединицы ~17 кДа) содержит два [Fe2S2]-кластера, которые существуют в двух формах — [Fe2S2]p2+ и [Fe2S2]+, соответственно, окисленной и восстановленной. Под воздействием супероксида восстановленная форма превращается в окисленную. В свою очередь, восстановленная форма регенерируется с помощью специфической редуктазы.
При окислении [Fе2S2]-кластеров белок SoxR активируется и связывается с промотором гена soxS. В свою очередь, если [Fe2S2]-кластеры восстановлены, белок SoxR перестает активировать транскрипцию гена soxS.
Существует альтернативный путь активации белка SoxR. В нем участвует моноксид азота, который вытесняет серу из [Fe2S2]-кластеров, и они превращаются в динитрозил-железо-цистеинильный комплекс. Заместить его интактными [Fе2S2]-кластерами позволяет цистеиндесульфураза IscS.
Вновь синтезированный белок SoxS играет роль регулятора и активирует транскрипцию >60 генов, в частности: гена Мn-супероксидцисмутазы (sodА)] гена глюкозо-6-фосфат-дегидрогеназы (zwf); гена антисмысловой РНК, регулирующей систему защиты от осмотического стресса (micF); гена эндонуклеазы IV (nfо); гена ферредоксинредуктазы (fpr): генов системы экскреции токсикантов (асrАВ) и др. Продукты этих генов регенерируют [Fe2S2]-кластеры белка SoxR, а также взаимодействуют с системами защиты при других стрессах.
Роль белков Fur и DtxR. Для борьбы с последствиями окислительного стресса необходимо контролировать внутриклеточную концентрацию свободного железа. С одной стороны, при его избытке запускается реакция Фентона (см. выше), продуктом которой является свободный гидроксильный радикал. С другой стороны, железо входит в состав активных центров каталазы и супероксидцисмутазы, и поэтому при голодании по нему клетки проявляют повышенную чувствительность к ROS.
Мы уже говорили о том, что железный гомеостаз обеспечивается системами Fur и DtxR (см. раздел 18.3.2.5). Благодаря взаимосвязи этих однокомпонентных сигнальных систем с механизмами защиты при окислительном стрессе концентрация ROS и свободных органических радикалов поддерживается на низком уровне.
В частности, у Е. coli при окислительном стрессе усиливается транскрипция гена fur. В сбою очередь, белок Fur влияет на характер экспрессии генов sodA и sodB, кодирующих Мп- и Бесу пероксидцисмутазы. На фоне избытка железа белок Fur действует как негативный регулятор гена sodA, однако позитивно регулирует ген sodB. В итоге, в зависимости от концентрации железа, используются разные супероксидцисмутазы.
Все сказанное также относится к DtxR-зависимой системе железного гомеостаза. Например, у Mycobacterium sm. egm. atis содержание железа контролирует белок IdeR, влияющий на транскрипцию генов katG и sodA, которые кодируют, соответственно, каталазу и Мn-супероксиддисмутазу.
Роль аконитазы. Свойства этого фермента уже рассматривались ранее, и поэтому мы отсылаем читателя к разделу 18.2.1.
Защита с помощью неспецифических молекулярных ловушек. Эффективной защитой от ROS служат молекулярные ловушки, например, аскорбиновая кислота и глутатион, а также металлы переходной валентности, в частности, марганец.
Аскорбиновая кислота, или витамин С (рис. 277) служит донором электронов для ферментов, обезвреживающих ROS, прежде всего для аскорбатпероксидазы. Кроме того, она может спонтанно восстанавливать гидроксильный радикал. В обоих случаях аскорбат регенерируется из дегидроаскорбата при помощи НАДФН-зависимой аскорбатдегидрогеназы (редуктазы).
Рис. 277. Аскорбиновая (А) и дегидроаскорбиновая (Б) кислота.
Восстановленный глутатион (GSH; см. II том учебника) связывает свободный гидроксильный радикал, а также косвенно препятствует его вредному воздействию, выступая в качестве донора электронов при восстановлении окисленных биомолекул. Для регенерации восстановленного глутатиона из его окисленной формы (GSSG), используется НАДФН-зависимая глутатионредуктаза.
Особой молекулярной ловушкой является «неорганический» марганец в степенях окисления II и IV. Например, хламидобактерия Leptothrix sp. образует небольшое количество пероксида водорода, который восстанавливается пероксидазой на поверхности ОМ. Донором электронов служит катион Мn2+.
Мn2+ + 2Н2O —> МnO2 + 2е- + 4Н+,
Н2O2 + 2е- + 2Н+ 2Н2O.
Нерастворимый диоксид МnO2 (степень окисления IV) откладывается в чехле.
При избытке органических субстратов образуется больше пероксида водорода, и он окисляется ранее накопленным диоксидом марганца:
Н2O2 + МnO2 + 2H+ —> O2 + 2Н2O + Мn2+.
Заметим, что процесс носит циклический характер.
Бактерии, не образующие супероксиддисмутазу, например, Lactobacillus plantarum, нейтрализуют O2- (с помощью катиона Мn2+:
О-2 • + Мn2+ + 2Н+ —> Н2O2 +Мn3+.
Мn3+ неферментативным путем вновь превращается в Мn2+. При этом восстановителем служит либо О2-•, либо пероксид водорода:
Мn3+ + O2-• —> Мn2+ + O2,
2Мn3+ + Н2O2 —> 2Мn2+ + O2 + 2Н+.
Защита с помощью репарационных систем и биосинтеза de novo. Очень эффективный механизм защиты — это репарация поврежденных [FenSn]-кластеров. В ней участвуют ферменты, которые либо восстанавливают [FenSn]-кластеры, либо синтезируют их de novo.
В частности, ферредоксин: НАДФ-оксидоредуктаза переводит [FenSn]-кластеры из неактивного окисного состояния в активное закисное состояние.
В свою очередь, окислительный стресс может необратимо разрушить [FenSn]- кластеры, например, входящие в состав аконитазы (см. раздел 18.1.2). Тогда они синтезируются de novo. В клетках Е. coli эту роль выполняют ферменты, закодированные в опероне isc. Его экспрессия контролируется по принципу обратной связи, причем в качестве репрессора выступает белок IscR (сокр. англ. iron stress cluster repressor), содержащий [Fe2S2]-кластер. В присутствии пероксида водорода экспрессия оперона isc усиливается, что непосредственно связано с инактивацией белка IscR.
Ферментативная защита. Существуют четыре фермента, обезвреживающие ROS: супероксидспецифичная супероксиддисмутаза, а также пероксидспецифичные каталаза, пероксидаза и гидропероксидаза.
Супероксиддисмутаза имеется у всех аэробов и у большинства аэротолерантных анаэробов; у облигатных анаэробов она отсутствует. Три других фермента распространены не универсально; они используются как по прямому назначению, так и в биосинтетических целях.
Роль супероксиддисмутаз. Супероксидный анион-радикал устраняется с помощью супероксиддисмутазы (англ. superoxide dismutase, SOD), которая диспропорционирует молекулы супероксида:
2О-2 + 2H+ —> Н2О2 + 3О2.
Этот фермент есть у всех аэробов, встречается у многих аэротолерантных анаэробов, но отсутствует у облигатных анаэробов.
При классификации SOD учитывается тип металла, входящего в состав активного центра (Cu/Zn-SOD, Mn-SOD, Fe-SOD и Ni-SOD).
Представители разных филогенетических доменов образуют SOD разного типа. Эукариоты содержат цитоплазматическую Cu/Zn-SOD.
Cu/Zn-SOD универсальна для эукариотов. У прокариотов она встречается крайне редко; примерами служат Caulobacter crescentus и Paracoccus denitrificans, а также некоторые штаммы Pseudomonas spp. По-видимому, ферменты данного класса возникли до дивергенции бактерий с эукариотами и археями. В ходе эволюции они сохранились, главным образом, у эукариотов, в то время как у бактерий и архей их заменили Mn-SOD и Fe-SOD.
Все известные Cu/Zn-SOD взаимно гомологичны, однако гомология между представителями этого и других классов SOD практически отсутствует, что указывает на их независимое происхождение.
Cu/Zn-SOD представляет собой гомодимер. Каждая субъединица (Мг ~ 32 кДа) содержит по одному атому меди и цинка. В активный центр входит только медь, тогда как цинк необходим для стабилизации структуры фермента и может быть заменен другим металлом. Cu/Zn-SOD очень стабильна и активна даже в присутствии таких мощных денатурирующих агентов, как 8М мочевина или 4%-ный додецилсульфат.
Для бактерий и архей, а также для пластид и митохондрий типичны Fе-SOD или Мn-SOD; у некоторых цианобактерий, наряду с Мn-SOD, имеется уникальная Ni-SOD.
Fе-SOD и Мпn-SOD - это гомодимеры, реже гомотетрамеры (Мг субъединицы ~20 кДа). В активном центре содержатся атомы марганца или железа, которые функционально взаимозаменяемы. Например, Bacteroгdes fragilis в анаэробных условиях образует Fе-SOD, а при окислительном стрессе тот же самый апопротеин используется для образования Mn-SOD.
Гены Мn-SOD(sodA) и Fе-SOD (sodВ) взаимно гомологичны, а продукты их экспрессии взаимозаменяемы — реконструированы функционально полноценные гетеродимеры, одна из субъединиц которых принадлежит Fe-SOD, а другая Мn-SOD.
Дисмутация супероксидного анион-радикала осуществляется в два приема. Вначале он по субстратному каналу проникает в активный центр фермента (Е), вступает в комплекс с катионом металла (Мn+) и восстанавливается одним электроном:
Е-Мn+ + O2- —> Е-М(n-1)+ +O2.
На следующей стадии активный центр окисляется вторым супероксидным анион-радикалом: Е - М(n-1)+ + О2- —> + 2Н+ —> Е - Мn+ + Н2O2.
Роль пероксидаз, каталаз и гидропероксидаз. Пероксид водорода устраняется тремя функционально родственными ферментами: пероксидазой, каталазой и гидропероксидазой.
Пероксидаза— это донор: Н2O2-оксидоредуктаза, устраняющая пероксид водорода:
DH2 + Н2O2 —> D + 2Н2O.
В качестве донора электронов пероксидазы могут использовать разнообразные субстраты, в частности глутатион и аскорбат. Большинство пероксидаз представляет собой мономеры или гомодимеры (Мг субъединиц 40-42 кДа); простетической группой служит протопорфирин IX (см. II том учебника).
Мультивариантные и широко распространенные пероксидазы не просто устраняют пероксид водорода, а с его помощью окисляют многие субстраты. Пероксидазы чаще всего встречаются у грибов и растений, где они выполняют разные функции. Например, у базидиомицетов они входят в состав лигнолитического комплекса, разрушающего древесину. Из пероксидаз животного происхождения наиболее изучены лактопероксидаза молока, миелопероксидаза лейкоцитов (действует на поздних стадиях фагоцитоза), а также тиреопероксидаза (участвует в биосинтезе гормона тироксина).
Каталаза — это Н2O2: Н2О2-оксидоредуктаза, устраняющая пероксид водорода посредством реакции:
Н2O2 + Н2O2 —> 2Н2O + 3O2.
Она представляет собой тетраэдр из субъединиц (Мг ~ 60 кДа), связанных гидрофобными связями; каждая содержит простетическую группу — протопорфирин IX.
Помимо обычных каталаз, кофактором которых служит геминовое железо, существуют Мn- зависимые, или негеминовые каталазы (англ, nonheme catalase). Негеминовая каталаза впервые описана у Lactobacillus plantarum; ее гомологи выявлены у филогенетически взаимно удаленных прокариотов, например, у бактерии Thermus thermophilus и археота Pyrobuculum caldifontis. Геминовая и негеминовая каталазы могут образовываться у одного и того же микроорганизма, в частности, у Salmonella enterica серовар Typhimurium.
Гидропероксидаза обладает двумя активностями, пероксидазной и каталазной. Гидропероксидазы I и II (англ. hydroperoxidase, Нр), изученные на примере Е. coli — это гомодимеры или гомотетрамеры. Их субъединицы имеют Мr ~85 кДа; простетической группой служит гем b или d (см. II том учебника).
19.1.7. pH-стресс
Повышенная кислотность или щелочность среды являются широко распространенными природными или антропогенными стрессорами.
В частности, гидротермальные источники, дренажные воды угольных и медных шахт, стоки промышленных предприятий и пищеварительный сок имеют рН~1, а закисленные почвы и фруктовые соки рН~3. В свою очередь, защелоченные почвы имеют рН~9, щелочные озера рН~10, а промышленные и прачечные сточные воды или увлажненная поверхность бетонных сооружений рН~11.
Большинство природных ниш имеет pH 5-9, и в этом интервале находятся оптимумы роста большинства бактерий и архей, способных временно переносить рН- стресс. Ацидо- и алкалитолерантные формы адаптированы к средам, соответственно, с низким и высоким pH, а для ацидофилов (оптимум рН~3) или алкалифилов (оптимум рН~9) такие условия являются оптимальными. Наконец, экстремальные ацидофилы оптимально развиваются при рН≤1, а экстремальные алкалифилы при рН≥ 12. Поскольку внутриклеточный pH ацидо- или алкалифилов близок к нейтральному, АрН у них велика по абсолютному значению.
Механизмы pH-адаптации довольно разнообразны. В кислой среде нейтрофилы, имеющие оптимум рН~7, либо откачивают протоны с помощью F0F1-АТФаз (см. II том учебника), либо используют декарбоксилазы аминокислот, что вызывает защелачивание цитоплазмы. Возможно также защелачивание наружной среды; характерным примером служит гидролиз мочевины, осуществляемый Helicobacter pylori с помощью уреазы. В щелочной среде нейтрофилы используют аналогичную стратегию — либо с помощью Nа+/Н+-антипортера откачивают избыточные катионы Na+, либо подкисляют наружную среду; например, триптофаназа TnaA Е. coli расщепляет триптофан с образованием органических кислот.
Ацидофилы для того, чтобы в условиях кислотного стресса сохранить pH цитоплазмы на нейтральном гомеостатическом уровне, постоянно экспортируют протоны против градиента химического потенциала, используя градиент электрического потенциала![]() ориентированный наружу из клетки. В свою очередь, алкалифи-
ориентированный наружу из клетки. В свою очередь, алкалифи-
лам нет необходимости удалять избыток протонов, но для фосфорилирования АДФ с помощью АТФ-синтазы они поддерживают высокий электрический потенциал на наружной поверхности СМ (см. II том учебника).
Механизм восприятия первичного стимула при pH-стрессе в большинстве случаев неясен, хотя установлены некоторые компоненты причастных к этому сигнальных систем. Например, в качестве сенсора щелочной среды Е. coli использует белок СрхА (см. раздел 19.2).
19.1.8. Токсический стресс
При токсическом стрессе в роли стрессоров выступают органические и неорганические вещества, которые (не)специфически поражают клеточные мишени. Адаптационный ответ связан с приобретением резистентности к стрессору и основан на четырех общих механизмах, которые реализуются совместно или независимо друг от друга: (1) детоксикация стрессора путем его ферментативной модификации или разрушения; (2) модификация мишени; (3) уменьшение проницаемости клеточной оболочки; (4) экскреция токсикантов с помощью MDR-транспортеров (см. ниже).
Причиной токсического стресса служат экзогенные вещества; реже он вызывается эндогенными метаболитами.
В качестве примера рассмотрим «глюкозо-фосфатный» стресс. Напомним, что глюкоза, субстрат гликолиза, импортируется фосфоэнолпируват-фосфотрансферазной системой (PTS; см. раздел 18.3.2.2) сопряженно с фосфорилированием. Стресс наступает, когда по той или иной причине нарушается гликолитический путь, что приводит к накоплению глюкозо-6-фосфата. Механизм бактериостатического или бактерицидного действия этого метаболита неизвестен. Сенсором повышенного уровня глюкозо-6-фосфата служит транскрипционный фактор SgrR (сокр. англ. sugar transport related). При связывании лиганда он активирует гены адаптационного ответа, в частности ген малой РНК SgrS. Последняя при участии РНК-шаперона Hfq (см. раздел 18.2.2) способствует деградации мРНК ptsG, кодирующей транспортер глюкозы. Благодаря негативной регуляции транспортера предотвращается дальнейшее накопление токсичного глюкозо-6-фосфата.
Стресс, вызванный липофильными соединениями. Токсичность (цикло) алканов, жирных спиртов, ароматических углеводородов, фенолов и терпеноидов объясняется их встраиванием в СМ. Накопление этих органических растворителей в мембранном матриксе не только влияет на взаимодействия типа липид-липид и липид-вода, но и изменяет конформацию гидрофобных доменов в мембранных белках. Вследствие этого нарушаются функции СМ, в частности ее избирательная проницаемость.
Чувствительность к липофильным соединениям зависит от их типа (например, этанол начинает действовать в концентрации ~1%, а толуол ~0,1%), а также от природы объекта (как правило, ниже у грамотрицательных бактерий). Среди высоко толерантных форм выделяются Lactobacillus heterohiochii, растущая в 20%-ном этаноле, и штаммы Pseudomonas jmtida,растущие в двухфазной системе, содержащей 90% ароматических углеводородов. Отметим, что во втором случае мы имеем дело с бактериями, перспективными в плане биоремедиации.
Ответ при данном токсическом стрессе осуществляется, в первую очередь, по принципу модификации мишени. Поскольку липофильные соединения воздействуют на мембранный матрикс аналогично повышенной температуре, то, как и при тепловом шоке, запускается механизм гомеовязкостной адаптации: путем изменения липидного состава (повышение доли длинноцепочечных жирных кислот; замена цис-ненасыщенных изомеров трансизомерами) мембрана возвращается к жидкостно-кристаллическому состоянию. Наряду с этим, «исправление» упаковки липидов и общая стабилизация структуры мембраны обеспечиваются, как при термических стрессах или водном и осмотическом стрессе, за счет накопления осмопротекторов, в частности трегалозы (см. раздел 19.1.2). Наконец, при токсическом стрессе, вызванном липофильными соединениями, в ответе принимают участие белки теплового шока (см. раздел 19.1.1).
Стресс, вызванный неорганическими ионами. Ионы незаменимых тяжелых металлов, в частности железа, меди и цинка, служат аллостерическими регуляторами ферментов, компонентами биоэнергетических систем и т. д. Однако если они присутствуют в количестве, превышающем нормальные физиологические потребности, это угрожает жизнеспособности и вызывает токсический стресс. В то же время некоторые неорганические ионы, например, катион ртути или анион арсената, обычно не только не участвуют в функционировании клеточных структур, но и токсичны в любой концентрации.
Уровень незаменимых неорганических ионов в цитоплазме поддерживается за счет транскрипционного контроля над системами, отвечающими за их транспорт и инкорпорирование, а токсичные не-незаменимые ионы подлежат удалению.
При стрессе, вызванном неорганическими ионами, индуцируются механизмы, которые позволяют клетке избавиться от этих стрессоров. В соответствующих адаптационных системах обязательно используется сенсор — транскрипционный фактор, характер взаимодействия которого с ДНК изменяется в результате связывания иона- лиганда.
Транскрипционные факторы устойчивости. Регуляторы транскрипции оперонов устойчивости к неорганическим ионам, выполняющие роль репрессоров или активаторов, относятся к двум отдаленно родственным семействам — MerR и SmtB / ArsR.
Регуляторные белки семейства MerR в отсутствии стрессора действуют как репрессоры, но после его связывания становятся активаторами. В качестве примеров можно назвать белки CoaR (Synechocystis sp.), CueR (E. coli), MerR (E. coli), PbrR (Ralstonia rnetallidurans) и ZntR (E. coli), лигандами для которых служат, соответственно, катионы Со2+, Cu2+, Hg2+, Pb2+ и Zn2+.
Белки семейства MerR содержат N-концевой ДНК-связывающий мотив НТН, характерный для многих транскрипционных регуляторов, в частности, для САР-белков (см. раздел 18.3.2.2) или для белка DtxR (см. раздел 18.3.2.5), а также С-концевой сайт для лигандирования токсичного иона. Активация или репрессия происходит при взаимодействии димера MerR-белка с операторным сайтом МегО, расположенным между блоками -35 и -10 промотора. В случае MerR-зависимых оперонов эти блоки разделены аномально длинным, >17 н., спейсером (см. раздел 16.7.1.1), что даже в отсутствии репрессора приводит к «вялой» транскрипции. Связывание Мег-белка с лигандом изменяет конформацию ДНК в центре оператора, что сближает блоки -35 и -10, которые начинают продуктивно взаимодействовать с РНК-полимеразой.
В отличие от белков семейства MerR, белки семейства SmtB/ArsR действуют исключительно как репрессоры. Примерами служат белки ArsR (E. coli), CadC (Staphylococcus aureus),NmtR (Mycobacterium tuberculosis) и SmtB (Synechococcus sp.), лигандами для которых становятся, соответственно, ионы AsO3-4, Cd2+, Ni2+ и Zn2+. Некоторые члены этого семейства являются сенсорами нескольких катионов, например, закодированный в плазмиде рI258 белок CadC реагирует на Bi3+, Cd2+, Pb2+ и Zn2+.
В отсутствии стрессора димеры белков семейства SmtB/AгsR связываются с промотор-операторным участком ДНК при помощи мотива НТН. При этом опероны резистентности репрессируются. Но когда токсичный ион внедряется в консервативный бокс С1и-Ьеи-Суз-Val-(Суs/Glу)-Аsр, репрессор теряет связь с ДНК, т. е. лиганд проявляет себя как негативный аллостерический регулятор. В частности, при лигандировании катионов Вi3+, Сd2+, Рb2+ или Zn2+ сродство белка СаdC к ДНК уменьшается в 170-340 раз.
Опероны устойчивости к катионам и оксианионам тяжелых металлов или металлоидов (Ag+, АsО3-4, Сd2+, Со2+, СrО2-4, Сu2+, Hg2+, Ni2+, Рb2+, Sb3+, Zn2+ и др.) содержатся в хромосомах, плазмидах или транспозонах. Они широко распространены у бактерий, однако не найдены у архей. Гены этих оперонов кодируют авторегуляторные факторы, а также «рабочие» компоненты защитных систем.
Адаптационная защита осуществляется с помощью двух основных механизмов: экскреции и детоксикации.
При экскреции используются два типа транспортных систем — мембранные Р- АТФазы, расходующие энергию АТФ, и «хемиосмотические» антипоргеры, расходующие Рmf (см. II том учебника).
При детоксикации токсичные неорганические ионы путем (не)ферментативного
восстановления превращаются в менее опасные соединения, которые активно или спонтанно выводятся из клетки.
Примером ферментативного восстановления служит превращение токсичного катиона Hg2+ в малорастворимую и летучую форму Hg0. Восстановление происходит при помощи НАДФН-зависимой цитоплазматической редуктазы МегА, продукта оперона тег. Вторым продуктом этого оперона является регулятор MerR (см. выше). Третий продукт, белок МегВ, разрывает химическую связь Hg-C в используемых для дезинфекции ртутьорганических соединениях, примером которых является фенилмеркуриацетат.
Неферментативное восстановление токсичных металлов известно у некоторых цианобактерий. Оно осуществляется с помощью металлотионеинов — небольших белков (~60 а. о.), в состав которых входят до десяти остатков Cys. Образование металлотионеина SmtA негативно регулируется белком SmtB (см. выше).
Стресс, вызванный лекарственными препаратами. В данном случае адаптационный ответ связан с использованием механизма множественной лекарственной устойчивости (англ. multidrug resistance, MDR). Ее можно определить, как способность выдерживать обычно летальные дозы сразу нескольких лекарственных препаратов. Неудивительно, что MDRявляется острой проблемой при бактериальных и грибковых инфекциях, а также при терапии злокачественного роста.
В случае бактерий MDR основана на экскреции токсикантов с помощью MDR- транспортеров, в частности ABC-транспортеров (см. I том учебника). Гены MDR- транспортеров регулируются транскрипционными факторами, причем индукторами или коактиваторами являются разнообразные лекарственные препараты, служащие субстратами для этих транспортеров. Иными словами, транскрипционные факторы выполняют роль цитоплазматического MDR-сенсора однокомпонентной сигнальной системы и реагируют на стрессор, т. е. на неустраненный лекарственный препарат. Важно отметить, что сенсор претерпевает конформационное изменение под воздействием гетерогенных лигандов. Это позволяет дать стандартный ответ при токсическом шоке, вызванном стрессорами разной структуры, которые поражают разные мишени.
Ответ при рассматриваемом токсическом стрессе выражается в индукции или активации генов MDR-транспортеров.
Активаторы генов, кодирующих MDR-транспортеры, принадлежат к семействам MerR, АrаС и LysR. В свою очередь, репрессоры этих генов относятся к семействам TetR, MarR и Lad. Рассмотрим важнейшие примеры.
Негативная регуляция белком MarR (сокр. англ, multiple antibiotic resistance). Транскрипционный фактор MarR негативно контролирует регулон mаг, обеспечивающий устойчивость Е. coli к разнообразным, актуальным для медицины антибиотикам.
В отсутствии стресса димер белка MarR (144 а.о.) связан с хромосомной ДНК в локусе marO, расположенном между геном marC и опероном marRAB. что подавляет экспрессию последнего. При стрессе белок MarR взаимодействует с транспортируемыми субстратами-индукторами, в результате чего оперон marRAB дерепрессиру- ется. Продукт экспрессии гена marA, транскрипционный фактор МагА, связывается с короткими (20 п. н.) непалиндромными операторами, что активирует транскрипцию >60 подконтрольных генов, в том числе генов, кодирующих MDR-транспортеры.
Позитивная, регуляция белком BmrR (сокр. англ. bacterial multidrug resistance regulator). Транскрипционный фактор BmrR, характерный для В. subtilis и принадлежащий к семейству регуляторов MerR (см. выше), активирует транскрипцию гена MDR-транспортера, субстратами которого служат токсичные липофильные катионы.
При стрессе С-концевой участок белка BmrR взаимодействует с транспортируемыми субстратами-коактиваторами, что способствует взаимодействию N-концевого участка (содержащего характерный НТН-мотив) с хромосомной ДНК. Благодаря этому активируется транскрипция ряда генов, в том числе гена bmr, кодирующего MDR-транспортер.
Негативная регуляция белком QacR (сокр. англ. quaternary ammonium compounds). Транскрипционный фактор QacR, характерный для Staphylococcus aureus и принадлежащий к семейству регуляторов TetR, уникален тем, что он кодируется плазмидой, которая дополнительно содержит гены устойчивости к антибиотикам.
В отсутствии стресса белок QacR связывается с псевдопалиндромной down- stream-последовательностью в плазмидной ДНК и репрессирует транскрипцию, препятствуя образованию открытого комплекса РНК-полимеразы с промотором гена qacA, кодирующего МDR-транспортер. При стрессе белок QacR взаимодействует с транспортируемыми субстратами-индукторами (катионными липофильными антисептиками, дезинфицирующими средствами и цитотоксинами) и покидает сайт связывания с ДНК.