МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ III - А. В. ПИНЕВИЧ - 2009
ГЛАВА 16. ЦИТОГЕНЕТИКА
16.4. Самовоспроизведение генома
Чтобы устойчиво наследоваться, т. е. сохраняться от поколения к поколению, наследственная информация должна самовоспроизводиться, или копироваться. Частичное копирование генома служит предпосылкой генетической рекомбинации путем горизонтального переноса генов (не от родительской клетки к гомологичным дочерним клеткам, а от клетки-донора к гетерологичной клетке-реципиенту).
Самовоспроизведение генома включает в себя два взаимосвязанных аспекта — матричный («информационный») и конструктивный («операционный»).
Матричный аспект самовоспроизведения генома общеизвестен, и мы не станем на нем задерживаться. Конструктивный аспект заключается в том, что для копирования ДНК используются мономеры-нуклеозидтрифосфаты — дезокси-АТФ, дезокси- ГТФ, дезокси-ЦТФ и дезокси-ТТФ. Они должны поступать в репликационную вилку (см. ниже) в сбалансированном и концентрированном количестве, а не просто находиться в диффузионном равновесии со своими цитоплазматическими пулами. Как это происходит, неизвестно. В частности, можно предположить, что в доставке мономеров-предшественников в репликационную вилку участвует мультиэнзимный комплекс энзоскелета (см. I том учебника).
Биосинтез мономеров ДНК осуществляется двумя способами — из «вторсырья» (англ. salvage synthesis) и de novo.
Биосинтез мономеров ДНК из «вторсырья» (рис. 175, А). В данном случае используются продукты деградации эндогенных или экзогенных ДНК и РНК — азотистые основания, (дезокси)рибонуклеозиды и (дезокси)рибонуклеозидмонофосфагы.
Рис. 175. Биосинтез мономеров ДНК из «вторсырья» (А) и de novo (Б). Черные прямоугольники — рибоза; белые прямоугольники — дезоксирибоза.
1 — тиоредоксинредуктаза; 2 — рибонуклеотидредуктаза NrdAB; 3 — тимидилатсинтетаза; Р — фосфорильная группа; PRPP — 5-фосфорибозил-1-пирофосфат; TRr — восстановленный тиоредоксин; TRo — окисленный тиоредоксин; [СН3-] — метальная группа (в форме метил-Н4-фолата).
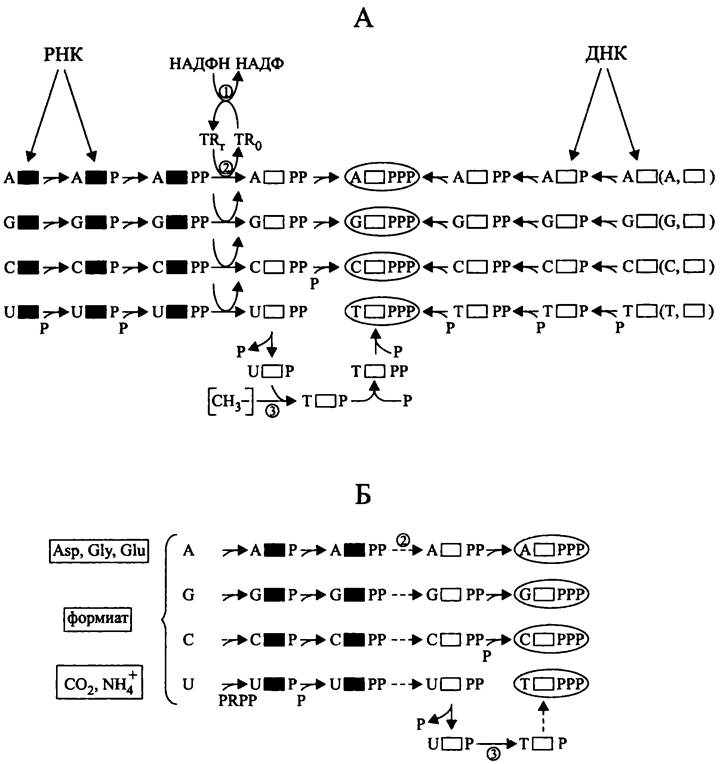
Из «подержанных» азотистых оснований и дезоксирибозы предварительно синтезируются дезоксирибонуклеозиды. Затем из них, а также из «подержанных» (дезокси)рибонуклеозидмонофос- фатов с помощью АТФ-зависимых киназ образуются соответствующие дезоксирибонуклеозидтрифосфаты.
«Подержанные» рибонуклеозиды и рибонуклеозидмонофосфаты с помощью субстратспецифичных АТФ-зависимых киназ предварительно превращаются в рибонуклеозиддифосфаты — АДФ, ГДФ, ЦДФ и УДФ. После этого они восстанавливаются в соответствующие соединения дезоксирибозного ряда. Донором электронов для АДФ-, ГДФ- и ЦДФ-редуктазы NrdAB служит восстановленный тиоредоксин (белок молекулярной массой ~10 кДа; его окисленная форма содержит дисульфидный мостик). В свою очередь, донором электронов для тиоредоксинредуктазы служит НАДФН. Дезокси-АДФ, дезокси-ГДФ и дезокси-ЦДФ превращаются в дезокси-АТФ, дезокси-ГТФ и дезокси-ЦТФ при помощи неспецифической АТФ-зависимой нуклеозиддифосфаткиназы.
Четвертый дезоксирибонуклеотид, дезокси-ТТФ синтезируется отдельно, в следующей цепи превращений:
дезокси-УДФ —> [дезокси-УМФ —> дезокси-ТМФ) —> дезокси-ТДФ —> дезокси-ТТФ.
Дезокси-УМФ метилируется в дезокси-ТМФ с помощью тимидилатсинтетазы, причем донором метальной группы служит К-метил-H4фолат (см. II том учебника).
В конечном счете, из четырех типов мономеров-дезоксинуклеозидтрифосфатов синтезируется молекула ДНК.
Биосинтез мономеров ДНК de novo (рис. 175, Б). Этот метаболический путь начинается с образования пиримидиновых и пуриновых оснований из аминокислот (аспартата, глицина и глутамата), формиата, СО2 и NH3. Затем из азотистых оснований и АТФ-активированной рибозы (5-фосфорибозил-1-пирофосфата, PR.PP) образуются четыре рибонуклеозидмонофосфата — АМФ, ГМФ, ЦМФ и УМФ. Под воздействием субстратспецифичных АТФ-зависимых киназ из этих рибонуклеозидмонофосфатов образуются рибонуклеозидцифосфаты. Затем рибонуклеотидредуктаза NrdAB восстанавливает рибонуклеозидцифосфаты в соединения дезоксирибозного ряда (см. выше). Единственное исключение составляет дезокси-ТДФ, предшественником которого служит дезокси-УДФ (см. выше).
Наконец, как и при биосинтезе из «вторсырья», неспецифическая киназа превращает все четыре дезоксинуклеозиддифосфата в соответствующие дезоксинуклеозидтрифосфаты, и из них синтезируется молекула ДНК.
16.4.1. Репликация
В основе самовоспроизведения генома лежит матричный процесс — репликация двухспиральной ДНК.
Репликацией в широком смысле слова (англ. replication; от лат. replicatio — возобновление) называется воспроизведение любых субклеточных структур, без чего невозможны клеточный рост и деление.
В первую очередь нас интересует репликация хромосомы. Ясно, что репликация ДНК как полинуклеотидной молекулы и репликация хромосомы как органеллы (см. I том учебника), в структурно-функциональной организации которой участвуют ДНК-связывающие белки, и которая взаимодействует с клеточной оболочкой, не одно и то же, хотя в литературе эти понятия обычно строго не разграничиваются.
16.4.1.1. Репликация хромосом
Репликация хромосомной ДНК происходит с помощью мультиферментного комплекса, организованного в форме временно существующей органеллы — реплисомы (см. ниже).
Репликация включает в себя три основные этапа: инициацию (начало), элонгацию (продолжение) и терминацию (завершение).
Ферментативный процесс репликации осуществляется полуконсервагивным способом — двойная спираль ДНК расплетается на одиночные цепи, а затем на каждой из них из четырех типов дезоксирибонуклеотидов с помощью ДНК-полимеразы, или репликазы собирается новая цепь. Залогом правильного копирования хромо-
сомы служит комплементарность азотистых оснований, т. е. определенный тип их взаимного спаривания: G=C; А=Т.
При образовании РНК-праймеров (инициирующих синтез фрагментов Оказаки для образования отстающей цепи; см. ниже) временно используются четыре типа рибонуклеотидов. Их полимеризация осуществляется с помощью ДНК-зависимой РНК-полимеразы, или праймазы. В данном случае соблюдается расширенное правило комплементарности: G=C; Т (старая цепь) = А(новая цепь) и А(старая цепь) = U(новая цепь).
Таким образом, субстратами при репликации служат восемь типов дезокси(рибо)нуклеозидтрифосфатов — дезокси(рибо)-АТФ, дезокси(рибо)-ГТФ, дезокси (ри- бо)-ТТФ, рибо-УТФ и дезокси(рибо)-ЦТФ. Кроме того, расходуется энергия, освобождающаяся при гидролизе их субтерминальной фосфодиэфирной связи (рис. 176).
У отдельных представителей мира прокариотов скорость полимеризации нуклеотидов существенно различается. В частности, для бактерии Mycoplasma capricolum она составляет 100 н.-с-1, для археота Pyrobaculum abyssii — 300 н. -с-1, а для бактерии Е. coli — 1 тыс н.-с-1.
Расплетенный участок, в котором на конкретный момент происходит репликативный синтез ДНК, называется репликационной вилкой (англ. replication fork).
По мере того, как вилка продвигается вперед, идет сопряженное копирование комплементарных цепей ДНК. А так как они антипараллельны, можно было бы ожидать, что одна цепь непрерывно наращивается в направлении 5' —> 3', а другая — в направлении 3' —> 5'. Однако на самом деле механизм репликации сложнее.
Природные ДНК-полимеразы могут синтезировать цепь ДНК только в направлении 5' —> 3', причем либо уже имеющуюся цепь, либо от затравки-праймера, роль которой выполняет короткая цепочка РНК. В обоих случаях к свободной 3'-ОН группе (дезокси)рибонуклеотида присоединяется 5'-фосфатная группа следующего нуклеотида. В качестве побочного продукта этой реакции образуется неорганический пирофосфат (рис. 176).
Рис. 176. Удлинение полинуклеотидной цепи с помощью ДНК-по- лимеразы. А — аденин; Т — тимин; G — гуанин.
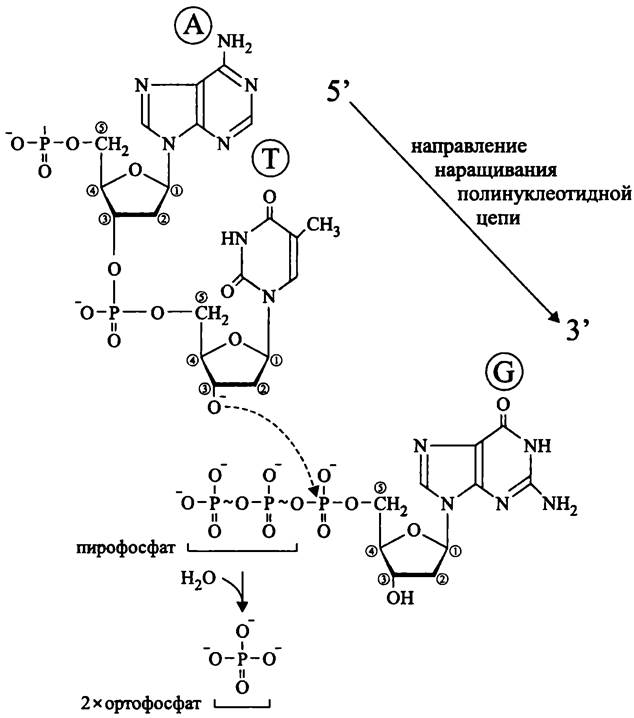
В природе нет таких ДНК-полимераз, которые действовали бы в направлении 3' —> 5', поскольку на 5'-конце несвязанного нуклеотида находится не свободная ОН- группа, а трифосфат РРР.
Не бывает и таких ДНК-полимераз (в отличие от РНК-полимераз), которые синтезировали бы полинуклеотидную цепь de novo, начиная с одного нуклеотида.
В реальности одна цепь ДНК, которая называется ведущей (англ. leading strand), копируется непрерывно в направлении 5' —> 3'. Другая цепь, которая называется отстающей (англ. lagging strand), копируется дискретно — путем сборки из отдельных полинуклеотидных блоков. Они называются фрагментами Оказаки (англ. Okazaki fragment) в честь японского генетика Рейдзи Оказаки (R. Okazaki), который открыл их в начале 1980-х годов.
Благодаря использованию такого возвратно-поступательного механизма ведомая цепь ДНК синтезируется в запрещенном направлении (З' —> 5') — в конечном итоге, в ту же сторону, что и ведущая цепь.
Итак, репликационная вилка асимметрична. Для инициации репликации ведущей цепи праймаза однократно синтезирует РНК-праймер, а затем наращивание идет уже без праймеров, непрерывно. Отстающая цепь собирается из отдельных фрагментов Оказаки. Для инициации их синтеза каждый раз требуется праймер, представляющий собой короткую молекулу РНК, или «мини-транскрипт» (см. ниже).
Основные этапы репликации хромосомы. Репликация кольцевой бактериальной хромосомы состоит из пяти последовательных этапов:
— инициации репликации в уникальном хромосомном локусе — ориджине репликации oriC (сокр. англ. origin — начало и С — chromosome), или репликаторе (англ, replicator);
— образования двух противоположно направленных репликационных вилок;
— синтеза сестринских копий хромосомы путем наращивания новых цепей ДНК от ориджина репликации oriC до другого уникального хромосомного локуса — терминуса репликации terC (сокр. англ. termination — завершение и С — chromosome);
— размыкания сплетенных колец сестринских хромосом, или декатенации (англ. decatenation; от лат. catena — цепь);
— сегрегации сестринских хромосом по обе стороны от клеточного экватора с помощью бактериального «митотического» аппарата.
Ориджин репликации хромосомы oriC. Репликация бактериальной хромосомы стартует от ориджина репликации oriC. Репликационные вилки перемещаются в двух взаимно противоположных направлениях (рис. 177). При этом образуются две симметричные реплихоры (англ. replichore; от лат. replicatio — возобновление и греч. choris — отдельно), которые соответствуют двум воссоздаваемым сестринским молекулам ДНК. В условно-графическом отображении реплицирующаяся хромосома похожа на греческую букву тета (θ). Поэтому данный механизм репликации называется «тета-механизмом». Его другое название — «механизм Кэрнса», в честь английского микробиолога Джона Кэрнса (J. Cairns), который с помощью метода радиоавтографии с включением Н3-тимидина получил в 1963 г. первое изображение хромосомы Е. coli в состоянии репликации.
В другом уникальном локусе terС, расположенном строго напротив ориджина oriC, репликация заканчивается (рис. 177).
Рис. 177. Тета-механизм репликации бактериальной хромосомы. Сплошные линии — старые нити ДНК; пунктиры — новые нити ДНК; гребенки — РНК-праймеры; белые стрелки — направление наращивания полинуклеотидной цепи на ведущей нити ДНК; черные стрелки — направление наращивания полинуклеотидной цепи на ведомой нити ДНК. оriС — локус инициации репликации (ориджин); terC — локус терминации репликации (терминус).
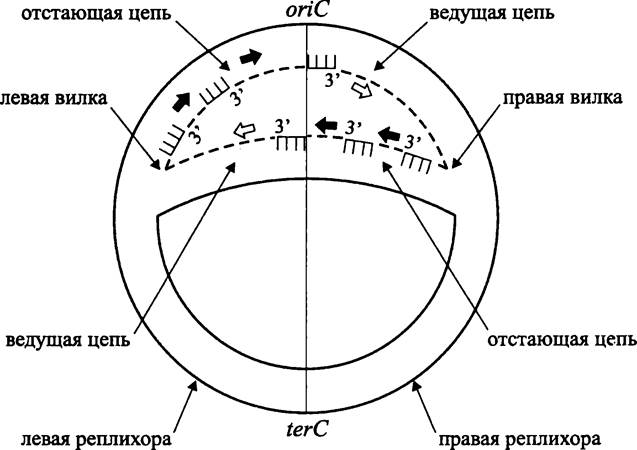
Ориджин является незаменимым компонентом хромосомы, и в случае его делеции бактерия теряет способность к размножению.
Клетка может содержать один или несколько ориджинов репликации, что определяется особенностью клеточного цикла у прокариотов (см. раздел 17.1).
Для медленно размножающихся бактерий интервал между двумя последовательными делениями, или время генерации (англ. generation time) составляет >120 мин. В данном случае пререпликативная фаза, фаза репликации хромосом(ы) и фаза расхождения дочерних хромосом вместе с фазой клеточного деления разделены во времени.
У тех бактерий, которые размножаются со средней или даже высокой скоростью, время генерации сокращается до 15-40 мин. Это ровно столько или в несколько раз меньше, чем требуется для репликации хромосомы. Например, минимальное время генерации Е. coli равно 15 мин, в то время
как при скорости полимеризации 1 тыс. н. с-1 на копирование генома этой бактерии (4,7 млн. п. н.: 103 н. с-1 = 78 мин) с помощью двух репликационных вилок уходит ~39 мин (78 мин:2).
Поскольку в ходе размножения бактерия должна передать дочерним клеткам не менее одного геномного эквивалента, процесс копирования забегает вперед: перекрываются два или больше раундов репликации одного и того же генома, т. е. эти раунды инициируются раньше, чем сестринские хромосомы распределятся между дочерними клетками. В данном случае на хромосоме образуются множественные репликационные вилки (рис. 178). Такая репликация называется многовилковой (англ. multifork replication). Некоторые бактерии, например, Caulobacter crescentus, к такому типу репликации не способны.
Рис. 178. Многовилковая репликация у быстро делящихся бактериальных клеток. Белые кружки — ориджины; черный кружок — терминус; сплошные стрелки — направление перемещения репликационных вилок; пунктиры — размещение ориджинов соответственно на 1/8, 3/8, 5/8 и 7/8 продольной оси, а терминуса на экваторе клетки.
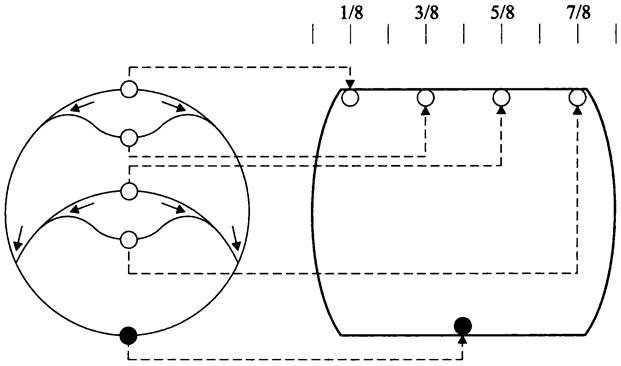
Расхождение хромосом и клеточное деление происходят на фоне репликации, благодаря чему хромосомы ювенильных дочерних клеток уже реплицированы примерно на 50%. Перед делением материнская клетка содержит один экваториальный терминус и либо два ориджина, расположенные на 1/4 и 3/4 длины продольной оси клетки, либо четыре ориджина — на 1/8, 3/8, 5/8 и 7/8 длины продольной оси (рис. 178).
Существование многовилковой репликации не противоречит положению о том, что репликация хромосомы инициируется только раз на протяжении клеточного цикла (см. раздел 16.4.1.1). Понятна разница между ситуацией, когда репликация инициируется «от нуля», и ситуацией, когда после очередного деления дочерняя клетка получает готовые вилки.
Локус oriC имеет минимальный размер 245 п. н. и содержит 56 мол. % GC, причем GC- и АТ-пары нуклеотидов распределены неравномерно по его длине (см. ниже).
Согласно результатам секвенирования ДНК, полученным для нескольких десятков видов бактерий, локус oriC имеет консервативную структуру (рис. 179).
В этой некодирующей области хромосомы находятся:
— от девяти до четырнадцати прямых повторов GАТС (в случае В. subtilis они отсутствуют);
— три 13-мерных (Е. coli) или три 16-мерных (В. subtilis) прямых повтора, обогащенных АТ-парами;
— четыре или пять 9-мерных инвертированных повторов, или «DnaA-боксов» со структурой 5'-ТТАТССАСА-3' и, соответственно, 5'-TGTGGATAA-3'.
Набор генов, фланкирующих ориджин oriC (в частности, это гены rnрА, rpmН, dnaA, dnaN, recF и gyrB), и их взаимное расположение также консервативны.
Иногда встречаются ориджины с уникальной структурой. Например, у почкующейся стебельковой бактерии Caulobacter crescents в состав локуса oriC входят сайты для связывания белка CtrA, негативно контролирующего репликацию в ходе диморфного клеточного цикла (см. раздел 17.1). Кроме того, нуклеотидная последовательность локуса oriC этой бактерии перекрывается с последовательностью гена hemE, который кодирует уропорфириноген-декарбоксилазу и фланкирован двумя неконсервативными генными кластерами.
Локус oriC является не только стартовой точкой репликации бактериальной хромосомы. Он также служит, мишенью регуляции репликации. Особые механизмы следят за тем, чтобы репликация не инициировалась на протяжении значительной части клеточного цикла, которая называется эклипс-периодом (от греч. eclipsis — исчезновение; в данном случае — отсутствие репликации).
В случае Е. coli регуляция репликации связана с действием метилазы (точнее — метилтрансферазы) Dam (сокр. англ. DNA adenine methylase; 32 кДа; ген dam). Этот фермент специфически метилирует остатки аденина в сайтах 5'-GATC-3' (см. также раздел 16.5.2). Таких сайтов в ДНК Е. coli имеется ~19 тыс. Содержание Dam зависит от скорости роста и определяется эффективностью транскрипции с промотора Р2 гена dam.
Поскольку ДНК реплицируется полуконсервативным способом, за репликационной вилкой образуются два «полуметилированных» дуплекса ДНК. Большинство неметилированных сайтов GАТС быстро реметилируется с помощью метилазы Dam. Исключением является ориджин репликации oriC, с которым связывается белок SeqA (21 кДа; сокр. англ. sequester— изолировать).
Белок SeqA конкурирует с метилазой Dam. Он взаимодействует с кластерами из двух и более сайтов GATC, что препятствует их метилированию. Кроме того, он блокирует синтез белка DnaA, связываясь с полуметилированными сайтами в промоторе гена dnaA.
Поскольку локус oriC содержит кластер из 13 сайтов GATC, он сильнее других участков хромосомы изолируется и от метилазы Dam и от инициаторного белка DnaA.
Белок SeqA не только связывается с полуметилированным локусом oriC, но и играет роль якоря, прикрепляющего этот локус к участку клеточной оболочки. В результате контакт между oriC и реплисомой блокируется, что препятствует преждевременной реинициации репликации.
Итак, в полуметилированном мембраносвязанном виде локус oriC не способен участвовать в репликации. В свою очередь, для реинициации репликации он должен перейти в полностью метилированную форму и потерять связь с клеточной оболочкой. Таким образом, оболочка Е. coli осуществляет негативный, а не позитивный контроль над репликацией.
Иная картина наблюдается в случае В. subtilis. Во-первых, у этой бактерии локус oriC не содержит GATC-сайтов для метилирования. Во-вторых, у нее нет «якорного» белка SeqA. Вместо него для прикрепления локуса oriC к клеточной оболочке используется белок DnaB (не путать с одноименной геликазой DnaB, имеющейся у Е. coli; см. ниже).
Инициаторный белок DnaA. Этот ДНК-связывающий белок (52 кДа) выполняет ключевую роль в инициации репликации. Его содержание в клетке довольно велико (103 копий у быстро растущей Е. coli). Гомологи гена dnaA кишечной палочки имеются во всех секвенированных бактериальных геномах, что свидетельствует об эволюционной консервативности и универсальности механизма репликации.
Инициаторы репликации, или ориджин-связывающие белки (англ. origin binding protein, ОВР) — это мономеры или мультисубъединичные комплексы. Они принадлежат к суперсемейству ААА-АТФаз (сокр. англ. ATPases associated with various cell activities; см. раздел 16.6.1.3).
ОВР обладают сродством к специфическим нуклеотидным последовательностям, расположенным в локусе огi, и кооперативно соединяются с ними, образуя олигомеры.
Инициаторные белки выполняют две функции. Вначале они расплетают небольшой участок двухспиральной ДНК на одиночные цепи с образованием «глазка» (англ. eyelet), или «пузыря» (англ. bubble). Затем они направляют туда другие ферменты репликации, а именно:
— геликазы, обеспечивающие продвижение репликационной вилки;
— праймазы, которые синтезируют РНК-праймеры, играющие роль затравки при синтезе дочерних цепей ДНК;
— ДНК-полимеразы.
Чтобы ОВР выполняли все эти функции, их необходимо активировать за счет энергии АТФ.
Помимо сайтов для связывания ОВР, локус огi содержит легко расплетающиеся прямые повторы, богатые АТ-парами.
Белок DnaA активируется в результате связывания с АТФ, а также при взаимодействии с кислыми фосфолипидами, входящими в состав СМ. При гидролизе связанного АТФ (что стимулируется регуляторным белком Hda) белок DnaA изменяет свою конформацию и теряет способность вызывать новый раунд репликации.
Белок DnaA прикрепляется к локусу oriC сайтспецифично, в нескольких DnaA- боксах (рис. 179). Это служит триггером для каскада структурных превращений молекулы ДНК, которые позволяют приступить к репликации.
В большинстве случаев ген dnaA непосредственно фланкирует локус oriC (за исключением энтеробактерий, в частности Е. coli, где они разделены последовательностью длиной 42 т. п. н.).
Как уже указывалось, локус oriC имеет консервативную структуру и включает в себя четыре (в случае Е. coli — пять) девятимерных DnaA-боксов. Они обозначаются как R1-R4. К ним в очередности R1—> R1—> R2 —> R3 присоединяются молекулы белка DnaA.
Белок DnaA в процессе репликации выполняет три функции:
— распознает DnaA-боксы в локусе oriC и кооперативно вступает с ними в прочную связь;
— расплетает двойную спираль ДНК на одиночные нити в AT-богатом конце локуса oriC, примыкающем к DnaA-боксам;
— направляет в расплетенный участок ДНК (глазок) геликазу DnaB.
При репликации в локусе oriC поочередно образуются три комплекса (рис. 179).
Puc. 179. Хромосомный локус oriC и комплексы, образующиеся в нем на стадии инициации репликации. I — инициальный комплекс; II — открытый комплекс; III — препраймерный комплекс. oriC— локус инициации репликации (ориджин); 13 — AT-богатые прямые повторы; R1-R4 — DnaA-боксы; IHF, Fis — сайты для связывания изгибающих белков; HU — ДНК-связывающий белок; DnaA — инициаторный белок; DnaB — геликаза; DnaC — вспомогательная АТФаза; SSB — белок, стабилизирующий одноцепочечную ДНК.
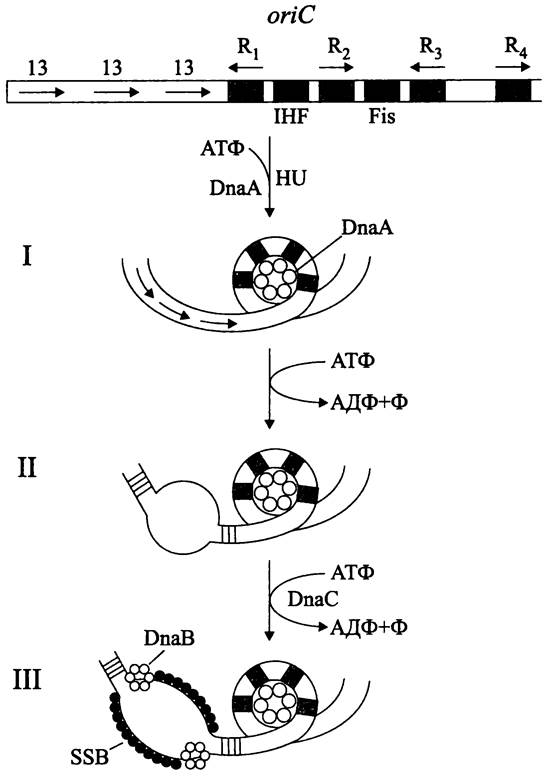
Во-первых, это инициаторный комплекс (англ. initial complex) (рис. 179, I). Так называется часть локуса oriC, содержащая DnaA-боксы. В этом месте негативно суперспирализованная ДНК делает локальный изгиб с образованием глобулы, ядро которой состоит из 20-40 молекул белка DnaA в АТФ-связанной форме. В образовании инициаторного комплекса, помимо белка DnaA, участвуют гистоноподобный белок HU (см. I том учебника), а также катионные белки IHF (сокр. англ. integration host factor) и Fis (сокр. англ. factor for inversion stimulation), изгибающие молекулу ДНК.
Во-вторых, это открытый комплекс (англ. open complex) (рис. 179, II). Он образуется в участке oriC размером 45 п. н., который «плавится», или расплетается на одиночные цепи путем разрыва водородных связей. Данное структурное изменение ДНК происходит потому, что белок DnaA поочередно вступает во взаимодействие с тремя «легкоплавкими» AT-богатыми 13-мерными повторами (как известно, GC-napa стабилизирована тремя водородными связями, а AT-пара только двумя), расположенными на левом конце локуса oriC. Переход от инициаторного комплекса к открытому комплексу осуществляется за счет использования энергии АТФ.
В-третьих, это препраймерный комплекс (англ. prepriming complex) (рис. 179, III). Он образуется после того, как в открытый комплекс внедряется геликаза DnaB (англ. helicase; от греч. elix — витой), расплетающая двойную спираль ДНК. Сборку гексамеров белка DnaB вокруг одноцепочечных участков ДНК осуществляет вспомогательный белок — АТФаза DnaC. Выполнив свою задачу, он покидает комплекс. В дальнейшем две молекулы геликазы DnaB расплетают ДНК во взаимно противоположных направлениях со скоростью 700-1000 п. н. с-1. С одноцепочечными участками ДНК кооперативно связываются молекулы SSB-белка (сокр. англ. single strand binding protein). Они стабилизируют жесткую форму эти участков, защищают их от нуклеаз и правильно ориентируют по отношению к ним ДНК-полимеразу. Следом за геликазой в состав препраймерного комплекса включается праймаза (см. ниже).
Белок DnaA многофункционален. Наряду с инициацией репликации он проявляет себя как репрессор транскрипции. Это происходит благодаря его взаимодействию с DnaA-боксами, имеющимися в промоторных участках некоторых незаменимых генов (гена mioC, продукт которого участвует в репликации; гена rроН, кодирующего субъединицу РНК-полимеразы; гена uvrB эксцизионной нуклеазы, осуществляющей репарацию ДНК, и др.). Кроме того, он регулирует свою собственную экспрессию, блокируя ген dnaA.
Уровень транскрипции гена dnaA тем больше, чем выше скорость роста. В свою очередь, негативным регулятором гена dnaA является «алармон» гуанозинтетрафосфат ppGpp (см. раздел 18.1.4). Концентрация ppGpp увеличивается, когда рост по той или иной причине затормаживается. При этом используется альтернативный ориджин oriM, расположенный по соседству с локусом оriС. Детали репликации в этих условиях неизвестны, хотя установлено, что она протекает в отсутствии белка DnaA.
Праймосома. Праймосома является частью органеллы репликации — реплисомы (см. ниже).
Как уже указывалось, отстающая цепь ДНК образуется прерывистым способом из фрагментов Оказаки. Для инициации биосинтеза фрагментов Оказаки используются мини-транскрипты, или РНК-праймеры, длина которых составляет 10-15 н. Синтез РНК-праймеров происходит с помощью особой РНК-полимеразы, или праймазы (англ. primase).
У разных прокариотов фрагменты Оказаки различаются по длине (в частности, для Е. coli это 1-2 т. п. н., а для археота Pyrococcus abyssii — 100 п. н.).
Сборка фрагмента Оказаки начинается с 3'-конца РНК-праймера и продолжается в направлении 5' —> 3' (рис. 180).
Рис. 180. Копирование хромосомной ДНК в репликационной вилке. Сплошные линии — старые нити ДНК; пунктир — новые нити ДНК; гребенки — РНК-праймеры; черные кружки — белки, стабилизирующие одноцепочечную ДНК (SSB-белки). А — ДНК-полимеразный комплекс (голофермент Pol III*) на ведущей цепи; В — ДНК-полимеразный комплекс (голофермент Pol III*) на ведомой цепи; С — ДНК-геликаза DnaB; D — праймаза DnaG; Е — ДНК-лигаза; F1 и F2 — фрагменты Оказаки.
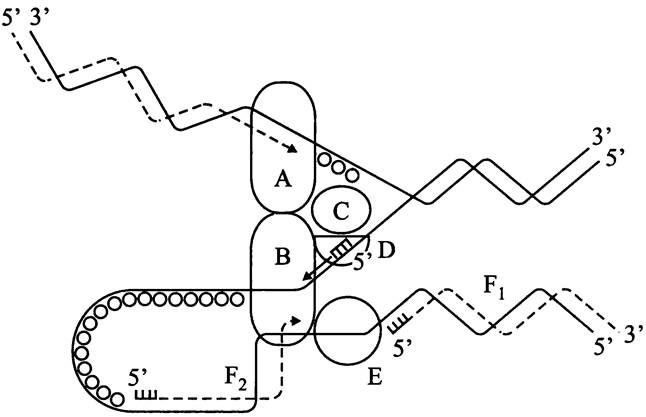
В состав праймосомы входят ДНК-геликаза DnaB со вспомогательным белком DnaC (см. выше) и праймаза DnaG, а также вспомогательные белки DnaT и PriABC. Как уже отмечалось, функция праймазы заключается в биосинтезе РНК-праймеров — однократно для ведущей цепи и многократно для отстающей цепи.
С праймазой тесно взаимодействует топоизомераза II (см. раздел 16.4.2), или ДНК-гираза. Ее роль состоит в том, чтобы по ходу продвижения репликационной вилки распрямлять двойную спираль ДНК, делающую один виток на десять пар нуклеотидов. В противном случае реплисоме пришлось бы вращаться вокруг молекулы ДНК, а это привело бы к взаимному спутыванию сестринских хромосом. Кроме того, ДНК-гираза устраняет положительные супервитки, накапливающиеся перед репликационной вилкой. Для этого она сначала делает двухцепочечные разрезы ДНК, а затем восстанавливает непрерывность обеих цепей перед геликазой DnaB.
Реплисома. Комплексная задача по обеспечению репликации решается помощью мультиферментной органеллы — реплисомы (англ. replisome). На примере В. subtilis показано, что реплисома формируется на экваторе клетки. Скорее всего, это характерно и для большинства других бактерий, делящихся бинарно-эквивалентно (в частности, Е. coli).
В отличие от стабильно существующих органелл, например, рибосом, отдельные компоненты реплисомы удерживаются вместе слабыми электростатическими силами. Поэтому нативную реплисому невозможно получить препаративно, но ее можно визуально наблюдать методом молекулярного зондирования in situ.
При репликации ДНК двойная спираль плавится, т. е. расходится на две старые цепи. На одноцепочечных участках, стабилизированных SSB-белками, синтезируются новые цепи.
Как мы уже отмечали, ДНК-полимераза не может стартовать от одного нуклеотида, и поэтому на обеих старых цепях ДНК — ведущей и ведомой — предварительно синтезируются РНК-праймеры (рис. 180). Поскольку при репликации бактериальной хромосомы образуются две противоположно направленные и расходящиеся в разные стороны репликационные вилки, в каждой из них действует отдельная ДНК-полимераза Pol III (см. рис. 180).
Таким образом, реплисома представляет собой тандем ДНК-полимераз Pol III в совокупности с двумя праймосомами, а также вспомогательными ферментами и неферментативными белками.
Еще раз напомним, что ведущая цепь ДНК наращивается непрерывно, а отстающая цепь образуется прерывистым способом из фрагментов Оказаки. После того, как заканчивается синтез очередного фрагмента Оказаки, ДНК-полимераза Pol I (см. ниже), обладающая уникальной 5' —> 3' экзонуклеазной активностью, разрушает РНК-праймер, который был ковалентно связан с предыдущим фрагментом, и заполняет образовавшуюся брешь (рис. 180). Однонитевой разрыв устраняется ДНК- лигазой, или просто лигазой (англ. ligase; от лат. ligatio — перевязывание). ДНК-лигаза Е. coli образует фосфодиэфирную связь в НАД-зависимой реакции; она состоит из одной субъединицы молекулярной массой 75 кДа и присутствует в количестве 200-400 копий на клетку.
ДНК-полимеразы Е. coli (общие сведения). Е. coli обладает пятью ДНК- полимеразами — Pol I, Pol II, Pol III, Pol IV и Pol V (сокр. англ. polymerase; римские цифры отражают хронологическую последовательность описания этих ферментов) (табл. 22).
В соответствии с условиями экспрессии и функционирования, различают два основных типа ДНК-полимераз:
— «нормальные», или репликативные полимеразы (Pol I и Pol III), которые синтезируются конститутивно; они участвуют в репликации и коррекции ошибок спаривания, а также в эксцизионной репарации;
— «SOS»-полимеразы (Pol II, Pol IV и Pol V), уровень экспрессии которых повышается при повреждении ДНК; они обходят участки, непреодолимые для репликативных полимераз.
Репликативные ДНК-полимеразы Е. coli Pol I и Pol III. Эти полимеразы осуществляют нормальный полуконсервативный синтез ДНК. Кроме того, ДНК- полимераза III и, в меньшей степени, ДНК-полимераза I способны самостоятельно исправлять ошибки спаривания.
Репликация является высокоточным процессом, что не удивительно, поскольку в противном случае частота спонтанных мутаций, многие из которых летальны, оказалась бы непомерно большой. Эндогенные ошибки репликации происходят с низкой частотой (10-9), что возможно только благодаря работе корректирующего аппарата, в отсутствии которого их количество оказалось бы намного выше.
Каноническое правило копирования ДНК (G=C, А=Т) соблюдается не абсолютно строго, поскольку все четыре типа дезоксирибонуклеотидов с частотой ~10-5 спонтанно переходят в короткоживущие таутомерные формы (*), которые участвуют в неканоническом спаривании. Например, в случае цитозина вместо пары G=C образуется пара А=С*.
Полимераза Pol III включает такой короткоживущий нуклеотид в состав новой цепи ДНК. Однако при возвращении цитозина в обычную таутомерную форму неканоническое спаривание нарушается, и у новой цепи появляется неспаренный 3'-конец.
Характерным свойством ДНК-полимеразы Pol III служит то, что она не умеет наращивать затравочную цепь на неспаренном 3'ОН-конце. Но зато ее θ-субъединица обладает вспомогательной 3' —> 5' экзонуклеазной активностью, что позволяет этому ферменту исправлять собственную ошибку — он отступает на шаг назад и удаляет неспаренный нуклеотид на затравочном З'-конце. В результате этого на матрице появляется спаренный конец, и она вновь активируется.
Наряду с системой исправления ошибок спаривания, по ходу репликации действует пострепликационная система репарации ошибок спаривания (подробнее см. раздел 16.5.1.3). С ее помощью удаляется участок новой цепи вместе с неспаренным нуклеотидом, что дает возможность избежать точечной мутации, т. е. сохранить без изменения локальную структуру генома. Перед тем, как репа- рировать ошибку спаривания, специальная система коррекции распознает еще не метилированную новую цепь (напомним, что старая цепь уже метилирована по остаткам аденина в повторяющейся последовательности GATC; см. выше). Мультиферментный комплекс сканирует ДНК на предмет присутствия в ней неметилированных последовательностей, после чего вырезается участок новой цепи, содержащий неспаренный нуклеотид. Образовавшаяся брешь заполняется с помощью ДНК- полимеразы, а одноцепочечный разрез устраняется с помощью ДНК-лигазы.
Репликативная ДНК-полимераза Pol I, состоящая из одной субъединицы, была открыта в 1958 г. Артуром Корнбергом (А.Kornberg; Нобелевская премия по физиологии и медицине, 1959 г.). Ее участие в нормальной репликации связано с заполнением однонитевых брешей в ДНК, возникающих после удаления РНК-прай- меров, ковалентно связанных с фрагментами Оказаки. Наряду с этим она обладает уникальным свойством — реплицировать ДНК в участках одноцепочечных разрывов, образующихся при эксцизионной репарации (см. раздел 16.5.1.2), причем это совершается без помощи других белков. О ведущей роли ДНК-полимеразы Pol I в репарационном синтезе ДНК свидетельствует ее более высокая копийность по сравнению с большинством других ДНК-полимераз.
Таблица 22. ДНК-полимеразы E. coli
Фермент |
Ген(ы) |
Мол. масса, кДа |
Число молекул на клетку |
Активность |
Основная функция |
||
5' —> 3' полимеразная («реплицирующая») |
3' —> 5' экзонуклеазная («корректирующая») |
5' —> 3' экзонуклеазная («репарирующая») |
|||||
Pol I |
polA |
103 |
400 |
+ |
+ |
+ |
Заполнение брешей при репликации и репарации |
Pol II |
polB |
90 |
40 |
+ |
+ |
+ |
? |
Pol III' (кор- комплекс) |
polC, dnaQ, holE |
175 (субъединицы αεθ 140, 25 и 10 кДа) |
10-20 |
+ |
+ |
+ |
Репликация; автокоррекция |
Pol IV |
dinB |
75 |
2500 (после SOS- индукции) |
+ |
? |
||
Pol V |
umuDC |
240 (комплекс (UmuD)′2 UmuC 2 x 85 + 70 кДа) |
15 (после SOS- индукции) |
+ |
SOS-репликация, адаптивный мутагенез |
||
Репликативная ДНК-полимераза Pol III, один из наиболее сложно устроенных ферментов, была открыта Корнбергом в 1969 г. В ее состав входят субъединицы десяти типов![]() молекулярной массой 8-130 кДа. Субъединицы αεθ образуют кор-комплекс (Pol Ill'). ДНК-полимеразную активность обеспечивает α- субъединица, тогда как ε- и θ-субъединицы контролируют точность репликации. Пара «димеризующих» т-субъединиц играет роль мостика между двумя кор-комплексами. Пара β-субъединиц, или зажим (англ. clamp) используется для прикрепления димера кор-комплексов к матрице ДНК. Пять вспомогательных субъединиц
молекулярной массой 8-130 кДа. Субъединицы αεθ образуют кор-комплекс (Pol Ill'). ДНК-полимеразную активность обеспечивает α- субъединица, тогда как ε- и θ-субъединицы контролируют точность репликации. Пара «димеризующих» т-субъединиц играет роль мостика между двумя кор-комплексами. Пара β-субъединиц, или зажим (англ. clamp) используется для прикрепления димера кор-комплексов к матрице ДНК. Пять вспомогательных субъединиц ![]() (y-комплекс) загружают димер кор-комплексов вместе с зажимом на матрицу ДНК. В итоге голофермент ДНК-полимеразы имеет субъединичный состав
(y-комплекс) загружают димер кор-комплексов вместе с зажимом на матрицу ДНК. В итоге голофермент ДНК-полимеразы имеет субъединичный состав ![]() и его молекулярная масса составляет около 900 кДа. ДНК-полимераза Pol III, работающая в репликационной вилке, представлена двумя идентичными голоферментами. Один из них наращивает ведущую цепь ДНК, а другой — остающую цепь. Голофермент ДНК-полимеразы, который реплицирует ведущую цепь, постоянно загружен на ДНК и непрерывно удлиняет ее в направлении 5' —> 3'. Напротив, голофермент ДНК-полимеразы, который реплицирует отстающую цепь, при синтезе каждого нового фрагмента Оказаки перезагружается на ДНК.
и его молекулярная масса составляет около 900 кДа. ДНК-полимераза Pol III, работающая в репликационной вилке, представлена двумя идентичными голоферментами. Один из них наращивает ведущую цепь ДНК, а другой — остающую цепь. Голофермент ДНК-полимеразы, который реплицирует ведущую цепь, постоянно загружен на ДНК и непрерывно удлиняет ее в направлении 5' —> 3'. Напротив, голофермент ДНК-полимеразы, который реплицирует отстающую цепь, при синтезе каждого нового фрагмента Оказаки перезагружается на ДНК.
SOS-полимеразы Е. coli Pol II, Pol IV и Pol V. Эти полимеразы обладают двумя основными особенностями.
Во-первых, уровень их экспрессии возрастает при адаптационном SOS-ответе на повреждение ДНК (см. раздел 16.5.1.4).
Повреждение ДНК у Е. coli вызывает дерепрессию SOS-регулона, гены которого участвуют в репликации, репарации и мутагенезе (см. раздел 18.1.2). Все они негативно контролируются белковым репрессором LexA. В свою очередь, репрессор LexA инактивируется под воздействием протеазы RecA, которая предварительно самоактивируется (RecA—> RecA*).
Во-вторых, SOS-полимеразы Pol IV и Pol V (но не полимераза Pol II, которая обладает корректирующей способностью) проходят мимо нерепарированных повреждений-сайтов с удаленными основаниями, пиримидиновых димеров, фотопродуктов типа пиримидин: 6-14 пиримидон и крупных молекулярных аддуктов, а также мимо ошибок спаривания.
Поэтому все три SOS-полимеразы называют «специализированными» (англ. specialized) репликазами, а SOS-полимеразы Pol IV и Pol V — «склонными к ошибкам» (англ. error-prone) или «синтезирующими поверх повреждения» (англ. translesion- synthesizing) репликазами. Последствием использования этих полимераз является накопление мутаций, некоторые из которых могут способствовать выживаемости, т. е. имеют адаптивный характер.
Поскольку повреждения ДНК, постоянно возникающие под воздействием эндогенных и экзогенных химических агентов, препятствуют работе «репликативных» полимераз Pol I и Pol III, использование «склонных к ошибкам» индуцибельных SOS-полимераз, в частности Pol V, позволяет реплицировать поврежденную ДНК. Однако ценой этого становится повышенная SOS-мутаторная активность.
Выбор той или иной SOS-полимеразы зависит от типа повреждения ДНК и характера конкретной нуклеотидной последовательности, в которой оно произошло, т. е. от локализации повреждения.
ДНК-полимераза Pol II, состоящая из одной субъединицы, была открыта Кэрнсом в 1969 г. Ее адаптивная экспрессия возрастает почти на порядок при активации системы SOS-ответа на облучение ультрафиолетовым светом (см. разделы16.5.1.1, 16.5.1.4 и 18.1.2). Поскольку полимераза Pol II обладает 3' —> 5' экзонуклеазной активностью, она реплицирует ДНК с высокой надежностью (<10-6 ошибок). В опытах in vitro было показано, что после устранения повреждения ДНК-полимераза Pol II возобновляет репликацию, причем ее активность стимулируется белковыми субъединицами ДНК-полимеразы Pol III и SSB-белками. Однако роль ДНК-полимеразы Pol II in vivo до конца не выяснена, поскольку мутанты роIВ- не обнаруживают фенотипических дефектов на уровне репликации и репарации. Есть данные, что она вмешивается в процесс исправления ошибок спаривания (см. раздел 16.5.1.3), что повышает частоту адаптивных мутаций.
ДНК-полимераза Pol IV, способность которой выступать в качестве истинной репликазы была доказана Вагнером (J. Wagner) в 1999 г., состоит из одной субъединицы — DinB. Для ее таргетинга в поврежденную область ДНК требуется участие βy-субъединиц ДНК-полимеразы Pol III (зажима и его загрузчика; см. выше). ДНК- полимераза Pol IV не обладает 3' —> 5' экзонуклеазной активностью, и поэтому совершает ошибки с высокой частотой (10-4-10-5). Роль ДНК-полимеразы Pol IV in vivo не ясна, поскольку мутанты dinB~ не обнаруживают фенотипических дефектов. Тем не менее, выяснилось, что при ее прохождении мимо поврежденного участка происходит сдвиг рамки считывания влево на один нуклеотид (-1), что является одной из причин адаптивного мутагенеза.
ДНК-полимераза Pol V, роль которой в качестве истинной репликазы была доказана Гудменом (М. F. Goodman) в 1999 г., играет ведущую роль в индуцированном мутагенезе при SOS-репарации Е. coli (англ. SOS-induced error-prone repair; см. ниже). Этот фермент представляет собой комплекс (UmuD)′2UmuC, состоящий из продукта гена umuD (сокр. англ. ultravioletmutagenesis), частично расщепленного в результате автопротеолиза, который индуцируется белком RecA* (см. разделы 16.5.1.4 и 16.6.1.2), и продукта гена итиС. Для таргетинга комплекса (UmuD)′2UmuC, как и в случае ДНК-полимеразы Pol IV, а также для прохождения им нерепарированных повреждений ДНК требуется участие βy-субъединиц ДНК-полимеразы Pol III. Пройдя повреждение и осуществив репликацию ближайшего к нему участка, полимераза Pol V уступает место полимеразе Pol III. Поскольку репликаза Pol V не обладает 3' —> 5' экзонуклеазной активностью, частота ее ошибок in vitro составляет 10-3-10-4.
Репликация «поверх повреждения» по точности намного уступает нормальной репликации. Но такая стратегия все же лучше, чем оставлять одноцепочечный участок ДНК вообще не реплицированным. В этом есть даже определенный селективный смысл, поскольку при угрозе потери жизнеспособности бактерии начинают активнее мутировать, что повышает их генетическое разнообразие и, как следствие — их адаптационный потенциал.
Репликативные ДНК-полимеразы других бактерий. У некоторых грамположительных бактерий, например, В. subtilis, репликативная ДНК-полимераза (функциональный эквивалент ДНК-полимеразы Pol III), обозначается как РоIС. В отличие от ДНК-полимеразы Pol III Е. coli, представленной двумя идентичными голоферментами, она состоит из двух разных голоферментов. Их α-субъединицы соответственно кодируются генами dnaE и polC.
Внутриклеточная локализация и расположение реплисомы относительно сестринских хромосом. Благодаря взаимодействию между праймосомой и ДНК-полимеразой, образующей новые цепи ДНК, репликационные вилки перемещаются в разные стороны от локуса oriC. Иными словами, реплисома и две копии хромосомы изменяют свое взаимное расположение. Как же при этом они ориентируются по отношению к другим клеточным структурам?
Рис. 181. Внутриклеточная ориентация хромосом В. subtilis в ходе репликации и взаимного расхождения. I — пререпликативное состояние; II — сборка реплисомы; III —вытеснение ориджинов к противоположным полюсам; IV — завершение расхождения сестринских хромосом после копирования терминуса и цитокинез.
Серые кружки — реплисомы; белые кружки — ориджины; черные кружки — терминусы.
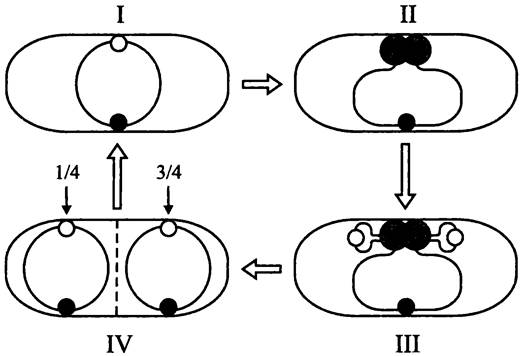
Предложены альтернативные гипотезы. Согласно одной из них, локус oriC зафиксирован на СМ, а реплисома перемещается по хромосоме, как поезд по рельсам (модель «локомотив»). Согласно другой гипотезе, фиксированное положение занимает реплисома, и сестринские хромосомы выходят из нее, подобно ткани в швейной машинке (модель «фабрика»).
Как оказалось, верна вторая г ипотеза. В конце 1990-х годов на В. subtilis были проведены опыты с использованием молекулярного гибрида между субъединицами ДНК-полимеразы и зеленым флуоресцирующим белком (GFP). Они наглядно показали, что ДНК-полимераза занимает стационарное положение на клеточном экваторе. Сестринские хромосомы вытесняются из реплисомы и расходятся к противоположным клеточным полюсам, локусами oriС вперед (рис. 181). При этом только что дуплицированные ориджины перемещаются к противоположным сторонам клетки, а терминус вплоть до окончательного завершения репликации остается на экваторе.
В случае Е. coli показано, что копии ориджинов переносятся к противоположным полюсам материнской клетки. После образования дочерних клеток они реориентируются и занимают экваториальное положение. В отличие от этого сестринские ориджины В. subtilis занимают положение на 1/4 и 3/4 длины продольной оси материнской клетки. Таким образом, после деления они оказываются на экваторах дочерних клеток, и реориентироваться им уже нет необходимости.
Сестринские терминусы перед делением всегда находятся по бокам септы, т. е. они сразу после деления оказываются на новых полюсах дочерних клеток. Позже они реориентируются и занимают экваториальное положение.
Терминация репликации. Хромосомный локус terC (в случае Е. coli) или IR (сокр. англ. inhibition of replication; в случае В. subtilis) имеет размер около 1,3 т. п. н. и расположен напротив ориджина. При двунаправленной репликации вилка, движущаяся по часовой стрелке, первой достигает локуса терминации. Спустя 5 мин с противоположной стороны туда приходит вторая репликационная вилка.
Блокирование репликационных вилок в локусе терминации осуществляется с помощью небольшого катионного белка, который называется «терминаторным». В случае Е. coli данную роль выполняет белок Tus (сокр. англ. terminus utilization substance). Его аналогом у В. subtilis служит белок RTP (сокр. англ. replication terminator protein). Они специфически связываются с соответствующими терминаторными сайтами terA-F (в случае Е. coli) и IR I-II (сокр. англ. inhibition of replication; в случае В. subtilis), которые находятся внутри локуса терминации и представляют собой инвертированные повторы длиной 20-30 п. н. Непосредственной мишенью для блока репликационной вилки служит геликаза.
Если присутствие ориджина в хромосоме строго обязательно, то терминаторный локус может делетироваться без угрозы потери жизнеспособности. Тем не менее, в норме он сохраняется, что предотвращает инициирование новых раундов репликации, иначе образовывались бы мультимерные хромосомы.
Репликация линейных хромосом. До сих пор мы говорили только о репликации кольцевых хромосом, которые типичны для бактерий, а также для архей из филы АII Euryarchaeota.
Репликация редко встречающихся у бактерий линейных хромосом имеет ряд особенностей.
Линейные хромосомы содержат теломеры, или концевые участки, отвечающие за структурную стабильность репликона, а также за то, чтобы он копировался по всей своей длине.
Механизм репликации линейных хромосом усложняется тем, что ДНК-полимераза не может копировать ДНК со срезанного двухцепочного конца. Напомним, что для наращивания полинуклеотидной цепи в направлении 5' —> 3' требуется РНК-праймер (см. выше). После удаления этого праймера на 3'-конце остался бы нереплицированный участок!
Теоретически, проблема репликации 3'-концов линейной хромосомы может быть решена следующими способами:
— концы образуют одноцепочечные шпильки;
— концы ковалентно связываются с теломерными белками;
— концы на время исчезают за счет перехода линейной хромосомы в кольцевую форму.
В первом случае локус oriC занимает центральное положение, разделяя хромосому на две реп- лихоры примерно равной длины. Репликация осуществляется в обоих направлениях в соответствии с тета-механизмом (см. выше). Роль локусов ter выполняют шпильки-теломеры. После копирования хромосомы сцепленные кольца теломеров декатенируются с помощью резольвазы (см. ниже), и концы сестринских хромосом заделываются одноцепочечными шпильками.
Если реализуется второй механизм, то в нем участвуют уже не РНК-овые, а белковые праймеры (по аналогии с репликацией аденовируса или фага ф29). Теперь роль ориджинов выполняют правый и левый теломеры, а локус ter занимает центральное положение. Инициаторный белок Тар (сокр. англ. telomere-associated protein) распознает локусы on, связывается с ними и начинает расплетать двойную спираль ДНК. После этого к свободным 3'-концам ковалентно присоединяется «терминальный» белок Tpg (сокр. англ. terminalprotein). Он выполняет роль праймера и вступает в комплекс с ДНК-полимеразой, образующей ковалентную связь между ним и первым дезоксирибонуклеозидтрифосфатом, который становится 5'-концевым нуклеотидом. От него дочерние цепи ДНК наращиваются в направлении 5' —> 3'. По завершении репликации белок Tpg удаляется.
Репликация хромосом симбиотических органелл. Хотя хромосомы симбиотических органелл ядерной клетки эволюционно происходят от бактериальных хромосом, для их репликации часто используются не бактериальные механизмы.
Например, митохондриальная ДНК (mtDNA) дрожжей реплицируется как хромосома, бактериальным тета-способом, а митохондриальная ДНК растений — как плазмида, способом катящегося кольца (см. раздел 16.4.1.2).
Пластидная ДНК (pDNA) реплицируется с помощью двух механизмов. Первый раунд репликации осуществляется тета-способом, а последующие раунды — способом катящегося кольца.
Репликация археотных хромосом. Археотные хромосомы сочетают в себе признаки бактериальных и эукариотных хромосом (см. I том учебника). С одной стороны, они кольцевые; с другой стороны, они имеют нуклеосомную структуру и содержат истинные гистоны. Что касается аппарата репликации, то у архей он радикально отличается от бактериального и проявляет разительное сходство с эукариотным.
Ориджины репликации эукариотных репликонов называются автономными репликационными последовательностями (англ. autonoinous réplication sequence, ARS), или репликаторами. Лучше всего они изучены на примере Saccharomyces cerevisiae. В гаплоидных клетках этих дрожжей 300-400 локусов ARS распределяются между 16 хромосомами.
В состав каждого локуса ARS входят консервативные последовательности двух типов — элементы А, или ACS (сокр. англ. ARS consensus sequence) и элементы В1-ВЗ.
Роль инициатора выполняет ориджин-распознающий комплекс (англ. origin récognition complex, ORC). Он состоит из шести белковых субъединиц Огс1-6 (120-50 кДа), которые связываются с репликатором в локусах А и В1, расходуя на это энергию гидролиза АТФ. В состав пререпликативного комплекса дополнительно входят белки Cdc6 и Мсm2-7.
Эукариотный белковый комлекс ORC, так же, как и бактериальный инициаторный белок DnaA, активируется кислыми фосфолипидами.
Репликатор(ы) и инициаторы. Напомним, что у бактерий «транс-действующий» белок (инициатор) связывается с «цис-действующей» последовательностью ДНК, или ориджином репликации оriС (репликатором). Единственный на всю хромосому AT-богатый локус оriС содержит мультикопийные сайты для связывания инициатора DnaA (DnaA-боксы). Как правило, ген dnaA соседствует с ориджином, что обеспечивает их совместное регулирование.
У архей количество ориджинов на одну хромосому может варьировать. В частности, единственная кольцевая хромосома Pyrococcus abyssii содержит ori C-подобный ориджин репликации, инициатором которого служит белок Orc1/Cdc6.
Некоторые археоты, например, метаноген Methanococcus jannashii, а также сера- зависимые термоацидофилы Sulfolobus acidocaldarius и S. solfataricus используют не один, а сразу три ориджина репликации oriCl-З. Имеющиеся в них сайты для связывания инициаторов Orc1/Cdc6-1, Orc1/Cdc6-2 и Orc1/Cdc6-3, или боксы узнавания ориджина (англ. origin récognition box, ORB) представляют собой консервативные инвертированные AT-богатые последовательности. Хотя репликация в них инициируется синхронно, они неравномерно распределяются по длине хромосомы, что приводит к асинхронной терминации репликации.
Все секвенированные геномы архей, за исключением геномов метаногенов, содержат 1-17 генов, которые гомологичны одновременно гену orc1 и гену cdc6. Продукты их экспрессии, белки Orc1/Cdc6, подобно ориджин-распознающему комплексу эукариотов ORC, принадлежат к суперсемейству ААА-АТФаз (см. раздел 16.6.1.3).
ДНК-геликаза. Напомним, что у бактерий репликативная ДНК-геликаза относится к суперсемейству ААА-АТФаз и функционирует в гомогексамерной форме. Соответствующую роль у эукариотов выполняет гетерогексамерная геликаза МСМ2-7 (сокр. англ. minichromosome maintenance complex; мутации по mcm-генам
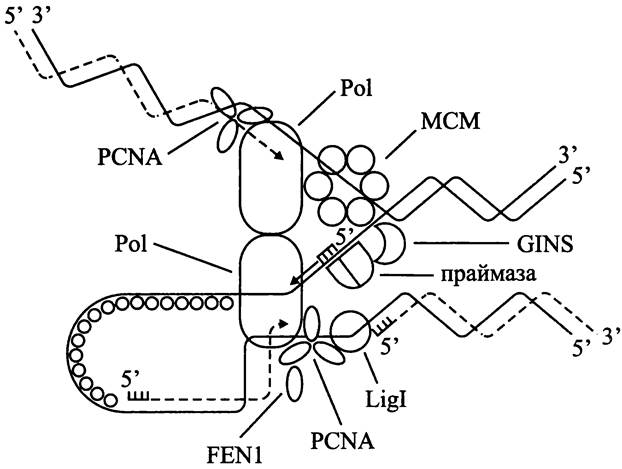
лишают дрожжей способности сохранять плазмиды с ориджином репликации и центромером). Что касается архей, то у них во всех секвенированных геномах имеется минимум один гомолог гена mcm. Продукт его экспрессии в гомогексамерной форме играет роль ДНК-гиразы (рис. 182). Каким образом происходит ее загрузка на ДНК, точно неизвестно (у бактерий этому способствуют ААА-АТФазы DnaA и DnaC). Предполагается, что, по аналогии с эукариотами, эту роль выполняет гетеротетрамер GINS (сокр. японск. go — пять, ichi — один, nii — два и san — три; впервые выявлен у дрожжей как комплекс белков SLD5, PSF1, PSF2 и PSF3). Помимо того, что GINS взаимодействует с ДНК-гиразой МСМ, находящейся на ведущей цепи, он образует мост между ней и праймазой, находящейся на отстающей цепи (рис. 182).
Puc. 182. Репликация у архей. Объяснение в тексте.
SSB-белки. Белки, связывающиеся с одиночной цепью ДНК, у архей обладают более высокой степенью гомологии с эукариотными RPA-белками, чем с бактериальными. Они существуют в виде множественных форм (RPA14, RPA32 и RPA41 в случае Pyrococcus furiosus; RPA12, RPA2 и RPA в случае Methanosacrina acetivorans и т.д.) и образуют гомо- или гетероолигомеры. Они имеют молекулярную массу ~16 кДа и составляют 2-5% суммарного растворимого белка.
Праймаза. В отличие от мономерной бактериальной праймазы DnaG, у эукариотов праймаза состоит из малой каталитической (PriS) и большой некаталитической (PriL) субъединиц. Они образуют комплекс с субъединицами Pola и В, входящими в состав ДНК-полимеразы. Археотная праймаза, как и у эукариотов, состоит из большой и малой субъединиц (рис. 182).
ДНК-полимеразы. Подобно бактериям и эукариотам, архей обладают несколькими ДНК-полимеразами, причем их набор варьирует в зависимости от филы. У
представителей филы АII Euryarchaeota, наряду с универсально распространенной В-полимеразой, которая синтезирует ведущую цепь, имеется уникальная D-полимераза, которая синтезирует отстающую цепь и состоит из субъединиц DP1 и DP2. В отличие от этого, представители филы AI Crenarchaeota лишены D-полимеразы, но обладают разными В-полимеразами, которые синтезируют отдельные цепи ДНК.
Как уже указывалось, у разных представителей архей скорость продвижения репликационной вилки значительно варьирует. Например, в случае Sulfolobus spp. она такая же, как у эукариотов (~100 н.-с-1) — на порядок медленнее, чем у Е. coli (см. выше). В то же время у Pyrobaculum abyssii она составляет (~300 н.-с-1), что соответствует промежуточному значению между темпом репликации ДНК эукариотов и бактерий.
Зажим. В случае бактериальной ДНК-полимеразы скользящий зажим из двух β-субъединиц способствует процессивности ДНК-полимеразы, не позволяя ей диссоциировать от матрицы. У эукариотов и архей эту роль выполняет гомотример PCNA (сокр. англ. proliferating cell nuclear antigen) (рис. 182). Для его загрузки на ДНК используется пентамерный белковый фактор RFC (сокр. англ. replication factor С). После своей загрузки PCNA связывается с ДНК-полимеразой и вовлекает в состав реплисомы другие белки, в частности эндонуклеазу FEN1, которая разрушает РНК-праймеры фрагментов Оказаки (сокр. англ. flap endonuclease; «избивающая» эндонуклеаза), а также ДНК-лигазу.
К сказанному следует добавить, что гистоны архей, как и гистоны эукариотов, подвергаются посттрансляционной модификации путем ацетилирования, что влияет на тесность их ассоциации с ДНК и, в свою очередь, на характер экспрессии генов.
Таким образом, аппарат репликации у архей гомологичен эукариотному, хотя он устроен проще последнего. В эволюционном плане он может представлять собой более архаичный, предковый по отношению к эукариотному, вариант.
16.4.1.2. Репликация плазмид
Чтобы сохраниться в популяции хозяина, плазмиды должны согласовывать скорость своей репликации со скоростью его размножения. Хотя некоторые плазмиды могут спонтанно пропадать из дочерних клеток, большинство из них стабильно наследуется.
Если скорость репликации плазмид окажется слишком медленной, появятся дочерние клетки, в которых их уже не будет. А поскольку воспроизводство плазмид обременительно для хозяйского метаболизма, в популяции начнут преобладать бесплазмидные особи. По этой же причине метаболической экономии для клетки обременительно избыточное накопление плазмид с опережающим темпом репликации. В итоге используется специальный механизм, который поддерживает содержание плазмид на низком и постоянном уровне. Благодаря контролю собственной репликации (в данном хозяине и при данных условиях роста) плазмиды синтезируются в определенном количестве копий.
Плазмиды бывают одно- и мультикопийными (по числу копий, приходящихся на клетку или хромосому). Факторы переноса и крупные коинтегративные плазмиды представлены 1-4 копиями; мелкие неконъюгативные плазмиды 10-30 копиями. При ослабленном контроле репликации плазмид после прекращения роста клетки они могут накапливаться в числе до 103копий.
В плазмидном репликоне имеется локус inc размером 100 -300 т. п. н. Он регулирует копийность таким образом, что скорость инициации репликации плазмид (в расчете на одну копию) обратно пропорциональна их количеству. Это типичный пример авторегуляции, или негативного ингибирования по типу обратной связи. Остальная часть репликона фактически обеспечивает только воспроизводство локуса inc.
Таким образом, за счет контроля собственной репликации плазмиды сохраняются в популяции их хозяина.
При работе с бактериями иногда нужны клоны, свободные от плазмид. Поэтому для искусственного «излечивания» от плазмид (англ. plasmid curing) применяют разные приемы, хотя встречаются «неизлечимые» плазмиды (англ. refractory plasmid). К числу «лечащих» агентов относятся красители, которые встраиваются в борозды ДНК (акридиновый оранжевый, акрифлавин, бромистый этидий, хинакрин), ингибиторы ДНК-гиразы (кумермицин, новобиоцин), ингибиторы РНК- полимераэы (рифампицин), мутагены (митомицин С) и детергенты (например, додецилсульфат). Кроме того, излечиванию способствуют повышенная температура или голодание по тимину.
Плазмиды для собственной репликации используют полимеразы хозяина и другие компоненты его репликационного комплекса. Иными словами, плазмидная реплисома имеет хозяйское происхождение.
Инициация репликации и собственно репликация кольцевых плазмид могут осуществляться с помощью одного из двух механизмов. В соответствии с условно-графической формой образующихся интермедиатов их обычно обозначают как тета- механизм (в) и сигма-механизм (а).
Тета-механизм. Он более распространен у плазмид грамотрицательных бактерий и сходен с одноименным механизмом репликации кольцевых хромосом, поскольку двойная спираль ДНК расплетается в локусе on, в результате чего образуется репликационный «глазок».
Однако, в отличие от двунаправленной репликации кольцевой хромосомы, репликация кольцевой плазмиды идет только в одном направлении, т. е. образуется только одна репликационная вилка. Кроме того, в тета-механизме участвует особый инициаторный белок, ген которого расположен в плазмиде по соседству с ориджином репликации. Наконец, плазмидные репликаторы структурно отличаются от локуса oriС (см. ниже).
Но, как уже отмечалось, при репликации плазмид используются хозяйские факторы репликации (ДНК-связывающие белки DnaA, HU и IHF, а также ДНК-геликаза DnaB, ДНК-праймаза DnaG, ДНК-гираза и ДНК-полимераза Pol III). В репликационной вилке они образуют плазмидную реплисому — мультиферментную органеллу, расположенную на экваторе клетки.
Плазмидный ориджин репликации oriV. Плазмиды, которые реплицируются с помощью тета-механизма, содержат итероны (см. ниже), или специфические некодирующие последовательности, которые взаимодействуют с инициаторным Rep-белком. Благодаря этому репликация плазмиды контролируется независимо от репликации хозяйской хромосомы.
При вегетативной репликации, когда плазмиды передаются дочерним клеткам, используется ориджин oriV (сокр. англ. vegetative). В конъюгативной репликации участвует альтернативный ориджин oriT (сокр. англ. transfer).
Роль инициатора репликации, изменяющего конформацию ДНК, что сопровождается расплавлением двойной спирали, выполняют Rep-белки. Ген гер расположен рядом с локусом oriV. Мишенью для белка Rep служат несколько итеронов (англ. iteron; от лат. iteratio — повторение и греч. ontos — сущее; «нечто повторяющееся»), или прямых повторов размером около 20 п. н. Итероны по суммарной протяженности занимают примерно половину локуса oriV. Нуклеотидные последо-
вательности итеронов в конкретной плазмиде высококонсервативны, но не идентичны. Подобно хромосомному ориджину оriС, в плазмидный ориджин оriV входят обогащенные АТ-парами прямые повторы, а также один или несколькоDnаА-боксов размером 9 т. п. н. (рис. 183).
Рис. 183. Плазмидный локус oriV и прилегающий к нему участок репликона. АТ — АТ-богатые прямые повторы; IR — инвертированные повторы; rерА — ген инициаторного белка RерА.
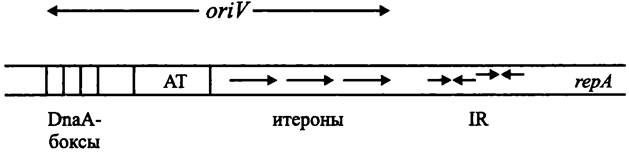
В ряде случаев локус oriV фланкирован короткими инвертированными повторами IR, которые служат операторами для генов ипициаторных белков, прежде всего для гена герА.
Инициаторные Rep-белки. Из всех представителей данного семейства наиболее охарактеризован белок RepA (26,5 кДа), служащий инициатором репликации плазмиды pPSlO фитопатогенной бактерии Pseudomonas savastanoi, а также белок RepE, инициатор репликации F-плазмиды Е. coli.
Белок RepA существует в двух формах: мономерной и димерной. Взаимный переход между ними осуществляется при помощи молекулярных шаперонов DnaJ/DnaK/GrpE, ClpA и ClpX. Мономеры белка RepA специфически связываются с итеронами и участвуют в инициации репликации совместно с хозяйскими факторами DnaA, HU и IHF (см. выше). Димеры, в свою очередь, связываются с инвертированными повторами IR.
Белок RepA связывается с итеронами, а также с IR-последовательностями в пределах одной плазмиды (cis-взаимодействие). Помимо этого, он участвует в образовании перекрестных комплексов между итеронами и IR-последовательностями, входящими в состав разных плазмид (trans- взаимодействие). Такую перекрестную связь образно называют «надеванием наручников» (англ. handcuffing). За счет нее предотвращается избыточная репликация плазмид.
Напомним, что хромосомный инициатор репликации, белок DnaA, специфически связывается с DnaA-боксами и за счет энергии АТФ изменяет конформацию ДНК, что приводит к ее расплавлению в локусе oriC.
В случае плазмид, содержащих итероны, белок DnaA играет роль коинициатора. Однако, вместо него плавление ДНК в области ориджина вызывает не-АТФазный белок RepA, который связывается с итеронами. Тем не менее, как и при репликации хромосомы, белок DnaA привлекает к участию в репликации геликазу DnaB (для дальнейшего расплетения ДНК), а также праймазу DnaG (для синтеза новой цепи ДНК на одноцепочечной матрице). Наряду с ним в этом процессе участвует белок RepA.
Сигма-механизм. Этот механизм репликации плазмид, известный еще иод названием «катящееся кольцо» (англ. rolling-circle, RC), был впервые описан в середине 1980-х гг. на примере плазмиды рТ181 Staphylococcus aureus. Первоначально плазмиды с данным механизмом репликации считались крайне редкими, хотя уже тогда было известно, что подобным же образом реплицируются фаги с одноцепочечной ss-ДНК (сокр. англ. single strand), например, колифаг 0174. В настоящее время показано, что сигма-механизм широко распространен у плазмид грамположительных бактерий (примером служат В. subtilis и S. aureus).
Напомним, что главная особенность тета-механизма состоит в том, что хромосомный или плазмидный локус ori распознается и расплетается специфическими белками. На обеих нитях синтезируются РНК-праймеры, и ДНК продолжает расплетаться перед репликационной вилкой.
В отличие от тета-механизма, главная особенность сигма-механизма состоит в том, что синтез ведущей цепи начинается в точке разрыва одной из комплементарных цепей ДНК. Репликационная вилка имеет специфическую структуру, а отстающая цепь не образуется до тех пор, пока не закончена сборка ведущей цепи. Наконец, инициаторный Rер-белок и репликаторный локус здесь иные, чем при тета-механизме. В то же время, подобно тета-механизму, сигма-механизм использует хозяйские факторы репликации — геликазу, РНК-полимеразу, ДНК-полимеразу и гиразу. Как и в других случаях прокариотной репликации, эти ферменты образуют плазмидную реплисому.
Основные шаги сигма-механизма изображены на рис. 184.
Рис. 184. Сигма-механизм репликации плазмидной хромосомы («катящееся кольцо»). Сплошные линии — старые нити ДНК; пунктиры — новые нити ДНК; черные сдвоенные овалы — активный димер белка Rep; белые сдвоенные овалы — неактивный димер белка Rep. Тyr — остаток тирозина, при помощи которого белок Rep ковалентно присоединяется к свободному 5′-концу антисмысловой (минус) нити ДНК; sso — «одноцепочечный» ориджин; dso — «двухцепочечный» ориджин; зигзагообразная стрелка — место нанесения одноцепочечного разреза в ДНК; SSB — белки, стабилизирующие одноцепочечную ДНК; Pol I и Pol III — ДНК-полимеразы; Pol — РНК-полимераза (праймаза).
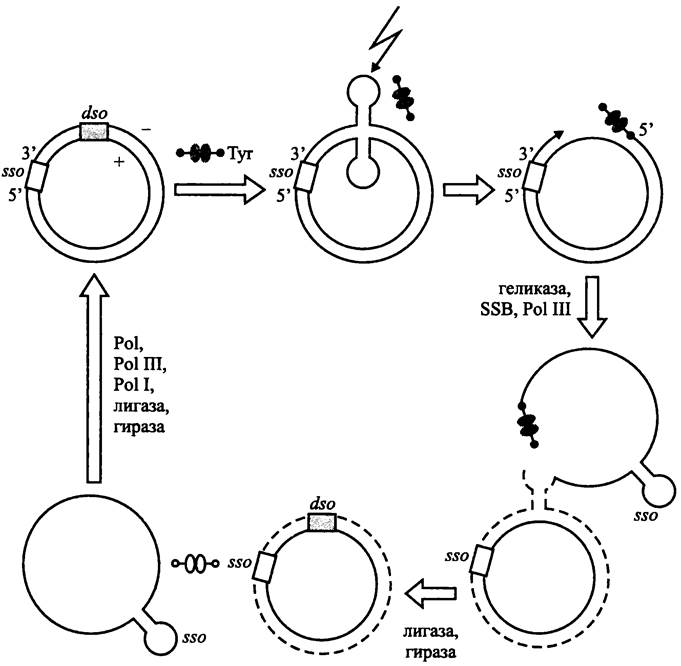
Инициаторный Rep-белок связывается с «двухцепочечным» ориджином dso (сокр. англ. double- strand origin). Помимо сайта длиной 30 нуклеотидов для связывания Rep-белка, локус dso содержит сайт для одноцепочечного разреза ДНК. Иногда (например, в плазмидах рТ181 и рС194) эти сайты примыкают друг к другу. В других случаях (например, в плазмидах рЕ194 и pLSl) их разделяет последовательность длиной 85 нуклеотидов.
В результате связывания с Rep-белком ДНК в локусе dso изгибается и образует двойную шпильку, что обнажает сайт для одноцепочечного разреза. Rep-белок наносит разрез в антисмысловой («минус») цепи ДНК и ковалентно прикрепляется к образовавшемуся 5'-концу при помощи остатка Туr, расположенного в его активном центре. Одновременно с разрезанием ДНК он привлекает в локус dso геликазу, SSB-белки (см. выше) и ДНК-полимеразу Pol III.
ДНК в точке разрыва начинает наращиваться на 3'-конце с помощью ДНК-полимеразы до тех пор, пока старая ведущая цепь полностью не вытеснится новой. Тогда Rep-белок отрезает вытесненную одноцепочечную ДНК в месте соединения старой и новой ведущих цепей (что соответствует скопированному участку разрыва). Кольцевая структура одно- и двухцепочечной ДНК восстанавливается с помощью лигазы. Одноцепочечная ДНК временно остается в релаксированной форме, а двухцепочечная ДНК суперспиралнзуется при помощи гиразы. Белок Rep освобождается и переходит в неактивную форму.
Одноцепочечная ДНК превращается в двухцепочечную ДНК за счет использования консервативного «одноцепочечного» ориджина sso (сокр. англ. single-strand origin). Число sso в плазмиде составляет от одного до трех.
РНК-полимераза Pol узнает в локусе sso свой промоторный участок и синтезирует РНК-овый праймер длиной в 17-18 нуклеотидов, а ДНК-полимераза Pol III его удлиняет. Завершает репликацию ДНК-полимераза Pol I, заращивающая одноцепочечный участок на месте, освободившемся после удаления праймера. После этого ДНК-лигаза замыкает концы новой цепи, и двухспиральная ДНК суперспирализуется с помощью гиразы.
Если белок Rep не отрезает вытесненную одноцепочечную ДНК в месте соединения старой и новой ведущей цепи, число последовательно соединенных копий материнской плазмиды может быть сколь угодно большим.
Тем не менее, в отличие от репликации фагов, при репликации плазмид продвижение репликационной вилки обычно блокируется. Такой регуляторный эффект можно объяснить взаимодействием между белком Rep и новым локусом dso, а также транскрипционным контролем за содержанием этого инициатора.
16.4.2. Взаимная изоляция сестринских репликонов
Репликоны ведут себя, как пространственно динамичные структуры.
Прежде всего, в ходе репликации бактериальные хромосомы подвергаются сложным топологическим превращениям. По мере того, как отрицательно суперспирализованный материнский дуплекс ДНК расплетается в «глазке», перед репликационной вилкой в качестве компенсации вводятся положительные супервитки. Подобные временно возникающие структурные аномалии устраняются при помощи топоизомераз, в частности топоизомеразы IIВ (ДНК-гиразы; см. ниже).
Другим проявлением постранственной динамичности бактериальных хромосом служит их взаимная изоляция. Она начинается с взаимной изоляции сцепленных колец сестринских хромосом, или декатенации. Следующий этап — это расхождение свободных сестринских хромосом к противоположным клеточным полюсам, что обычно предшествует клеточному делению.
Плазмидные репликоны тоже пространственно динамичны. Подобно хромосомам, они расходятся при делении. Кроме того, при конъюгативном переносе они векторно перемещаются между гетерологичными клетками-партнерами.
Сегрегация сестринских хромосом строго контролируется и выполняется с высокой надежностью, поскольку после окончательного смыкания септы вносить исправления будет уже поздно. Если при сегрегации хромосом совершена ошибка (а это случается со средней частотой 1 • 10-5), одна из дочерних клеток получает укороченную хромосому или оказывается вообще «безъядерной», т. е. без хромосомы.
Сегрегация низкокопийных плазмид находится под менее строгим контролем, а сегрегация многокопийных плазмид вообще происходит случайным образом.
Декатенация кольцевых сестринских хромосом. Поскольку хромосомная ДНК имеет кольцевую структуру, после завершения репликации сестринские ДНК- дуплексы представляют собой два взаимно переплетенных кольца, или катенана (лат. catena — цепь). Перед тем, как они разойдутся по дочерним клеткам, их необходимо расцепить, или декатенировать.
Декатенация осуществляется путем нанесения двухцепочечного разреза в одном из двух сцепленных колец ДНК, разведения образовавшейся линейной молекулы с неразрезанным кольцом и восстановления ее кольцевой формы.
В случае Е. coli все эти действия выполняет резольваза. Этот фермент относится к классу топоизомераз (англ. topoisomerase; от греч. topos - место; «фермент, меняющий местами»).
Топоизомеразы вызывают такие молекулярные перестройки ДНК, которые изменяют взаимное расположение ее цепей или взаимное расположение отдельных участков двойной спирали.
По механизму действия топоизомеразы подразделяются на две группы.
В первую группу входят взаимнородственные топоизомеразы типа-I А и типа-II. Они делают в молекуле ДНК временные одноцепочечные или двухцепочечные разрезы. Топоизомеразы типа- IA производят одноцепочечный разрез, через который пропускается либо одноцепочечный участок ДНК, либо ДНК-дуплекс. Топоизомеразы типа-II делают двухцепочечный разрез, через который пропускается ДНК-дуплекс. Топоизомеразы обоих типов влияют на суперспирализацию ДНК, а топоизомеразы типа-II также могут обеспечить декатенацию.
Во вторую, структурно обособленную группу, входят топоизомеразы типа-IIВ, или ДНК-гиразы (англ. gyrase; от лат. gyro — крутить). Они производят в молекуле ДНК временные одноцепочные разрезы, а затем вращают одну цепь ДНК-дуплекса относительно другой. Они влияют на суперспирализацию ДНК, но в декатенации не участвуют
Топоизомеразы, осуществляющие взаимный обмен цепями между двумя молекулами ДНК, называются рекомбиназами (англ. recombinase). Они, в свою очередь, подразделяются на обратимо действующие интеграэы (англ. integrase) и резолъвазы (от англ. résolve — распадаться на части), которые необратимо разъединяют две молекулы ДНК.
Резольваза (топоизомераза Торо IV) относится к топоизомеразам типа-II. Она представляет собой гетеродимер субъединиц РаrЕ и РаrС. Субъединица РаrЕ содержит АТФазный домен, а субъединица РаrС — домен для связывания ДНК, а также домен для разрыва и последующего лигирования ДНК.
Поскольку субъединица РаrС взаимодействует с С-концевым участком белка деления FtsK (в случае Е. coli) или его гомолога SpoIIIE (в случае В. subtilis), топоизомераза Торо IV локализуется в области кольца деления (см. раздел 17.4.2).
Устранение димеризации хромосом. В некоторых случаях в ходе репликации между сестринскими хромосомами происходит гомологическая рекомбинация. При нечетном числе рекомбинативных актов образуется кольцевой хромосомный димер, содержащий два локуса ori и два локуса ter. Образование димеров, по сути, является повреждением и несовместимо с расхождением хромосом. Их обязательно нужно разделить на мономеры, т. е. репарировать.
Для этого в локусе ter имеется сайт dif размером 28 п. н., фланкированный повторяющимися G-богатыми Rag-элементами (см. раздел 16.3.2.1). Перед разделением на мономеры dif-сайты спариваются, и в этом месте при помощи рекомбиназы XerCD (в случае Е. coli) происходит сайтспецифичная рекомбинация по типу кроссинговера. Хромосома В. subtilisсодержит гомолог сайта dif кишечной палочки, а также гены codV и ripX, гомологичные генам рекомбиназы XerCD.
При устранении димеризации хромосомы могут образовывать нежелательные катенаны. В этом случае для декатенации используется топоизомераза Торо IV (см. выше).
16.4.2.1. Расхождение сестринских хромосом
Сегрегация хромосом у бактерий осуществляется иначе, чем у эукариотов. Напомним, что у эукариотов конденсированные гомологичные хромосомы выстраиваются напротив друг друга в метафазной пластинке, а затем растаскиваются за центромеры по митотическому веретену к полярно расположенным центриолям (см. раздел 16.1).
Существует ли у бактерий функциональный аналог митотического аппарата? Иными словами, используют ли они для сегрегации сестринских хромосом:
— центромеры и теломеры;
— молекулярный мотор типа кинезинового;
— направляющие структуры, сходные с митотическим веретеном;
— индикаторы окончательного расположения хромосом, на манер центриолей.
При ответах на поставленные вопросы следует учитывать два крайне важных обстоятельства. Во-первых, бактериальные хромосомы сегрегируются одновременно с их репликацией и конденсацией, т. е. прокариотный митотический аппарат (если таковой существует) должен принципиально отличаться от эукариотного. Во-вторых, бактерии могут обходиться и без митотического аппарата, поскольку при расхождении сестринских хромосом им нужно преодолеть очень короткое расстояние.
В настоящее время у ряда бактерий выявлен аналог эукариотного центромера. В частности, в хромосомах В. subtilis и С. crescentus он расположен по соседству с локусом ori. В то же время на хромосоме Е. coli аналог центромера отсутствует или имеет другое строение и иную локализацию.
Установлено, что в случае Е. coli ориджин репликации не является тем сайтом, который первым перемещается к полюсу. В данном случае направление движения задает последовательность migS (25 п. н.), расположенная по соседству с локусом oriC.
Независимо от присутствия или отсутствия центромера пререпликативный ориджин, как правило, находится на экваторе, и дуплицированные ориджины направляются к клеточным полюсам (рис. 181). Отсюда следует вывод, что у бактерий имеется некий механизм для заякоривания и ориентированного перемещения сестринских хромосом.
По современным данным, разные бактерии по-своему решают эту проблему. Одни виды обладают аналогами кинезинового мотора и митотического веретена, тогда как у других они отсутствуют.
На роль бактериальных аналогов эукариотного митотического аппарата предлагаются несколько систем — ParAB, MinCDE/SeqA, MreB/Mbl, FtsK/SpoIIIE и RacA/DivIVA/Spo0J.
Система ParAB. Гены, кодирующие компоненты этой системы взаимной изоляции репликонов, были первоначально обнаружены в низкокопийных плазмидах, в частности F и Р1 (см. ниже). Позднее оказалось, что гомологи плазмидных раг- генов имеются в хромосомном геноме многих бактерий, например, гены parАВС (в случае С. crescentus) и гены soj/spo0J/parS (в случае В. subtilis). В то же время у энтеробактерий, в том числе Е. coli, гомологи par-генов отсутствуют.
Показано, что белок РагА, кодируемый плазмидой, образует спиральные фила- менты по продольной оси клетки. В свою очередь, его хромосомный гомолог, белок Soj В. subtilis,участвует в транспортировке сестринских хромосом к противоположным клеточным полюсам при вегетативном размножении, а также при образовании эндоспоры (см. ниже).
Показано также, что белок РагВ, кодируемый плазмидой, связывается с плазмидным аналогом центромера — нуклеотидной последовательностью, которая содержит итероны (см. раздел 16.4.1.2). В свою очередь, его хромосомный гомолог, белок Spo0J В. subtilis связывается с хромосомными сайтами parS.
Считается, что система РаrАВ не играет решающей роли при расхождении хромосом. Она не является полной альтернативой митотического аппарата, а лишь ассистирует в этом процессе. И, действительно, отсутствие системы РаrАВ не препятствует нормальному размножению бактерий, за исключением С. crescentus, где она совершенно необходима.
Система MinCDE/SeqA. Участие этих белков в расхождении хромосом допускается для Е. coli, у которой, как уже отмечалось, отсутствует система РаrАВ. Показано, что белок MinD, компонент регуляторной системы клеточного деления MinCDE (см. раздел 17.4.1), образует спиральные микрофиламенты, которые служат треками-направляющими для сестринских ориджинов. Другим претендентом на роль треков являются агрегаты белка SeqA, который связывается с полуметилированной ДНК в сайтах GATC, не допуская преждевременной реинициации репликации под воздействием белка DnaA (см. раздел 16.4.1.1).
Система МrеВ/МЫ. Актиноподобный белок МrеВ обладает моторной АТФазной активностью и образует спиральные филаменты, от присутствия которых зависит «несферическая» форма клетки (см. I том учебника и раздел 17.3.1 настоящего тома). Показано, что филаменты белка МrеВ (в случае Е. coli) или его функциональных эквивалентов МrеВ/МЫ (в случае В. subtilis) колокализуются с интегральным мембранным белком SetB, а он тоже способен объединяться в протяженные спиральные агрегаты. Мембранная спираль белка SetBзаякоривает цитоплазматическую спираль белка МrеВ, по которой сестринские хромосомы перемещаются к клеточным полюсам.
Система FtsK/SpoIIIE. Моторная АТФаза FtsK жизненно необходима для вегетативных клеток Е. coli, поскольку этот белок эвакуирует терминальные участки сестринских хромосом из области, где замыкается септа. Это предотвращает их «гильотинирование».
Аналогичную задачу для В. subtilis, но уже при дифференциации эндоспоры, решает белок SpoIIIE (см. ниже).
Система RacA/DivIVA/SpoOJ. Она используется в спорообразовании (см. раздел 17.5.2.2). В данном случае поведение сестринских хромосом в корне отличается от их поведения при вегетативном росте.
На раннем этапе спорообразования В. subtilis (рис. 185) сестринские хроматиновые структуры, вместо того чтобы компактно занять позиции на 1/4 и 3/4 длины продольной оси клетки, изменяют свою конформацию и протягиваются от одного полюса до другого, образуя общую аксиальную нить (англ. axial filament). При этом каждая хромосома занимает свою половину клетки. Участок хромосомы (~30%), ближайший к локусу oriC, образует полярный домен, заякоренный на клеточном полюсе.
Рис. 185. Поведение сестринских хромосом В. subtilis при спорообразовании.
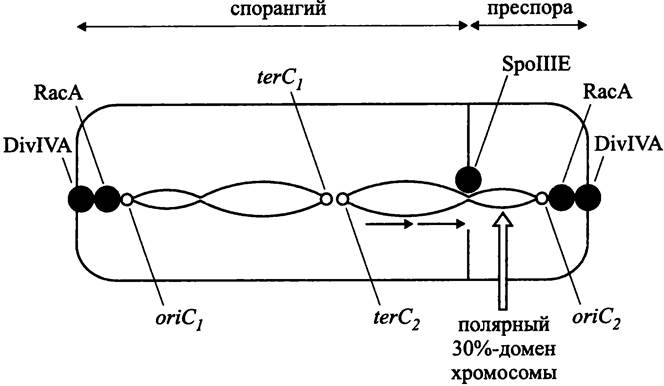
Главная роль в образовании полярного домена принадлежит ДНК-связывающему белку Spo0J (сокр. англ. sporulation; нулевая стадия; продукт гена j), который является гомологом белка РагВ. Он присоединяется к 8 из 10 хромосомных сайтов parS на отрезке хромосомы протяженностью 800 т. п. н. и собирает их в компактную группу. В образовании полярного домена дополнительно участвует ДНК-связывающий белок Soj (сокр. англ. sporulation; нулевая стадия; продукт α-аллели гена j), гомолог белка РагА. Эта роль для него не главная; прежде всего, он является репрессором транскрипции и негативно регулирует процесс спорообразования.
Продолговатую форму нуклеоиду, который состоит из двух сестринских хромосом, придает белок RacA (сокр. англ. remodelling and anchoring of the chromosome). Кроме того, на основе белка RacA формируется бактериальный аналог эукариотного кинетохора, который взаимодействует с аналогом центромера, расположенным по соседству с локусом oriC.Одновременно с этим белок RacA связывается с белком DivIVA (сокр. англ. division — деление), который выступает в роли аналога центриолей, скапливается на клеточных полюсах и заякоривает там ориджины.
При спорообразовании симметрично закладываются два Z-кольца: одно — на 1/4, другое — на 3/4 длины продольной оси клетки. Этот процесс контролируется системой MinCDE, которая определяет выбор сайта деления при вегетативном росте (см. раздел 17.4.1). Затем из двух первоначально заложенных Z-колец (произвольно, но под контролем белка SpoIIAA) выбирается одно. Это кольцо продолжает формироваться, а другое разбирается. В итоге септа образуется в субполярной области, изолируя два неравноценных по объему компартмента — клетку более крупного размера и меньшую клетку, преспору (рис. 185).
Одна из хромосомных копий транспортируется в преспору «ориджином вперед» через отверстие в септе. Но поскольку септа расположена асимметрично, преспора захватывает только полярный домен, ближайший к локусу огiС. Остальные 70% хромосомы позже переносятся из материнской клетки при помощи транслоказы SpoIIIE, расположенной на переднем краю еще не замкнутой септы.
Таким образом, до полного переноса в преспору хромосома асимметрично компартментализована. Гены, удаленные от ориджина (в том числе, ингибитор развития преспоры SpoIIAB), находятся вне преспоры, но зато в материнской клетке они присутствуют сразу в двух копиях.
Расхождение бактериальных хромосом в отсутствии аналогов митотического аппарата. Данная модель, получившая образное название «выталкивание- захват» (англ. extrusion-capture), была предложена в 2001 г. Лимоном (К. Р. Lemon) и Гросменом (A. D. Grossman). В соответствии с ней, противоположно направленная миграция сестринских хромосом и фиксация ориджинов в полярных областях происходят без участия кинематического устройства, будучи прямым следствием репликации ДНК.
Двигательным импульсом для расхождения хромосом служит удлинение двойной спирали ДНК и торсионная энергия ее негативной суперепирализации. Репликационные вилки ориентируются таким образом, что продукты репликации выталкиваются к противоположным клеточным полюсам. В данном случае ориджин или близлежащие сайты играют роль центромера и содержат информацию о местах, которые займут расходящиеся сестринские хромосомы.
Важная роль в этой модели отводится компактизации ДНК с помощью ДНК- связывающих белков из суперсемейства SMC. В случае Е. coli роль компактизующего белка, или конденсина выполняет SMC-белок MukB (сокр. японск. mukaku — плод без косточки; в данном случае — безъядерная клетка; при мутации по гену muкВ нормальный процесс расхождения хромосом, нарушается, и одна из дочерних клеток остается без хромосомы).
SМС-конденсины образуют V-образные димеры, которые, как щипцами, захватывают ДНК. Они связываются с взаимно удаленными участками двойной спирали, стягивая их вместе (см. 1 том учебника).
При репликации конденсация сестринских хромосом происходит по обе стороны реплисомы, и они изолируются друг от друга.
Особая роль в таргетинге локусов оп приписывается трансляции мембранных белков на фоне еще не завершенной репликации хромосомы. Сестринские хромосомы заякориваются на мембране благодаря образованию четвертичного комплекса ДНК: РНК-полимераза: мРНК: белок. Заметим, что РНК-полимераза является самым мощным из всех известных молекулярных моторов. Она тянет на себя матрицу ДНК с силой ~3 • 10-11 Н. Для сравнения, тянущая сила молекулы миозина на порядок меньше (~6 • 10-12 Н).
Таким образом, случайная диффузия ДНК ограничивается трансерцией (англ. transertion), т. е. котранскрипционной трансляцией и транслокацией мембранных белков.
Особенности репликационного аппарата и расхождения сестринских хромосом у бактерий с диморфным клеточным циклом (на примере Caulobacter crescentus). Согласно модели «фабрика», которая подтверждена для В. subtilis (см. выше), перед началом репликации ориджин занимает экваториальное положение. Сразу же после инициации репликации копии ориджинов мигрируют к противоположным полюсам материнской клетки. Когда в дочерних клетках, в свою очередь, инициируется репликация хромосом, их ориджины вновь занимают экваториальное положение и т. д.
Существует исключение из этого правила — у стебельковой простекобактерии Caulobacter crescentus ориджин всегда находится на клеточном полюсе.
С. crescentus обладает диморфным клеточным циклом (к этому вопросу мы еще вернемся в разделе 17.1). Сидячая, или прикрепленная к субстрату стебельковая особь выполняет роль стволовой клетки. При ее делении образуются две не эквивалентные дочерние клетки — способная к репликации («репликативная») новая стебельковая клетка и неспособная к репликации («нерепликативная») подвижная клетка-швермер с полярным жгутиком (рис. 186, е). Когда швермер дифференцируется, он сбрасывает жгутик, на месте которого образуется стебелек. Одновременно с этим разрушаются хеморецепторы, бесполезные при сидячем образе жизни.
Рис. 186. Репликация хромосомы в ходе диморфного клеточного цикла Caulobacter crescentus. а — нерепликативная клетка-швермер; б — инициация репликации, с помощью, полярно расположенной реплисомы; в — репликативная стебельковая клетка с реплисомой, смещенной на экватор; г — расхождение сестринских хромосом к противоположным полюсам стебельковой клетки; д — образование нового терминуса и разборка реплисомы; е — неэквивалентное деление.
Белый кружок — ориджин репликации (Согi); черный кружок — терминус репликации (ter); серые кружки — реплисомы; CtrA - белок-репрессор репликации.
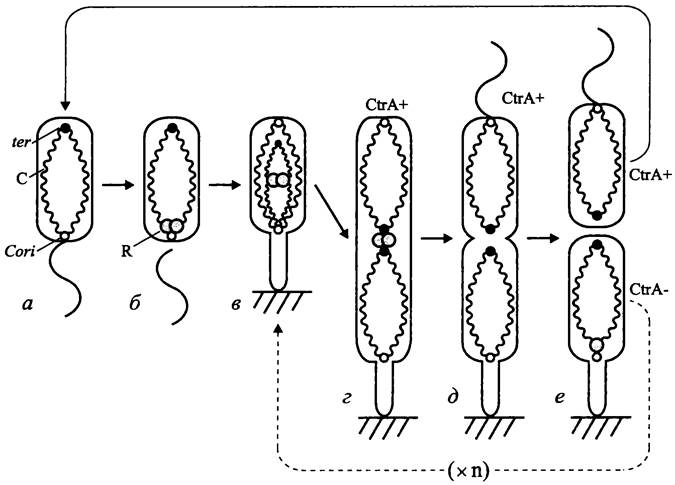
В швермере ориджин репликации Соri находится на том же полюсе, что и жгутик, а терминус ter расположен у противоположного полюса (рис. 186, а). При инициации репликации ориджин сохраняет свое положение, и реплисома формируется не на экваторе, как в случае В. subtilis, а на том полюсе, где прежде находился жгутик (рис. 186, б). Новый ориджин направляется к противоположному полюсу. ДНК по мере репликации скапливается сперва на том полюсе, где образовался стебелек. В результате этого реплисома оттесняется на середину клетки в будущую плоскость деления (рис. 186, в). Теперь ДНК, выходящая из реплисомы, направляется к разным полюсам (рис. 186, г). После образования нового терминуса реплисома разбирается (рис. 186, д), и клетка неэквивалентно делится (рис. 186, е).
Когда швермер превращается в стебельковую клетку, в нем избирательно деградирует регуляторный белок CtrA. В случае С. crescentus он выполняет две функции — глобального транскрипционного фактора и избирательного репрессора репликации.
Белок CtrA влияет на уровень транскрипции ~25% генов. В частности, он позитивно регулирует жгутиковые опероны, оперон хемотаксиса и гены биосинтеза фимбрий, а также контролирует биогенез клеточной стенки и цитокинез.
В случае С. crescentus белок CtrA является промежуточным звеном между комплексом событий клеточного цикла и репликацией хромосомы. Точнее сказать, он служит конечным адресатом сигнала, поступающего из окружающей среды через двухкомпонентную сигнальную систему (см. раздел 18.1.1.3).
Превращение неактивного белка CtrA в активную фосфорилированную форму CtrA~P происходит при помощи гистидинкиназы СcкА, которая фосфорилирует его по консервативному остатку Asp51.
Другая особенность репликации хромосомы С. crescentus состоит в уникальном строении ориджина СогiС. Как и у типового ориджина (см. выше), в нем имеется сайт для связывания инициаторного белка DnaA, сайт для связывания «изгибающего» белка IHF, а также «легкоплавкий» АТ-богатый сайт. Однако, в отличие от типового ориджина, в локусе СогiСотсутствует кластер DnaA-боксов, а имеется только один DnaA-бокс. Кроме того, АТ-богатый сайт размером 40 п. н. не содержит повторов, хотя в нем есть участок, гомологичный АТ-богатому 13-меру Е. coli. Наконец, в локусе CoriC присутствует сайт для связывания белка CtrA.
Особенности репликационного аппарата и расхождения сестринских хромосом у бактерий с мультипартитным геномом (на примере Vibrio cholerae). До этого мы рассматривали сегрегацию сестринских хромосом только у бактерий с унипартитным геномом, который содержится в единственной (иногда многокопийной) хромосоме.
Помимо бактерий с унипартитным геномом существуют бактерии с мультипартитным геномом, распределенным между разными хромосомами. Характерным примером является энтеропатоген V. cholerae, имеющий две кольцевые хромосомы — x1-хромосому (2,96 млн. п. н.) и x2-хромосому (1,07 млн. п. н.). Насколько специфичны процессы их репликации и сегрегации?
Согласно данным секвенирования мультипартитных геномов, доминирующая и вторичная хромосомы содержат разные ориджины репликации. В первом случае ориджин принадлежит к Con-типу, типичному для С. crescentus (см. выше), и инициатором репликации является белок DnaA. Во втором случае ориджин относится к RepABC-типу, который характерен для некоторых плазмид (см. раздел 16.4.1.2), и инициатором репликации служит белок RepC. Благодаря этому две разные хромосомы при инициации репликации не конкурируют друг с другом, что делает их взаимно совместимыми.
Методом флуоресцентной гибридизации in situ (англ. fluorescence in situ hybridization, FISH) установлено, что в молодых клетках ориджин репликации доминирующей хромосомы (oriCIvc) находится на одном из полюсов, а ориджин репликации вторичной хромосомы (oriCIIvc) расположен на экваторе. В ходе репликации две копии ориджина oriCIvc ределяются асимметрично — одна остается на полюсе, а другая перемещается через всю клетку к противоположному полюсу. В свою очередь, две копии ориджина огiСНvс симметрично расходятся от экватора и занимают положения на 1/4 и 3/4 длины продольной оси клетки (рис. 187).
Рис. 187. Расхождение копий двух разных хромосом Vibrio cholerae.
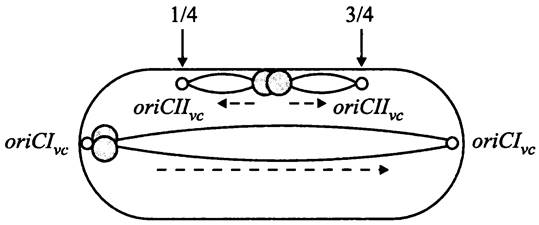
Асимметричная сегрегация ориджина оriСIvс напоминает только что рассмотренную нами картину расхождения сестринских хромосом С. crescentus. В свою очередь, симметричная сегрегация ориджина oriCIIvc характерна для низкокопийных плазмид, например, R1, F и Р1 (см. ниже).
Репликация хромосом x1 и х2 инициируется синхронно и только один раз в ходе клеточного цикла, т. е. она контролируется общим глобальным регулятором. Поскольку хромосома x2меньше хромосомы x1, ее репликация заканчивается несколько раньше.
Механизм независимой сегрегации сестринских копий хромосом x1 и x2 еще не установлен (возможно, для этого используется не один, а разные механизмы). Тем не менее, ясно, что при репликации хромосом x1 и x2 образуются две реплисомы: одна экваториальная, другая субполярная.
Недавно выяснилось, что сегрегация ориджина oriCIvc зависит от продукта гена parA1, тогда как в сегрегации ориджина oriCIIvc принимают участие продукты генов parAB2. При этом par-гены хромосомы x1 гомологичны хромосомным раr-генам других бактерий, а раr-гены хромосомы x2 гомологичны плазмидным раr-генам.
Все это укладывается в гипотезу о мегаплазмидном происхождении вторичных бактериальных хромосом (см. раздел 16.1.1).
Необратимость процесса расхождения сестринских хромосом у бактерий. Почему ДНК, распределенная по полюсам, не возвращается на экватор? Каким образом локусы оriСфиксируются в позициях, соответствующих 1/4 и 3/4 длины продольной оси материнской клетки, так что после деления они попадают в дочерние клетки?
Ответы на данные вопросы еще не получены. Возможно, что в качестве факторов, обеспечивающих заякоривание ориджинов на мембране, выступают белок РагВ (в случае С. crescentus) или белковый комплекс РагВ/Spo0J/Rac (в случае В. subtilis).
Расхождение сестринских хромосом у архей. Согласно немногочисленным данным, расхождение сестринских хромосом у представителей филы АI Crenarchaeota и у представителей филы АII Euryarchaeota происходит по-разному.
У кренархеотов, в частности Sulfolobus sр., вслед за репликацией хромосомы наблюдается период задержки, который напоминает фазу G2 митотического цикла эукариотной клетки (см. табл. 29). В течение этого периода сестринские хромосомы конденсируются и располагаются друг против друга в центре клетки, что напоминает метафазу. Роль аналога эукариотного центромера, наличие которого окончательно не доказано, могут выполнять короткие повторы, аналогичные центромерным повторам. В случае S. acidocaldarius такие повторы специфически связывают белок молекулярной массой 17,5 кДа, который, возможно, играет роль аналога нитей митотического веретена. Для устранения хромосомной ДНК с пути замыкающейся септы, по-видимому, используется «моторная» АТФаза НеrА, гомолог бактериального белка FtsK (напомним, что у бактерий эту роль выполняют белки FtsK/SpoIIIE). Таким образом, система расхождения сестринских хромосом у кренархеотов в одном сходна с митотическим аппаратом эукариотной клетки, а в другом — с типично бактериальным механизмом.
Что касается эвриархеотов, в частности Меthanothermobacter sр., то здесь сегрегация сестринских хромосом происходит, как у бактерий — одновременно с репликацией ДНК.
16.4.2.2. Расхождение сестринских плазмид
Существуют два способа сегрегации плазмидных копий между дочерними клетками — контролируемое расхождение с помощью Par-системы и случайное распределение.
Контролируемое расхождение плазмид с помощью Par-системы. Ранее мы уже упоминали базовый репликон плазмиды, состоящий из ориджина репликации, а также из генов rep, inc и сор, которые контролируют несовместимость и копийность (см. раздел 16.1.2).
Ахиллесова пята низкокопийных плазмид состоит в том, что при делении хозяйской клетки их устойчивое наследование не гарантировано. Поэтому помимо базового репликона они содержат так называемую сегрегационную кассету (англ. partition cassette). Она отвечает за то, чтобы каждая дочерняя клетка получила не менее одной плазмидной копии. В состав сегрегационной кассеты входят два структурных гена и аналог центромера, или cis-действующий сайт (см. ниже).
Хронология расхождения плазмид отличается от хронологии расхождения хромосом. В то время как хромосомы начинают расходиться сразу после копирования локуса ori, расхождение плазмид задерживается до момента завершения репликации центромерного сайта (см. ниже).
Контролируемое расхождение плазмид не зависит от хозяйских факторов и протекает независимо от клеточного цикла.
В основе механизма контролируемого расхождения плазмид лежит Раr-система (сокр. англ. partitioning — разделение). Она аналогична митотическому аппарату эукариотов и переносит плазмидные копии на концы подготовленной к делению материнской клетки.
С помощью Par-системы сегрегируются низкокопийные плазмиды, например, R1, F и Р1.
Компонентами Par-системы являются:
— сайт, аналогичный центромеру;
— аналог теломерного белка, который связывается с сайтом-аналогом центромера;
— моторная АТФаза.
Во всех известных сегрегационных кассетах ген моторной АТФазы транскрибируется раньше гена теломерного белка.
Роль аналога центромера выполняет сайт рагС (сокр. англ. centromere-like; в плазмиде R1), сайт sopС (в плазмиде F) или сайт parS (в плазмиде Р1).
Функцию аналога теломерного белка в случае плазмиды R1 выполняет белок ParR (сокр. англ. repressor; связывается с промотором внутри сайта parС и регулирует свою собственную транскрипцию). В случае плазмиды F эту функцию выполняет белок SopB, в случае плазмиды Р1 — белок РагВ.
В качестве моторной АТФазы используется белок РагМ (сокр. англ. motor; в случае плазмиды R1), белок SopA (в случае плазмиды F) или белок ParА (в случае плазмиды Р1). Показано, что белок РаrМ образует филаменты, которые ориентируются вдоль продольной оси клетки и растаскивают сестринские плазмиды к противоположным полюсам. Белок РаrМ гомологичен актину, а его предполагаемым эволюционным предшественником является морфоскелетный белок МrеВ (см. I том учебника).
Интересно, что в то время как митотическое веретено эукариотов образуется из тубулиновых микротрубочек, кольцо деления состоит из актиновых микрофиламентов. У прокариотов наблюдается обратная картина разделения труда: материалом для аналога митотического веретена служит актиноподобный белок, а кольцо деления состоит из гомолога тубулина (см. раздел 17.4).
Реплицированные сайты раrС спариваются друг с другом при помощи белка ParR. Образовавшийся сегрегационный комплекс (англ. partitioning complex) служит затравкой для самосборки белка РаrМ в протофиламенты. В сайте раrС находятся десять прямых повторов для связывания белка РаrМ (который синтезируется в количестве ~1,5 • 104 молекул на клетку), что позволяет полимеризовать сразу несколько протофиламентов.
Пучки протофиламентов образуют два столбообразных тяжа, по одному на каждую сестринскую плазмиду.
Сестринские плазмиды оттесняются к клеточным полюсам за счет полимеризации АТФ-связанной формы белка РаrМ на затравочных концах протофиламентов. На противоположных, не затравочных концах протофиламентов АТФ гидролизуется, и полимеры белка РаrМ разбираются на субъединицы (рис. 188). Отметим, что такой способ пространственного перемещения плазмид напоминает актинзависимую подвижность внутриклеточных паразитов Listeria monocytogenes, Shigella flexneri и Rickettsia spp. (см. 1 том учебника).
Рис. 188. Расхождение сестринских плазмид при помощи Раr-системы. 1 — реплисома; 2 — сегрегационный комплекс; 3 и 3' — сестринские плазмиды; 4 — РаrМ- АДФ; 5 - РаrМ-АТФ.
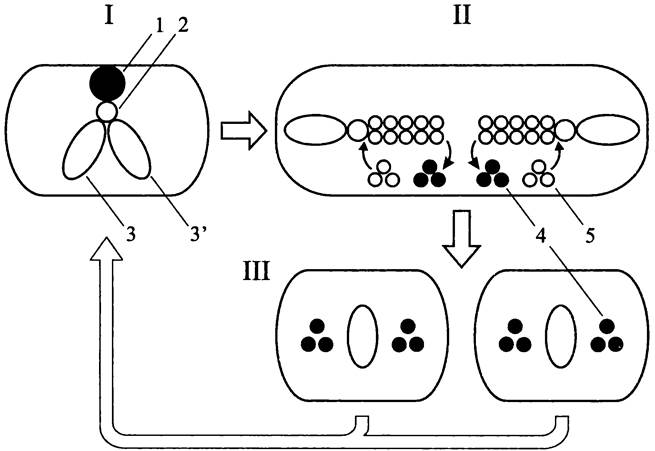
Расходящиеся сестринские плазмиды занимают позиции, соответственно, на 1 /4 и 3/4 длины продольной оси материнской клетки. Поэтому по завершении цитокинеза они оказываются в экваториальных областях. В других случаях они размещаются вблизи старых клеточных полюсов. Многокопийные плазмиды образуют мультимерные, неслучайным образом расположенные группы-кластеры, из которых с целью репликации извлекаются отдельные копии.
Случайное распределение плазмид. Раr+-плазмиды, которые содержат сегрегационную кассету, перед контролируемым расхождением образуют пары на экваторе. Поскольку Раr--плазмиды лишены сегрегационной кассеты, они случайным образом диффундируют в разные стороны или в одном и том же направлении. По этой причине базовый репликон Par--плазмид не способен стабильно поддерживаться в хозяйской популяции. В результате, часть бактериальных клеток «излечивается» от присутствия таких плазмид.