МИКРОБИОЛОГИЯ БИОЛОГИЯ ПРОКАРИОТОВ ТОМ III - А. В. ПИНЕВИЧ - 2009
ГЛАВА 16. ЦИТОГЕНЕТИКА
16.6. Изменения генома
Постоянство прокариотных геномов не абсолютно. Время от времени они подвергаются эндогенным перестройкам и экзогенным рекомбинациям (см. ниже). Эти изменения носят наследственный характер и составляют полезный ресурс адаптивной эволюции.
По мере накопления наследственных изменений потомки не только генетически дистанцируются от своих предков, но и взаимно дивергируют. В итоге образуются две перекрывающиеся сферы биоразнообразия прокариотов — актуалистическая и виртуальная. Первая сфера представлена (не)культивируемыми объектами; их изучают при помощи многофакторного анализа (см. I том учебника). Вторая сфера состоит из фантомных объектов, которых исследуют традиционными методами молекулярной геномики, а также с помощью аналитического аппарата новой дисциплины — метагеномики (см. раздел 16.6.3 настоящего тома).
Наряду с наследственными изменениями у бактерий возможны ненаследуемые внутригеномные перестройки. Однако они происходят только у некоторых типов терминально дифференцированных клеток (см. раздел 16.6.2). Хотя такие изменения также имеют адаптивный характер, в эволюции генома они не участвуют.
16.6.1. Наследственные изменения
При размножении прокариотов, которое обычно происходит путем бинарного деления, материнская клетка передает свои генетические детерминанты дочерним клеткам. Возможность, воспроизводимость и полноценность передачи эстафеты генотипа гарантируются матричным копированием ДНК, а также эффективностью «работы над ошибками», возникающими в ходе этого процесса (см. разделы 16.4 и 16.5).
Поскольку механизмы репликации и репарации действуют с высокой надежностью, прокариоты в полной мере обладают свойством, присущим любому живому существу — консерватизмом наследственности, что, впрочем, не препятствует наследственной изменчивости.
У прокариотов существуют два пути преодоления консерватизма наследственности и, соответственно, два типа наследственных изменений генома.
Те из них, которые происходят в процессе клонального размножения и сопровождаются изменениями фенотипа, относятся к мутациям (генным и хромосомным).
Независимо от мутагенеза существует другой механизм, также обеспечивающий наследственную изменчивость. Он связан с генетической рекомбинацией между клетками, происходящими из разных клональных популяций, и называется горизонтальным, или латеральным переносом генов (см. разделы 16.6.1.2 и 16.6.1.3).
Спонтанные мутации создают новые аллели, а генетическая рекомбинация — новые сочетания уже существующих аллелей. Таким образом, мутации могут распространяться в микробных популяциях двумя путями: благодаря вертикальному наследованию и за счет горизонтального переноса.
Возникновение и поддержание разнообразия жизненных форм служит одним из условий существования биосферы, и поэтому механизмы мутагенеза и генетической рекомбинации подвергались позитивной селекции на всем протяжении органической эволюции.
16.6.1.1. Мутации
Системы репликации и репарации несовершенны и постоянно ошибаются, в результате чего возникают наследственные различия между представителями одной и той же генеалогической линии. Такие различия, касающиеся структуры нуклеотидной последовательности и/или количества ДНК, называются мутациями (англ. mutation; от лат. mutatio — изменение вообще; в данном случае — изменение генома), а их возникновение — мутагенезом (англ. mutagenesis) или мутированием (англ. mutability).
Термины «мутация» и «мутагенез» часто используются как синонимы, хотя, строго говоря, они не равнозначны.
Применительно к прокариотной клетке мутацией называется нерекомбинативное необратимое изменение информационных свойств хромосомы, плазмиды или умеренного фага. Точнее сказать, мутация представляет собой изменение кодирующей или регуляторной последовательности в пределах одной группы сцепления, либо изменение набора/числа групп сцепления. В первом случае это cis-мутация, во втором случае — trans-мутация.
Классификация мутаций. Поскольку единой общепризнанной классификации мутаций не существует, мы приведем один из возможных вариантов.
По общему характеру вызвавших их причин мутации подразделяются на две группы:
— спонтанные;
— индуцированные.
Спонтанные мутации служат побочным эффектом эндогенных физиологических процессов. Они происходят постоянно и, как правило, с индивидуальной частотой.
Индуцированные мутации являются результатом воздействия на наследственный аппарат тех физико-химических факторов внешней среды, которые напрямую изменяют структуру ДНК или косвенно влияют на точность репликации. Они происходят периодически, и их частота, как правило, выше частоты спонтанных мутаций.
В свою очередь, по общему характеру инфраструктурных изменений генетического материала мутации можно подразделить на две группы:
— генные мутации;
— хромосомные мутации.
Генные мутации (см. раздел 16.3.1.3) представляют собой структурные изменения генов или генетических элементов, контролирующих гены. Такие мутации вызывают изменения фенотипа через изменение структуры продуктов генной экспрессии (белка, рРНК и тРНК), или посредством изменений уровня генной экспрессии.
Хромосомные мутации изменяют набор, число и взаимное расположение генов или набор и число групп сцепления. Такие мутации влияют на комплексную фенотипическую экспрессию генов.
Вредные, нейтральные и полезные мутации. Изменения нуклеотидной последовательности ДНК при точечных мутациях, а также при мутациях со сдвигом рамки считывания (см. ниже) связаны с заменой, инсерцией или делецией одного или нескольких нуклеотидов. Такие мутации возникают случайно и распределяются более или менее равномерно по всему геному, за исключением преимущественно мутирующих «горячих» точек.
Первичным фенотипическим проявлением точечных мутаций и мутаций со сдвигом рамки считывания служит изменение аминокислотной последовательности белка. В свою очередь, структурные изменения белка приводят к разным физиологическим результатам, в зависимости от того, затрагиваются или остаются интактными ключевые сайты/домены полипептидной цепи.
Большинство мутаций, изменяющих аминокислотную последовательность, приводит к образованию функционально неполноценных белков. Такие мутации называются вредными, и они отбраковываются естественным отбором. Относительно небольшое число мутаций (на четыре-пять порядков меньше, чем вредных) приводит к образованию более эффективного белкового продукта. Такие мутации называются полезными, они подхватываются естественным отбором, и при распространении мутантной аллели в микробной популяции она, в конце концов, может закрепиться, т. е. вытеснить аллель дикого типа. Наконец, определенная часть мутаций не оказывает заметного влияния на функцию белка. Такие мутации называются нейтральными. и их закрепление может быть результатом случайного дрейфа генов.
В большинстве случаев мутации проявляются на фенотипическом уровне, и тогда речь идет о соответствующих мутантах.
В зависимости от конкретного характера структурно-функциональных изменений, по сравнению с микроорганизмом дикого типа, различают следующие группы мутантов:
— цитоморфологические;
— по клеточному делению;
— по клеточной дифференциации;
— биохимические;
— транспортные;
— метаболические;
— регуляторные;
— поведенческие;
— по экологической адаптациии;
— по симбиотическим свойствам.
Мутация, произошедшая в одном гене, может воздействовать сразу на несколько фенотипических признаков. Такие мутации называются плейотропными (греч. pleion — многочисленный и tropos — направление). Причина плейотропного эффекта генной мутации заключается в способности последней вызывать эпигенетические изменения, поскольку продукт отдельного гена может участвовать одновременно в нескольких процессах или структурах.
В частности, мутация по гену фитоиндесатуразы приводит к блокированию глобального пути биосинтеза окрашенных каротиноидов (см. II том учебника), хотя остальные ферменты данного пути остаются незатронутыми. Благодаря такой мутации изменяется не только окраска клетки, но и нарушается биогенез фотосинтетического аппарата, повышается чувствительность к окислительному стрессу и т. д.
В некоторых случаях фенотипический эффект мутации реализуется только в специфических условиях роста. Например, потеря способности к самостоятельному биосинтезу первичного метаболита или витамина из-за мутационных дефектов соответствующих ферментов приводит к тому, что рост бактерий становится возможным только на средах с этими соединениями. Такие мутанты называются ауксотрофными (греч. auхо — выращиваю и trophe — питаюсь) в отличие от клеток дикого типа, или прототрофов (греч. protos — изначальный и trophe — питаюсь), развивающихся на минимальной среде (англ. minimal medium), т. е. без ростовых добавок.
Другим примером, когда изменение фенотипа наблюдается в специфических условиях роста, служат термочувствительные мутанты (англ. thermosensitive). В данном случае мутация проявляется только при пермиссивной температуре (англ. permissive — разрешающий). Хрестоматийным примером служат fts-мутанты Е. coli, которые при супероптимальной температуре продолжают расти без деления, в результате чего клетки теряют палочковидную форму и превращаются в полиплоидные филаменты (см. раздел 17.4.2).
Закономерность спонтанных мутаций. Спонтанные мутации постоянно происходят в размножающихся популяциях бактерий. Для такого процесса наследственной изменчивости существует особое название — мутагенез, зависящий от смены поколений (англ. generation-dependent mutagenesis).
Спонтанные мутации являются движущей силой органической эволюции. Однако с какой закономерностью они происходят?
По современным представлениям, можно говорить о двух взаимно дополняющих сценариях.
С одной стороны, спонтанные мутации накапливаются в микробной популяции с относительно постоянным темпом, не зависящим от селекционного давления со стороны окружающей среды. Они случайным образом создают резерв адаптационных свойств, который становится актуальным при изменении внешних условий в (не)благоприятную сторону, т. е. при появлении соответствующего селекционного давления.
Классическое доказательство ненаправленного характера спонтанных мутаций и их неадаптивности было получено в начале 1940-х годов Сальвадором Лурия (S. Е. Luria; Нобелевская премия по физиологии и медицине, 1969 г.) и Максом Дельбрюком (М. Delbrück; Нобелевская премия по физиологии и медицине, 1969 г.).
На примере Е. coli они проанализировали частоту мутаций, вызывающих устойчивость к бактериофагу Т1. Для сравнения были взяты две культуры одинаковой плотности, но разного объема (малая и большая). Клетками из таких культур в равном количестве засевали два ряда чашек Петри с газоном бактериофага. При подсчете оказалось, что число устойчивых колоний, полученных при посеве малой культуры, было в среднем ниже, хотя и давало отдельные флуктуации, тогда как для посева клеток из большой культуры оно было в среднем выше и характеризовалось меньшей дисперсией. Отсюда следовало, что устойчивые клетки возникли еще до встречи с бактериофагом; в противном случае в обоих вариантах опыта их число не различалось бы ни по среднему количеству, ни по характеру дисперсии. В историю генетики этот тест вошел под названием «флуктуационного».
С другой стороны, могут происходить вспышки спонтанных мутаций, когда геномная нестабильность бактерий провоцируется разнообразными экологическими стрессами. В данном случае под влиянием неблагоприятных условий среды происходит мутагенез, индуцированный стрессом (англ. stress-induced mutagenesis).
За счет повышения скорости спонтанного мутирования в популяции появляются фитинг-мутанты (англ. fitter — ремонтник; в данном случае — лучше приспособленный), обладающие более высоким уровнем адаптации, чем клетки дикого типа.
Иными словами, повышение скорости мутирования становится частью популяционного ответа на стресс, вызванный низким исходным уровнем экологической адаптации. Хотя такой индуцированный мутагенез ускоряет адаптивную эволюцию, он происходит только в период стресса. Мутанты, адаптированные к новым условиям, уже не находятся в состоянии стресса и поэтому возвращаются к низкой скорости мутирования.
Спонтанные мутации. Существуют два эндогенных источника спонтанных мутаций — накопление эндометаболитов, непосредственно изменяющих структуру ДНК, и эндогенные ошибки репликации.
Химические индукторы мутаций называются мутагенами. Различают мутагены- эндометаболиты и внешние мутагены. Мутации, вызванные мутагенами-эндометаболитами, в нормальных условиях очень редки. Однако в некоторых случаях их частота увеличивается сразу на несколько порядков, например, при окислительном стрессе, когда в клетке накапливаются активные формы кислорода или азота (см. раздел 19.1.6.1).
Эндогенные ошибки репликации происходят с очень низкой частотой, порядка 10-9, поскольку репликативные ДНК-полимеразы Pol I и Pol III обладают способностью к автокоррекции (см. раздел 16.4.1.1). Тем не менее, частота эндогенных ошибок резко возрастает в условиях стресса, когда роль репликаз на время переходит к SOS-полимеразам Pol IV и Pol V (там же).
Индуцированные мутации. В разделе 16.5.1 мы уже перечислили основные физические и химические агенты, повреждающие структуру ДНК, и кратко охарактеризовали природу этих повреждений.
Напомним, что к числу физических факторов, служащих индукторами мутаций, в первую очередь относится ультрафиолетовое излучение.
Мутагены, поступающие в клетку из окружающей среды, могут вызывать два типа генных мутаций — точечные мутации, когда изменяется пара оснований, и мутации со сдвигом рамки считывания, когда происходит инсерция (т. е. вставка) или делеция (т. е. выпадение) одной или нескольких нуклеотидных пар.
При точечных мутациях (англ. point mutation) мутагены непосредственно изменяют структуру азотистых оснований или включаются в состав ДНК вместо канонических оснований. В обоих случаях это ведет к ошибке в очередном цикле репликации.
Некоторые химические соединения, которые называются супермутагенами, способны индуцировать мутации с особо высокой частотой. Ярким примером супермутагена служит N-метил-N′-нитро-N-нитрозогуанидин (англ. nitrosoguanidine, NTG). Его воздействие на ДНК связано с прямым метилированием аденина и гуанина, в результате чего образуются соответственно 7- метиладенин и 7-метилгуанин (рис. 197, А). Такие химически модифицированные основания продолжают участвовать в нормальном спаривании, т. е. их образование не вызывает ошибок при репликации. Однако они не воспринимаются как канонические основания ДНК-зависимыми РНК- полимеразами, что приводит к появлению множественных ошибок при считывании, в том числе к сдвигу рамки. Последствиями этого становятся патологические изменения фенотипа.
Точечная мутация может произойти в любой паре оснований двухцепочечной ДНК. Замена в паре оснований пурина другим пурином (GC —> AT, AT —> GC) или пиримидина другим пиримидином (CG —> ТА, ТА —> CG) называется транзицией (англ. transition). Она приводит к изменению типа спаривания. В свою очередь, замена пурина пиримидином (AT —> ТА, GC —> CG) или пиримидина пурином (ТА —> АТ, CG —> GC) называется трансверсией (англ. transversion). Она не изменяет тип спаривания, но приводит к перераспределению оснований между двумя цепями ДНК. В обоих случаях, если произошедшее изменение осталось нерепарированным, оно закрепляется в результате репликации.
Транзиция с изменением типа спаривания часто вызывается прямым превращением одного основания в другое. Характерным примером служит мутагенное воздействие азотистой кислоты, которая окислительно дезаминирует цитозин в урацил (рис. 197, Б), в результате чего GC-napa превращается в GU-napy. В следующем цикле репликации урацил спаривается уже не с гуанином, а с аденином, т. е. происходит промежуточное образование неканонической AU-иары. В очередном цикле репликации аденин спаривается с тимином, что приводит к окончательной замене исходной GC-пары на АТ-пару.
Рис. 197. Примеры мутагенов и пути их воздействия на структуру ДНК. А — превращение аденина и гуанина в метальные производные с помощью N-метил-N'- нитро-N-нитрозогуанидина (NTG); Б — дезаминирование цитозина с помощью азотистой кислоты; В — замена пары оснований в результате таутомеризации 5-бромурацила; Г — структура акридина.
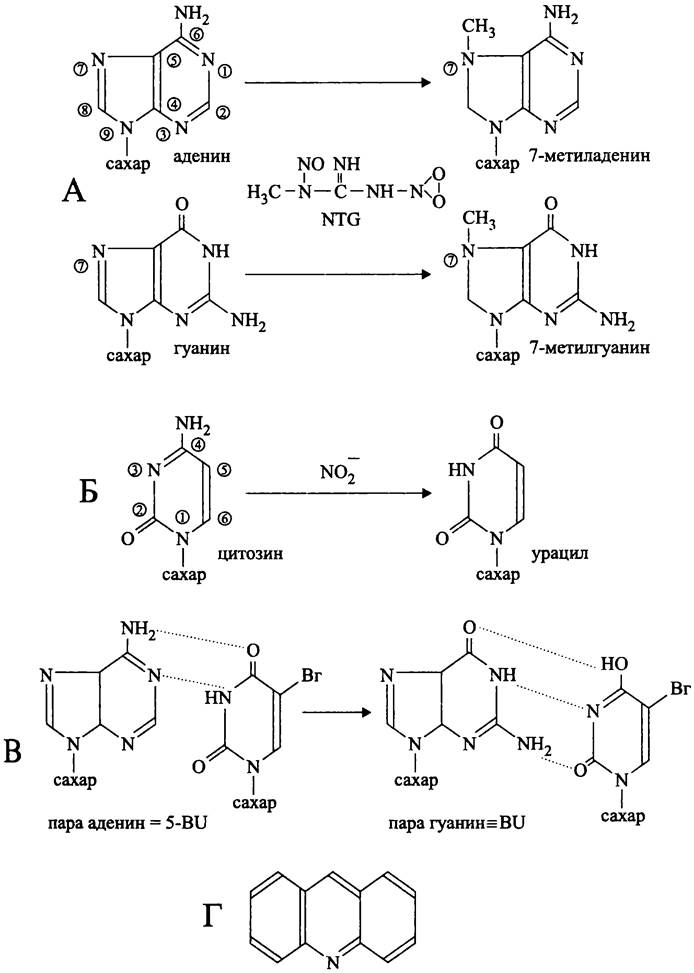
Другой причиной транзиции может стать ошибка спаривания (англ. mismatch). Поскольку некоторые мутагены являются стерическими аналогами обычных оснований, они включаются вместо них в состав ДНК. Например, кетоформа 5- бромурацила является аналогом тимина и поэтому образует пару с аденином. В результате спонтанной таутомеризации она переходит в редкую енольную форму, которая при репликации спаривается уже не с аденином, а с гуанином (рис. 197, В). После очередного цикла репликации происходит окончательная замена исходной АТ-пары на GC-napy. Иными словами, после однократного ошибочного включения 5-бромдезоксиурацила в состав полинуклеотидной цепи он будет индуцировать транзицию в каждом новом цикле репликации.
Мутации со сдвигом рамки считывания (англ. frameshift), как уже отмечалось, связаны со вставкой или делецией одного, или нескольких нуклеотидов, что нарушает порядок взаимного расположения кодирующих триплетов.
Такое структурное изменение часто затрагивает последовательность, состоящую из одинаковых оснований (например, АААА). Предполагается, что в результате одноцепочечного разрыва ДНК локально денатурируется («плавится»), и в ней образуется одноцепочечная петля. При воссоединении («отжиге») цепей происходит случайное смещение фазы спаривания на один или несколько нуклеотидов. Образовавшаяся брешь и одноцепочечный разрыв репарируются с помощью ДНК-полимеразы Pol I и ДНК-лигазы. Фиксация положения ошибочно реассоциированного участка осуществляется в ходе репликации, что приводит к сдвигу рамки считывания.
Еще одной причиной мутаций со сдвигом рамки считывания служат некоторые мутагены, в частности из группы акридина (рис. 197, Г). Молекулы акридина и его
производных, например, акрифлавина, являются структурными аналогами пуриновых оснований. Они интеркалируют (т. е. встраиваются) между соседними парами оснований в малой борозде ДНК, в результате чего при образовании репликационной вилки в одной из цепей имитируется дополнительное основание. При копировании такой цепи в результате ошибочного спаривания с акридином в дочернюю цепь включается дополнительное основание. Акридины могут индуцировать не только одиночные инсерции, но и одиночные делеции.
Мутации со сдвигом рамки считывания происходят в несколько раз чаще, чем мутации с заменой основания (соответственно 80% и 20%).
Исключением служат спонтанные мутации по горячим точкам (англ. hot spot mutation). Данным термином обозначаются сайты, содержащие один из продуктов пострепликационной модификации ДНК — 5-метилцитозин (см. раздел 16.5.2). И обычное, и модифицированное основание способны спонтанно дезаминироваться, однако с разными последствиями. В первом случае цитозин превращается в урацил, и поэтому GC-napa заменяется ошибочной GU-парой. Такой дефект распознается системой эксцизионной репарации с удалением основания (см. раздел 16.5.1.2). Во втором случае 5-метилцитозин превращается в тимин, и поэтому GC-napa заменяется ошибочной GT-парой, которая уже не распознается репарационной системой, поскольку тимин — это нормальный компонент ДНК. После очередного акта репликации GT-napa окончательно заменяется АТ- парой.
Хромосомные мутации. В отличие от генных мутаций, которые происходят по одному или нескольким нуклеотидам в пределах последовательности отдельного гена, хромосомные мутации затрагивают одновременно много генов или изменяют архитектуру хромосомы в целом.
Частой причиной хромосомных мутаций служат мобильные элементы (см. раздел 16.3.1.3). Вызываемые ими инсерционные мутации затрагивают большие участки ДНК. Как уже отмечалось, происходящие изменения подразделяются на инсерции, делеции, инверсии, дупликации и транслокации (см. рис. 172, А-Е).
Мутации, индуцированные стрессом. Мы уже говорили о том, что большинство мутаций носит вредный характер, и их накопление может привести к вымиранию популяции. Отсюда следует, что прокариотам выгодно максимально ограничить скорость мутирования — что они и делают, корректируя эндогенные ошибки, а также устраняя экзогенные повреждения. Легко заметить, что подобная консервативная стратегия становится барьером на пути эволюционного процесса.
Для выхода из кажущегося тупика прокариоты прибегают к альтернативной стратегии, которая вносит изменения в структуру генома — в нем закрепляются спонтанные мутации и «горизонтальным» путем приобретаются нуклеотидные последовательности чужеродной ДНК. В ходе селекционного процесса это позволяет предпочесть старым аллелям новые аллели, продукты экспрессии которых обеспечивают лучшую адаптацию к измененным условиям среды. Ярким примером служит появление в популяциях патогенных бактерий спонтанных мутантов, устойчивых к антибиотикам, что является серьезной клинической проблемой.
Особый вариант наследственной изменчивости связан с повышением спонтанной мутабильности в неблагоприятных условиях среды, т. е. при стрессах разного типа. Такое неординарное явление изучается с конца 1980-х годов, в основном на примере Е. coli и родственных ей бактерий.
Соответствующие мутации получили название мутаций, индуцированных стрессом (англ. stress-induced mutation). Те из них, которые оказываются полезными и обеспечивают выживание микробной популяции, были названы адаптивными мутациями (англ. adaptive mutation).
Адаптивные мутации, подобно мутациям в отсутствии стресса, происходят спонтанно и случайно, и поэтому их появление и накопление не должны рассматриваться как проявление направленной эволюции.
Известны три механизма повышения мутабильности бактериальной популяции (рис. 198).
Рис. 198. Причины повышения частоты точечных мутаций на примере Е. coli. А — дефект системы репарации ошибок спаривания; Б — репликация «поверх повреждения» с помощью, SOS-индуцированной ДНК-полимеразы Pol V (сверху — мутация в поврежденном локусе, снизу—«неадресная» мутация из-за ошибки Pol V); В — индукция RpoS- регулона при голодании, вызывающая адаптивную экспрессию «склонной к ошибкам» ДНК- полимеразы Pol IV. Pol III — репликативная ДНК-полимераза; MMR — система репарации ошибок спаривания; ТТ — тиминовый димер; SOS — индукция SOS-регулона в ответ на фотоповреждение ДНК; Pol IV и Pol V — SOS-полимеразы. х — точечная мутация.
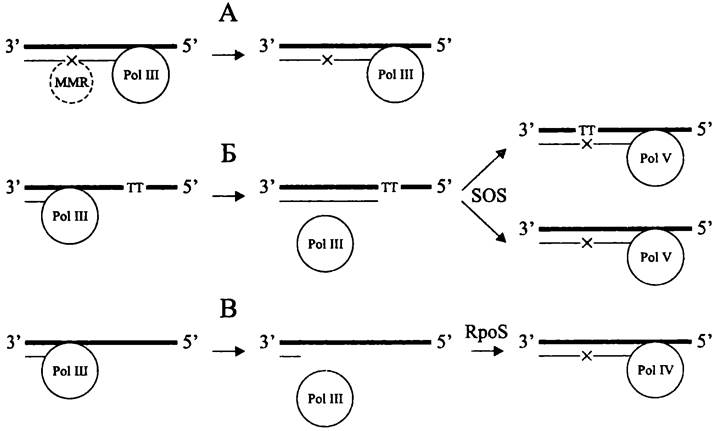
Первый из них (рис. 198, А) — конститутивный. Он связан с генетическим дефектом MMR-системы, которая в норме реагирует на отсутствие метилирования оснований в дочерней цепи ДНК, исправляя ошибки спаривания, совершенные репликативной ДНК-полимеразой Pol III (см. раздел 16.5.1.3).
Селекция, происходящая в условиях стресса, приводит к обогащению микробной популяции мутантами, характеризующимися повышенной частотой мутирования, или мутаторами (англ. mutator mutant). Мутаторами и гипермутаторами (англ. hypermutator) называются такие штаммы, у которых скорость мутирования увеличена на два порядка и более из-за нарушения в генах, кодирующих репарационную систему исправления ошибок спаривания MMR (mutSLH и uvrD). Такие мутанты, в первую очередь устойчивые к антибиотикам, описаны для многих патогенов человека (Е. coli. Haemophilus influenzae, Neisseria meningitidis, Pseudomonas aeruginosa, Salmonella spp., Staphylococcus aureus и др.), и ихобнаруживают с частотой 2-50%.
Второй механизм (рис. 198, Б) — индуцибельный. Он связан с использованием вместо «репликативной» полимеразы Pol III SOS-полимеразы Pol V (см. раздел
16.4.1.1). При стрессовом SOS-ответе, например, при образовании тиминового димера на материнской цепи ДНК, число копий этой полимеразы увеличивается на порядок. После связывания SSB-белков с одноцепочечным участком ДНК они по- лимеризуют и активируют белок RecA, который, в свою очередь, инактивирует белок LexA, играющий роль репрессора SOS-ответа (см. раздел 16.5.1.4). Среди множества SOS-генов особое место занимают гены-мутаторы (англ. mutator gene) — umuDC (в случае Е. coli) или их ортологи (в случае других бактерий). Они кодируют субъединицы ДНК-полимеразы Pol V. Хотя в дальнейшем тиминовый димер, образовавшийся на материнской цепи ДНК, может быть устранен системой фотореактивации (см. раздел 16.5.1.1), напротив него в дочерней цепи остается точечная мутация, проигнорированная «ненадежной» ДНК-полимеразой Pol V.
Третий механизм (рис. 198, В) — также индуцибельный. К его помощи прибегают голодающие клетки, и он связан с активацией RpoS-регулона, который играет центральную роль при трофическом стрессе (см. раздел 18.1.2). После блокировки продвижения репликационной вилки и выхода из нее ДНК-полимеразы Pol III репликация возобновляется, но теперь уже с использованием «ненадежной» ДНК- полимеразы Pol IV, которую кодирует ген-мутатор dinB. При стрессе число ее копий увеличивается на целый порядок (с 250 до 2500; см. раздел 16.4.1.1).
Нестабильность генома, спровоцированная стрессом, выражается в разнообразных изменениях структуры ДНК — от генных мутаций, связанных с делецией или инсерцией нуклеотидов, до хромосомных мутаций, вызванных транслокацией мобильных элементов.
Один из парадоксов мутаций, индуцированных стрессом, заключается в том, что ДНК, как правило, уже повреждена, т. е. повышенная мутабильность создает дополнительный риск для жизни клетки.
Тем не менее, можно предположить, что от увеличения скорости мутирования положение популяции, подвергнутой стрессовому воздействию, по меньшей мере, не ухудшается. Решающее значение приобретает соотношение между расплатой за ускоренное мутирование (накопление вредных и нейтральных мутаций) и полученной выгодой (появление полезных мутаций, благодаря которым можно выжить в новой среде).
Большинство мутаций, индуцированных стрессом, принадлежит к числу вредных или нейтральных, и лишь немногие из них, а именно адаптивные мутации, полезны. Для популяции в целом выгодно, чтобы в условиях стресса частота адаптивных мутаций увеличивалась. Эту задачу можно решить двумя способами — умеренно мутировать в большой популяции или мутировать с повышенной скоростью в небольшой популяции, при активном использовании систем генетической рекомбинации.
И вновь подчеркнем, что индуцибельные мутаторные системы действуют только на фоне соответствующего давления отбора. В отсутствии стресса экспрессия генов- мутаторов umuDC и dinB подавляется белком LexA. Одновременно с этим подавляется экспрессия генов recA, recN, ruvA и ruvB, отвечающих за репарационную рекомбинацию (см. раздел 16.5.1.4).
В особых случаях адаптивный мутагенез сопровождается отбором на повышенное соответствие микробной популяции условиям окружающей среды, т. е. изменчивость носит направленный характер. Формально это противоречит синтетической теории эволюции, которая в качестве механизма эволюционного процесса рассматривает нейтральные мутации в сочетании с дрейфом генов.
Широкую известность приобрели опыты Кэрнса, проведенные в конце 1980-х годов на lас- - мутанте Е. coli FC40, неспособном расти на лактозе в качестве единственного источника энергии и углерода. Они положили начало целому научному направлению, разрабатываемому по настоящее время. Было показано, что адаптивные lас+ -мутанты не просто образуются в условиях стресса на минимальной среде (109), но их количество резко возрастает на фоне специфического селекционного давления, т. е. в присутствии лактозы (2 • 10-7-5 • 10-7). Обязательным условием мутационного процесса служит доступность энергии; аллель lас- ослаблена (англ. leaky), благодаря чему в покоящихся клетках синтезируется небольшое количество ß-галактозидазы, недостаточное для размножения, но способное поддерживать репликацию и рекомбинационную репарацию.
Механизм адаптивных lас+-мутаций не получил однозначного объяснения. В частности, есть идея, что они возникают в результате действия полимеразы Pol IV, которая неточно копирует поврежденную ДНК, и рекомбинационного мутирования (англ. recombination-dependent mutation, RDM), сопровождающего демонтаж хиазм Холлидея резольвазой RuvABC(см. разделы 16.5.1.4 и 16.6.1.2).
16.6.1.2. Рекомбинация
Напомним, что наследственные изменения генома могут происходить двумя путями — за счет мутагенеза и с помощью рекомбинации. Поскольку потенциальной мишенью для мутагенеза является вся хромосома, накопление вредных мутаций рано или поздно привело бы микроорганизм к гибели, независимо от параллельного накопления нейтральных и даже полезных мутаций.
Однако на деле эта тенденция встречает противодействие со стороны рекомбинации, благодаря которой полезные и нейтральные мутации не только отсеиваются от вредных мутаций, но и фиксируются в одной группе сцепления.
Было бы чрезмерным упрощением сводить биологическую роль рекомбинации исключительно к обеспечению генетического разнообразия. Согласно современным представлениям, три «Р» — репликация, репарация и рекомбинация связаны друг с другом общими ферментативными системами и общим характером молекулярных изменений. Часто они представляют собой одно и то же явление, хотя и воспринимаемое под разным углом зрения. Как мы увидим в дальнейшем, рекомбинационная репарация и гомологическая рекомбинация представляют собой фактически один и тот же процесс, который инициируется двухцепочечным концом донорной ДНК или одноцепочечной брешью в реципиентной ДНК. В свою очередь, в процессе рекомбинации происходит ограниченная репликация, а прекращение репликации из- за разрушения вилки требует рекомбинационной репарации (см. ниже).
Есть предположение, что в ходе эволюции ферментативные системы репликации и репарации вторично использовались в целях генетической рекомбинации. В свою очередь, это способствовало биологическому прогрессу прокариотов и обусловило диверсификацию основных типов рекомбинации.
Основные типы рекомбинации. Генетическая рекомбинация, или просто рекомбинация (англ. recombination; от лат. recombinatio — иное сочетание) представляет собой молекулярный процесс, при котором путем внутри- или межгеномных структурных перестроек образуется новый набор генетических признаков в пределах конкретной группы сцепления. Иными словами, рекомбинация перетасовывает гены и аллели, создавая практически неисчерпаемый пул генотипического разнообразия.
Традиционно различают три типа генетической рекомбинации: гомологическую, сайтспецифичную и незаконную.
Гомологическая, или общая рекомбинация распространена наиболее широко. Она представляет собой обмен «выравненными» (англ. aligned) участками гомологии между двумя генетически различными молекулами ДНК. Хотя в ней может участвовать пара последовательностей практически с любой степенью генетического сходства, частота рекомбинационных событий в первую очередь определяется гомологией. В результате гомологической рекомбинации образуются рекомбинантные хромосомы.
Сайтспецифичная рекомбинация происходит между специфическими последовательностями, которые содержат очень короткую область гомологии. Так, например, благодаря рекомбинации данного типа ДНК бактериофага интегрируется в хозяйскую хромосому.
Незаконная рекомбинация затрагивает такие последовательности ДНК, которые полностью лишены гомологии. Рекомбинация данного типа происходит, в частности, при транспозиции мобильных генетических элементов, что приводит к перестройке инфраструктуры отдельно взятого генома.
Гомологическая рекомбинация. Гомологическая рекомбинация, или общая, рекомбинация (англ. homologous recombination; general recombination) — это обмен фрагментами одиночных цепей, который происходит между двумя молекулами ДНК на участке выровненных гомологичных последовательностей.
Успешные участники этого процесса, или рекомбинанты (в случае прокариотов ими являются хромосомы, плазмиды или бактериофаги) содержат рекомбинантную ДНК, и на этой основе могут проявлять фенотипические признаки, которых у них раньше не было.
Гомологическая рекомбинация была впервые описана в 1946 г. американскими генетиками Джошуа Ледербергом и Эдвардом Тейтемом (Е. L. Tatum; Нобелевская премия по физиологии и медицине, 1958 г.) на примере конъюгации Е. coli К-12. Она служит неотъемлемой частью полового процесса у прокариотов. Иногда с целью уточнения такой половой процесс называют парасексуальным (греч. para -почти), поскольку прокариоты, в отличие от эукариотов, не обладают механизмами, необходимыми для поддержания диплоидности. Гомологичные хромосомы у прокариотов являются продуктом авторепликации и сегрегируются между дочерними вегетативными клетками. Вместо объединения признаков обоих родителей происходит векторная передача части генома (правда, иногда очень существенной) от клетки-донора клетке-реципиенту.
При парасексуальном процессе в реципиентную клетку вводится фрагмент чужеродной ДНК, который временно образует с хозяйской хромосомой мерозиготу (англ. merozygote; от греч. meros — часть; в данном случае — диплоид по отдельному участку хромосомы). В большинстве случаев из-за своей нестабильности мерозиготы демонтируются безо всяких последствий. Однако часть из них претерпевает гомологическую рекомбинацию. В ходе нее участок ДНК реципиента замещается участком ДНК донора, который отличается по структуре некоторых сайтов.
Фрагмент чужеродной ДНК может быть доставлен в прокариотную клетку тремя способами (см. раздел 16.6.1.3):
— посредством генетической трансформации;
— посредством фаговой трансдукции;
— посредством конъюгации.
При генетической трансформации в роли вектора выступает фрагмент молекулы ДНК, происходящий из клетки-донора. Такая «голая» ДНК импортируется в
клетку-реципиент, где она может рекомбинировать с гомологичным участком хромосомной ДНК.
При фаговой трансдукции фрагмент хромосомы клетки-донора упаковывается в вирусный капсид, выполняющий роль вектора. Доставленный к поверхности реципиента фрагмент чужеродной ДНК инъецируется внутрь клетки, а затем, как и при конъюгативной рекомбинации, встает на место гомологичного участка хромосомы.
При конъюгации между двумя половыми партнерами, а в случае Е. coli это лишенная фактора фертильности «женская» клетка-реципиент (F-) и обладающая фактором фертильности «мужская» клетка-донор (Hfr), устанавливается физический контакт, т. е. для направленного переноса ДНК не требуется помощь посредника-вектора. ДНК донора поступает в клетку реципиента по конъюгативному мостику, а затем в процессе конъюгативной рекомбинации обменивается на гомологичный участок хромосомной ДНК.
Важно подчеркнуть, что при половом процессе всех трех типов рекомбинация носит вероятностный характер и происходит с низкой частотой. Причина этого заключается в нестабильности экзогенных мерозигот, поскольку линейный фрагмент чужеродной ДНК не может самостоятельно реплицироваться и становится мишенью для экзонуклеаз, а также эндонуклеаз рестрикции (см. раздел 16.5.2).
Эндогенные мерозиготы, которым свойственна более высокая стабильность и более высокая частота рекомбинации, могут образовываться в четырех случаях:
— когда хромосома несет повторы;
— когда клетка содержит многокопийные хромосомы;
— когда клетка обладает мультипартитным геномом, причем в разных хромосомах имеются взаимно гомологичные участки;
— когда в клетке присутствуют плазмиды, в которых есть участки гомологии с хромосомной ДНК.
Частота общей рекомбинации зависит не только от степени гомологии, но и от длины гомологичных участков ДНК. Минимально необходимый размер равен 30- 50 н.; более короткие последовательности рекомбинируют либо неэффективно, либо с использованием «незаконных» механизмов (см. ниже). Кроме того, частота рекомбинации определяется свойствами партнеров и локализацией гомологичных последовательностей по отношению друг к другу.
Белок RecA. Центральную роль в процессе гомологической рекомбинации Е. coli играет рекомбиназа — мультифункциональный белок RecA (RecAEc).
Белок RecA (сокр. англ. recombination) принадлежит к общему семейству с археотным белком RadA, эукариотными белками Rad51/Dmc1 и белком UvsX бактериофага Т4. Все эти белки обладают трансферазной активностью, т. е. они катализируют «переключение» спаривания, приводящее к обмену цепями между двумя молекулами ДНК. За исключением белка Dmc1, который образует октамерные кольца, все остальные белки этого семейства полимеризуются в филаменты вдоль одноцепочечных участков ДНК.
Предложена конкретная модель, согласно которой нуклеопротеиновый филамент, образованный одно цепочечным участком ДНК и белком RecA, навинчивается на двухцепочечную ДНК, в результате чего выявляется область гомологии, производится спаривание, а затем его «переключение». При внедрении одноцепочечного участка ДНК-донора одна из цепей двухцепочечной ДНК-реципиента вытесняется и спаривается с другим одноцепочечным участком ДНК-донора, который существовал
ранее или синтезируется заново. В результате обмена цепями возникает гибридная молекула, которая обозначается как перекрест, или хиазма Холлидея (см. ниже). После миграции перекреста и демонтажа хиазмы Холлидея оба партнера по рекомбинации становятся гетеродуплексными.
Белки RесА, RаdА, Rаd151/Dmс1 и UvsХ имеют консервативный центральный домен размером ~240 аминокислотных остатков. В отличие от белков RаdА и Rаd151/Dmс1, белки RесА и UvsХ содержат С-концевой домен размером ~100 аминокислотных остатков и одновременно с этим лишены N-концевого домена размером ~80 остатков.
Свойством ДНК-зависимой АТФазы обладает только белок RecА. Следует подчеркнуть, что для гомологического спаривания и обмена цепями не требуется энергия АТФ. Роль АТФ здесь иная — белок RесА обладает высоким сродством к ДНК в АТФ-связанной форме и низким сродством к ДНК в АДФ-связанной форме. Способность гидролизовать АТФ позволяет ему либо прочно связываться с ДНК, либо легко диссоциировать от нее.
Белок RесА (37,842 кДа) содержит 362 аминокислотных остатка и состоит из девяти α-спиралей и одиннадцати β-складчатых цепей. Он полимеризуется в направлении 5' —> 3' в стехиометрическом количестве, один мономер на три нуклеотида. Данный процесс протекает медленнее в случае ДНК-дуплекса и быстрее — вдоль одиночной цепи ДНК, особенно в области бреши. Как правило, скорость полимеризации не зависит от характера нуклеотидной последовательности, хотя в сайтах, обогащенных остатками G и Т, она несколько увеличивается.
Нуклеопротеиновый филамент, или пресинаптический комплекс состоит из полимеризованного белка RесА и одиночной цепи ДНК. Он имеет диаметр ~10 нм и закручен вправо (шесть мономеров белка/оборот, три нуклеотида/мономер). В результате связывания с белком ВесА одноцепочечная ДНК, лежащая внутри филамента, имеет длину в полтора раза больше по сравнению с обычной В-формой ДНК.
Белок RecA примечателен своей многофункциональностью, так как он:
— участвует в механизме гомологической рекомбинации (производит гомологическое спаривание и реципрокный обмен цепями между донорной и реципиентной молекулами ДНК);
— индуцирует SOS-ответ (выступает в качестве аллостерического кофактора при автопротеолитическом процессинге белка LexА (репрессора SOS-регулона);
— индуцирует SOS-мутагенез (осуществляет протеолитический процессинг белковой субъединицы UmuD, входящей в состав «склонной к ошибкам» ДНК-полимеразы Pol V);
— способствует репликации «поверх повреждения» (взаимодействует с комплексом (UmuD')2C, входящим в состав ДНК-полимеразы Pol V).
Пути гомологической рекомбинации (общие сведения). Рекомбинация между донором и реципиентом при помощи белка RecA связана с внедрением одноцепочечного участка ДНК в гомологичный участок ДНК-дуплекса. Вопрос в том, как образуется этот одноцепочечный участок?
С одной стороны, одноцепочечные участки закономерно появляются в ходе репликации, когда ведущая цепь копируется непрерывным способом, а отстающая цепь — на основе фрагментов Оказаки (см. раздел 16.4.1.1). В таком структурном состоянии может находиться как экзогенная ДНК (например, при конъюгации по мере того, как фактор Hfr, проникший в реципиентную клетку, переводится в двухцепочечную форму), так и эндогенная ДНК (например, при нормальной репликации бактериальной хромосомы).
С другой стороны, одноцепочечный участок может возникнуть в условиях стресса в результате блокирования ДНК-полимеразы Pol III, когда репликационная вилка достигает одноцепочечного повреждения, и SOS-синтез ДНК возобновляется с помощью ДНК-полимеразы Pol V (см. рис. 195, А).
Наконец, одноцепочечный участок может быть подготовлен путем процессинга донорной ДНК — либо путем образования «глазка» на молекуле кольцевой формы, либо в результате образования «навеса» за счет неравномерного эндонуклеазного расщепления двух цепей линейной молекулы.
Во всех перечисленных случаях одноцепочечный участок ДНК укрывается SSB- белками, прежде всего, с целью защиты от эндонуклеаз. Для проведения рекомбинации они должны быть вытеснены белком RecA, а это становится возможным только путем его АТФ-зависимой активации при участии вспомогательных белков RecFOR.
Как показали исследования американского генетика Элвина Кларка (А. J. Clark), который открыл ген гесА в 1965 г., гомологическая рекомбинация Е. coli может происходить двумя путями. Один из них инициируется двухцепочечным концом донорной молекулы ДНК, другой — одноцепочечной брешью в реципиентной молекуле ДНК.
Некоторые ферментные белки (табл. 25) являются специфическими участниками только одного из этих путей.
Таблица 25. Важнейшие участники системы гомологической рекомбинации Е. coli*
Белок |
Мол. масса, кДа |
Активность |
SSB |
18,8 |
Образование комплексов с одноцепочечной ДНК |
RecA |
37,8 |
Выравнивание ДНК; обмен цепями. |
LexA |
22,2 |
Связывание с SOS-сайтами; репрессия SOS-ответа |
RecB |
133,7 |
Геликазная; эндонуклеазная; сборка филаментов RecA. |
RecC |
128,6 |
Геликазная; эндонуклеазная; сборка филаментов RecA. |
RecD |
66,7 |
Экзонуклеазная |
RecF |
40,3 |
Связывание с одно- и двухцепочечной ДНК. |
RecO |
27,2 |
Связывание с одноцепочечной ДНК; сборка филаментов RecA. |
RecR |
21,8 |
Связывание с одно- и двухцепочечной ДНК; сборка филаментов |
RecA |
||
GyrA |
96,8 |
Устранение супервитков ДНК для создания синапса. |
GyrB |
89,8 |
Устранение супервитков ДНК для создания синапса |
Pol A |
102,9 |
ДНК-полимераза Pol I (устранение одноцепочечных брешей). |
LigA |
73,4 |
ДНК-лигаза, устранение одноцепочечных разрывов |
RuvA |
21,9 |
Распознавание хиазм Холлидея. |
RuvB |
37,0 |
Геликазная. |
RuvC |
18,6 |
Резольвазная |
TopA |
97,1 |
Топоизомераза I (устранение супервитков в гетеродуплексе) |
* без учета компонентов праймосомы, а также субъединиц ДНК-полимеразы Pol III
Действие белка RecA носит универсальный характер, и поэтому мутации по гену rесА приводят к потере способности осуществлять гомологическую рекомбинацию.
Гомологическая рекомбинация, инициированная двухцепочечным концом ДНК. Основным путем рекомбинации в клетках Е. coli К-12 дикого типа, является RecBC-путь. Свое название он получил по продуктам экспрессии двух генов, мутации по которым приводят к пониженному выходу рекомбинантов. По имеющимся данным, распространение данного пути не ограничивается E. coli, и он широко представлен у других грамотрицательных, а также грамположительных бактерий.
RecBC-путь используется в том случае, когда донорной молекулой служит линейный фрагмент двухцепочечной ДНК, например при конъюгации и фаговой трансакции.
Рис. 199. Подготовка донорной молекулы с целью проведения гомологической рекомбинации, индуцированной двухцепочечным концом ДНК. Chi — Chi-сайт; RecBCD и RecBC — два состояния комплекса геликазы/нуклеазы.
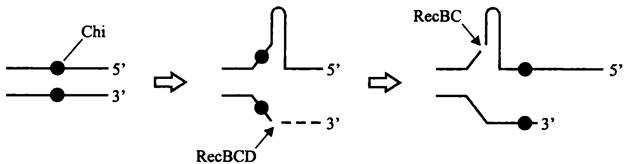
Рекомбинация по RecBC-пути происходит с помощью ферментативного комплекса RecBCD. Его компоненты действуют точно так же, как при рекомбинационной репарации двухцепочечного разрыва, которую мы уже рассматривали в разделе 16.5.1.1
На пресинаптической стадии донорная молекула ДНК подготавливается к тому, чтобы стать субстратом рекомбинации. На синаптической стадии белок RecA катализирует ключевые реакции рекомбинации (комплементарное спаривание, взаимный обмен цепями), в результате чего создается хиазма Холлидея. На постсинаптической стадии хиазма демонтируется, и образуются два рекомбинанта.
На пресинаптической фазе конец донорной ДНК процессируется белковым комплексом RecBCD, в результате чего образуется одноцепочечный «навес». Он становится затравкой при полимеризации белка RecA, филамент которого атакует реци- пиентную молекулу ДНК.
Комплекс RecBCD обладает четырьмя ферментативными активностями — ДНК- зависимой АТФазной, ДНК-геликазной, ДНК-экзонуклеазной (фрагментация цепи с полярностью 3' —> 5') и ДНК-эндонуклеазной (фрагментация цепи с полярностью 5' —> 3'). Конец двухцепочечной ДНК расплетается за счет энергии гидролиза АТФ. Затем начинается расщепление комплементарных цепей (рис. 199). Вначале доминирует экзонуклеазная активность 3' —> 5'. По достижении «горячей точки» рекомбинации (Chi-сайта; см. разделы 16.3.2.1 и 16.5.1.4) на смену ей приходит эндонукле- азная активность 5' —> 3', что приводит к образованию одноцепочечного «навеса» на 3х-конце.
На синаптической стадии одноцепочечный участок ДНК внедряется в ДНК-дуплекс реципиента. Положительные супервитки, образующиеся при взаимодействии реципиентного дуплекса с одноцепочечным участком ДНК, устраняются с помощью ДНК-гиразы GyrAB.
На постсинаптической стадии хиазма Холлидея демонтируется с помощью резольвасомы RuvABC.
Последовательность событий, которые происходят при гомологической рекомбинации, индуцируемой двухцепочечным концом ДНК, схематически изображена на рис. 200. Отметим, что для заполнения одноцепочечной бреши на реципиентной молекуле и сшивания 3'-конца внедренной нити с фланкирующим разрыв 5'-концом используются ДНК-полимераза Pol I и ДНК-лигаза (табл. 25).
Рис. 200. Гомологическая рекомбинация, индуцированная двухцепочечным концом ДНК. I — подготовка 3'-навеса в донорной молекуле ДНК с помощью геликазы/нуклеазы RecBCD(RecQJ или RecQE); II — реципиентная молекула ДНК; III — образование перекреста и D-петли, миграция перекреста и нанесение разрезов, заполнение бреши и устранение разрезов; IV — «кроссоверные» рекомбинанты. Косыми стрелками указаны сайты разрезов.
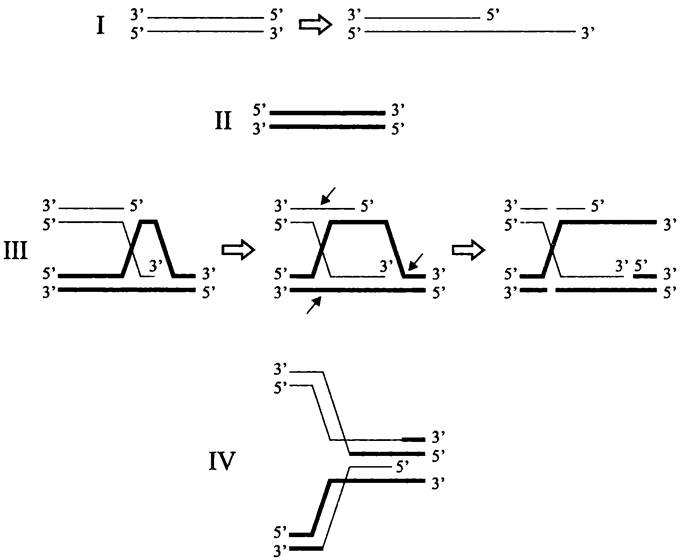
У мутантов recBC- Е. coli существуют два запасных пути рекомбинации — RecQJ и RecQE. На фазе пресинапса роль геликазы-нуклеазы RecBCD выполняют геликаза RecQ и одно цепочечные 5' —> 3' экзонуклеазы RecJ или RecE. Хиазма Холлидея по-прежнему демонтируется с помощью резольвасомы RuvABC.
Гомологическая рекомбинация, инициированная одноцепочечной брешью. При рекомбинации между двумя кольцевыми молекулами ДНК (например, между двумя хромосомами или между хромосомой и плазмидой) клетки Е. coli дикого типа, а также другие грамотрицательные бактерии и, по крайней мере, одна грамположительная бактерия, В. subtilis, используют четвертый путь рекомбинации — RecFOR. Свое название он получил от вспомогательных белков, которые способствуют активации белка RecA (см. выше). Функции этих белков такие же, как при рекомбинационной репарации бреши с одноцепочечным разрывом (см. раздел 16.5.1.4).
В данном случае хиазму Холлидея демонтирует уже не резольвасома RuvАВС, а геликаза RecG. Каким образом работает эта альтернативная резольваза, пока не ясно.
Хиазма Холлидея. Модель хромосомного перекреста была предложена в 1964 г. для объяснения феномена генной конверсии у возбудителя головни, базидиомицета Ustilago mayáis.В молекулярно-генетический словарь она вошла как хиазма Холлидея (англ. Holliday junction) — по имени ее автора, английского генетика Робина Холлидея. В детализированном виде модель Холлидея используется для описания механизма гомологической рекомбинации у разнообразных про- и эукариотных объектов.
Основной смысл модели Холлидея заключается в образовании перекреста, временно объединяющего две молекулы ДНК (рис. 201, I-III). При латеральной миграции перекреста — путем разрыва старых и образования новых водородных связей, что напоминает застежку на «молнии» — во взаимодействующих молекулах ДНК появляются гетеродуплексные участки (рис. 201, IV). Демонтаж хиазмы Холлидея посредством одноцепочечных разрывов и соединения цепей одинаковой полярности дает два свободных гетеродуплекса (рис. 201, V-VIII).
Рис. 201. Образование и демонтаж хиазмы Холлидея. I — выровненные двухцепочечные ДНК; II — нанесение одноцепочечных разрезов; III — воссоединение цепей с образованием перекреста; IV — миграция перекреста с образованием гетеродуплексных участков; V — хиазма в «сложенной» конформации; VI — хиазма в «квадратно-плоской» конформации; VII — резольвасома в действии; VIII — образование рекомбинантов.
Детали в тексте.
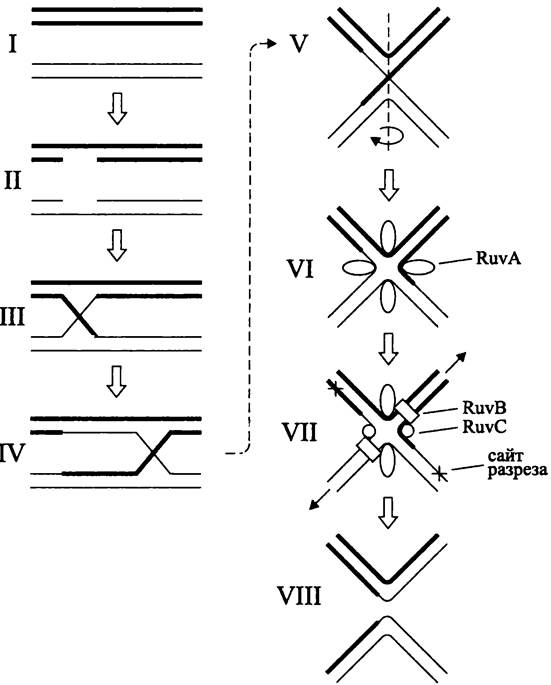
За образование хиазмы Холлидея отвечает белок RecА. Благодаря его комплексной активности (расплетение ДНК, связывание с одноцепочечными участками, комплементарное спаривание, обмен цепями) гомологичные участки двух молекул ДНК вступают в перекрестное взаимодействие.
За демонтаж хиазмы Холлидея, который приводит к образованию двух свободных гетеродуплексов, отвечает резольвасома RuvАВС.
Резолъвасома RuvABC. Комплексная задача по демонтажу хиазмы Холлидея решается с помощью реэолъвасомы (от англ. resolve — распадаться; в данном случае — органелла, осуществляющая демонтаж). Резольвасома связывается с хиазмой, придает ей оптимальную конформацию, защищает одноцепочечные участки от непродуктивного эндонуклеазного расщепления, перемещает зону перекреста, а также перераспределяет цепи ДНК путем нанесения симметричных одноцепочечных разрезов и соединения образующихся концов.
При образовании резольвасомы тетрамер белка RuvA распознает хиазму Холлидея, связывается с ней и поворотом вокруг вертикальной оси переводит ее из «сложенной» конформации, когда латеральное перемещение перекреста затруднено (рис. 201, V), в «квадратно-плоскую» конформацию, когда перекрест легко перемещается, что создает гетеродуплексные участки (рис. 201, VI).
Затем к тетрамеру RuvA присоединяются два гексамера геликазы RuvB, которые охватывают противоположные плечи перекреста. За счет энергии гидролиза АТФ они обеспечивают смещение двухцепочечной ДНК относительно зоны перекреста, что эквивалентно смещению перекреста относительно синапса; при этом внутрь резольвасомы втягиваются сайты для разреза (рис. 201, IV и VII).
На следующем этапе к тетрамеру RuvA и двум гексамерам RuvB присоединяется димер резольвазы RuvC, наносящий симметричные разрезы в двух цепях ДНК одинаковой полярности. Сайтом узнавания резольвазы служит вырожденная нуклеотидная последовательность 5'-(A/T)TT↓(G/C)- 3'. Путем соединения свободных концов образуются два гетеродуплекса ДНК (рис. 201, VIII).
Рекомбинационная индукция вилки (oriC-независимая репликация). По традиционным представлениям, двунаправленная репликация ДНК инициируется в сайте oriC. Однако нередко складываются такие ситуации, когда репликация стартует вне зависимости от оriС.
С одной стороны, на пути oríС-индуцированной репликационной вилки могут вставать повреждения ДНК или химические блокаторы. Это приводит к остановке продвижения вилки или даже ее коллапсу. Реставрация вилки осуществляется с помощью гомологической рекомбинации (см. раздел 16.5.1.4 и рис. 195, Б).
С другой стороны, оriС-независимая репликация хромосомы происходит при конъюгации, для чего специально индуцируется репликационная вилка (рис. 202). После попадания донорской ДНК внутрь реципиента она переходит в двухцепочечную форму и обрабатывается пресинаптическим комплексом ферментов RecBCD таким образом, что приобретает симметричные одноцепочечные 3'-навесы (рис. 202, I). Они внедряются в кольцевую хромосому реципиента с образованием двух D- петель (рис. 202, II). Эти рекомбинационные интермедиаты превращаются в репликационные вилки, в которых инициируется новый раунд репликации, не зависящий от локуса оriС (рис. 202, III).
Рис. 202. Рекомбинация с помощью оriС-независимой репликации. I — донорная ДНК с 3'-концами, подготовленными геликазой-нуклеазой RecBCD, и реципиентная ДНК; II — внедрение 3'-концов донорной ДНК в реципиентную ДНК, образование D-петель (1); III — превращение D-петель в репликационные вилки (2), стрелками указано смещение перекрестов; IV — демонтаж хиазм Холлидея; V — образование рекомбинантной хромосомы (сверху) и реципиентной хромосомы (снизу).
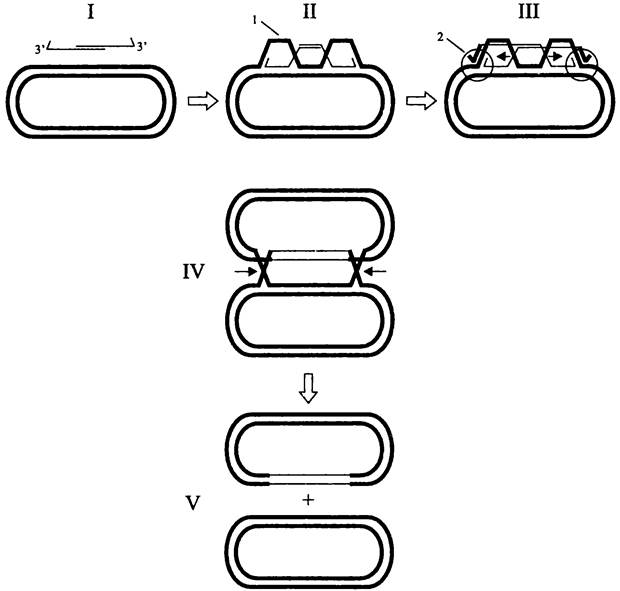
Установлено, что оriС-независимая репликация осуществляется прерывистым путем, т. е. через синтез фрагментов Оказаки (см. раздел 16.4.1.1). В организации праймосомы участвуют белки PriABC, DnaBC, DnaG и DnaT.
Предполагается, что данный способ репликации, протекающий без участия «канонического» белка DnaA, используют в своих целях молекулярные паразиты — фаги и плазмиды, в том числе конъюгативные.
После прохождения полного раунда репликации хиазмы Холлидея демонтируются, и донорная ДНК оказывается интегрированной в одну из двух сестринских хромосом.
Заметим, что в обоих рассмотренных нами случаях реплисома образуется в области внедрения одноцепочечного участка донорной ДНК в реципиентный дуплекс.
Сайтспецифичная рекомбинация. Как мы уже отмечали, существует возможность рекомбинации между молекулами ДНК при условии низкой гомологии (сайтспецифичная рекомбинация) и даже если гомология вообще отсутствует (незаконная рекомбинация). Естественно, что соответствующие механизмы отличаются от гомологической рекомбинации; прежде всего, они не зависят от генов rесАВС.
Сайтспецифичная рекомбинация может быть связана с репликацией или происходит в ее отсутствии. Так, транспозиция мобильных элементов может сопровождаться репликацией (см. раздел 16.3.1.3). Напротив, в процессе интеграции фаговой ДНК в бактериальную хромосому принимают участие ранее реплицированные геномные молекулы.
Сайтспецифичная рекомбинация первоначально была изучена на примере процессов интеграции и эксцизии, которые происходят в жизненном цикле фага лямбда ![]() Этот вирус реплицируется либо ценой лизиса хозяйской клетки, либо путем клонирования его ДНК в общем репликоне с хозяйской хромосомой, т. е. он может на время переходить в лизогенное состояние.
Этот вирус реплицируется либо ценой лизиса хозяйской клетки, либо путем клонирования его ДНК в общем репликоне с хозяйской хромосомой, т. е. он может на время переходить в лизогенное состояние.
При лизогении кольцевая фаговая ДНК интегрируется в хозяйскую хромосому и превращается в профаг. Репрессорный белок, продукт фагового гена с/, почти полностью подавляет экспрессию вирусного генома.
При индукции литического цикла белок-антирепрессор, продукт фагового гена его, блокирует синтез репрессора. Это приводит к эксцизии вирусного генома и, как следствие, к воспроизводству популяции инфекционных частиц-вирионов.
Процессы интеграции и эксцизии основаны на сайтспецифичной рекомбинации (рис. 203). В интеграции со стороны бактерии принимают участие уникальный сайт присоединения attB(сокр. англ. attachment — присоединение и В — bacterium), а со стороны бактериофага — уникальный сайт присоединения attP (сокр. англ. attachment — присоединение и Р —plasmid). В свою очередь, в эксцизии участвуют сайт attL (сокр. англ. left) и сайт attR (сокр. англ. right), фланкирующие профаг с левой и правой стороны.
Рис. 203. Интеграция и эксцизия фага лямбда. attB и attP — рекомбинационные сайты присоединения; attL и attR — гибридные рекомбинационные сайты; Int — интеграза; Xis — эксцизионаза; IHF — хозяйский ДНК-связывающий белок.
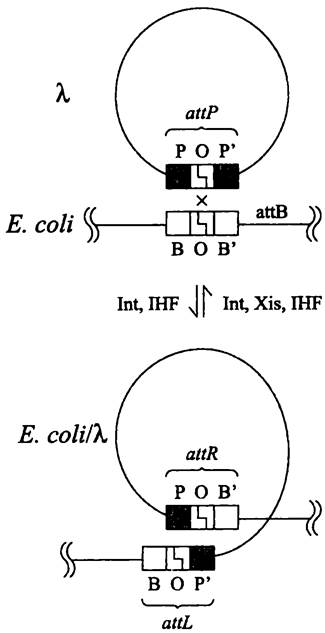
Все перечисленные сайты обладают высоким сродством к соответствующим рекомбинационным белкам, что объясняет консервативную локализацию профага в хромосоме Е. coli(между генами gal и biо). Если сайт attB делетирован, интергация допускается в иных участках хромосомы, но тогда ее частота будет примерно в 1 тыс. раз ниже.
Хозяйский рекомбинационный сайт attB состоит из центральной части, или АТ- богатой кор-последовательности О (сокр. англ. overlap region — перекрывающийся участок). Она имеет длину 15 п. н. и фланкирована короткими «плечами» В и В' (оба ~20 п. н.). Таким образом, этот сайт имеет структуру ВОВ'. Фаговый рекомбинационный сайт attP состоит из такой же кор-последовательности О, но она фланкирована длинными плечами Р и Р' (~160 и ~80 п. н.), т. е. имеет структуру POP'.
При интеграции, происходящей в результате рекомбинации по кор-последовательностям в составе сайтов ВОВ' и POP', образуются сайты attL и attR, имеющие гибридную структуру ВОР' и РОВ'. При эксцизии происходит рекомбинация по сайтам ВОР' и РОВ' с возвращением к первоначальным сайтам ВОВ' и POP' (рис. 203). Важно отметить, что, хотя интеграция обратима, она и эксцизия осуществляются разными путями. В этих процессах используются разные сайты узнавания интегразы, что требует участия асимметричного набора рекомбинационных белков.
Интеграза Int. Интеграцию осуществляет продукт фагового гена, интеграза Int совместно с хозяйским ДНК-связывающим белком IHF. Для проведения эксцизии помимо них требуется другой продукт фагового гена — эксцизионаза Xis (сокр. англ. excision — вырезание). Сайт attP содержит семь субсайтов для связывания ин- тегразы Int, три субсайта для связывания ДНК-изгибающего белка IHF (H1, Н2 и Н') и один субсайт для связывания белка Xis. Сайт attB содержит только два субсайта для связывания интегразы Int.
При интеграции и эксцизии интеграза Int выступает в качестве сайтспецифичной топоизомеразы I (см. раздел 16.4.2).
Интеграза наносит одно цепочечные разрезы в кор-последовательностях обоих рекомбинационных сайтов и параллельно с этим устраняет их суперспирализацию, что позволяет образовать перекрестные фосфодиэфирные связи (например, как это изображено на рис. 201, I — III). Предполагается, что за счет миграции перекреста образуется хиазма Холлидея с гетеродуплексным участком, который укладывается в границы сайта POP'.
Интеграза Int (40 кДа) принадлежит к суперсемейству «тирозиновых» рекомбиназ, которые участвуют в разнообразных перестройках ДНК у прокариотов — репликации, декатенации сцепленных репликонов, сегрегации сестринских репликонов и т. д. (см. раздел 16.4.2).
Все эти ферменты, действуя в тетрамерной форме, катализируют обмен цепями ДНК путем образования и демонтажа крестообразных структур, или хиазм Холлидея. Напомним, что для этого требуется последовательно нанести две пары одноцепочечных разрезов, а затем провести лигирование (см. рис. 201).
Характерно, что данные реакции происходят без затраты энергии, посредством образования ковалентно связанных З'-фосфотирозиновых ДНК-белковых интермедиатов.
Интеграза Int содержит большой С-концевой домен, который присоединяется к обеим кор-последовательностям и осуществляет ферментативные стадии рекомбинации. В свою очередь, небольшой N-концевой домен интегразы связывается с плечами за пределами участка обмена цепями.
ДНК-изгибающие белки. Чтобы единичная молекула, или протомер интегразы смогла взаимодействовать с взаимно дистанцированными областями субстрата, используются вспомогательные белки, которые образуют на молекуле ДНК сайте- специфичный изгиб. При эксцизии эту роль выполняет фаговый белок Xis; при его дефиците в качестве заместителя используется хозяйский белок Fis (сокр. англ. factor for inversion stimulation).
Третий ДНК-изгибающий белок, IHF (сокр. англ. integration host factor; название объясняется тем, что этот белок имеет отношение к интегративной рекомбинации фага А в хромосому хозяина) участвует и в интеграции, и в эксцизии. Он состоит из двух субъединиц — IHFα (10,5 кДа; ген himА) и IHFβ (9,5 кДа; ген hip/himD).
Незаконная рекомбинация. Довольно расплывчатый термин незаконная рекомбинация (англ. illegitimate) обычно используют по отношению к таким рекомбинационным событиям, в которых участвуют негомологичные области одной и той же молекулы ДНК или негомологичная пара ДНК-донор/ДНК-реципиент. Иными словами, он применяется по отношению к разным явлениям, формально объединенным по негативному признаку — отсутствию гомологии между рекомбинирующими партнерами. Поэтому такой тип рекомбинации правильнее было бы назвать негомологической.
Рис. 204. Незаконная рекомбинация при эксцизии фага лямбда. аttL и аttR — гибридные рекомбинационные сайты; R — сайт незаконной рекомбинации.
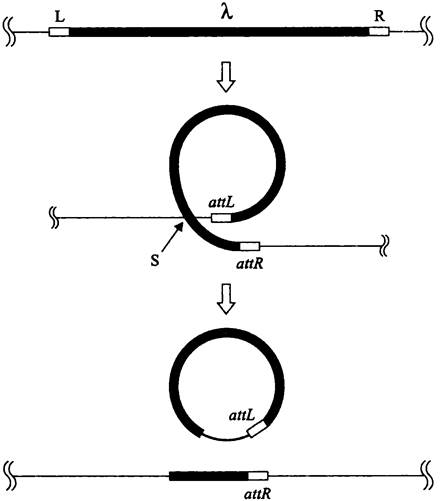
Наиболее изучена незаконная рекомбинация при транспозиции мобильных элементов. Ее механизмы были рассмотрены в разделе 16.3.1.3, и во избежание повторов мы отсылаем читателя к соответствующим страницам учебника.
Иногда термин «незаконная», или «необычная» (англ. extraordinary) используется применительно к рекомбинации, затрагивающей гомологичные сайты, что создает путаницу.
В данном случае имеется в виду эксцизия фага лямбда путем рекомбинации между внутренней (т. е. расположенной между сайтами присоединения) последовательностью профага и последовательностью бактериальной ДНК, удаленной от одного из сайтов присоединения. Обмен осуществляется при помощи RecA-зависимого механизма и связан со случайной гомологией между короткими последовательностями фаговой и бактериальной ДНК (рис. 204).
В результате такой рекомбинации образуются дефектные вирусные частицы, поскольку фрагмент фаговой ДНК замещается фрагментом бактериальной хромосомы вместе с одним из сайтов присоединения. Благодаря тому, что часть бактериальных генов включилась в состав фагового репликона, они могут переноситься в реципиентную бактерию посредством фаговой трансдукции (см. раздел 16.6.1.3).
Рекомбинация у архей. Как известно, продукты «информационных» генов у архей обнаруживают большее сходство с эукариотными функциональными эквивалентами, чем с бактериальными. Не являются исключением и факторы гомологической рекомбинации, в частности белок RadA.
Археотная рекомбиназа RadA была впервые описана в 1998 г. на примере Sulfolobus solfataricus\ позднее этот белок нашли у других представителей филы AI Crenarchaeota, таких как Desulfurococcus amylolyticus, Pyrobaculum islandicum и Pyrococcus furiosus. Характерно, что все они активны только при высокой температуре, т. е. это «термофильные» белки.
Белок RadA обладает сходными функциональными свойствами как с бактериальным белком RecA, так и с эукариотным белком Rad51:
— полимеризуется на одноцепочечной ДНК с предпочтением таких же последовательностей (богатых G и Т), с такой же стехиометрией (три нуклеотида/мономер) и тоже с образованием правозакрученного микрофиламента;
— катализирует реципрокный обмен цепями ДНК;
— выступает в качестве ДНК-зависимой АТФазы.
В то же время по аминокислотной последовательности белок RadA обладает более высоким сходством с эукариотным белком Rad51 (53-63% гомологии, 34-42% идентичности), чем с бактериальным белком RecA (25-31% гомологии, 14-17% идентичности).
16.6.1.3. Горизонтальный перенос генов
Генетическое разнообразие возникает в результате и внутригеномных, и межгеномных преобразований. Внутригеномные преобразования бывают трех типов- точечные мутации, хромосомные мутации с помощью мобильных элементов (см. раздел 16.3.1.3) и хромосомные перестройки в результате рекомбинации.
При накоплении точечных мутаций происходит постепенная модификация резидентных генов, передающихся вертикальным путем от поколения к поколению. Это позволяет прокариотам медленно наращивать свое присутствие в старых нишах и таким же темпом осваивать новые ниши.
В отличие от точечных мутаций, обеспечивающих микроэволюцию, в основе макроэволюционных изменений у прокариотов лежат хромосомные мутации, а также процессы рекомбинации, которые американский бактериолог Сидней Фолкоу (S. Falkow) назвал «генетическими квантовыми скачками».
Считается, что именно рекомбинационным путем появились обладающие множественной лекарственной устойчивостью штаммы Mycobacterium tuberculosis и Streptococcuspneumoniae, а также высоковирулентные серотипы Е. coli, Haemophilus influenzae и Vibrio cholerae.
Механизмы рекомбинации позволяют перераспределять генетический материал как в пределах одного генома, так и между геномами. Во втором случае мы говорим о горизонтальном: или латеральном переносе генов от донора к реципиенту (англ. horizontal gene transfer, HGT; lateral gene transfer, LGT). Такой перенос еще называют «негенеалогическим», поскольку процесс передачи генов не означает их одновременного наследования (что происходит при делении).
Относительный вклад в наследственную изменчивость со стороны внутригеномных перестроек или горизонтального переноса зависит от конкретного организма и селекционного фона. Однако в целом горизонтальный перенос является главным механизмом адаптации прокариотов к изменяющимся условиям внешней среды.
Специфика горизонтального переноса. Геномные изменения вследствие горизонтального переноса отличаются от геномных изменений при мутировании тем, что в первом случае реципиент чаще всего приобретает «проверенные» гены, которые полезно функционировали у донора; во втором случае изменения носят преимущественно нейтральный или вредный характер. Тем не менее, возможны такие случаи, когда горизонтально переданные гены вызывают вредный эффект; в результате реципиент, как и при вредных мутациях, элиминируется.
В отличие от эукариотов, горизонтальный перенос генов у прокариотов не связан с половым размножением. Более того, за исключением конъюгации он происходит в отсутствии межклеточного контакта, основанного на взаимном узнавании партнеров.
Подобно эукариотам, горизонтальный перенос генов у прокариотов и сопутствующая ему рекомбинация позволяют обменивать гомологичные участки генома, создавая новые комбинации аллелей. Однако в отличие от эукариотов, у прокариотов в геном могут вводиться новые последовательности (например, кассета метаболических генов, гены устойчивости к антибиотикам или островки патогенности), что приводит к резким изменениям фенотипа.
Обмен генетическим материалом у прокариотов возможен между далеко дистанцированными объектами, вплоть до представителей разных доменов глобального древа (см. ниже).
Доказательства горизонтального переноса. В условиях эксперимента не всегда удается получить прямое доказательство передачи селективного признака от донора к реципиенту, а в эволюционной ретроспективе сделать это вообще невозможно. Поэтому кандидаты на роль горизонтально переданных генов косвенно выявляются по ряду признаков:
— преимущественному использованию GC-nap (особенность нуклеотидного состава);
— предпочтительному использованию синонимических кодонов (англ. codon bias);
— частоте встречаемости динуклеотидов;
— уникальным «маркерным» сайтам (англ. signature — личная подпись) в пределах нуклеотидной последовательности;
— аномально высокому сходству с ортологом на фоне других генов;
— порядку расположения в опероне;
— типу, числу и распределению некодирующих последовательностей, например, нитронов;
— характеру встречаемости в филогенетических ветвях.
Масштабы горизонтального переноса; классификация генов в соответствии со способностью передаваться горизонтальным путем. В последнее время много спорят о том, насколько распространен горизонтальный перенос генов, и какие гены он затрагивает.
По мнению одних авторов, некоторые гены свободно путешествуют между прокариотными и эукариотными геномами (часто при посредстве вирусов), так что горизонтальные генетические связи охватывают всю биосферу, уподобляя ее «глобальному организму». Как полагает один из мировых авторитетов в области метагеномики Евгений Кунин, горизонтальный перенос затрагивает значительную часть, если не большинство, прокариотных генов. Другие авторы не соглашаются с данным выводом, указывая на трудность доказательства горизонтального переноса конкретного гена, а также на проблему количественного учета этого явления. Так или иначе, горизонтальный перенос генов документирован практически для любой филогенетической дистанции и для гена практически любого типа.
По способности передаваться горизонтальным путем, гены прокариотных хромосом подразделяются на три группы:
— «жесткий кор» (англ. hard соге); не передаются почти никогда;
— «гибкий кор» (англ. soft соге); передаются редко;
— «окружение» (англ. shell); передаются часто.
Гены жесткого кора составляют относительно небольшую, но крайне существенную часть бактериального генома (1-5%). Причина нетрансмиссивности и эволюционной стабильности этих генов связана с их особой биологической ролью. Это, прежде всего, абсолютно незаменимые информационные гены, которые универсально представлены у всех живых организмов, и поэтому их приобретение не обеспечивает реципиенту никакого селективного преимущества. Такие гены крайне редко передаются горизонтальным путем еще и потому, что они входят в состав многокомпонентных и внутренне сбалансированных систем, из-за чего их продуктам трудно функционально соответствовать «чужому» окружению.
Данные о горизонтальном переносе генов жесткого кора немногочисленны. В частности, это касается переноса генов рРНК от Proteus vulgaris к Е. coli или миграции этих генов между разными видами родов Aeromonas и Rhizobium, а также между экстремально термофильными археями Archaeoglobus fulgidus и Pyrococcus horikoshii (см. также раздел 16.6.3). Горизонтальным путем передавались и гены рибосомных белков, например, ген белка S14 (Rpsl4) малой субъединицы. Интердоменный перенос белка L23 малой рибосомной субъединицы зарегистрирован между метаногенными археями пор. Methanococcales и бактериями р. Hélicobacter.
Рассматривая это явление с позиций физиологической эволюции, можно предположить, что замещение незаменимых генов их «изофункциональными» гомологами происходило под специфическим селекционным давлением, в частности, на фоне антибиотиков или при адаптации к высокой температуре.
Гены гибкого кора — это незаменимые операционные гены; их продукты используются по «модульному» принципу, т. е. они могут входить в состав разных функциональных комплексов. Примером служат гены протонтранслоцирующих АТФаз, а также гены ключевых ферментов сульфатного дыхания (см. II том учебника), которые археи приобрели от бактерий.
Что касается генов окружения, то они не принадлежат к числу незаменимых, и их продукты наиболее часто подвергаются горизонтальному переносу.
Поскольку гены жесткого кора, как правило, передаются вертикальным путем, они служат надежными маркерами филогении. Мы уже много говорили о том, что результаты секвенирования рДНК используются для построения эволюционных дендрограмм (см. I том учебника).
В то же время характер распределения генов окружения в природных популяциях бактерий, в особенности патогенных форм, отвечает концепции «глобального» организма.
За миллионы лет «чужая» ДНК замещает значительную часть собственной ДНК, следы вертикального наследования стираются, и генеалогическое древо постепенно вырождается в сеть. Это создает большие — возможно, даже непреодолимые — трудности для филогенетической систематики прокариотов, в первую очередь, при выработке концепции вида (см. I том учебника).
Вклад горизонтального переноса в инфраструктуру генома. Анализ бактериальных геномов (особенно полностью секвенированных) показывает, что они сформировались на основе горизонтального переноса 5-30% генов между отдельными филогенетическими ветвями домена Bacteria, а также путем передачи генов от представителей доменов Archaea и Еuсаrуа.
Интердоменный перенос характерен для термофильных бактерий. Например, Aquifex aeolicus и Thermotoga marítima приобрели, соответственно, 16 и 24% генов от
гипертермофильных архей. Мезофилы, в частности В. subtilis и Synechocystis spp., гораздо беднее теми генами, гомологи которых имеются в археотных геномах. В качестве конкретного примера получения бактериями гена от архей можно назвать ген прокариотного опсина bop (см. II том учебника).
Случаи, когда гены горизонтальным путем передаются бактериям от эукариотов, обычно связаны с эндосимбиотическими ассоциациями. В частности, таково происхождение АДФ/АТФ-транслоказы у облигатного внутриклеточного паразита Chlamydia trachomatis. Бактерии, в свою очередь, могут передавать гены хозяйской эукариотной клетке (примером служит ген аспартатаминотрансферазы Wolbachia pipiens; см. раздел 20.3.4.2).
Примеры генов, которые приобретены прокариотами горизонтальным путем и отвечают за функциональные свойства разной степени важности, приводятся в таблице 26.
Таблица 26. Гены прокариотов, приобретенные горизонтальным путем (примеры)
Объект |
Ген |
Продукт |
Энергетический метаболизм |
||
Rhodocyclus gelatinosus |
pufL |
Апопротеин реакционного центра |
Arthrospira sp. |
срсАВ |
Апопротеины антенны |
Oligotropha carboxydovorans |
cdhL |
Субъединица СО-дегидрогеназы |
Конструктивный метаболизм |
||
Methanococcus lithoautetrophicus |
nifH |
Fe-белок нитрогеназы |
Erwinia chrysanthemi |
celY |
Целлюлаза |
Brevibacterium sp. R312 |
amiE |
Амидаза |
Придаточные структуры |
||
Bacteroides nodosus |
fimA |
Пилин |
Haemophilus influenzae |
kfiA |
Полимераза капсулы |
Устойчивость к стрессу |
||
Halobacterium cutirubrum |
sodB |
Ге-супероксиддисмутаза |
Neisseria, meningitidis |
penA |
Модифицированный РВР-белок |
Вирулентность |
||
Streptococcus pyogenes |
emm12 |
Поверхностный белок серотипа М12 |
Vibrio cholerae |
ctxAB |
Холерный токсин фага СTХф |
Явление горизонтального переноса очень часто наблюдается у патогенных бактерий. Соответствующие гены обычно входят в островки патогепности (англ. pathogenicity island, PI).
Напомним, что кроме кора, детерминирующего важнейшие структурно-функциональные свойства клетки и представленного ансамблем слабо мутирующих генов, существует меньшая часть генома (~15%), или так называемое окружение. Это, главным образом, геномные островки (англ. genome island) размером 10-200 т. п. н. Они отличаются от кора по содержанию ГЦ-пар и набору преимущественно используемых кодонов, что является характерным признаком «чужих» генов.
Геномные островки часто ассоциированы с генами тРНК, а также геном интегразы. Поэтому предполагается, что они эволюционно произошли от интегрированных в геном мобильных генетических элементов — плазмид, транспозонов и бактериофагов. Геномные островки организованы по общей схеме и содержат прямые повторы, мобильные элементы, а также структурные и регуляторные гены. Концы геномного островка, как правило, фланкированы прямыми повторами, приобретенными в результате интеграции в хромосому мобильного элемента.
Основу геномного островка составляют структурные гены. Как правило, речь идет о полном наборе генов, который необходим для реализации какого-либо признака, что делает возможным и целесообразным его горизонтальный перенос.
Геномные островки можно подразделить на несколько групп:
— островки сапрофитности;
— экологические островки;
— симбиотические островки;
— островки патогенности и т. д.
Геномные островки содержат гены специализированного метаболизма, гены адаптации к абиотическим факторам среды и гены устойчивости к антибиотикам, а также гены симбиоза и вирулентности. В частности, островки патогенности содержат кластеры генов, которые обеспечивают вирулентность и часто встраиваются в гены тРНК.
Способы горизонтального переноса генов у прокариотов. Напомним, что у прокариотов существуют три способа доставки ДНК от донора к реципиенту — трансформация, конъюгация и трансдукция (см. раздел 16.6.1.2). Различие между ними связано со спецификой маршрута ДНК, который включает в себя три стадии:
— презентацию ДНК донором;
— перенос ДНК между донором и реципиентом;
— восприятие ДНК реципиентом.
На вторую из этих стадий обращается наибольшее внимание, поскольку речь идет о природе вектора. Сильно упрощая, можно сказать, что трансформацию обеспечивает «голая» ДНК, конъюгацию — конъюгативная плазмида, мигрирующая по конъюгационному мостику, а фаговую трансдукцию — ДНК, упакованная в оболочку вирусной частицы.
При горизонтальном переносе генов, преодолевая барьер из одной или нескольких мембран, в цитоплазму реципиента поступает либо одноцепочечная ДНК (в случае трансформации и конъюгации), либо двухцепочечная ДНК (в случае фаговой трансакции).
Некоторые бактерии, например, Е. coli, способны осуществлять обмен генетическим материалом несколькими способами. У других бактерий, в частности представителей рода Neisseria, единственным способом горизонтального переноса генов служит трансформация, поскольку они не имеют конъюгативных плазмид (в том числе, способных мобилизовать часть хромосомы), а также не являются хозяевами для трансдуцирующих фагов.
Знакомство со способами горизонтального переноса генов у бактерий мы начнем с самого распространенного из них — трансформации.
Трансформация. Генетической трансформацией, или просто трансформацией (англ. transformation; от лат. transformatio — преображение) называется свойство клеток поглощать из окружающей среды «голую» чужеродную ДНК с последующим включением в хромосому или сохранением в качестве автономно реплицирующейся плазмиды. Результатом трансформации становится наследственное изменение генома, которое фенотипически выражается на селективном или неселективном фоне.
Отметим, что данных о том, что позволяет свободной ДНК уцелеть в природных экосистемах, крайне мало. Известно, что в водном растворе она легко становится мишенью для нуклеаз и иных повреждающих агентов; при адсорбции на носителях ее физико-химическая резистентность возрастает.
По-видимому, наилучшим образом ДНК защищена в биопленках, заключенных в полисахаридный матрикс (см. I том учебника). Так или иначе, в почвах или илах присутствует ~1 мкг • г-1свободной ДНК, а в пробах пресной или морской воды она выявляется в количестве 3 • 10-1 -88 мкг • л-1.
Приоритет открытия феномена трансформации, а также сам термин «трансформация» принадлежат английскому бактериологу Фреду Гриффиту (F. Griffith), который в 1928 г. сообщил о том, что убитые нагреванием инкапсулированные клетки Streptococcus pneumoniae, если их вводить мышам совместно с живыми бескапсульными и, соответственно, непатогенными пневмококками, передают последним способность образовывать капсулу, делая их вирулентными. В настоящее время известно, что за образование капсулы отвечают до 20 генов, входящих в состав cap-кассеты, и что полисахаридная капсула является важнейшим фактором вирулентности пневмококков, поскольку она защищает их от поглощения и переваривания полиморфноядерными лейкоцитами.
Поскольку молекулярная природа носителя генетической информации была в ту пору неизвестна, Гриффит предположил, что при трансформации переносится затравка капсульного полисахарида или соответствующий биосинтетический фермент.
В 1930 г. Дэвсон (М. Н. Dawson) и Сиа (R. H. P. Sia) провели трансформацию пневмококков in vitro. Год спустя Эллоуэй (J. L. Alloway) добился аналогичного результата, но уже с применением клеточных экстрактов. Решающее доказательство природы трансформирующего начала — препарата ДНК — получили в 1944 г. Эвери (О. Т. Avery), Маклеод (С. М. MacLeod) и Маккарти (М. McCarty).
Если первоначально о трансформации судили по такому визуальному признаку колоний пневмококков, как шероховатые (бескапсульные) и гладкие (инкапсулированные), то во второй половине 1950-х гг. в качестве маркера стали использовать устойчивость к антибиотикам, в частности стрептомицину. В результате было показано, что частота трансформации пропорциональна количеству добавленной ДНК, т. е. на поверхности реципиентных клеток находится определенное число сайтов для поглощения ДНК. Кроме того, выяснилось, что частота трансформации зависит от фазы развития культуры бактерий.
Трансформация в каждом конкретном случае является специфическим процессом, который находится под контролем генома, хотя в целом природа трансформирующей ДНК может широко варьировать.
Это либо хромосомная ДНК генетически близкой или дистанцированной бактерии, либо ДНК бактериальной плазмиды, либо препарат ДНК бактериофага (в последнем случае трансформацию называют трансфекцией). Трансформация хромосомной, плазмидной и фаговой ДНК также описана у метаногенных и экстремально галофильных архей.
По современным взглядам, биологический смысл трансформации неоднозначен.
Во-первых — и это самое главное — экзогенная ДНК играет роль вектора при горизонтальной передаче селективно-полезных аллелей (например, аллели реnА, отвечающей за устойчивость Neisseria gonorrhoeae к пенициллину).
Во-вторых, если нет альтернативы, экзогенная ДНК выступает в качестве матрицы при репарации двухцепочечных повреждений ДНК (см. раздел 16.5.1.4).
Втретьих, ДНК может тривиально использоваться в качестве питательного субстрата. Так, на примере Haemophilus influenzae показано, что лишь ~15% экзогенной меченой ДНК интегрируются в хромосому реципиента, а 85% деградируют до нуклеотидов и нуклеозидов, которые утилизируются при метаболизме; в случае В. subtilis и S. pneumoniaeинтегрируются ~50% ДНК, а другая половина разрушается.
Различают феномен природной трансформации и экспериментальный метод индуцированной трансформации. В первом случае объект способен самостоятельно трансформироваться с помощью эндогенных механизмов — либо перманентно, либо за счет временного перехода в особое физиологическое состояние, которое называется компетентностью (см. ниже). Во втором случае компетентность вызывают искусственно, т. е. объект вынуждают воспринимать препарат ДНК из окружающей среды. Для этого грамотрицательные бактерии, например, Е. coli, преинкубируют на холоде в среде, содержащей 50-100 мМ Са2+; хорошие результаты дает обратимое увеличение проницаемости СМ под воздействием пульсирующего электрического поля, или электропорация.
Истинные масштабы трансформации в природной среде неизвестны. В лабораторных условиях она обнаружена примерно у 50 видов бактерий и трех видов архей, в частности Halobacterium volcanii.
В настоящее время механизмы бактериальной трансформации охарактеризованы на ряде модельных объектов, среди которых есть грамположительные (прежде всего, В. subtilis и S. pneumoniae) и грамотрицательные (в частности, Acinetobacter sp. штамм BD4123, Н. influenzae, Helicobacter pylori, N. gonorrhoeae, N. meningitidis, Pseudomonas stutzeri и Thermusthermophilus).
Напомним, что различие между этими морфотипами состоит в том, что оболочка грамотрицательных бактерий образована двумя мембранами — СМ и ОМ, которые ограничивают периплазматический компартмент, содержащий, в числе прочего, пептидогликановый саккулус толщиной 3-7 нм. В отличие от этого грамположительные бактерии не обладают ОМ, а их саккулус обычно имеет толщину >50 нм (см. I том учебника).
Таким образом, характер преодолеваемых клеточных барьеров у грамположительных и грамотрицательных бактерий существенно различается, что отражается в деталях системы импорта ДНК (рис. 205 и 206).
В обоих случаях трансформация включает в себя пять этапов:
— освобождение ДНК донором, а также приобретение состояния компетентности реципиентом (эти процессы могут быть сопряженными или протекают независимо друг от друга);
— рецепция ДНК и связывание ДНК;
— доставка ДНК к транслокатору;
— процессинг ДНК и транслокация ДНК в цитоплазму;
— интеграция ДНК в геном.
Освобождение ДНК донором. Необходимым условием трансформации служит появление свободной ДНК донора вблизи клетки реципиента. Теоретически, существуют два пути «пожертвования» ДНК.
С одной стороны, ДНК может выходить в окружающую среду после автолиза части популяции. Это — вероятностное событие, которое происходит при достижении стационарной фазы, а также в том случае, когда клетки попадают в неоптимальные условия и оказываются в состоянии стресса. Патогенные бактерии могут лизироваться иод воздействием иммунной системы хозяина или в результате антибиотикотерапии. Избирательный автолиз также может быть следствием фазовой изменчивости (см. раздел 16.6.2) или апоптоза, т. е. запрограммированной смерти клетки (см. раздел 17.2.2). Центральную роль при автолизе играет N-ацетилмурамил-L-аланин-амидаза, а также фосфолипаза, нарушающая целостность СМ.
С другой стороны, ДНК может секретироваться живыми клетками. Вероятно, в данном случае используется секреторная система IV типа (см. I том учебника). Однако неизвестно, предшествует ли экспорту ДНК репликация и подвергается ли секретируемая ДНК какому-нибудь подготовительному процессингу.
У ряда грамотрицательных бактерий, в частности Е. coli, Н. influenzae, Pseudomonas aeruginosa, N. gonorrhoeae. Salmonella entérica серовар Typhimurium и Shigella flexneri, существует альтернативный механизм трансформации - ДНК секретируется не в «голом» виде, а упаковывается в эвагинирующий участок ОМ, или блебинг-везикулу (см. I том учебника). В таком инкапсулированном виде хромосомная или плазмидная ДНК, совместно с периплазматическими автолизинами, а также факторами вирулентности, в частности гемолизинами и Шига-токсинами, доставляется к поверхности ОМ реципиента. После слияния отпочковавшегося фрагмента ОМ донора и ОМ реципиента содержимое «трансформосомы» (англ. transfórmaseme), в том числе трансформирующая ДНК, попадает в периплазматический компартмент.
Данный механизм трансформации внешне напоминает трансдукцию (см. ниже), когда ДНК также передается от донора к реципиенту в упакованном виде.
Приобретение состояния компетентности реципиентом. Компетентностью по отношению к генетической трансформации, или просто компетентностью (англ. competence) называется приобретенная в ходе онтогенеза способность связывать и переносить в собственный цитоплазматический компартмент экзогенную высокомолекулярную ДНК. Иными словами, это регулируемая экспрессия генов, кодирующих систему импорта ДНК.
Подавляющее большинство природно трансформируемых бактерий приобретает состояние компетентности только в определенной экологической обстановке — по достижении критической плотности популяции (~108 клеток • мл-1), что обычно соответствует поздней логарифмической или ранней стационарной фазе (см. раздел
21.1.1). При этом компетентность индуцируется либо у всей культуры, либо только у части клеток, иногда очень небольшой (примером служит В. subtilis).
В ходе развития компетентности синтезируются de novo около 20 специфических белков, так что ее можно рассматривать как своеобразную дифференциацию.
Приобретение компетентности связано с «чувством кворума» и является регуляторным ответом индивидуальной клетки на коллективный биосинтез автоиндуктора, или феромона (см. раздел 18.4.2). Роль последнего выполняет гептадекапептид CSP (сокр. англ. competence stimulating peptide). Зрелый феромон образуется в результате протеолитического процессинга N-концевого домена преферомона, полипептида СоmС и секретируется с помощью ABC-транспортера ComAB. При пороговом накоплении во внеклеточном пространстве феромон начинает воздействовать на двухкомпонентную сигнальную систему, состоящую из автофосфорилирующейся гистидинкиназы ComD (мембранного проводника сигнала) и акцептора фосфорильной группы — цитоплазматического белка СоmЕ (регулятора клеточного ответа). Белок СоmЕ связывается с контролирующим элементом оперона компетентности сот и индуцирует транскрипцию структурных генов comCDE.
Таким образом, компетентность регулируется окружающей средой (исключением служат представители рода Neisseria, компетентные во всех фазах роста культуры).
Гены компетентности comCDE располагаются по соседству с локусом ori, отвечающим за инициацию репликации. Показано также, что частота актов инициации репликации у Е. coliзависит от полноценности питательной среды. Отсюда следует, что изменение темпа репликации должно непосредственно влиять на число копий генов comCDE. Иными словами, можно предположить, что расположение генов comCDE близко к началу репликации позволяет соотнести компетентность с клеточным размножением, и что чувство кворума дает бактериям возможность предвидеть момент наступления неблагоприятных условий голодания, когда приобретение селективно-полезных признаков путем трансформации может способствовать выживанию.
Рецепция и связывание ДНК. Хотя по расчетным данным на поверхности компетентной бактериальной клетки имеется 30-80 сайтов связывания трансформирующей ДНК, эта сторона явления наименее изучена. В частности, до сих пор неизвестно, существует ли вообще специфический рецептор для ДНК.
Высокая эффективность внутривидовой трансформации Haemophilus influenzae и Neisseria gonorrhoeae определяется наличием в геномах этих бактерий, повторяющихся DUS-последователь- ностей длиной 9-10 п. н. (сокр. англ. DNA uptake sequence). В частности, DUS-последовательность N. gonorroehae имеет структуру 5'-GCCGTCTGAA-3' и представлена 1965 копиями на хромосому.
Однако корреляция между существованием в геномах этих бактерий большого количества DUS-повторов и присутствием на клеточной поверхности рецепторов (которые различали бы «родственную» ДНК, содержащую DUS, и «неродственную» ДНК, которая DUS не содержит) до сих пор не выявлена.
Как уже отмечалось, представители рода Neisseria обладают перманентной компетентностью. Благодаря высокому уровню горизонтального переноса генов популяции этих бактерий приобретают панмиктический характер, а их геномы имеют мозаичную структуру.
Центральную роль в связывании ДНК и ее доставке к транслокаторному комплексу как у грамположительных, так и у грамотрицательных бактерий играют псевдофимбрий компетентности (англ. competence pseudopili,![]() — гомологи фимбрий IV (англ. type four pili, TFP).
— гомологи фимбрий IV (англ. type four pili, TFP).
Напомним, что обычные фимбрии IV типа представляют собой длинные (до нескольких мкм) и одновременно с этим тонкие (диаметром ~6 нм) поверхностные придатки, состоящие из субъединиц белка пилина. Они участвуют в образовании биопленок и плодовых тел миксобактерий, а также — благодаря способности собираться и вновь разбираться — обеспечивают поверхностное перемещение рывком, или твитчинг (см. I том учебника).
Для трансформации не требуются полноценные фимбрии IV типа, а достаточно псевдофимбрий — коротких цилиндрических структур (длиной ~50 нм, что соответствует радиальной протяженности периплазматического компартмента), состоящих из 40-100 субъединиц псевдопилина.
Судя по тому, что фимбрии IV типа и псевдофимбрии содержат взаимно гомологичные компоненты, они имеют одинаковую архитектуру и сходный механизм действия. К числу консервативных белков у них относятся:
— препилины и препсевдопилины;
— сигнальные пептидазы, осуществляющие процессинг препилинов и препсевдопил инов;
— экспортные АТФазы;
— вспомогательные белки в составе СМ;
— вспомогательные поверхностные белки и белки ОМ;
— секретины.
Белки первых четырех групп входят в состав псевдофимбрий как у грамположительных, так и у грамотрицательных бактерий (например, В. subtilis и N. gonorrhoeae). Белки последних двух групп участвуют в трансформации только у грамотрицательных бактерий.
Предполагается, что за счет своего сокращения псевдофимбрия доставляет ДНК к транслокатору, расположенному в СМ, причем этот процесс не требует затраты энергии.
Таким образом, полые цилиндрические структуры, встроенные в клеточную поверхность, могут транспортировать белки (при секреции) или ДНК (при трансформации).
Следует обратить внимание на существенное различие механизмов перемещения белка и ДНК с помощью (псевдо)фимбрии. При секреции белка фимбрия служит выходным каналом, в то время как при трансформации псевдофимбрия перемещает ДНК за счет своего сокращения.
Доставка ДНК к транслокатору у грамположителъных бактерий (на примере В. subtilis). Псевдофимбрия В. subtilis состоит из псевдопилинов ComGC, ComGD, ComGE и ComGG (рис. 205). Сборка этой структуры является эндергоническим процессом; источником энергии служит АТФаза ComGA, связанная с внутренней поверхностью СМ.
Рис. 205. Поглощение ДНК при трансформации В. subtilis. СМ — цитоплазматическая мембрана; СW — клеточная стенка; ДНКд — ДНК донора; ДНКр — ДНК реципиента;![]() — псевдофимбрия; DВ — ДНК-связывающий белок; СоmЕА — мембранный рецептор ДНК; СоmЕС — мембранный канал; N — нуклеаза; СоmFА — АТФаза.
— псевдофимбрия; DВ — ДНК-связывающий белок; СоmЕА — мембранный рецептор ДНК; СоmЕС — мембранный канал; N — нуклеаза; СоmFА — АТФаза.
Стрелкой показано сокращение псевдофимбрии.
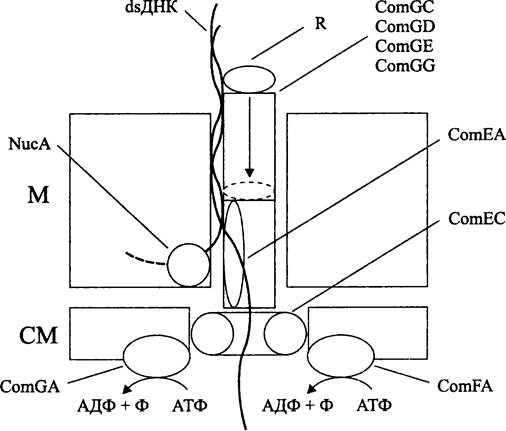
Предполагается, что на дистальном конце псевдофимбрии находится неиденгифицированный рецептор ДНК.
Сократимая псевдофимбрия играет роль динамического посредника при взаимодействии между рецептором ДНК и ДНК-связывающим белком СоmЕА. В свою очередь, белок СоmЕА презентирует ДНК транслокатору СоmЕС, который образует сквозной канал в СМ. Параллельно с этим ДНК переводится в одноцепочечную форму (см. ниже).
При доставке к транслокатору ДНК необходимо преодолеть клеточную стенку, для чего требуются локальные изменения в пептидогликановом саккулусе. По- видимому, физический доступ ДНК к белку СоmЕА обеспечивает цилиндр псевдофимбрии, который пронизывает клеточную стенку и состоит из СоmG-белков.
Доставка ДНК к транслокатору у грамотрицательных бактерий (на примере N. gonorrhoeae). У грамотрицательных бактерий путь ДНК к транслокатору усложняется тем, что она должна дополнительно преодолеть ОМ.
Вначале экзогенная ДНК связывается с неидентифицированным рецептором, который распознает имеющиеся в ней DUS-последователыюсти (см. выше). Затем ДНК проникает в периплазматический компартмент при помощи специализированной транспортной системы — гомолога секреторной системы II типа. В обоих случаях используется пора, расположенная в ОМ и состоящая из секретина РilQ (рис. 206).
Рис. 206. Поглощение ДНК при трансформации N. gonorrhoeae. СМ — цитоплазматическая мембрана; ОМ — наружная мембрана; М — муреиновый саккулус; Трс — муреингидролаза; DUS — рецептор для DUS- последовательности; dsДНК — двухцепочечная ДНК; ssДНК — одноцепочечная ДНК; PilQ — субъединица секретиновой водной поры в наружной мембране; РilЕ и СоmР — псевдопилины; EndA — эндонуклеаза; СоmЕ — периплазматический рецептор одноцепочечной ДНК; СоmА — субъединица водного канала в цитоплазматической мембране; PilF и РilТ— АТФазы.
Стрелкой показано сокращение псевдофимбрии.
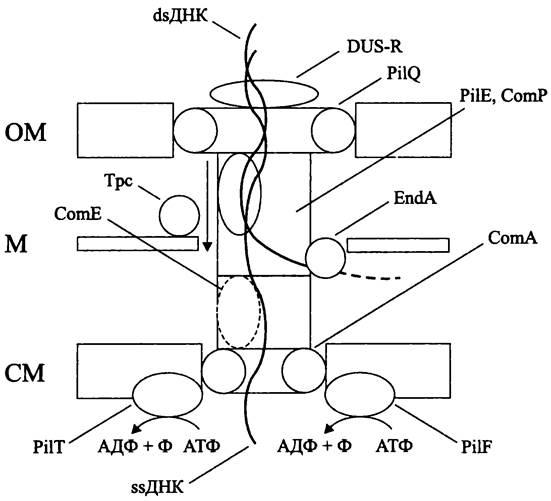
Напомним, что секреторная система II экспортирует белки свернутой конформации (см. I том учебника). Помимо этого, секретины образуют портал для выхода
фимбрии IV типа через ОМ на клеточную поверхность, а также используются при конъюгации (см. ниже).
Дистальным компонентом секреторной системы II служит водная пора, образованная додекамером белка секретина. Ее максимальный внутренний диаметр составляет 9,5 нм; этого достаточно, чтобы дать проход двухцепочечной ДНК, диаметр которой 2,4 нм.
После проникновения в периплазматической компартмент ДНК связывается с белком СоmЕ, а затем доставляется к транслокатору с помощью сократимой псевдофимбрии, которая состоит из псевдопилинов РilЕ и СоmР. Сборка этой структуры является эндергоническим процессом; источником энергии служит АТФаза РilТ, находящаяся на внутренней поверхности СМ.
Прохождению ДНК сквозь муреиновый саккулус способствуют муреингидролаза Трс и пенициллинсвязывающие белки, а также вспомогательный белок СоmL.
Процессинг и транслокация ДНК в цитоплазму. Процессинг трансформирующей ДНК заключается, во-первых, в ее расщеплении на фрагменты и. во- вторых, в ее переходе в одноцепочечную форму.
Размер хромосомной ДНК, которая интегрируется в реципиентный геном, в общем случае не оценивался, хотя имеются данные, что клетка может воспринимать несколько независимых фрагментов, в сумме составляющих 1-5% ее хромосомы. В свою очередь, согласно результатам, полученным в опытах по трансформации плазмидами, относительно крупные молекулы ДНК (~50 кДа) перед транслокацией расщепляются на фрагменты размером ~10 кДа.
При трансформации грамположительных и грамотрицательных бактерий через СМ всегда проходит только одна цепь ДНК. Вторая цепь подвергается нуклеолитическому расщеплению с помощью мембраносвязанной нуклеазы (в частности, B. subtilis использует для этого нуклеазу NucA, а N. gonorrhoeae нуклеазу EndА). Продукт процессинга, одноцепочечная ДНК, проникает в цитоплазму в линейной форме, причем начало импорта инициируется свободным концом молекулы. Одноцепочечная ДНК устойчива к воздействию цитоплазматических рестриктаз, а от других повреждений ее защищают цитоплазматические SSB-белки.
Как уже указывалось, ДНК транслоцируется в цитоплазму через водный канал, который образуют интегральные белки СоmЕС (В. subtilis) или СоmА (N. gonorrhoeae).
Транслокация ДНК является энергозависимым процессом. Теоретически, источником энергии может быть гидролиз АТФ или протонный градиент, хотя этот вопрос до конца еще не решен. Имеются данные, что транслокация происходит за счет энергии гидролиза АТФ в реакции, которую катализируют АТФазы ComFA (В. subtilis) или PilF (N. gonorrhoeae).
У компетентных палочковидных бактерий, например, В. subtilis, система для импорта ДНК ассоциирована с клеточными полюсами. В частности, там сосредоточена «сборочная» АТФаза ComGA и «транслокационная» АТФаза ComFA, а также SSB- белки и белок RecA.
Интеграция ДНК в состав генома. Грамположительные бактерии, например, В. subtilis и S. pneumoniae, а также грамотрицательные бактерии, например, Acinetobacter sp. штамм BD413 и Pseudomonas stützen, способны воспринимать и гомологичную, и гетерологичную ДНК. Напротив, представители родов Haemophilus и Neisseria трансформируются только ДНК близкородственных объектов, содержащую видоспецифические DUS-повторы.
Вероятность интеграции высокогомологичной ДНК близка к единице, тогда как для низкогомологичной ДНК она составляет 0,1-10%. Иначе говоря, основным препятствием для трансформации является не поглощение ДНК или ее рестрикция, а процесс интеграции в хромосому реципиента, который зависит от типа рекомбинации. В частности, для гомологической рекомбинации необходимо, чтобы трансформирующая ДНК содержала участки гомологии с резидентной ДНК протяженностью порядка 25-200 п. н. В свою очередь, интеграция путем незаконной рекомбинации происходит с очень низкой вероятностью.
Главным барьером на пути интеграции дивергентной ДНК в геном бактерии является система исправления ошибок спаривания, кодируемая генами mutSLH (см. раздел 16.5.1.3).
Поступившая в цитоплазму процессированная хромосомная ДНК интегрируется путем рекомбинации с гомологичным участком реципиентной ДНК. Для этого используется белок RecA и система рекомбинации RecBCD (см. раздел 16.6.1.2).
В случае трансформации с помощью плазмидной ДНК последняя либо интегрируется в хромосому путем гомологической или сайтспецифичной рекомбинации
(т. е. становится эписомой), либо принимает кольцевую двухцепочечную форму с возобновлением способности к автономной репликации — при том условии, что она защищена от разрушительного воздействия хозяйских рестриктаз.
Конъюгация. Конъюгацией (англ. conjugation; от лат. conjugatio — слияние) называется механизм одностороннего переноса плазмиды или транспозона, который осуществляется путем прямого контакта между донором и реципиентом, в результате чего последний сам становится потенциальным донором.
Уникальной особенностью конъюгации является асимметричный перенос ДНК от клетки к клетке, одна из которых играет роль донора, отвечающего за все транспортные функции (закодированные в плазмиде или транспозоне), а другая является реципиентом. В отличие от трансформации и трансдукции, конъюгация всегда происходит с участием живого донора.
Конъюгацию рассматривают в качестве своеобразного полового процесса (англ. bacterial sex). Действительно, в ходе нее партнеры находят друг друга, вступают в физический контакт, встречно сигнализируют о готовности к передаче генетической информации и производят акт передачи.
Конъюгативная плазмида может содержать только гены, необходимые для ее переноса, а может, как и конъюгативный транспозон, включать в свой состав отдельные хромосомные гены. Благодаря этому между бактериями разной степени родства, в том числе филогенетически взаимно удаленными, распространяются гены, обеспечивающие эффективное приспособление к изменяющимся условиям среды (устойчивость к антибиотикам, тяжелым металлам, детергентам и ультрафиолетовому излучению; образование экзоферментов и биодеградация ксенобиотиков; способность вступать в симбиоз и т. д.).
Конъюгация играет особую роль в распространении устойчивости патогенных бактерий к антибиотикам. Известны три стратегии резистентности к антибиотикам: (1) инактивация; (2) экскреция и (3) модификация мишени. Примерами соответствующих механизмов служат: (1) синтез β-лактамаз: (2) использование АВС-транспортеров и (3) метилирование рРНК.
Каково происхождение генов, отвечающих за устойчивость к антибиотикам? Маловероятно, что речь идет об ответе бактерий на введение антибиотиков в медицинскую практику, связанном с быстрым накоплением мутаций. Скорее всего, за миллионы лет до начала эры антибиотиков (1950-е годы) гены устойчивости использовались актинобактериями и плесеневыми грибами для защиты от побочного воздействия этих вторичных метаболитов (изначальной ролью которых служит внутриклеточный и межклеточный сигналинг).
На фоне повсеместно используемой аитибиотикотерапии горизонтальный перенос устойчивости, как способ достижения экологической адаптации патогенных бактерий, приобрел угрожающие размеры. Считается, что основное значение в этом процессе принадлежит конъюгации.
По сравнению с остальными механизмами горизонтального переноса конъюгация меньше зависит от степени родства между донором и реципиентом, т. е. она характеризуется наибольшим промискуитетом (см. раздел 16.1.2.1). В редких случаях она даже принимает интердоменный характер, и тогда бактерии конъюгируют с клетками дрожжевых грибов, высших растений и млекопитающих (в последнем случае примером служит клеточная культура китайского хомячка).
Конъюгацию у бактерий впервые продемонстрировали в 1946 г. американские генетики Джошуа Ледерберг и Эдвард Тейтем (Е. L. Tatum). При смешивании двух ауксотрофных мутантов Е. coli К12, thr- и lеu- они наблюдали ревертантов к прототрофности с частотой ~10~7 (среднестатистическая вероятность спонтанного появления двойных ревертантов была бы на пять порядков меньше).
Помимо Е. coli, к настоящему времени конъюгативные системы обнаружены у представителей 30 родов грамотрицательных бактерий (в частности, у родов Agrobacterium, Bacteroides, Citrobacter, Erwinia, Paracoccus, Pseudomonas, Rhizobium, Rhodobacter и Salmonella), а также у грамположительных бактерий (в частности, у родов Enterococcus, Staphylococcus, Streptococcus и Streptomyces). Процесс, подобный конъюгации, описан в 1980-х гг. у экстремально галофильных архей, однако в дальнейшем это не подтвердилось.
Как отметил Ледерберг в своих воспоминаниях 1987 г., открытие конъюгации, послужившее стартовой чертой для генетики бактерий, было типичным случаем серендипити.
Применительно к научным исследованиям слово серендипити (англ. serendipity) используется для обозначения открытия, совершенного проницательным исследователем при благоприятном стечении обстоятельств. Авторство этого неологизма принадлежит английскому писателю Хорейсу Уолполу (Н. Walpole; 1717-1797), который в волшебной сказке «Три принца Серендипа» (1754 г.) описал путешествие владетелей о-ва Серендип (старинное название индийского о-ва Цейлон, ныне островное государство Шри Ланка), которые не проходили мимо ценных находок.
Действительно, штамм К12, наугад выбранный Ледербергом и Тейтемом из 20 штаммов Е. coli коллекции Стэнфордского университета (США), характеризуется редчайшим сочетанием свойств:
— содержит конъюгативную F-плазмиду, что само по себе довольно редко;
— трансферная система F-плазмиды дерепрессирована; в противном случае частота рекомбинантов оказалась бы за гранью обнаружения;
— реципиент спонтанно потерял F-плазмиду, иначе ее передача блокировалась бы из-за феномена поверхностного исключения (см. раздел 16.1.2.1);
— F-плазмида содержит четыре инсерционные последовательности и может интегрироваться в разные участки хромосомы, что делает К12 часто рекомбинирующим (Hfr) штаммом;
— маркеры thr и leu тесно сцеплены, поэтому частота появления рекомбинантов выше, чем в том случае, когда бы они находились на разных концах хромосомы.
После открытия конъюгации ключевые достижения в области ее феноменологии последовали одно за другим. В 1950 г. классический опыт Дэйвиса (В. D. Davis), в котором между донором и реципиентом помещалась перегородка из пористого стекла, показал, что фактор генетической рекомбинации Е. Coli — не фильтрующийся, т. е. хромосомные маркеры переносятся только при межклеточном контакте. В 1953 г. английский генетик Вильям Хейс (W. Hayes) идентифицировал «инфекционный вектор», или отвечающий за конъюгацию и горизонтально передаваемый фактор фертильности (F). Наконец, в 1955 г. с помощью методики «прерывистого» спаривания Франсуа Жакоб и Элие Вольман (Е. L. Wolman) установили, что гены Е. coli расположены линейно и при конъюгации передаются однонаправленно. Так впервые была построена генетическая карта бактериальной хромосомы. В дальнейшем методы конструирования рекомбинатных геномов, основанные на конъюгации, стали одним из важнейших орудий генетики бактерий.
Основные этапы и системы конъюгации. Па первом этапе конъюгации (не путать с последовательностью событий, которая начинается с первичного контакта между партнерами; см. ниже) происходит репликация плазмиды или транспозона, а также процессинг их ДНК в нуклеопротеиновый интермедиат, или трансферный конъюгат.
На втором этапе одноцепочечная, или трансферная Т-ДНК (сокр. англ. transferred — переносимая) секретируется в цитоплазму реципиентной бактерии.
На третьем этапе синтезируется комплементарная цепь, после чего двухцепочечная ДНК может реплицироваться (автономно или после интеграции в хромосому реципиента).
Для осуществления этих этапов используются две функциональные системы, гены которых относятся к области tra (сокр. англ. transfer) конъюгативной плазмиды или конъюгативного транспозона:
— Mpf-система для формирования партнерской пары (сокр. англ. mating pair formation);
— Dtr-система для процессинга и секреции ДНК (сокр. англ. DNA transfer and replication).
Необходим также функциональный посредник, или интерфейс между этими системами. Его роль выполняет сопрягающий белок СР (сокр. англ. coupling protein). Он доставляет продукт Dtr-системы, или трансферный конъюгат ко входному порталу Mpf-системы и в той или иной степени способствует перемещению ДНК по конъюгационному каналу.
Генетические детерминанты Mpf- и Dtr-систем, а также фактора СР содержатся в факторах фертильности — самостоятельно передающейся конъюгативной плазмиде или конъюгативном транспозоне. Эти факторы не только распространяются горизонтальным путем, но и осуществляют перенос хромосомной ДНК или мобилизуемой нетрансмиссивной плазмиды (см. раздел 16.1.2.1).
Мобилизуемые (англ. mobilized, Mob) плазмиды не обладают способностью к самостоятельному переносу, поскольку у них имеется своя собственная Dtr-система и собственный фактор СР, но нет Mpf-системы. Если в клетке той же самой донорной бактерии присутствует конъюгативная плазмида, она играет роль хелпера, в результате чего Dtr-система Mob-плазмиды «паразитирует» на ее Mpf-системе.
Мобилизация может происходить двумя способами. При транс-мобилизации конъюгативная плазмида и мобилизуемая ДНК остаются физически разделенными. При цис-мобилизации происходит рекомбинационное слияние конъюгативной плазмиды с мобилизуемой ДНК, и они образуют ковалентный коинтеграт. После конъюгационного переноса коинтеграт либо сохраняется, либо разделяется на составные части при помощи резольвазы.
В некоторых случаях, например, у Bacteroides fragilis, в качестве хелпера при цис- мобилизации Mob- плазмиды выступает не конъюгативная плазмида, а конъюгативный транспозон (см. ниже).
Конъюгативные плазмиды. Конъюгативные плазмиды, в частности фактор фертильности F и F-подобные плазмиды, широко распространены у энтеробактерий. Реже они встречаются у представителей других родов, например, псевдомонад.
Они обладают способностью:
— к «вегетативной» репликации (в свободном или интегрированном состоянии);
— к переносу через тесно взаимодействующие клеточные оболочки половых партнеров (индивидуально или в комплексе с другой ДНК);
— к рекомбинации с хромосомами ДНК донора и реципиента (в разных их участках).
Фактор фертильности Е. coli (F) является представителем большой группы плазмид с одной и той же системой горизонтального переноса, которая закодирована в области tra.
Как и в общем случае, эти плазмиды классифицируются по группам несовместимости Inc (см. раздел 16.1.2.1). Плазмиды одной и той же группы взаимно «интерферируют», или конкурируют друг с другом за системы, осуществляющие репликацию и за взаимную изоляцию сестринских репликонов. В том случае, когда в клетке оказываются две плазмиды, принадлежащие к одной и той же группе несовместимости, одна из них рано или поздно будет элиминирована в ходе клеточного размножения. Иными словами, плазмиды одной и той же группы несовместимости не могут сосуществовать в общем хозяине.
В группы несовместимости IncF, IncH, IncJ и IncT входят F-подобные плазмиды, а в группы IncI, IncN, IncP и IncW — P-подобные плазмиды (см. ниже).
Группы несовместимости, в свою очередь, делятся на подгруппы. Например, к подгруппе IncFI относятся 24 плазмиды (в частности, F); к группе IncFII — 55 плазмид (в частности, СоIВ2), к группам IncFIII-IncFVII — 16 плазмид (в частности, pSU316); кроме того, существуют еще шесть неклассифицированных F-подобных плазмид (в частности, R51).
Фактор фертильности F представляет собой стабильно реплицируемую кольцевую двухцепочечную ДНК (1-2 копии на хромосому; ~100 т. п. н.; 60 генов). На участке размером 34 т. п.н. группируются 24 гена, продукты которых выполняют роль регуляторов процесса конъюгации (гены finCQUVW; сокр. англ. fertility inhibition) или непосредственно являются субъединицами Dtr- и Mpf-систем (гены traA-W). Продукты этих генов позитивно регулируют конъюгацию, обеспечивают эффект поверхностного исключения, биосинтез половых фимбрий (см. ниже) и стабилизацию партнерской пары, а также осуществляют процессинг и секрецию ДНК.
Системы конъюгативного переноса у разных грамотрицательных бактерий либо содержат многочисленный набор взаимно гомологичных компонентов (примером служат плазмиды F, R388, RP4 и Ti), либо их сходство проявляется только на уровне отдельных гомологов.
Ti-плазмида. Agrobacterium tumefaciens — это фитопатоген, вызывающий образование коронарных галлов вследствие интердоменного переноса Ti-плазмиды от бактерии к растению-хозяину (сокр. англ. tumor inducing). Другим примером онкогенной бактерии служит A. rhizogenes, вызывающая гипертрофию корневой системы.
Гены Ti-плазмиды обозначаются как vir-гены (сокр. англ. virulence). Среди них есть гомологи ira-генов, а также уникальные гены, обеспечивающие интердоменный перенос, и гены, которые начинают экспрессироваться в реципиентном растении (см. I том учебника).
В состав оперона virB входят 11 генов (virB1-virB11), которые кодируют субъединицы Mpf- системы, состоящей из канала для транспорта ДНК, и фимбрии, служащей для прикрепления донора к реципиенту. В свою очередь, оперон virD содержит 5 генов (virDl -virD5); три из них (virD1, virD2 и virD4) кодируют Dtr-систему, осуществляющую процессинг и секрецию ДНК.
Наряду с vir-онкогенами, которые вызывают сверхсинтез фитогормонов, Ti-плазмида содержит vir-гены, отвечающие за образование опинов. Бактерии, колонизировавшие растение, используют эти вещества в качестве питательного субстрата (см. I том учебника).
Внешними индукторами процесса горизонтального переноса Ti-плазмиды служат фенольные соединения и моносахара, которые секретируются поврежденными клетками растения и активируют двухкомпонентную сигнальную систему VirA/VirG. Она, в свою очередь, активирует транскрипцию регулона vir. Наряду с указанными субстратами, индукторами онкогенеза служит кислая среда (pH 5,0-5,5) или дефицит неорганического фосфора, сигнал, о чем воспринимается глобальной регуляторной системой PhoB (см. раздел 18.3.2.4).
В общем разделе, посвященном плазмидам, мы уже говорили, что у небольшой части клеток конъюгативная плазмида может путем «законной» или «незаконной» рекомбинации встраиваться в хромосому. В свою очередь, при эксцизии часть хромосомных генов захватывается плазмидой и вместе с ее собственными генами передается реципиенту. Иными словами, хромосома мобилизуется благодаря приобретению плазмидного ориджина горизонтального переноса oriT (см. ниже). В случае фактора F такое событие происходит с относительно высокой частотой и называется Hfr-переносом (см. раздел 16.1.2.1).
Из-за существенной разницы в размере молекулы ДНК конъюгационный перенос хромосомы отличается от конъюгационного переноса плазмиды. Поскольку он может случайно прерваться в любой момент, частота рекомбинации прогрессивно уменьшается для генов, удаленных от локуса oriT, который первым поступает в клетку реципиента. Кроме того, для стабильного наследования хромосомные гены донора должны включиться в хромосому реципиента посредством гомологической, или RecBCD-зависимой рекомбинации (см. раздел 16.6.1.2).
Конъюгативные транспозоны. Термин «конъюгативный транспозон» (англ. conjugative transposon) применяется по отношению к мобильному генетическому элементу, который вырезается из генома донора и с помощью «контактного» секреторного аппарата переносится в клетку реципиента, а затем включается в геном эксконъюганта.
В начале 1980-х гг. у грамположительных бактерий были описаны конъюгативные транспозоны размером 15- 70 т. п. н., кодирующие устойчивость к одному или нескольким антибиотикам и обладающие широким промискуитетом (классическим примером служит Tn916 Enterococcus faecalis, который имеет размер 18 т. п. н. и несет в себе ген устойчивости к тетрациклину).
Конъюгативные транспозоны у грамотрицательных бактерий, преимущественно энтеробактерий, были обнаружены только во второй половине 1990-х гг. (например, CTnscr94 Salmonella enterica серовар Typhimurium).
В настоящее время показано, что конъюгативные транспозоны имеются в геномах представителей родов Bacillus, Clostridium, Enterococcus, Escherichia, Haemophilus, Listeria, Neisseria, Proteus, Pseudomonas, Salmonella, Serratia, Staphylococcus, Streptococcus, Vibrio и др. (всего 25 родов, более 50 видов).
По данным секвенирования конъюгативного транспозона СТn391, он имеет мозаичную структуру и кодирует систему интеграции/эксцизии, сходную с таковой фага ![]() (см. раздел 16.6.1.2), а также систему горизонтального переноса, сходную с Mpf- и Dtr-системами плазмид, например R27 Salmonella sp. (см. выше). Помимо «эгоистических» детерминант, в том числе генов рестрикции/модификации, в число его 96 открытых рамок считывания входят гены устойчивости к ртути, а также к антибиотикам, в частности канамицину.
(см. раздел 16.6.1.2), а также систему горизонтального переноса, сходную с Mpf- и Dtr-системами плазмид, например R27 Salmonella sp. (см. выше). Помимо «эгоистических» детерминант, в том числе генов рестрикции/модификации, в число его 96 открытых рамок считывания входят гены устойчивости к ртути, а также к антибиотикам, в частности канамицину.
В отличие от плазмид, конъюгативные транспозоны не содержат ориджина репликации, и поэтому не конкурируют друг с другом за репликационные системы, т. е. не проявляют взаимной несовместимости. Поэтому в одной и той же клетке могут сосуществовать несколько таких генетических элементов.
Мобилизация конъюгативного транспозона происходит путем его вырезания из хозяйской хромосомы с помощью сайтспецифичной рекомбинации. Для этого он использует собственную систему, состоящую из интегразы/рекомбиназы и эксцизионазы (см. раздел 16.6.1.2). В результате этого транспозон покидает хромосому и превращается в кольцевой интермедиат. Он передается реципиенту с помощью механизма, аналогичного конъюгативному переносу плазмиды — путем нанесения разреза в локусе oriT и секреции одноцепочечной Т-ДНК (см. ниже). В некоторых случаях конъюгативный транспозон является нетрансмиссивным, и его перенос осуществляется с помощью Mpf-системы трансмиссивной плазмиды или в составе коинтеграта с конъюгативной плазмидой.
После проникновения в реципиентную клетку транспозонная ДНК рециркуля- ризируется и реплицируется. Благодаря собственной системе модификации она не подвергается хозяйской рестрикции. После этого она интегрируется в хромосому реципиента с помощью сайтспецифичной рекомбинации.
Важно иметь в виду, что гены, отвечающие за перенос конъюгативной плазмиды или конъюгативного транспозона, экспрессируются не конститутивно, а находятся под контролем со стороны глобальных регуляторных систем, а также специально предназначенных регуляторных элементов, которые входят в состав областей tra или vir (см. выше).
Расширенной вариацией на тему конъюгативных транспозонов являются интегроны (англ. integron; от англ. integration — объединение в одно целое и греч. on — сущее; «нечто, являющееся результатом объединения»). Это природные системы для клонирования и экспрессии генов, которые собирают иод одной крышей открытые рамки считывания и превращают их в функциональные гены. Неизменная «функциональная платформа» интегрона состоит из гена интегразы и соседствующего с ним прикрепительного сайта attI, который может рекомбинировать с прикрепительным сайтом attC другого репликона. В свою очередь, сайт attC тесно ассоциирован с кассетой, несущей гены устойчивости к антибиотикам, гены вирулентности и т. д. Рекомбинационный захват разнообразных кассет создает гибридные генетические структуры — интегроны и суперинтегроны. Функциональная платформа интегрона обычно не способна к автономной транспозиции, и поэтому интегроны горизонтально переносятся при помощи конъюгативных транспозонов или конъюгативных плазмид. Хромосомные суперинтегроны, эквивалентные по размеру небольшому геному, широко распространены у протеобактерий, обеспечивая их устойчивость к антибиотикам и патогенность.
Система формирования партнерской пары. Для переноса ДНК от донора к реципиенту используется координированно действующий мультипротеиновый комплекс, или аппарат конъюгации (англ. conjugation apparatus). Одной из его первоочередных задач и, соответственно, предпосылкой конъюгативного переноса служит образование интимной ассоциации между поверхностными структурами половых партнеров.
Первичный контакт в конъюгационных системах грамотрицательных бактерий осуществляет половая фимбрия (англ. sex pilus). Обычно это длинные (2-20 мкм), гибкие и сократимые фимбрии F-типа; реже — короткие (0,2-1 мкм), жесткие и несократимые фимбрии P-типа, например, Ti, pKM101, R388 и RP4.
F-фимбрии относятся к числу фимбрий IV типа (см. I том учебника). Они могут занимать как полярное, так и латеральное положение. В зависимости от штамма, их число на клетку варьирует в пределах 1-4. Цилиндрическая нить F-фимбрии имеет внешний диаметр 8 нм и содержит аксиальный канал диамером 2 нм. Она состоит из сильно гидрофобного белка F-пилина (7,2 кДа), который не содержит аргинина, гистидина, пролина и цистеина.
За образование зрелого F-пилина отвечают три гена. Структурный ген traA кодирует препи- лин молекулярной массой ~13 кДа. Процессинг препилина осуществляет сигнальная пептидаза LepB (продукт гена traB), расположенная на внутренней поверхности СМ (ей ассистирует продукт гена traQ). Она отрезает от белка-предшественника фрагмент, состоящий из 51 аминокислоты. Продукт гена traX путем N-ацетилирования образует из оставшегося фрагмента зрелый пилин. Всего в секреции и сборке пил ина участвуют не менее 17 генов, которые кодируют структурные и регуляторные белки.
Белок ТгаК образует в ОМ секретиновую пору, через которую фимбрия выходит на клеточную поверхность. Для фиксации секретинового кольца в ОМ используется белок TraV. Белок ТгаВ прикрепляет секретиновое кольцо к СМ. Белки TraEL с помощью «секреторной» АТФазы ТгаС участвуют в сборке фимбрии и регулируют ее рост в длину. Белки TraHUW и ТгbС принимают участие в сокращении фимбрии, а белки TraGN стабилизируют взаимодействие партнеров.
Кончик F-фимбрии связывается с поверхностными рецепторами реципиента, роль которых, по-видимому, играют липополисахариды и порин ОmрА. При этом
донор может принимать разное положение относительно реципиента (бок о бок, полюсом к полюсу, боком к полюсу или полюсом к боку).
После установления конъюгационного контакта кончик F-фимбрии взаимодействует с неидентифицированным вторичным конъюгационным рецептором. Сигнал об этом поступает на основание F-фимбрии, и она спонтанно, без затраты энергии, сокращается (точнее сказать, разбирается на мономеры, начиная с проксимальной части). За счет этого F--клетка подтягивается к F+-клетке, и они образуют партнерскую пару (англ, mating pair).
Итак, механизм первичного контакта с помощью сократимой фимбрии более или менее понятен. Однако, каким образом партнерская пара образуется с помощью несократимой фимбрии, не установлено. Одно из двух — либо фимбрия разбирается на мономеры, начиная с дистальной части, либо сбрасывается целиком; в обоих случаях дистанция между партнерами уменьшается и переходит в плотный контакт.
Характерным признаком партнерской пары между двумя грамотрицательными бактериями служит образование конъюгационного мостика (англ. conjugational junction) в результате слияния прилегающих друг к другу участков ОМ донора и ОМ реципиента. Протяженность таких мостиков составляет 150-200 нм при контакте полюсом к полюсу и до 1500 нм при контакте бок о бок.
Ранее (см. раздел 16.1.2.1) мы уже упоминали о несовместимости плазмид, основанной, в частности, на феномене поверхностного исключения. Запрет на вход (англ. entry exclusion, Еех) объясняется тем, что белок ТгаТ, содержащийся в ОМ реципиента, препятствует связыванию F- фимбрии. Кроме того, после образования партнерской пары белок TraS, входящий в состав СМ реципиента, блокирует проникновение донорской ДНК.
Система для процессинга донорской ДНК и секреции Т-ДНК. Если у грамотрицательных бактерий для формирования партнерской пары донору необходима придаточная структура — половая фимбрия, то для процессинга и секреции ДНК ему нужны две органеллы: цитоплазматическая релаксосома и транслокон, или конъюгационная пора в клеточной оболочке.
Каким образом запускается процессинг донорской ДНК, еще неизвестно. В любом случае сигнал об установлении контакта между партнерами (англ, mating signal) поступает на релаксосому (англ. relaxosome) — консервативную органеллу, осуществляющую процессинг ДНК (рис. 207). Суть дела состоит в каталитическом превращении су перепирал изованной, кольцевой двухцепочечной ДНК в линейную одноцепочечную форму. Каскад этих превращений инициируется в уникальном локусе огiТ (сокр. англ. origin of transfer).
Рис. 207. Релаксосома (на примере плазмиды R388 Е. coli). оriТ — ориджин переноса; 1 — релаксазный и 2 — геликазный домены релаксазы/геликазы TrwC; Тук18 — каталитический остаток тирозина, образующий ковалентную связь с Т-ДНК; IHF — хозяйский ДНК-связывающий белок; TrwA — репрессор транскрипции.
Стрелкой показано направление складывания ДНК под воздействием белка IHF.
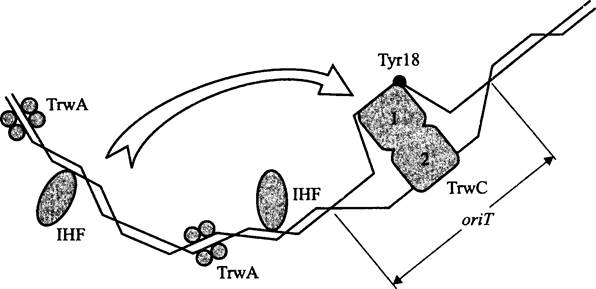
В состав релаксосомы входят:
— сегмент двухцепочечной плазмидной ДНК, содержащий ориджин переноса оггТ и фланкирующие участки;
— плазмидная релаксаза/геликаза;
— плазмидный репрессор транскрипции;
— хозяйский ДНК-изгибающий белок IHF.
Локус огiТ расположен по одну из сторон области tra. Он имеет небольшой размер (<200 п. н.) и по сравнению с остальными участками плазмидной хромосомы характеризуется более высоким содержанием АТ-пар. Он первым поступает в реципиентную клетку; следом за ним в ориентации 5' —> 3' доставляется остальная часть нити Т-ДНК.
Релаксаза/геликаза ТгаI и TrwC (соответственно, в случае плазмид F и R388), как следует из названия этого фермента, обладает двумя активностями, локализованными в разных доменах. Релаксазный домен, обладающий эндонуклеазной (точнее сказать, трансэтерификазной) активностью, находится на N-конце. В свою очередь, геликазный домен, который расплетает двойную спираль ДHК, расположен на С-конце.
Репрессор транскрипции TraY и TrwA (соответственно, для плазмид F и R388) представляет собой небольшой тетрамерный белок, который занимает положение, но обе стороны локуса oriT и стимулирует активность релаксазы/геликазы, а также негативно регулирует экспрессию оиеронов tra или traw.
Хозяйский белок IHF локально изгибает молекулу ДНК под углом ~160°, в результате чего она принимает форму буквы U. Это завершает сборку релаксосомы и помогает релаксазе/геликазе нанести разрез в Т-цепи. Сайт для связывания белка IHF представляет собой консервативную последовательность 5'- YAAN NNNTTGАТ- 3' (Y обозначает С или Т, N — одно из четырех канонических оснований).
Процессинг плазмидной ДНК начинается с того, что релаксаза/геликаза выбирает одну из комплементарных цепей и наносит разрез в nick-сайте локуса oriT. Этот сайт представляет собой динуклеотид GC или СС и находится внутри консервативной последовательности «5' -TAAYTGCGCCCT-3', которая фланкирована инвертированными повторами (они образуют шпильки, позволяющие релаксазе/геликазе распознать локус oriT). Попутно отметим, что название «релаксаза» (англ. relaxase) связано с тем, что посредством одноцепочечного разрыва эта эндонуклеаза устраняет негативную суперспирализацию плазмидной ДНК.
После нанесения разреза релаксаза/геликаза расплетает двухцепочечную ДНК в направлении 5' —> 3', постепенно удаляясь от генов оперона tra. Источником энергии служит АТФ. Интактная цепь служит матрицей для образования комплементарной цепи с помощью хозяйской ДНК-полимеразы Pol III. При этом действует механизм «катящегося кольца» (см. раздел 16.4.1.2). Освобожденный 5'-конец вытесняемой Т-цепи связывается фосфоэфирной связью с остатком Туг18 релаксазы, в то время
как 3'-конец остается незанятым (рис. 208). В результате образуется ДНК-релаксазный аддукт, или нуклеопротеиновый интермедиат, который играет роль трансферного субстрата. Таким образом, релаксаза/геликаза преобразует свободную энергию расщепления фосфодиэфирной связи в свободную энергию фосфотирозильного интермедиата.
Рис. 208. Конъюгативный перенос ДНК. А — релаксаза; Б — праймаза; В — ДНК-полимераза Pol III. Белые треугольники — SSB-белки; черные треугольники — белок ArdA; сплошные линии — старые нити ДНК; пунктиры — новые нити ДНК; гребенки — РНК- праймеры. Положение релаксазы и праймазы, а также пограничные структуры партнерской пары и конъюгационного канала схематизированы; репликация Т-ДНК условно изображена в процессе переноса до рециркуляризации.
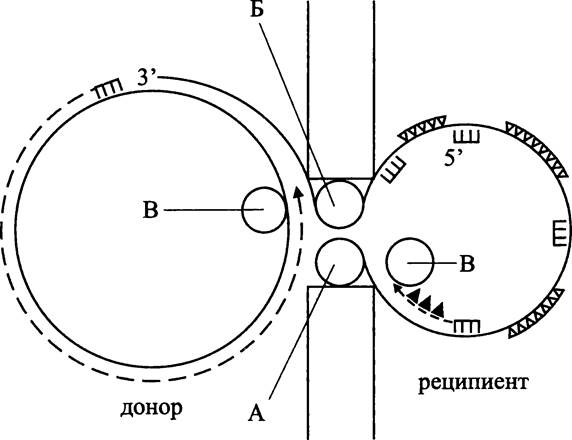
После этого релаксосома вступает в контакт с секреторной порой транслокона, входной портал которой расположен на внутренней поверхности СМ (рис. 207). Важно подчеркнуть, что источником сигнала для распознавания трансферного субстрата служит не сама ДНК, а релаксаза/геликаза, играющая роль «пилотного» белка. В этом заключается одно из существенных отличий конъюгации от трансформации.
Секреторная часть Мрf-системы гомологична секреторной системе III типа (см. I том учебника). Подобные ей системы транспортируют экзопротеины, например, токсины, совершенно независимо от ДНК. В случае конъюгации мы сталкиваемся с парадоксальной ситуацией, когда ДНК фактически является попутчиком релаксазы/геликазы.
Рецептором для секреторного субстрата служит сопрягающий белок. После связывания с трансферным субстратом он либо самостоятельно играет роль АТФ-зависимой транслоказы (в частности, в случае плазмиды 11388), либо презентирует трансферный субстрат транслоказе и совместно с ней выступает в качестве АТФ-
зависимой экспортной помпы (например, в случае плазмид F и Ti). Характерно, что сопрягающие белки обнаруживают гомологию с ДНК-транслоказами SpoIIIE В. subtilis и FtsK Е. coli(см. раздел 16.4-2.1).
Сопрягающий белок. Субъединицы сопрягающего белка TraG (в случае F- плазмиды), VirD4 (в случае Ti-плазмиды) и TrwB (в случае плазмиды R388) заякорены N-концом в СМ и образуют гексамерное кольцо на внутренней поверхности СМ.
Сопрягающие белки принадлежат к суперсемейству ААА-АТФаз, которое представлено во всех трех доменах глобального древа.
Мономеры этих белков содержат консервативные сегменты, или нуклеозидтрифосфаг-связывающие мотивы Уокера (англ. Walker A and В nucleoside triphosphate binding-motif; по имени английского биохимика J. Е. Walker, который впервые описал их в 1982 г.). За счет гидролиза нук- леозидтрифосфатов, в частности АТФ, ААА-белки выполняют «моторную» роль.
Гексамерные голоферменты ААА-белков содержат внутренний канал шириной 2 нм. У тех из них, которые связаны с мембранами, он на цитозольной стороне сужается до 0,8 нм.
К представителям суперсемейства ААА, в частности, относятся:
— белок DnaA (см. раздел 16.4.1.1)',
— белок RecA (см. раздел 16.6.1.2)',
— αβ-субъединицы периферического F1-домена АТФазы/АТФ-синтазы (см. II том учебника);
— ДНК-геликаза (участвует в составе праймосомы в репликации ДНК; см. раздел 16.4.1.1)',
— δ'-субъединица «загрузочного» комплекса ДНК-полимеразы Pol III (см. раздел 16.4.1.1)',
— ДНК-транслоказы FtsK (участвует в сегрегации сестринских хромосом; см. раздел 16.4.2.1) и SpoIIIE (участвует в асимметричной компартментализации хромосомы при образовании эндоспоры; см. раздел 16.4.2.1)',
— фактор терминации транскрипции Rho (см. раздел 16.7.1.3)',
— Lon-протеазы (см. раздел 17.2.2);
— белок KaiC, входящий в состав центрального осциллятора биологических часов цианобактерий (см. раздел 17.1.3).
Роль входного портала транслоказы выполняют субъединицы TraD/TraC (в случае F-плазмиды) или VirBll/VirB4 (в случае A. tumefaciens). Они содержат мотивы Уокера, обладают АТФ-азной активностью и образуют гексамерные кольца, связанные с внутренней поверхностью СМ.
После входного портала трансферный субстрат проходит через интегральную часть транслоказы — водный канал, соединяющий цитоплазматический и пери- плазматический компартменты. Он образован мультидоменной субъединицей ТгаВ (VirB6).
Преодолев СМ, трансферный субстрат не выходит прямо в периплазматический компартмент, а пересекает его по каналу, который образован проксимальной частью половой фимбрии и состоит из пилина TraA (VirB2).
Для прохождения конъюгационного мостика — продукта слияния ОМ донора и ОМ реципиента — используется секретиновая пора, образованная субъединицами ТгаК или VirB9 (см. I том учебника).
Каким способом трансферный субстрат преодолевает последний барьер в виде СМ реципиента, еще не выяснено.
Судьба Т-ДНК после попадания в реципиентную клетку. В цитоплазме реципиента одноцепочечная Т-ДНК превращается в дуплекс за счет синтеза на ней, как на матрице, комплементарной цепи. Предварительно она приобретает кольцевую форму путем замыкания в локусе огiТ, что формально эквивалентно обращенной эндонуклеазной реакции. Предполагается, что рециркуляризация плазмидной ДНК не зависит от реципиента, и что в роли лигазы выступает релаксаза/геликаза, которая локализуется в области транслокона, однако где именно — неизвестно.
Синтез комплементарной цепи плазмидной ДНК в реципиентной клетке (англ. recipient conjugative DNA synthesis, RCDS) осуществляется прерывистым способом с помощью плазмидной праймазы, которая в качестве экскорта сопровождает трансферный субстрат.
Для защиты воссозданного дуплекса от нуклеолитического расщепления используется плазмидная система антирестрикции, состоящая из метилазы ArdA (сокр. англ. alleviation ofrestriction of DNA), ген которого экспрессируется на стадии T- ДНК.
Конъюгация у грамположительных бактерий. Процесс конъюгации у грамположительных бактерий был описан на примере ауксотрофных штаммов Streptomyces spp. в начале 1950-х годов. Позднее, в начале 1970-х годов его обнаружили у ауксотрофных штаммов Mycobacterium smegmatis. Несмотря на исключительную важность стрептомицетов в качестве продуцентов антибиотиков, а также колоссальное значение возбудителей туберкулеза и широкое распространение лекарственной устойчивости среди клинических штаммов М. tuberculosis, это явление до конца 1990-х годов не привлекало внимания исследователей.
В настоящее время установлено, что системы конъюгативного переноса у грамположительных бактерий более разнообразны, чем у грамотрицательных, а иногда они даже уникальны.
Общее различие между конъюгацией грамположительных и грамотрицательных бактерий заключается в способе образования первичного межклеточного контакта. У грамположительных бактерий, в отличие от грамотрицательных бактерий, отсутствуют половые фимбрии. Способ взаимной адгезии половых партнеров, а также молекулярный механизм конъюгативного переноса ДНК у них в большинстве случаев неизвестен.
Тем не менее, у многих одноклеточных грамположительных бактерий существуют Dtr-системы и сопрягающие белки, гомологичные тем, которые грамотрицательные бактерии используют для процессинга ДНК плазмиды или транспозона, а также для секреции одноцепочечной Т-ДНК. Конъюгативные плазмиды грамположительных бактерий обладают широким промискуитетом и могут мигрировать между представителями родов Bacillus, Clostridium, Enterococcus, Lactococcus, Listeria, Pediococcus и Staphylococcus.
Особенностью конъюгативного переноса плазмид Enterococcus faecalis является то, что его стимулируют половые феромоны. Эти термостабильные гекса- или гептапептиды секретируются реципиентом, в ничтожной концентрации (<5 пМ, или 1-5 молекул на клетку) поглощаются донором и вызывают у него ответную реакцию, которая выражается в образовании поверхностных адгезинов (англ. aggregation substance). В свою очередь, на поверхности реципиента образуется рецептор (англ. binding substance). Формирование половой пары не связано с хемотаксисом (см. 1 том учебника, а также раздел 18.4. 1.1 настоящего тома), а происходит в результате случайного соприкосновения клеток.
Конъюгативный перенос плазмид у других одноклеточных грамположительных бактерий (в частности, В. thuringiensis и Lactococcus lactis) не стимулируется феромонами. В данном случае половая пара образуется путем автоагрегации, после совместной секреции донором и реципиентом белка молекулярной массой 32 кДа, который взаимодействует с поверхностным доменом липотей- хоевой кислоты.
Как уже отмечалось, у грамположительных бактерий имеются конъюгативные транспозоны (примером служит Тn916 Е. faecalis, который несет ген устойчивости к тетрациклину и передается между 50 видами 20 родов грамположительных и грамотрицательных бактерий).
Необычна конъюгация у микобактерий, в частности у М. smegmatis. В данном случае конъюгативные плазмиды не содержат генов tra и локуса oriT (который распознается и процессируется продуктами плазмидных генов). Конъюгация обеспечивается аналогами oriT — bom-последовательностями (сокр. англ. basis of mobility) и связана с существованием протяженных участков гомологии между плазмидой и хромосомой реципиента, а также зависит от его системы гомологической рекомбинации, в частности от белков RecA и RecBCD(см. раздел 16.6.1.2). Есть предположение, что bom-последовательности служат сайтами для нанесения двухценочечных разрезов, после чего линейная двухцепочечная ДНК плазмиды передается в реципиентную клетку, где она становится субстратом для систем рекомбинационной репарации (см. раздел 16.5.1.4), восстанавливающих ее кольцевую форму.
Конъюгация у многоклеточных грамположительных бактерий изучена на примере нескольких видов рода Streptomyces. Конъюгация стрептомицетов отличается от конъюгации всех других бактерий не только по молекулярному механизму, но и по уникальному фенотипическому проявлению, которое можно наблюдать невооруженным глазом.
Перенос плазмиды на агаризованной питательной среде сопровождается образованием характерных зон подавления роста и дифференциации реципиента, или «оспинок» (англ. pock) диаметром 1-3 мм. В некоторых случаях (примером служит S. lividans) реципиент накапливает в этих зонах красный антибиотик актинородин.
Конъюгативный перенос у стрептомицетов происходит в ранней фазе роста, когда на плотной питательной среде образуется только субстратный мицелий (см. I том учебника). Установлено, что конъюгативный перенос плазмид, в том числе совместно с мобилизованными хромосомными маркерами, обеспечивает единственный мембранный белок — Тrа. Он содержит консервативный мотив Arg-Ala-Ala-Gly-Ile и проявляет высокую степень гомологии с ДНК-транслоказами семейства FtsK/SpoIIIE (которые, в свою очередь, входят в суперсемейство AAA-белков; см. выше).
Избыточную транскрипцию генов tra предотвращает репрессор GntR, отсутствие которого приводит к подавлению роста и дифференциации, а в некоторых случаях вызывает летальный эффект, поскольку в результате сверхсннтеза гидрофобного белка Тrа нарушается целостность СМ.
Конъюгационная система стрептомицетов уникальна. Самое главное — в отличие от остальных конъюгационных систем, она не имеет плазмидной релаксазы, под воздействием которой образуется одноцепочечная Т-ДНК. В данном случае за перенос отвечают только два плазмидных локуса — tra (хотя он не кодирует релаксазы) и clt (хотя он не соответствует локусу oriT, в nick-сайте которого наносится одноцепочечный разрез). Отсюда следует, что у стрептомицетов отсутствует специальная система для формирования половой пары, и что транспортной формой ДНК при конъюгации у них становится не одноцепочечная, а двухцепочечная ДНК (напомним, что белок Тrа высоко гомологичен ДНК-транслоказам FtsK/SpoEIII, субстратом которых служит именно двухцепочечная ДНК).
Отсутствие у стрептомицетов специальной системы для формирования половой пары можно объяснить тем, что формой вегетативного роста у этих неподвижных почвенных бактерий является ветвящийся субстратный мицелий, гифы которого тесно соприкасаются друг с другом. В такой ситуации для конъюгации достаточно закодированного в плазмиде транспортного белка Тга, а также сайта для его связывания, расположенного в локусе clt. Предполагается, что мономеры белка Тrа агрегируют в мембране с образованием кольцевого агрегата диаметром 30-40 нм, внутри которого проходит канал диаметром 10 нм, способный пропустить сложенное кольцо двухцепочечной ДНК. Перемещение ДНК по внутримембранному каналу осуществляется за счет энергии АТФ.
Первичный перенос плазмиды от донора к реципиенту сопровождается ее вторичным переносом внутри мицелия реципиента. За этот процесс, помимо белка Тrа, отвечают небольшие белки уникальной первичной структуры, продукты 3-5 генов оперона spd (сокр. англ. spreading распределение).
Конъюгация у микоплазм. Процесс, напоминающий конъюгацию, обнаружен у некоторых микоплазм, в частности у Acholeplasma spp., Mycoplasma pulmonis и Spiroplasma citri. В данном случае данные о молекулярном и цитологическом
механизме конъюгационного переноса ДНК отсутствуют; в частности, неизвестно, какая форма ДНК — одноцепочечная или двухцепочечная — является трансферной. Поскольку эти бактерии лишены клеточной стенки, можно предположить, что конъюгационным мостиком служит зона прямого контакта между двумя СМ.
Трансдукция. Термином «трансдукция» (англ, transduction; от лат. trans- duco — переправлять) обозначен горизонтальный перенос хромосомной или плаз- мидной ДНК с помощью фага.
При трансдукции часть генома донора упаковывается в белковую оболочку фага, или капсид. Затем она передается реципиенту в ходе инфекционного процесса, который включает в себя адсорбцию фаговой частицы поверхностными структурами клетки-мишени и инъецирование упакованной ДНК в цитоплазму. Внутри реципиента донорская ДНК либо деградирует, либо сохраняется и получает возможность реплицироваться — автономно или после интеграции в хромосому.
Подобно трансформации, при трансдукции не соблюдается принцип совпадения места/времени, т. е. для нее не требуется образование партнерской пары. Однако, в отличие от голой трансформирующей ДНК, в данном случае ДНК упакована, что защищает ее от повреждений, в частности нуклеазами. Поэтому трансдукция служит гарантированным способом доставки ДНК реципиенту.
Поскольку в капсиде может поместиться только небольшая молекула ДНК — размером около эквивалента фагового генома (не более 100 т. п. н.), с помощью трансдукции переносится ограниченное число тесно сцепленных генов, в частности в случае фага Р1 это <2% генома Е. coli.
Феномен трансдукции впервые обнаружили в 1952 г. Джошуа Ледерберг и Натан Зиндер (N. D. Zinder) на примере бактериофага Р22 Salmonella enterica серовар Typhimurium. Спустя три года был открыт первый трансдуцирующий фаг PI Е. coli
В настоящее время трансдукция продемонстрирована более, чем у 50 видов бактерий из 25 родов, а также у трех видов архей, относящихся к двум родам.
Если вначале считали, что передача генов путем трансдукции происходит только в узком кругу, в основном у энтеробактерий (как в случае фагов ![]() или Т4), то в настоящее время показано, что многие трансдуцирующие фаги характеризуются довольно широким промискуитетом. Кроме того, выяснилось, что бактериальные геномы до 20% состоят из фаговых генов. Наконец, следует иметь в виду, что концентрация вирусных частиц, прежде всего бактериофагов, в водных экосистемах оценивается в 104-108 мл-1 (что на три порядка больше, чем бактерий). Все это наводит на мысль о том, что трансдукция является одним из факторов эволюции геномов в природных популяциях бактерий, способствуя освоению новых ниш и лучшей экологической адаптации к занимаемой нише. Кроме того, трансдукция имеет важное клиническое значение, в частности при распространении генов вирулентности и устойчивости к антибиотикам.
или Т4), то в настоящее время показано, что многие трансдуцирующие фаги характеризуются довольно широким промискуитетом. Кроме того, выяснилось, что бактериальные геномы до 20% состоят из фаговых генов. Наконец, следует иметь в виду, что концентрация вирусных частиц, прежде всего бактериофагов, в водных экосистемах оценивается в 104-108 мл-1 (что на три порядка больше, чем бактерий). Все это наводит на мысль о том, что трансдукция является одним из факторов эволюции геномов в природных популяциях бактерий, способствуя освоению новых ниш и лучшей экологической адаптации к занимаемой нише. Кроме того, трансдукция имеет важное клиническое значение, в частности при распространении генов вирулентности и устойчивости к антибиотикам.
Если трансформацию можно рассматривать как использование в генетических целях механизма трофического импорта полинуклеотидов, а конъюгацию — механизма секреции ферментов и токсинов, то трансдукция представляет собой побочный эффект репродукции облигатных внутриклеточных паразитов-фагов.
Две стратегии репродукции бактериофагов. Фаги подразделяются на литические и умеренные.
Литический фаг (англ. lytic phage), инфицирующий бактерию, запускает программу образования зрелого поколения вирионов, которые обычно покидают клетку хозяина ценой ее лизиса, т. е. гибели.
Умеренный фаг (англ. temperate phage) поступает иначе. Хотя при некоторых обстоятельствах он может вести себя как литический, выбор делается в сторону стабильного партнерства с хозяином. Фаг координирует собственную репликацию с хозяйской репликацией; при этом избирательно подавляется экспрессия тех генов, продукты которых могут причинить вред хозяину.
Как правило, фаговая ДНК физически интегрируется в состав генома хозяина. В этом случае она называется профагом (англ. prophage).
Инфраструктурный анализ полностью секвенированных бактериальных геномов показал, что в них широко представлены профаги. Помимо индуцибелъных профагов встречаются криптические профаги. Их геном сильно преобразовался из-за инсерций, а иногда предельно редуцировался из-за делеций, что затрудняет его выявление на основе компьютерных программ.
Довольно надежным маркером профага служит ген интегралы (хотя гомологи этого гена имеются в транспозонах, а также в островках патогенности, и ему гомологичны гены рекомбиназы xerCD, отвечающие за устранение димеризации хромосом Е. coli; см. раздел 16.4.2).
Лучше всего на предмет наличия профагов изучены бактерии фил ВХII Рго- teobacteria и ВХIII Firmicutes. В частности, 11 из 14 секвенированных геномов протеобактерий содержат по 7-20 профагов. В свою очередь, все 9 секвенированных геномов фирмикутов содержат по 2-6 профагов.
Остальные филы в этом отношении охарактеризованы гораздо слабее, хотя широко распространена точка зрения, что обладать профагом — скорее правило, чем исключение. Характерно, что паразитические бактерии с «минимизированными» геномами не содержат профагов, что можно рассматривать как следствие эволюционной стратегии массового делетирования генов, даже незаменимых. Примерами служат такие эндопаразиты, как Buchneva spp. и Mycobacterium leprae, а также эктопаразиты Mycoplasma spp.
На сегодняшний день чемпионом по числу профагов, одновременно присутствующих в хромосоме (18, что составляет ~16% генома), является инфицирующий пищевые продукты патоген Е. coli штамм 0157: Н7 Sakai. Еще один опасный патоген, Streptococcus pyogenes, одновременно содержит 4-6 профагов (до 12% генома). Примером богатой профагами непатогенной бактерии служит В. subtilis (10 профагов).
Многие промышленно используемые, а также патогенные бактерии содержат профаги (табл. 27).
Некоторые умеренные фаги (например, LEI, N15, Р1. ф20 и фВВ-1) не способны к интеграции и существуют в качестве автономно реплицирующейся плазмиды.
В соответствии с характером развития трансдуцирующего фага, различают два типа трансдукции — общую и специализированную.
Общая трансдукция. Субстратом общей трансдукции (англ. generalized transduction) являются случайные участки ДНК, т. е. практически любые гены могут мобилизоваться с одинаковой частотой.
Общая трансдукция (примером служит колифаг Р1) происходит при репродукции литических фагов или при индукции умеренных фагов. В обоих случаях в результате экспрессии генов фаговых эндонуклеаз хозяйская хромосома разрезается на фрагменты. Некоторые из них с низкой частотой, <10~6 на вирусную частицу, упаковываются в капсид. Причину поведения по принципу «кукушки» связывают с присутствием участков гомологии с упаковочными рас-сайтами фага (см. раздел
16.5.2). В результате такой функциональной мимикрии хозяйская ДНК упаковывается в головку капсида взамен фаговой ДНК. Естественно, что после попадания в реципиентную клетку фальшивый фаг не в состоянии пройти литический цикл, хотя сохраняет способность к адсорбции и инъецированию.
Таблица 27. Промышленно используемые и патогенные бактерии, содержащие профаги (примеры)
Продуценты |
Патогены человека |
Фитопатогены |
Фила ВХII Proteobacteria |
||
— |
Escherichia coli STEC (энтероколит); Haemophilus influenzae (бактериальный менингит); Salmonella typi (брюшной тиф); Shigella flexneri(дизентерия); Vibrio cholerae (холера); Yersinia pestis (чума) |
Xanthomonas campestris(черная гниль); Xyella fastidiosa (хлороз) |
Фила ВХIII Firmicutes |
||
Clostridium acetobutylicum (бутанол); Lactobacillus delbrueckii (пробиотик); Lactococcus lactis (стартер в сыроделии); Streptococcus thermophilus (стартер при получении йогурта) |
C. botulinum (пищевой ботулизм); C. perfringens (газовая гангрена); С. tetani (столбняк); Corynebacterium diphtheriae (дифтерит); Mycobacterium tuberculosis (туберкулез); Staphylococcus aureus (синдром острого кишечного отравления); Streptococcus pneumoniae (острая бактериальная пневмония); S. pyogenes (сепсис) |
— |
— данные отсутствуют.
Специализированная трансдукция. При специализированной трансдукции (англ, specialized transduction) фаг интегрируется в донорскую хромосому. Есть фаги, которые интегрируются только в одном хромосомном сайте (примером служит attB-сайт интеграции фага ![]() ); есть и такие, которые могут интегрироваться в нескольких сайтах (свыше десяти в случае фага Р2). Наконец, некоторые фаги обладают способностью к интеграции в практически любые участки хромосомы (например, фаг Мu).
); есть и такие, которые могут интегрироваться в нескольких сайтах (свыше десяти в случае фага Р2). Наконец, некоторые фаги обладают способностью к интеграции в практически любые участки хромосомы (например, фаг Мu).
После эксцизии фаг захватывает с собой и передает реципиенту только те гены, которые были расположены по соседству с сайтом его интеграции.
Специализированную трансдукцию производит умеренный фаг, который может встраиваться в бактериальную хромосому в одном или нескольких специфических сайтах (см. раздел 16.6.1.2). Такое состояние системы фаг-хозяин называется лизогенией (англ. lysogeny), а умеренный фаг и его хозяин — лизогенными (англ. lysogenic).
При спонтанной или внешне вызванной индукции фаг переходит от лизогенного цикла к литическому циклу и вырезается из хромосомы. В редких случаях, с частотой <10-6 на лизогенную клетку, эксцизия происходит путем незаконной рекомбинации, и тогда сегмент фаговой ДНК замещается участком бактериальной хромосомы (см. раздел 16.6.1.2).
Переходу умеренного фага в лизогенное состояние с частотой 10-1-10-2 способствует стресс, например, при помещении бактерии-хозяина на голодную среду. Для сохранения лизогенного состояния необходим фаговый репрессор, который подавляет экспрессию большинства фаговых генов, в частности тех, которые нужны для образования вирионов и лизиса клетки.
Спонтанная инактивация рецептора индуцирует литический цикл с частотой 10-5-10-6 на клетку, несущую профаг. Стимулированную индукцию профага можно вызвать практически одновременно у всех лизогенных клеток, для чего требуется специфическое внешнее воздействие, например, ультрафиолетовое облучение или обработка мутагенами. В обоих случаях активизируются гены литического цикла, в результате чего образуются зрелые вирионы, выход которых почти всегда связан с лизисом клетки (она потому и названа лизогенной, что способна лизироваться при индукции профага).
Лизис, наблюдаемый визуально или оцениваемый по уменьшению светорассеяния культуры при 550 нм, является следствием разрушения муреина (см. I том учебника) литическими системами фага или клеточными автолизинами. Известны две крайние ситуации — когда клетка мгновенно «растворяется» с образованием мельчайших осколков (например, в случае фага лямбда) или, когда от нее остается палочковидная «тень» (например, в случае фага фХ174). Полное разрушение клеточной стенки в первом случае вызывает «эндолизин», или гетерогенный комплекс ферментов, к которым относятся лизоцим (гликозидаза), литическая трангликозилаза и эндопептидаза. Они закодированы в геноме фага, и их гены начинают экспрессироваться к моменту начала синтеза капсомеров. Лямбда-подобные фаги обладают тремя «поздними» генами (s, r и rz), которые транскрибируются с общего промотора. Первый из них контролирует лизис, второй кодирует транс- гликозилазу; функция третьего гена еще не установлена. В свою очередь, частичное разрушение клеточной стенки вызывается бактериальными автолизинами, в частности амидазой и эндопептидазой.
Как уже сказано, при лизогении экспрессируется только незначительная часть фаговых генов, причем тех, которые не имеют отношения к образованию вирионов и лизису клетки. Среди них особо интересны гены, вызывающие изменение фенотипа хозяйской клетки, или фаговую конверсию (англ. phage conversion).
Среди грамположительных бактерий примером служит С. diphtheriae, которая становится патогенной в результате лизогенизации коринефагом β, кодирующим дифтерийный токсин. В свою очередь, S. aureus «обязан» профагу своим энтеротоксином А. Аналогичным образом, экзотоксин S. pyogenes кодируется умеренным фагом Т12.
Соответствующими примерами для грамотрицательных бактерий являются STEC-штаммы Е. coli (Шига-токсин), Salmonella entérica серовар Typhi (энтерогемолизин), Shigella flexneri(несколько факторов вирулентности) и Vibrio cholerae (токсин СТ).
Судьба инъецированной ДНК. При трансдукции переносится двухцепочечная молекула ДНК, причем — по крайней мере, в случае бактериофагов Р1 и Р22 — линейной конфигурации. Если трансдуцированная ДНК донора и ДНК реципиента содержат гомологичные участки, между ними происходит рекомбинация, и генетический материал донора ассимилируется реципиентом.
Трансдукция у архей. Первое сообщение о том, что у архей существует процесс, напоминающий общую трансдукцию, было опубликовано в 1989 г.; объектом исследования послужили два штамма Methanobacterium voltae. Через десять лет аналогичный феномен был обнаружен для фага ![]() Ml М. thermoautotrophicum, а также для фагоподобной частицы VTA М. voltae (сокр. англ. voltae transfer agent), которая переносит короткие фрагменты археотной ДНК (~4,5 т. п. н.). Детали этого процесса до сих пор не выяснены.
Ml М. thermoautotrophicum, а также для фагоподобной частицы VTA М. voltae (сокр. англ. voltae transfer agent), которая переносит короткие фрагменты археотной ДНК (~4,5 т. п. н.). Детали этого процесса до сих пор не выяснены.
Половая изоляция у прокариотов. Как известно, половая изоляция служит одним из факторов видообразования (см. I том учебника). Существует ли она у прокариотов?
Пока горизонтальный перенос генов не приобрел в глазах исследователей практической актуальности (в связи с распространением лекарственной устойчивости), пока не появилась возможность теоретически изучать данный феномен (на основе анализа инфраструктуры секвенированных геномов с применением компьютерных программ), его считали редким явлением. По мере накопления фактов возникла другая крайняя точка зрения, согласно которой глобальная популяция прокариотов рассматривается как единый пул генов, пронизанный горизонтальными связями (см. выше). Истина лежит посередине — половой процесс у прокариотов распространен широко, однако не универсально. Это позволяет говорить о ряде накладываемых на него ограничений, иными словами, о факторах половой изоляции.
Стратегическим ограничением горизонтального переноса является невыгодность неограниченного промискуитета, иначе бы все бактерии приобрели все гены, представленные в разных экологических нишах. Это привело бы к перегрузке геномов и, как следствие, к их нестабильности. В результате конкретные организмы утратили бы селективные авто- и синэкологические свойства и подверглись бы элиминации.
Другим стратегическим ограничением горизонтального переноса служит риск приобрести вредную аллель. Кроме того, привнесенный ген может функционально дисгармонировать с резидентным комплексом генов, который обеспечивает экологическое соответствие организма занимаемой им нише. Баланс «плюсов» и «минусов», в конечном счете, определяет частоту горизонтального переноса, а также широту его распространения.
По имеющимся данным, рекомбинация у бактерий происходит с низкой частотой (в случае трансформации В. subilis она составляет 10-7 на участок генома размером 1 т. п. н. за одну генерацию). Тем не менее, рекомбинационное преобразование генома происходит в 50 раз быстрее, чем за счет спонтанного мутирования (в пересчете на замену одного нуклеотида).
Существуют и тактические ограничения, из-за которых горизонтальный перенос генов попадает в зависимость от ряда селектирующих факторов. Рассмотрим каждое из этих ограничений по отдельности.
Избирательность экотипа. Предпочтительно, чтобы оба партнера находились в одной и той же нише; иными словами, рекомбинация «отбирает» бактерий сходного экотипа. Крайним примером служит зависимость близкородственной трансформации от феромонов, которые секретируются во внеклеточную среду и провоцируют у донора чувство кворума (см. выше). Конъюгация, требующая прямого межклеточного контакта, также происходит у экологически сходных бактерий. В отличие от этого, для трансдукции не требуется колокализация партнеров, поскольку вирионы распространяются независимо от характера ниши и служат потенциальными векторами для переноса ДНК между представителями не только одинакового, но и разных экотипов.
Избирательность рецепции. По аналогии с эукариотами, половой процесс у которых начинается с взаимного узнавания партнеров, избирательность полового процесса у прокариотов связана с рецепторами.
В случае трансформации это выражается в состоянии компетентности, в частности в образовании рецепторов для специфических DUS-последовательностей донорской ДНК. В результате Haemophilus influenzae «не узнает» трансформирующий субстрат Neisseria gonorrhoeae и наоборот (см. выше). Однако столь высокая селективность не распространяется на других бактерий, например, В. subtilis, S. pneumoniae и Synechococcus spp., способных воспринимать ДНК из разных источников.
В случае конъюгации партнерские пары образуются с помощью половых фимбрий или адгезинов. При образовании конъюгационного мостика у грамотрицательных бактерий две ОМ сливаются вместе, что подразумевает определенное сходство их состава, за которым стоит родство партнеров. Тем не менее, различие в строении оболочки не служит непреодолимым препятствием для «интерграмовой» (т. е. происходящей между грамположительной и грамотрицательной бактерией) и даже интердоменной конъюгации.
В случае трансдукции фаг распознает рецепторные сайты клеточной поверхности, что лежит в основе его хозяйской специфичности. Хотя спектр хозяев фага может варьировать от единичного вида до представителей разных родов (например, фаг Sn-T хламидобактерии Sphaerotilus natans может развиваться на псевдомонадах, пурпурных бактериях и энтеробактериях), большинству фагов свойственна высокая хозяйская специфичность. Именно это ограничивает трансдукцию в сравнении с конъюгацией более узким кругом объектов, а примеры «интерграмовой» трансдукции вообще неизвестны.
Избирательность воздействия на ДНК. Главным ограничителем промискуитета при трансформации является нестабильность «голой» ДНК. Поэтому эффективность трансформации зависит от индивидуальной способности ДНК противостоять повреждениям, а также от природы воздействующих на нее физико-химических факторов среды — температуры, ионного состава, ультрафиолетового излучения и нуклеаз.
Фактором, ограничивающим промискуитет за счет селективного воздействия реципиента на структуру поглощенной ДНК, является система рестрикции-модификации (см. раздел 16.5.2), поскольку короткие фрагменты ДНК, образовавшиеся в результате рестрикции, легче разрушаются цитоплазматическими нуклеазами.
При трансформации внутрь реципиента попадает одноцепочечная ДНК, которая не расщепляется рестриктазами.
Транспортной формой ДНК при конъюгации также служит одиночная цепь, но она превращается в дуплекс, который может быть защищен системой антирестрикции (см. выше).
Трансдукция, при которой переносится двухцепочечная ДНК, особо уязвима по отношению к системам рестрикции-модификации, однако многие фаги обладают собственной системой антирестрикции.
Избирательная интеграция ДНК в хромосому. Для своего стабильного наследования чужеродная ДНК должна интегрироваться в хозяйскую хромосому. В зависимости от степени взаимной гомологии, это может произойти путем сайтс- пецифичной или гомологической рекомбинации (см. раздел 16.6.1.2).
Сайтспецифичная рекомбинация происходит реже гомологической рекомбинации. Однако она исключительно важна, поскольку за счет нее геном реципиента обогащается новыми последовательностями. Сайтспецифичная рекомбинация обеспечивается фаговой интегразой и не зависит от существования протяженных участков гомологии между резидентной и чужеродной ДНК. В результате горизонтальный перенос возможен как между близкородственными, так и между дистанцированными объектами.
В свою очередь, при гомологической рекомбинации в геноме реципиента на протяженном участке гомологии с чужеродной ДНК происходят инсерции, делеции и другие инфраструктурные изменения. Естественно, что частота гомологической рекомбинации тем ниже, чем меньше взаимное родство донора и реципиента. Кроме того, она контролируется системой исправления ошибок спаривания (см. раздел 16.5.1.3), которая служит дополнительным фактором половой изоляции.
Особое тактическое ограничение действует у симбиотических бактерий, обладающих геномом небольшого размера. В силу специфики своей ниши они имеют мало возможностей для приобретения чужеродных генов, и у них отсутствует отбор, направленный на поддержание систем, обеспечивающих генетическую ассимиляцию экзогенной ДНК.
16.6.2. Ненаследуемые изменения
Изменения генома, которые обсуждались в предыдущем разделе, имеют наследственный характер и передаются по потенциально бесконечной цепи поколений вегетативных клеток.
В отличие от них, ненаследуемые изменения происходят в тупиковом звене, т. е. в терминально дифференцированной нерепродуктивной клетке, онтогенез которой завершается запрограммированной смертью, или апоптозом.
У прокариотов описаны, по крайней мере, два примера таких изменений. Они получили название перестройки гена, вызванной изменением условий развития (англ. developmentallyregulated gene rearrangement). Первый пример имеет отношение к спорообразованию В. subtilis — из хромосомного гена терминально дифференцированной материнской клетки вырезается прерывающий фрагмент. Второй пример связан с дифференциацией гетероцист цианобактерий, где аналогичная эксцизия происходит в трех хромосомных генах.
В обоих случаях две части кодирующей последовательности воссоединяются и начинают считываться с общего промотора.
Перестройка гена sigK у В. subtilis. Завершающие стадии споруляции контролирует четвертый сигма-фактор — σ к (см. раздел 18.1.1.1). В результате его образования в материнской клетке активируется группа генов, отвечающих за созревание споры, в частности за образование кортекса и защитных покровов.
Регуляция экспрессии гена sigK носит сложный характер, и одним из ее проявлений становится структурная перестройка хромосомы материнской клетки. При помощи сайтспецифичной рекомбиназы, которую кодирует ген spoIVCA, из гена sigK вырезается кольцевой элемент размером 42 т. п.н. Он получил название skin- элемента (сокр. англ. sigKintervening element) и содержит ген интегразы.
Предполагается, что skin-элемент происходит от дефектного профага или от мобильного элемента.
Перестройка генов nifD, fdxN и hupL у цианобактерий. Перестройка гена nifD (входит в состав онерона nifHDK, кодирует α-субъединицу MoFe-белка динитрогеназы; см. II том учебника), а также гена fdxN (входит в состав оперона nifB-fdxN-nifSU, кодирует ферредоксин) осуществляется на позднем этапе дифференциации гетероцисты у ряда штаммов Аnabaena spp. и Nostoc spp. По времени она совпадает с созданием микроаэробной внутриклеточной среды, а также с началом транскрипции генов нитрогеназы.
Гетероцистами цианобактерий называются терминально дифференцированные клетки, в которых, вопреки аэробному окружению, экспрессируются гены, ответственные за диазогрофию, и создаются условия для каталитического действия нитрогеназы (см. раздел 17.5.1.2).
В присутствии связанного азота глобальный регулятор Мtг подавляет транскрипцию гена nifA, продукт которого активирует промоторы генов, отвечающих за диазотрофию (см. раздел 18.3.2.3). Поскольку в большинстве случаев белок инактивируется при контакте с молекулярным кислородом, дифференциация гетероцист находится под двойным контролем — со стороны связанного азота и со стороны молекулярного кислорода.
Наряду с нитрогеназой в реакции N2 —> 2NН3 участвуют два ключевых фермента, играющие роль донора электронов — ферредоксин и гидрогеназа. Все три белка исключительно лабильны по отношению к кислороду и при контакте с ним необратимо инактивируются в течение нескольких секунд. Для экспрессии их генов требуется делеция в кодирующих участках, программу которой определяет неустановленная регуляторная система.
Элемент размером 11 т. п. н., встроенный в рамку считывания гена nifД вырезается путем сайт-специфичной рекомбинации по двум фланкирующим его прямым 11-мерным повторам 3'-СССТСАТТАСО-5' (рис. 209). Эксцизия совершается с помощью уникальной рекомбиназы, которую кодирует ген хisA, расположенный внутри делетируемого элемента.
Рис. 209. Ненаследуемая перестройка генов nifD и fdxN при дифференциации гетероцист Anabaena sp. РСС7120. А — схема оперонов nifHDK и nifB-fdxN-nifSU; Б — эксцизияэлемента размером 11 т. п. н. XisA — рекомбиназа; Fis — ДНК-изгибающий белок; HU — ДНК-связывающий белок.
Пунктирной стрелкой обозначено направление транскрипции. Сплошными стрелками указаны сайты рекомбинации.
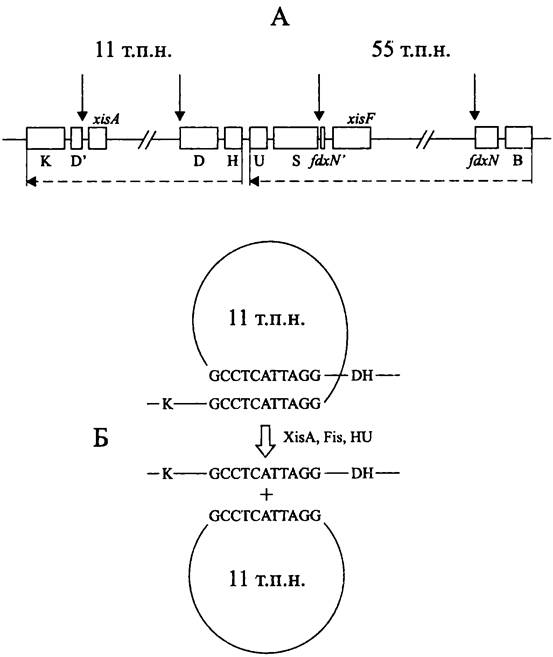
Перестройка гена fdxN идет путем вырезания элемента размером 55 т. п. н. Сайт- специфичную рекомбинацию по двум фланкирующим его прямым 5-мерным повторам 3'-СТТАТ-5' осуществляет резольваза (см. раздел 16.4.2) — продукт гена xisF, который расположен внутри делетируемого фрагмента.
Перестройка гена hupL, кодирующего мембранную uptаке-гидрогеназу (см. II том учебника), происходит путем удаления элемента размером 10,5 т. п. н. с помощью рекомбиназы XisС по двум фланкирующим его прямым 16-мерным повторам 3'- САСАССАСТТАТАТСС-5'. Подобно рекомбиназе ХisА, этот фермент уникален и не принадлежит к числу интеграз или резольваз.
Цель всех трех перестроек очевидна: устранить элементы, которые прерывают рамку считывания генов, играющих ключевую роль в физиологии гетероцисты (в противном случае транскрипция генов, расположенных правее вставки, была бы невозможна).
Хотя налицо сходство поведения прерывающих элементов В. subtilis и цианобактерий с поведением лизогенного фага, вопрос об их эволюционном происхождении остается открытым. Неизвестно, на каком уровне — транскрипционном или посттранскрипционном — регулируются соответствующие рекомбиназы. Непонятно также, почему вставка в гене nifD наследуется более стабильно, чем вставки в генах fdxN и hupL.
16.6.3. Эволюция прокариотных геномов
Еще задолго до появления геномики существовало представление о том, что эволюция прокариотов носит адаптивный характер и приводит к увеличению их генетического разнообразия.
На основе таких формализованных критериев, как общее изменение инфраструктуры и размера, можно выделить три основные стратегии эволюции прокариотных геномов (рис. 210):
— перестройка;
— экспансия;
— редукция.
Рис. 210. Стратегии и механизмы эволюции прокариотных геномов.
Понятно, что все эти стратегии не обособлены друг от друга, хотя их вклад в общую картину эволюции не одинаков; кроме того, они в разной степени используются представителями разных филогенетических ветвей.
Благодаря секвенированию хромосомной ДНК у нескольких сотен бактерий (особенно близкородственных; см. раздел 16.3.1), а также у нескольких десятков архей установлено, что основными механизмами эволюции прокариотных геномов являются:
— генные дупликации;
— потеря генов;
— хромосомные перестройки;
— приобретение генов за счет горизонтального переноса.
Если вначале пальму первенства среди этих механизмов отдавали генным дупликациям, то теперь считается, что ведущая роль принадлежит горизонтальному переносу генов (см. раздел 16.6.1.3).
В конечном счете, эволюция прокариотных геномов протекает па основе вертикальной и горизонтальной передачи генетических детерминант. Отсюда далеко идущее следствие — родство определяется не только общим предком, но и частотой обмена генами, что создает проблему при филогенетической классификации на основе анализа семантид (см. I том учебника). Как уже отмечалось, реже всего горизонтально передаются гены жесткого кора, в частности rrs-гены, гораздо чаще гены гибкого кора и наиболее часто- гены окружения (см. раздел 16.6.1.3).
Древо, реконструированное только с учетом гомологии rrs-генов, не отражает истинной субординации его ветвей из-за разного темпа мутирования. Кроме того, его структура может искажаться из-за горизонтального переноса гена rrs (примером служит Rhizobium galeagae) и даже
всего rrn-оперона (в случае бактерии Thermomonospora sp. и археота Halobacterium salinarium). Поэтому более объективную картину филогении дает «супердрево», реконструированное на основе комплексного сравнения ортологов генов atpD, clpP, dnaK, groEL. grpE, hrcA, recA и tuf A.
Эволюция прокариотных геномов преимущественно связана не с эндогенными хромосомными изменениями, а с привнесенными генетическими элементами, которые являются потомками плазмид, фагов, конъюгативных транспозонов и интегронов. Именно так произошли геномные островки, в частности островки патогенности (см. раздел 16.6.1.3).
Перестройка генома. Эта эволюционная стратегия практически не затрагивает размер генома. Дело ограничивается локальным преобразованием нуклеотидной последовательности за счет точечной мутации (см. раздел 16.6.1.1), передислокацией генетических элементов (см. раздел 16.3.1.3) или рекомбинационной заменой генетического элемента его гомологом (см. раздел 16.6.1.2).
Локальное преобразование нуклеотидной последовательности заключается в замене нуклеотида, а также в инсерции или делеции одного или нескольких нуклеотидов. Причинами этого служат ошибки репликации, имманентная нестабильность нуклеотидов (особенно цитидилового) или воздействие химических и физических мутагенов. Но поскольку прокариоты обладают эффективными системами репарации (см. раздел 16.5.1), скорость таких локальных преобразований относительно невысока по сравнению с передислокацией генетических элементов или их рекомбинационной заменой.
Хотя частота гомологической рекомбинации у прокариотов ниже, чем у размножающихся половым путем эукариотов, этот «недостаток» с лихвой компенсируется промискуитетом. Вклад в адапативную эволюцию бактерий и, в конечном счете, в их эволюционный успех, вносят векторы: вирусы, конъюгативные транспозоны и другие вспомогательные генетические элементы.
Экспансия генома. Экспансия, или увеличение размера генома достигается:
— путем эндогенной амплификации гена или увеличения копийности репликона;
— путем введения в состав генома чужеродных последовательностей.
Первоначально ведущую роль в экспансии генома отводили амплификации генов, поскольку именно так возникают гены-паралоги и с ними новые функции (см. раздел 16.3.1.1). Согласно концепции, которую выдвинул в начале 1970-х гг. японский эволюционист Сусуму Оно (S.Ohno), дупликация гена создает функциональную избыточность, что освобождает один из паралогов от контроля со стороны отбора, позволяя ему накопить нейтральные мутации. Большинство таких мутаций — это функционально бессмысленные «нуль-мутации», в результате чего ген вырождается в псевдоген (см. раздел 16.3.1.1). Редкой альтернативой служат спонтанные или индуцированные мутации, приводящие к появлению полезной функции. Они подхватываются и фиксируются отбором.
Согласно «канонической» модели, дупликация гена основана на рекомбинационном процессе и может происходить двумя способами.
Первый из них состоит в гомологической рекомбинации на участке дуплицируемого гена, которая принимает вид асимметричного кроссинговера между сестринскими репликонами (рис. 211, А).
Рис. 211. Каноническая модель дупликации гена. А — асимметричный кроссинговер; Б — эксцизия и реинсерция кольцевого элемента.
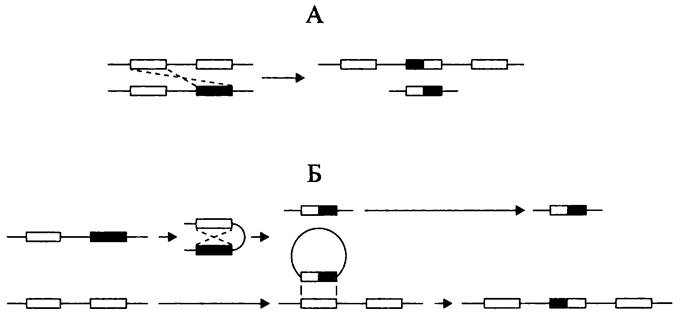
Второй способ заключается в эксцизии, путем сайтспецифичной рекомбинации, кольцевого элемента с дуплицируемым геном и реинсерции этого элемента в сестринский репликон (рис. 211, Б).
В то время как механизм амплификации гена более или менее понятен, способы увеличения копийности репликонов, особенно хромосом, еще предстоит выяснить. Что касается копийности плазмид, то она определяется геном сор (см. раздел 16.1.2).
Хотя амплификация генов и репликонов важна для экспансии геномов, ведущая роль в этом процессе, как уже отмечалось, принадлежит горизонтальному переносу, при котором в состав генома включаются экзогенные последовательности.
Особое место в экспансии геномов принадлежит геномным островкам (см. раздел 16.6.1.3). Передача сцепленной группы «экологических» генов способствует быстрой адаптивной эволюции реципиентов, а сами эти гены эволюционируют за счет делеций и превращения в псевдогены.
Чужеродная ДHК может стать автономным репликоном, что происходит с плазмидой, если она совместима и обладает собственным ориджином (см. раздел
16.4.1.2). Но чаще бывает так, что горизонтально перенесенный генетический элемент — плазмида, фаг, конъюгативный транспозон или интегрон — путем сайт-специфичной рекомбинации включается в состав хромосомы (см. раздел 16.6.1.3).
Редукция генома. Редукция, или уменьшение размера генома достигается за счет уменьшения количества генов или числа репликонов.
В первом случае ген поэтапно деградирует либо единовременно делетируется; во втором случае — клетка излечивается от плазмиды (см. раздел 16.4.1.2).
В отличие от эукариотов, у которых общий диапазон размеров генома составляет четыре порядка (107-1011 п. н.; см. I том учебника), у прокариотов он варьирует в пределах одного порядка (5 • 105-9,5 • 106 п. н.; см. раздел 16.2). Кроме того, если размер эукариотного генома не прямо пропорционален числу генов (в частности, геномы H. sapiens и S. cerevisiaeразличаются по размеру в 300 раз, а по числу генов — всего в 6 раз), геномы прокариотов на 75-95% состоят из кодирующих последовательностей. Иными словами, различие в размере генома отражает различие в числе генов, т. е. редукция генома происходит за счет уменьшения числа генов.
Редукция генома за счет потери архаичных генов домашнего хозяйства вообще закономерна для филогении прокариотов. Делетирование даже немногих генов (прежде всего, ответственных за морфотип или способ энергетического метаболизма) нередко контрастно отражается на фенотипе. Этим, а также горизонтальным переносом соответствующих генов объясняется «парадоксальная» структура глобального древа и его отдельных ветвей, когда грамотрицательные объекты соседствуют с грамположительными, фототрофы — с хемотрофами, аэробы — с анаэробами и т. д. (см. I том учебника).
При значительной редукции генома резко сужается норма реакции генотипа, что особо характерно для бактерий, входящих в состав тесных симбиотических ассоциаций. Характерным примером служат облигатные патогены человека Chlamydia spp.,
Mycoplasma spp. и Rickettsia spp., а также эндоцитобионты насекомых Buchnera spp. и Wigglesworthia spp. (см. разделы 19.1.6.1, 20.3.4.2 и 20.3.5). Их геном имеет размер 0,5-1 млн. п. н. и редуцирован за счет генов, избыточных для занимаемой ниши или снижающих темп адаптивной эволюции. Прежде всего, это гены, отвечающие за биосинтез ключевых метаболитов; гены подвижности; гены репарационных систем и т. д. (характерно, что свободноживущие родственники Buchnera spp., в частности энтеробактерии, имеют геном размером 3-6 млн. п. н.). При отсутствии селекционного давления потеря гена обычно является результатом крупной делеции. Возможен и другой вариант: из-за сдвига рамки считывания ген превращается в нефункциональный псевдоген, а тот за счет новых нейтральных мутаций устраняется или вырождается в спейсер (см. раздел 16.3.1.1).
Хотя «малые» геномы в большинстве случаев являются плодом редукционной эволюции, в некоторых случаях они могут отражать прототип генетической организации прокариотной клетки.
Возможным примером служит археот Nanoarchaeum equitans (см. I том учебника), размер генома которого составляет 491 т. п. н., что соответствует 537 структурным генам. Геном N. equitans имеет необычно компактную структуру, гены расположены бок о бок. Еще одной его особенностью служит отсутствие оперонов, в том числе rrn-оперона, одновременно с присутствием аномально большого количества интронов (11 в структурных генах и 4 в генах тРНК).
С одной стороны, все это может указывать на массовую редукцию и перетасовку генов. С другой стороны, в геноме N. equitans нет таких признаков эволюционной деградации, как псевдогены и спейсеры, хотя большое число псевдогенов не обязательно свойственно редуцированным геномам (например, у Rickettsia spp. их много, а у Chlamydia spp.— мало).
Таким образом, вопрос о первичности или вгоричности карликового размера генома N. equitans остается открытым.
Соотношение экспансии генома и редукции генома. Считается, что при эволюции геномов экспансия, как правило, уравновешивает редукцию. В итоге, размер генома остается относительно постоянным.
Тем не менее, во многих случаях одна из двух эволюционных стратегий преобладает над другой, и тогда изменение размера, генома в ту или иную сторону определяется соотношением между потерей нуклеотидных последовательностей и их приобретением. В свою очередь, это зависит от типа занимаемой ниши. Например, размер генома эндо- и экзоклеточных штаммов Е. coli различается на 20%.
Темп эволюции прокариотных геномов. Темп эволюции прокариотного генома находится в обратной зависимости от его консерватизма. Яркой иллюстрацией этого служат различия в стабильности геномов у бактерий разных экотипов, когда мутационный процесс вместе с сопровождающим отбором принимают контрастную форму.
По современным данным, среди бактерий чемпионом по стабильности генома является эндосимбионт насекомых Buchnera aphidicola. За последние 50-200 млн. лет геном этой бактерии практически не подвергался перестройкам за счет передислокаций и горизонтального переноса, хотя образование псевдогенов и потеря генов в результате накопления точечных мутаций происходили с обычной скоростью.
Противоположностью В. aphidicola являются ее родственники — Е. coli и S. enterica, в геномах которых отношение числа перестроек к нуклеотидным заменам в 2 тыс раз выше. Темп эволюции генома Е. coli (на примере штамма К-12) был крайне высоким — свыше 17% открытых рамок считывания она приобрела от неэнтеробактерий за последние 100 млн. лет.
Пангеномика. Как уже отмечалось (см. раздел 16.3.1), полная расшифровка прокариотных геномов принимает столь широкий размах, что по прогнозам на исходе первого десятилетия XXI в. число завершенных геномных проектов превысит тысячу. Благодаря развитию сверхдешевых технологий секвенирования (англ. ultra-low cost sequencing; ULCS) у исследователей появилась возможность, не прекращая секвенировать геномы все новых видов, приступить к секвенированию геномов нескольких представителей одного и того же вида.
Ясно, что полная последовательность ДНК отдельного штамма отражает только его собственный генетический репертуар, а не генетическое богатство вида, в состав которого входят объекты с разными гено- и фенотипическими признаками, в частности с разными экологическими свойствами. Ясно также, что общий пул генов бактерий определенного вида проецируется на геномы отдельных клональных популяций или коллекционных штаммов.
Целостный подход к анализу пула генов, свойственных отдельному виду, был предложен в начале 2000-х гг. и был назван пангеномикой (англ, pan-genomics; от греч. pantos — всецело), а набор всех генов представителей вида — пангеномом (англ. pan-genome).
Результаты самых первых анализов выявили существенные различия в содержании генов между близкими объектами; например, модельный штамм E. coli К-12 имеет только 40% общих генов с уропатогенными и энтерогеморрагическими штаммами. Различия между геномами родственных объектов касаются не только набора генов, но также набора или числа инсерционных последовательностей и транспозонов.
К середине 2005 г. пангеномный подход был применен к представителям 40 родов восьми бактериальных фи л.
В частности, на основе секвенированния 20 индивидуальных геномов получена первая версия пангенома Е. coli, который состоит из универсального кора из ~2 тыс генов и периферии из ~8 тыс генов (имеющихся не у всех, а только у некоторых штаммов).
Хотя по числу расшифрованных геномов археи значительно уступают бактериям (к середине 2006 г. -27 против 327), в настоящее время доступна первая версия пангенома Haloquadratum walsbyi, а также пангенома метаногенов «кластера I», характерного для микробиоты рисовых полей.
Благодаря горизонтальному переносу пангеном представляет собой вариабельную коллекцию адаптационных детерминант, дополняющих стабильный кор. Объем пангеномов у представителей разных эволюционных ветвей может различаться, что зависит от широты адаптационных возможностей вида. Иногда пангеном исчерпывается последовательностями всего нескольких штаммов, как, например, в случае термоацидофилов Ferroplasma spp. и Leptospirillum spp.
Практический аспект пангеномики заключается в разработке универсальных вакцин (применительно к стрептококкам трупы В такую роль может сыграть пагеном Streptococcusagalactiae).
Метагеномика. Большинство обитателей природных ниш принадлежит к числу некультивируемых объектов (см. I том учебника). Факт их существования регистрируется по присутствию в «природной» ДНК уникальных последовательностей гена рРНК. Случайная амплификация последовательностей, фланкирующих этот ген, дает дополнительные сведения о структуре генома, что в ряде случаев позволяет делать выводы о функциональной роли его фантомного обладателя в микробном сообществе.
В настоящее время эту задачу решает метагеномика (англ. metagenomics; от греч. meta — между; в данном случае — переход к другой геномике). Первые иссле-
дования в области метагеномики морского пикопланктона провела в 1991 г. группа Нормана Пейса (N. R. Расе), а сами термины «метагеном» и «метагеномика» были предложены Рондоном (М. R. Rondon) с соавторами в 2000 г.
Метагеномика занимается анализом комплекса геномов из определенной ниши; с этой целью амплифицируют природную ДНК (англ. environmental DNA) и проводят компьютерную обработку полученных последовательностей. Метагеномика решает две основные задачи — идентифицирует новые гены, в том числе гены, имеющие практическое значение, а также расширяет и углубляет представления об экологии прокариотов.
В отличие от традиционной геномики, метагеномика использует для секвенирования не материал лабораторной культуры, а препарат ДНК смешанной популяции в определенной природной нише.
Метагеномный анализ начинается с получения природной ДНК. Иногда это довольно проблематично из-за загрязнения препарата полифенолами, мешающими амплификации.
На втором этапе создаются «библиотеки» небольших фрагментов ДНК (<10 т. п. н.) путем амплификации природных последовательностей и их клонирования в стандартных векторах с использованием Е. coli в качестве хозяина. Обычно применяют вырожденные праймеры, которые дают возможность провести случайную shortgun-амплификацию (от англ. shotgun— ружье-дробовик; буквально — амплификация вразлет). Естественно, что шанс выявить тот или иной кластер генов зависит от размера вставки. Поэтому для вставок величиной 25-35 т. п.н. в качестве вектора используют космиды, т. е. плазмиды с «липкими» концами (от сокр. англ. cohesive site plasmid), а для вставок размером до 200 т. п. н. — искусственные плазмиды (см. раздел 16.1.2).
На третьем этапе секвенируют амплифицированные последовательности и обирают протяженные последовательности с перекрывающимися участками.
Четвертый этап заключается в компьютерной расшифровке метагенома. С помощью специальных программ от «сырого» прочтения переходят к протеому и идентифицируют отдельные гены. Если ген с известной или ранее неизвестной функцией сцеплен с одним из 25- 35 консервативных генов-маркеров (прежде всего, с геном рРНК), это четко указывает на филогенетическое положение его хозяина.
К настоящему времени успешно завершен ряд метагеномных проектов, в частности, характеризующий акваторию Саргассова моря, что позволило идентифицировать ряд новых генов, которые после клонирования могут найти применение в биотехнологии. В число продуктов экспрессии этих генов входят амилазы, липазы, оксидоредуктазы, эстеразы и ряд других ферментов, например синтетаза 2,5-дикето- D-глюкуроновой кислоты (промежуточного продукта при производстве аскорбиновой кислоты из глюкозы) и β-кетоацилсинтетаза (участвующая в образовании антибиотиков с поликетидным «хвостом» -S-(СО-СHR)n-NHR, например блеомицина,
ванкомицина и эритромицина).
Приведем два примера вклада метагеномики в фундаментальные знания по экологии прокариотов — открытие бактериального ретинопротеина (см. II том учебника) и характеристика микробных сообществ биопленок, колонизирующих медицинское оборудование и резиновые покрытия в системах водоснабжения.