ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 2. Клетки, осуществляющие иммунный ответ
■ Многие виды клеток различного происхождения предназначены для выполнения специализированных функций в иммунном ответе.
■ В- и Т-лимфоциты экспрессируют на своей поверхности антигенсвязывающие рецепторы и другие молекулы (маркеры), необходимые для осуществления разнообразных функций.
■ Для Т-клеточного ответа требуется представление антигенов антигенпрезентирующими клетками. В-клетки способны распознавать нативные антигены, не процессированные и не представленные другими клетками.
■ Различные функциональные субпопуляции Т-лимфоцитов проявляют хелперную, супрессивную или цитотоксическую активность.
■ Фагоцитарные клетки, несущие специфические поверхностные маркеры, циркулируют с кровотоком (моноциты и гранулоциты) и присутствуют в тканях (например, клетки Купфера впечени).
■ Эозинофилы, базофилы, тучные клетки и тромбоциты принимают участие в воспалительной реакции.
Предшественниками клеток иммунной системы служат плюрипотентные стволовые клетки, которые проходят два основных пути дифференцировки (рис. 2. 1):
✵ лимфопоэз — образование лимфоцитов;
✵ миелопоэз - образование фагоцитов (моноцитов, макрофагов и гранулоцитов), а также других клеток.
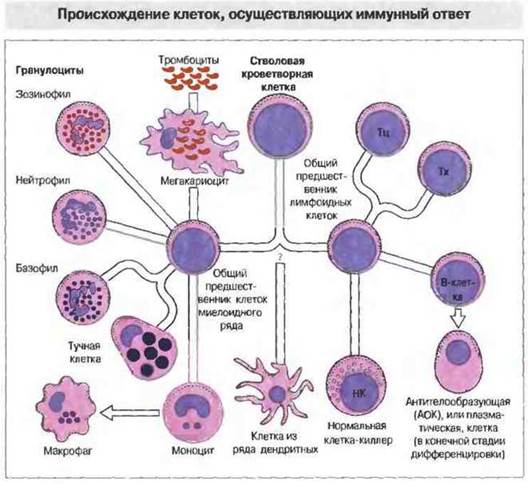
Рис. 2.1. Все клетки гемопоэтического происхождения образуются из плюрипотентных стволовых клеток, дающих начало клеткам двух основных направлений кроветворения: лимфоидного и миелоидного. В зависимости от микроокружения клетка-предшественник лимфоидного ряда может дифференцироваться либо в Т-, либо в В-клетку. У млекопитающих Т-клетки созревают в тимусе, тогда как В-клетки развиваются сначала в печени плода, а после рождения - в костном мозге. Точное происхождение отдельных видов антигенпрезентирую- щих клеток (АПК) остается пока неизвестным, хотя в общем все они образуются из гемопоэтических стволовых клеток. Нормальные клетки-киллеры (НК) происходят, вероятно, из общих предшественников лимфоидных клеток, созревающих в печени плода, а после рождения в костном мозге. Предшественники клеток миелоидного ряда дифференцируются в зрелые (коммитированные) клетки, изображенные слева. Эозинофилы, нейтрофилы и базофилы объединены под групповым названием гранулоциты.
Лимфоциты могут относиться кТ-, В-и НК-клеткам. Две главные популяции лимфоцитов названы Т-клетками и В-клетками. Т-клетки развиваются из своих предшественников в тимусе, тогда как В-клстки у млекопитающих сначала дифференцируются в печени плода, а после рождения — в красном костном мозге. У птиц дифференцировка В-клеток происходит в уникальном для этого класса позвоночных органе - фабрициевой сумке. Органы, где происходит дифференцировка лимфоцитов, относятся к центральным, или первичным, лимфоидным органам. Именно в них предшественники В- и Т-лимфюцитов приобретают способность распознавать антигены благодаря экспрессии антигенспецифичных поверхностных рецепторов.
Лимфоциты третьей популяции, не экспрессирующие антигенсвязывающих рецепторов, названы нормальными (естественными) клетками-киллерами (НК). Они происходят из предшественников лимфоидных клеток в костном мозге и функционально отличаются от Т- и В-клеток своей способностью лизировать in vitro клетки определенных опухолевых линий (но не свежеудаленных опухолей) без предварительной иммунизации. Морфологически это большие зернистые (гранулярные) лимфоциты (БГЛ) (см. ниже).
В качестве фагоцитов могут функционировать моноциты/макрофаги или полиморфноядерные гранулоциты. Подобно лимфоцитам, фагоциты также представлены двумя популяциями: моноцитами/макрофагами и полиморфноядерными гранулоцитами. У последних ядро неправильной формы, сегментированное (полиморфное). В зависимости от характера окрашивания цитоплазматических гранул кислыми и основными красителями гранулоциты относят к нейтрофилам, базофилам или эозинофилам. Эффекторныс функции этих трех типов клеток различны. Наиболее многочисленны нейтрофилы, называемые также полиморфноядерными нейтрофилами (ПМН) и составляющие большинство лейкоцитов (белых кровяных телец) в циркулирующей крови (примерно 60—70% у взрослого человека).
Вспомогательные клетки (А-клетки). Кроме лимфоцитов и фагоцитов, к компонентам иммунной системы относится ряд вспомогательных клеток.
✵ Антигенпрезентирующие клетки (АПК) — представляют антигены Т- и В-клеткам.
✵ Тромбоциты — участвуют в свертывании крови и в воспалительных реакциях.
✵ Тучные клетки, структурно и функционально сходные с базофильными полиморфноядерными гранулоцитами, — принимают участие в определенных типах воспаления (см. гл. 23).
✵ Эндотелиальные клетки — экспрессируют молекулы, способные узнавать циркулирующие с кровотоком лейкоциты, обеспечивая таким образом их адгезию — прилипание, а также распределение в сосудистом ложе.
ЛИМФОИДНЫЕ КЛЕТКИ
Ежесуточно в первичных (центральных) лимфоидных органах — тимусе и постнатальном костном мозге — образуется значительное количество лимфоцитов. Часть этих клеток мигрирует из кровотока во вторичные лимфоидные ткани — селезенку, лимфатические узлы и лимфоидные образования слизистых оболочек. В организме взрослого человека содержится примерно 1012лимфоидных клеток и лимфоидная ткань в целом составляет приблизительно 2% общей массы тела. При этом на лимфоидные клетки приходится примерно 20% циркулирующих с кровотоком лейкоцитов. Многие зрелые лимфоидные клетки относятся к долгоживущим и могут многие годы существовать в качестве клеток иммунологической памяти.
Лимфоциты морфологически разнообразны. В обычном мазке крови лимфоциты различаются как по размерам (диаметр 6—10 мкм), так и по морфологии. Варьирует соотношение величина ядра: величина цитоплазмы (Я:Ц), а также форма самого ядра. В цитоплазме некоторых лимфоцитов могут содержаться азурофильные гранулы (рис. 2.2).
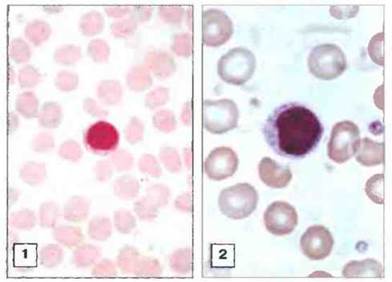
Рис. 2.2. Морфологическое разнообразие лимфоцитов. 1. Малый лимфоцит имеет округлое ядро, высокое ядерноцитоплазматическое (Я:Ц) соотношение и не содержит гранул в цитоплазме. 2. Большой гранулярный лимфоцит имеет меньшее соотношение Я:Ц, вогнутое ядро и азурофильные гранулы в цитоплазме. Окраска по Гимзе. (Фото любезно предоставлено д-ром A. Stevens и проф. J. Lowe.)
При световой микроскопии мазков крови, окрашенных, например, гематологическим красителем Гимза, можно обнаружить два морфологически различных типа циркулирующих лимфоцитов: первый — относительно мелкие клетки, в типичном случае лишенные гранул, с высоким соотношением Я:Ц — и второй - более крупные клетки с меньшим соотношением Я:Ц, содержащие в цитоплазме гранулы и известные как большие гранулярные лимфоциты. (Не следует путать БГЛ с гранулоцитами, моноцитами или их предшественниками, также содержащими азурофильные гранулы.)
Покоящиеся Т-клетки крови. Большая часть их экспрессирует αβ-Т-клеточные рецепторы (αβ-Т-клетки; см. ниже) и может иметь один из двух описанных выше типов морфологии. Большинство (95%) хслперныхТ-клсток (Тх) и часть (50%) цитотоксических Т-лимфоцитов (Тц) относятся к малым лимфоцитам, лишенным гранул и имеющим высокое соотношение Я:Ц. Кроме того, в их цитоплазме присутствуют особая структура, названная тельцем Голла, — скопление первичных лизосом возле липидной капли. Тельце Голла легко выявить при электронной микроскопии (рас. 2.3) или цитохимически, методом определения лизосомных ферментов. Менее 5% Тх-клеток и примерно половина Тц имеют другой тип морфологии, характерный для БГЛ, с рассеянными по цитоплазме первичными лизосомами и хорошо развитым комплексом Гольджи (рас. 2.4). Интересно, что у мыши нет цитотоксических Т-клеток, сходных по морфологии с БГЛ.
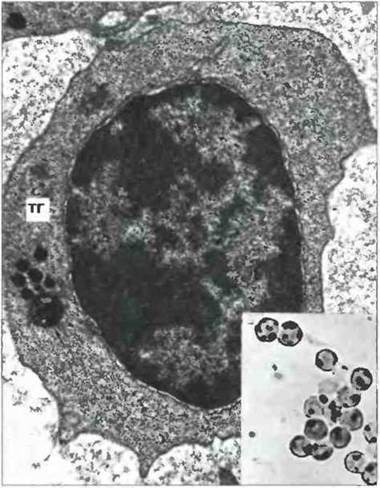
Рис. 2.3. Ультраструктура негранулярных Т-клеток. На электронной микрофотографии видно характерное для морфологии большинства покоящихся Т-клеток тельце Голла (ТГ). Оно состоит из первичных лизосом и липидной капли (показана стрелкой), х 10 500. Врезка: В световом микроскопе при окраске на неспецифические эстеразы тельце Голла выглядит как гомогенное пятно, х 400. По Zucker-Franklin D., Greaves M.F., Grossi C.E. et at. 1988. Atlas of Blood Cells. Function and Pathology. Vol. II. 2nd edn. Milan. E.E. Ermes, Philadelphia: Lea and Febiger.
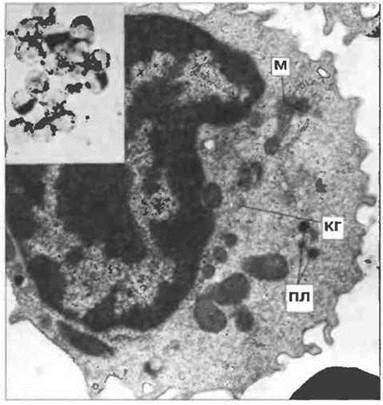
Рис. 2.4. Ультраструктура гранулярных Т-клеток. Для этих клеток характерно наличие рассеянных по цитоплазме и частично сосредоточенных вблизи хорошо развитого комплекса Гольджи (КГ) электроноллотных, не содержащих пероксидазу гранул (первичных лизосом, ПЛ) и большое количество митохондий (М). х 10 000. Врезка: Для световой микроскопии гранулы в Т-клетках можно выявить цитохимически с помощью метода выявления кислой фосфатазы, х 400. По Zucker-Franklin D., Greaves M.F., Grossi С.Е. et at.
1988. Atlas of Blood Cells: Function and Pathology. Vol. II 2nd edn. Milan: E.E. Ermes, Philadelphia: Lea and Febiger.
Признаки больших гранулярных лимфоцитов свойственны также еще одной субпопуляции Т-лимфоцитов, а именно Т-клеткам с γδ-рецепторами (γδ-Т-клетки). В лимфоидных тканях эти
клетки имеют дендритную (ветвистую) морфологию (рис. 2.5); при культивировании in vitro они способны прикрепляться к подложке, принимая в результате разнообразную форму (рис. 2.6).
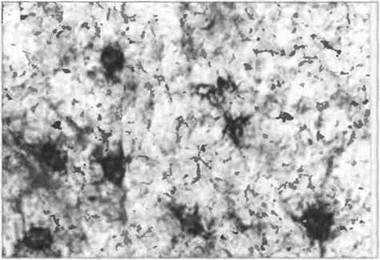
Рис. 2.5. Дендритная морфология γδ-Т-клеток в ткани миндалин. Эти γδ-Т-клетки расположены преимущественно в межфолликулярных Т-зависимых зонах. Заметна их разветвленная форма. Окраска с применением γδ-Т-слецифичных моноклональных антител, конъюгированных с флуорохромом и пероксидазой. х 900. (Еиг. J. Immunol. 1991. 21: 173. Фото любезно предоставлено д-ром A. Favre.)

Рис. 2.6. Морфологические изменения клонированных γδ-Т-клеток при культивировании in vitro. 1. Клетки прилипают к подложке таким же образом, как макрофаги. х 6000. 2. Клетки вытягиваются, образуя уропо- ды с выступающими на полюсах филоподиями. х 2000. 3. На концах филоподий формируются участки адгезивного контакта. х20 000. Еur. J. Immunol. 1991.21: 173. Фото любезно предоставлено д-ром G. Aranda и д-ром W. Maiorni.
Неактивированные В-клетки крови. Эти клетки не содержат тельца Голла и морфологически нс сходны с большими гранулярными лимфоцитами; их цитоплазма в основном заполнена рассеянными монорибосомами (рис. 2.7). В кровотоке иногда можно наблюдать активированные В-клетки с развитым шероховатым эндоплазматическим ретикулумом (рис. 2.8).
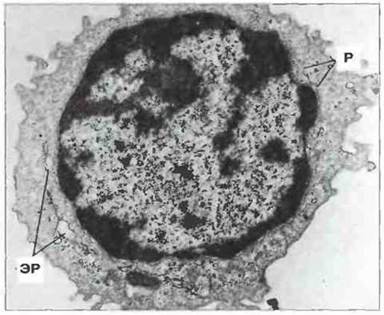
Рис. 2.7. Ультраструктура покоящихся В-клеток. В цитоплазме таких клеток отсутствуют тельца Голла и гранулы, но имеются рассеянные рибосомы (Р) и канальцы шероховатого эндоплазматического ретикулума (ЭР). После активации в В-клетках происходит ассоциация комплекса Гольджи с лизосомами. х 11 500.
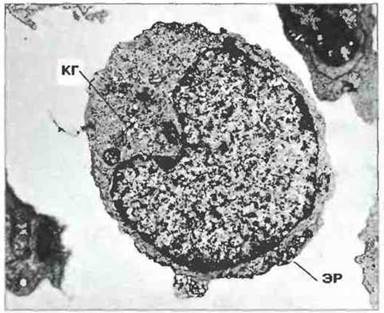
Рис. 2.8. Ультраструктура В-лимфобластов. Главный при знак активации В-клеток - развитие структур для синтеза иммуноглобулинов: шероховатого эндоплазматического ретикулума (ЭР), свободных полирибосом и комплекса Гольджи (КГ), который принимает участие в гликозилировании иммуноглобулинов, х 7500.
НК-клетки. Нормальные киллерные клетки, подобно γδ-Т-клеткам и одной из субпогтуляиий Тц, имеют морфологию БГЛ. Однако при этом в их цитоплазме больше азурофильных гранул, чем у гранулярных Т-клеток.
Лимфоциты экспрессируют особые у каждой субпопуляции поверхностные маркеры. На поверхности лимфоцитов (как и других лейкоцитов) присутствует множество разнообразных молекул, которые могут служить метками (маркерами) рахличных субпопуляций. Значительная часть этих клеточных маркеров в настоящее время легко идентифицируется с помощью специфических моноклональных антител. Разработана систематизированная номенклатура маркерных молекул; в ней группы моноклональных антител, каждая из которых специфически связывается с определенной маркерной молекулой, обозначены символом CD (Cluster Designation — групповая метка). За основу CD-номенклатуры принята специфичность прежде всего мышиных моноклональных антител к лейкоцитарным антигенам человека. В создании этой классификации участвуют многие специализированные лаборатории разных стран. Для ее обсуждения проведена серия международных рабочих встреч, на которых удалось определить характерные наборы образцов моноклональных антител, связывающихся с различными популяциями лейкоцитов, а также молекулярные массы выявляемых при этом маркеров. Моноклональные антитела совпадающей специфичности связывания объединяют в одну группу, присваивая ей номер в системе CD. Однако в последнее время принято таким образом обозначать не группы антител, а маркерные молекулы, распознаваемые данными антителами (Перечень CD-маркеров приведен в приложении.)
В дальнейшем молекулярные маркеры стали классифицировать в соответствии с информацией, которую они несут об экспрессирующих их клетках, например:
✵ популяционные маркеры, которые служат характерным признаком данного иитопоэтического ряда, или линии; пример — маркер CD3. выявляемый только на Т-клетках;
✵ дифференцировочные маркеры, экспрессируемые временно, в процессе созревания; пример — маркер CDI, который присутствует на развивающихся тимоцитах, но не на зрелых Т-клетках;
✵ маркеры активации, такие как CD25 - низкоаффинный Т-клеточный рецептор для фактора роста (ИЛ-2), экспрессируемый только на Т-клетках, активированных антигеном.
Иногда такой подход к классификации маркеров весьма полезен, однако не всегда он возможен. У некоторых популяций клеток маркер активации и маркер дифференцировки — это одна и та же молекула. Например, CD 10. присутствующий на незрелых В-клетках, исчезает при созревании, но появляется вновь при активации (см. рис. 12.14). Кроме того, маркеры активации могут постоянно присутствовать на клетках в низкой концентрации, но в более высокой — после активации Так, под действием ИФγ возрастает экспрессия молекул главного комплекса гистосовместимости (МНС) класса II на моноцитах.
Клеточные маркеры образуют несколько семейств. Компоненты клеточной поверхности относятся к различным семействам, гены которых произошли, вероятно, от нескольких предковых. Маркерные молекулы и з разных семейств различаются по структуре и образуют следующие основные группы:
✵ суперсемейство иммуноглобулинов, включающее молекулы, близкие по строению к антителам; к нему относятся CD2, СD3, CD4, CD8, CD28, молекулы МНС классов I и II, а также многие другие;
✵ семейство интегринов — гетеродимерных молекул, образованных α- и β-цепями; существует несколько подсемейств интегринов; все члены одного подсемейства имеют общую β-цепь, но разные, уникальные в каждом случае, α-цепи; в одном из подсемейств (β2-интегрины) β-цепь представляет собой маркер CD18. В комбинации с CD11a, CD11b, CD11с или αD он образует соответственно лимфоцитарные функциональные антигены LFA-1, Mac-1 (CR3) и р 150, 95 (CR4) и молекулы клеточной поверхности αDβ2, часто выявляемые на лейкоцитах. У второго подсемейства (β1- интегрины) β-цепь представляет собой маркер CD29; в сочетании с различными α-цепями он образует маркеры поздней стадии активации (VLAs, от very late antigens);
✵ селектины (Е, L и Р), экспрессируемые на лейкоцитах (L) или на активированных клетках эндотелия (Е и Р). Они обладают лектиноподобной специфичностью в отношении сахаров в составе высокогликозилированных мембранных гликопротеинов; к селектинам относится, например, CD43;
✵ прогеогликаны (типичный маркер — CD44), имеющие ряд глкжозаминогликановых участков связывания; пример — хоидроитинсульфат.
Другие семейства клеточных маркеров — это суперсемейство рецепторов для фактора некроза опухолей (ФНО) и фактора роста нервов (ФРН), суперсемейство лектинов С-типа, включающее, например, CD23, а также суперсемейство многодоменных трансмембранных рецепторных белков, в которое входит рецептор для ИЛ-6.
Следует подчеркнуть, что маркеры, экспрессируемые лимфоцитами, можно обнаружить и на клетках иных линий. Так, CD44 часто выявляется на клетках эпителия. Молекулы клеточной поверхности можно выявить с помощью флуоресцирующих антител, используемых в качестве зондов (рис. 2.9). На этом подходе основан метод проточной иммунофлуоресцентной цитометрии, позволяющей сортировать и подсчитывать клетки в зависимости от их размеров и параметров флуоресценции (см. гл. 29). С помощью этого метода удается проводить детальную сортировку популяций лимфоидных клеток.
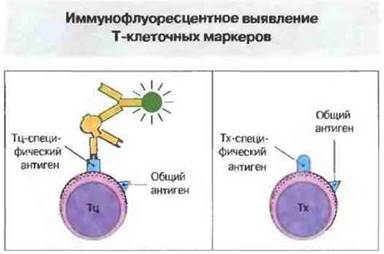
Рис. 2.9. Мышиные моноклональные антитела к специфическому антигену цитотоксических Т-лимфоцитов (Тц) (например, к CD8) связываются именно с Тц, а не с хелперными Т-клетками (Тх). Связавшиеся антитела легко выявить с помощью конъюгированных с флуорохромом антител к иммуноглобулинам мыши. Этот метод позволяет идентифицировать и определять количество Т-клеток, относящихся к разным субпопулициям.
Т-клетки
Т-клетки различаются по своим антигенраспознающим рецепторам. Маркером, характеризующим линию Т-клеток, служит Т-клеточный рецептор для антигена (ТкР). Имеется два различных типа ТкР, и тот и другой — гетеродимеры из двух соединенных дисульфидными связями полипептидных цепей. ТкР первого типа образован цепями α и β, второго типа, сходный по структуре — цепями γ и δ. Оба рецептора ассоциированы на клеточной поверхности с пятью полипептидами СD3-комплекса, образуя вместе с ним рецепторный комплекс Т-клетки (ТкР—СD3-комплекс, см. гл. 7). Примерно 90—95% Т-клеток в крови представляют собой αβ-Т-клетки, остальные 5—10% — γδ-Т-клетки.
αβ-Т-клетки различаются в свою очередь по экспрессии CD4 или CD8. αβ-Т-клетки подразделяются на две различные, неперекрывающиеся субпопуляции: клетки одной из них несут маркер CD4 и в основном «помогают» в осуществлении иммунного ответа или «индуцируют» его (Тх), клетки другой несут маркер CD8 и обладают преимущественно цитотоксической активностью (Тц). Т-клетки CD4+ распознают антигены, к которым они специфичны, в ассоциации с молекулами МНС класса II, тогда как Т-клетки CD8+способны узнавать антигены в ассоциации с молекулами МНС класса I (см. гл. 7). Таким образом, возможность взаимодействия Т-клетки с клеткой другого типа зависит (ограничена, или рестриктирована) от присутствия на первой маркера CD4 или CD8 (рис. 2.10). Небольшая часть αβ-Т-клеток не экспрессирует ни CD4, ни CD8. Подобным же обра зом «дважды отрицательны» большинство циркулирующих γδ-Т-клеток, хотя некоторые из них все же несут CD8. Напротив, большая часть γδ-Т-клеток в тканях экспрессирует этот маркер.
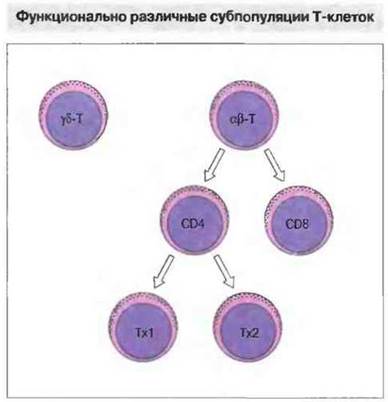
Рис. 2.10. Т-клетки экспрессируют либо γδ-, либо αβ-ТкР, и подразделяются на субпопуляции CD4+и CD8+, распознающие пептиды антигена в ассоциации с молекулами МНС класса I или И соответственно. Т-клетки CD4+ можно далее разделить на субпопуляции Тх1 и Тх2 по набору образуемых ими цитокинов. Четких данных о различии цитокиновых профилей у γδ-Т-клеток и у αβ-Т-клеток CD8+не получено.
αβ-T-клетки CD4+и CD8+подразделяются на функционально различные субпопуляции. Как отмечено выше, примерно 95% Т-клеток CD4+и 50% Т-клеток CD8+морфологически представляют собой малые нефанулярные лимфоциты. Эти популяции можно дифференцировать дальше по фенотипической экспрессии CD28 и CTLA-4 на функционально различные субпопуляции. Экспрессируемый Т-клетками CD4+маркер CD28 обеспечивает передачу костимулирующего сигнала активации при распознавании антигена. (В отсутствие такого сигнала контакт ТкР с антигеном может вызывать анергию».) Лигандами CD28 служат молекулы B7-1 (CD80) и В7-2 (CD86) на АПК. Гомологичную CD28 молекулу CTLA-4 Т-клетки CD4+ начинают экспрессировать после активации. CTLA-4 связывается с теми же лигандами, что и CD28, тем самым ограничивая активацию (см. гл. 11). Кроме того, αβ-Т-клетки экспрессируют различные изоформы общего лейкоцитарного антигена, CD45. Считается, что CD45RO, а не CD45RA, связан с клеточной активацией. Для выделения функционально различных субпопуляций αβ-Т-клеток используют также другие критерии, в частности экспрессию клеточных маркеров нормальных киллерных клеток (CD56, CD57 и CDllb/CD18), выявляемых на 5—10% циркулирующих Т-клеток. Эти клетки образуют ИД-4, но не ИЛ-2, и дают слабый пролиферативный ответ на антигены и митогены.
αβ-T-лимфоциты можно классифицировать также по профилю цитокинов. Функциональное разнообразие Т-клеток можно продемонстрировать, анализируя профили секреции цитокинов разными клонами Т-хелперов. У мыши и человека идентифицировано по две группы Т-клеточных CD4+-клонов. Субпопуляция Тх1 секретирует ИЛ-2 и ИФγ, а субпопуляция Тх2 — ИЛ-4, ИЛ-5, ИЛ-6 и ИЛ-10 (рис. 2.10; см. также гл. 11). Клетки Тх1 принимают участие в активации цитотоксических Т-клеток и в местных воспалительных реакциях. Следовательно, они важны для противодействия организма внутриклеточной вирусной, бактериальной или паразитарной инфекции. Клетки же Тх2 более эффективны в стимуляции В-клеток к пролиферации и образованию антител, поэтому их функции связаны в первую очередь с защитой организма от микробов, размножающихся внеклеточно (гуморальный иммунитет).
Перечень основных маркеров αβ-Т-клеток человека и мыши представлен на рис. 2.11.
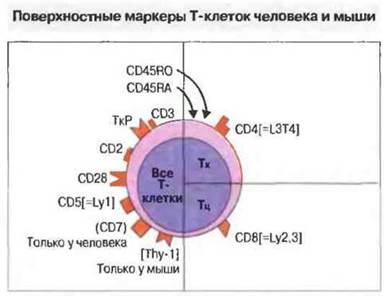
Рис. 2.11. К настоящему времени молекулярный маркер CD7 выявлен только у человека, тогда как Thy-1 - только у мыши. Другие маркеры, указанные в квадратных скобках, - это мышиные эквиваленты маркеров человека. Большинство маркеров относится к иммуноглобулиновому суперсемейству молекул межклеточной адгезии.
γδ-T-клетки - обычный компонент слизистых оболочек и эпидермиса у мыши. γδ-Т-клетки относительно часто встречаются в эпителии слизистых оболочек, но представляют лишь минорную субпопуляцию среди циркулирующих Т-клеток. У мыши почти все внутриэпителиальные лимфоциты относятся к γδ-Т-клеткам, экспрессирующим CD8 — маркер, который отсутствует на большинстве циркулирующих γδ-Т-клеток. Как установлено, γδ-Т-клетки CD8+ обладают особым репертуаром Т-клеточных рецепторов, специфичных к определенным бактериальным и вирусным антигенам (суперантигенам), Согласно современной точке зрения, эти клетки могут играть важную роль в защите слизистых оболочек организма от инфекции.
Т-клетки обладают рядом общих маркеров с клетками других линий. До сих пор мы описывали клеточные маркеры и антигенспецифичные рецепторы, характерные для отдельных субпопуляций Т-лимфоцитов. Однако ряд молекул экспрессируется на поверхности всех Т-клеток («пан-Т-клеточные маркеры»), а также на клетках других линий. Хороший пример — рецепторы для эритроцитов барана (CD2). В норме молекула CD2, связываясь с соответствующими лигандами, принимает участие в процессе активации Т-клеток вместе с ТкР — CD3- комплексом и другими гликопротсинами в составе мембран. Вместе с тем CD2 выявляется также у 75% НК-клеток CD3-. Другая участвующая в Т-клеточной активации молекула это маркер CD5, экспрессируемый на всех Т-клетках и на одной из субпопуляций В-клеток. Молекула CD5 может связываться с CD72, но вопрос о ее роли в качестве физиологического лиганда В-клеток остается открытым. Маркер CD7 присутствует почти на всех НК- и Т-клетках. Полный перечень Т-клеточных CD-маркеров, часть которых экспрессируется и на других клетках гемопоэтического происхождения, приведен в приложении. Т-клетки мыши экспрессируют маркеры, сходные с обнаруженными на Т-клетках человека.
Супрессорные Т-клетки. Получены очевидные функциональные доказательства существования антигенспецифичных супрессорных Т-клеток (Тс), однако эти клетки, по-видимому, не составляют отдельной субпопуляции Т-клеток с исключительно супрессивной функцией. Доказано также, что Т-клетки, как CD4+, так и CD8+, способны подавлять иммунный ответ либо путем прямою цитотоксическою действия на антигенпрезентируюшие клетки, либо путем выделения «супрессивных» цитокинов (см. гл. 11), либо путем передачи сигнала отрицательной регуляции (при связывании CTLA-4 с его лигандами; см. выше), либо посредством идиотип-антиидиотипических сетевых взаимодействий (см. гл. 13).
В-клетки
От 5 до 15% циркулирующих с кровью лимфоидных клеток — это В-лимфоциты, выявляемые по наличию поверхностных иммуноглобулинов (Ig). Молекулы Ig синтезируются конститутивно; они встроены в цитоплазматическую мембрану клетки и функционируют как антигенспецифичные рецепторы. Такие рецепторы можно определить на клеточной поверхности, используя меченные флуорохромом антитела к иммуноглобулину. Иммунофлуоресцентная окраска кольцеобразно охватывает В-клетку (рис. 2.12). Бивалентные антитела к иммуноглобулину, взаимодействуя с рецепторами, вызывают их перекрестное связывание с образованием иммуноглобулиновых «пятен» неправильной формы на клеточной поверхности. При повышении температуры болынинст во этих пятен активно перемещается по поверхности клетки и собирается на одном из ее полюсов в виде «колпачка» (рис. 2.12, врезка). За этим процессом, названным кэппинюм, следует погружение (интернализация) молекул иммуноглобулина внутрь клетки, где они подвергаются расщеплению. Кэппинг можно также наблюдать с другими поверхностными гликопротеинами и не только на В-клетках.
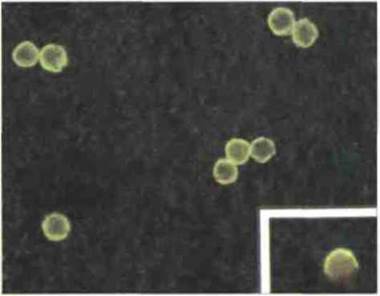
Рис. 2.12. В-клетки, окрашенные для выявления поверхностного иммуноглобулина. Окрашенные флуоресцирующими антителами к IgM на холоде В-клетки дают кольцеобразную флуоресценцию в ультрафиолетовом свете. Инкубация при 37 °С с этими антителами приводит к перераспределению (кэппингу) флуоресцентной метки на один из полюсов клетки (см. врезку). х300. По Zucker-Franklin D., Greaves M.F., Grossi С Е. et at. 1988. Atlas of Blood Cells: Function and Pathology. Vol. II. 2nd edn. Milan: E.E. Ermes, Philadelphia: Lea and Febiger.
«Рецепторный комплекс» В-клеток. Большинство В-клеток периферической крови человека экспрессирует на своей поверхности иммуноглобулины двух изотипов - IgM и IgD (см. гл. 6). На каждой отдельной В-клетке антигенсвязываюшие центры у этих изотипов идентичны Менее 10% В-клеток циркулирующей крови экспрессируют IgG, IgA и IgE, но в определенных областях тела такие клетки встречаются с большей частотой; например, В-клеток, несущих IgA, мною в слизистой оболочке кишечника. Ассоциируя с другими молекулами на поверхности В-клеток, иммуноглобулин образует антигенраспознаюший рецепторный комплекс В-клетки. К этим другим, «вспомогательным» молекулам относятся соединенные дисульфидными связями гетеродимеры, состоящие из Igα (CD79a) и Igβ (CD79b). Эти гетеродимеры, взаимодействуя (подобно составным частим ТкР-СD3-комплскса Т клеток) с трансмембранными сегментами иммуноглобулинового рецептора, участвуют в процессе активации В-клеток.
Другие В-клеточные маркеры и субпопуляции. Ряд других молекулярных маркеров экспрессируется на В-клетках и мыши, и человека (рис. 2.13). Большая часть В-клеток несет на поверхности антигены МНС класса II, которые важны для кооперативных (контактных) взаимодействий с Т-клетками. У мыши это антигены 1-А или 1-Е, у человека — HLA-DP, HLA-DQ и HLA-DR. Выявляемые почти на всех В-клетках рецепторы для компонентов комплемента С3b (CR1, CD35) и C3d (CR2, CD21) вовлечены в процессы клеточной активации и, вероятно, «хоминга». Взаимодействие CD19/CD21 с комплексом комплемент + антиген играет роль в активации В-клеток при участии антигенсвязывающего рецептора антител. На В-клетках имеются также Fc-рецепторы для экзогенного IgG (FcγRII, CD32), передающие сигналы отрицательной регуляции для В-клеток.
Основные маркеры, используемые в настоящее время для идентификации В-клеток человека, — это CD19, CD20 и CD22. Известны также другие В-клеточные маркеры человека — CD72 и CD78. Маркер CD72 обнаружен и на В-клетках мыши (Lyb-2) вместе с В220, представляющим собой высокомолекулярную (220 кДа) изоформу маркера CD45 (Lyb-5). Существенная роль в контактных взаимодействиях между Т- и В-клетками принадлежит маркеру CD40 (см. рис. 11.5).
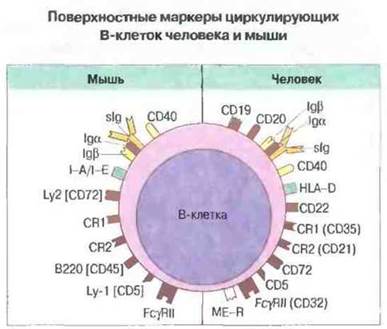
Рис. 2.13. Среди В-клеточных маркеров человека и мыши много гомологичных; они показаны одним цветом. Маркеры человека, эквивалентные мышиным, указаны в квадратных скобках. Маркер В220 ранее обозначали Lyb-5. Цепи Igα и Igβ, взаимодействуя с поверхностным иммуноглобулином (slg), образуют рецепторный комплекс В-клетки. Номера по классификации СD приведены в скобках после функционального названия.
В-клетки можно разделить на две субпопуляции: В-1 (Мас-1+, CD23-) и В-2 (Мас-1-, СD23+). Большинство В-1-клеток экспрессирует маркер CD5 (Lyl), первоначально обнаруженный только на Т-клетках. Функция CD5 для В-клеток человека пока неизвестна; этот маркер ассоциирован с В-клеточным рецептором и может участвовать в регуляции процесса активации В-клеток. B-1-клетки спонтанно синтезируют так называемые нормальные антитела к определенным бактериальным антигенам, а также к аутоантигенам, таким как ДНК, Fc-фрагмент IgG, фосфолипиды и белки цитоскелета. У человека В-1-клетки особенно часто выявляются в крови новорожденных, у мыши — преимущественно в перитонеальной полости. По некоторым данным, они проходят особый путь дифференцировки, отличающийся от созревания «обычных» В-клеток, которые относятся к субпопуляции В-2.
Кроме общего с Т-клетками маркера CD5, В- клетки имеют общие маркеры с друг ими клетками, например маркер CD40, который присутствует на некоторых дендритных клетках.
Нормальные (естественные) клетки-киллеры
Клетки, названные нормальными киллерами (НК), составляют до 15% лимфоцитов крови; они не экспрессируют ни Т-клеточных, ни В-клеточных антигеневязываюгцих рецепторов.
Фенотипические маркеры НК-клеток. Большинство антигенов, выявляемых на поверхности НК с помощью моноклональных антител, присутствует также на Т-клетках и на моноцитах/макрофагах. Основные маркеры НК-клеток человека с указанием их перекрестной специфичности перечислены на рис. 2.14. В очищенных лимфоцитарных популяциях НК-клетки чаще всего выявляют с использованием моноклональных антител к CD16 (FcγRIII). Маркер CD16 участвует в одном из механизмов активации НК и экспрессируется также нейтрофилами, некоторыми разновидностями макрофагов и γδ-Т-клеток.
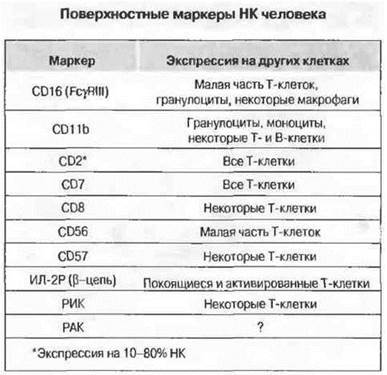
Рис. 2.14. Ни один из этих маркеров не специфичен только для НК. (РИК - рецепторы для ингибиторов киллерных клеток; РАК - рецепторы для активаторов киллерных клеток.)
У гранулоцитов маркер CD16 связан с цитоплазматической мембраной посредством фосфатидилинозитолгликана, тогда как НК, макрофаги и γδ-Т-клетки экспрессируют трансмембранную форму этой маркерной молекулы. Другой важный для идентификации маркер НК — это CD56, представляющий собой гомофильную молекулу межклеточной адгезии (N-CAM) из суперсемейства иммуноглобулинов. У человека лимфоциты, лишенные CD3, но экспрессирующие по одному или оба маркера CD56 и CD16, вероятнее всего относятся к НК, хотя и тот, и другой маркеры присутствуют и у небольшой части Т-клеток. Неактивированные НК репрессируют, кроме того, β-цепь рецептора к ИЛ-2 (рецептор средней аффинности с мол. массой 70 кДа) и передающую сигнал у-цепь, общую для рецепторов, связывающих ИЛ-2 и другие цитокины. Разумеется, прямая стимуляция интерлейкином-2 вызывает активацию НК. Представляет интерес тот факт, что рецептор с мол. массой 70 кДа экспрессируется также на всех Т-клетках. имеющих морфологию БГЛ, а именно на γδ-Т-клетках и на части αβ-Т-клеток CD8+. Под влиянием ИЛ-2 все эти клетки, включая НК, приобретают неспецифическую цитотоксическую активность, превращаясь в клетки, известные под общим названием активированные лимфокином киллерные клетки (ЛАК). ЛАК-клетки проявляют цитотоксическое действие на свежевыделенные клетки опухолей, причем спектр их мишеней гораздо шире, чем у неактивированных НК.
По сравнению с НК человека НК мыши содержат в цитоплазме меньше азурофильных гранул, которые, однако, у них гораздо крупнее. Перечень фенотипических маркеров НК мыши представлен на рис. 2.15.
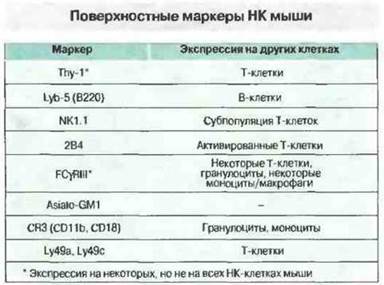
Рис. 2.15. Почти все молекулярные маркеры НК-клеток мыши экспрессируются и на других клетках, однако выявлены и НК-специфичные маркеры.
Функции нормальных клеток-киллеров. Функция НК - распознавание и уничтожение клеток некоторых опухолей (рис. 2.16), а также клеток, инфицированных вирусами. Механизм распознавания полностью пока неясен. Субпопуляции НК экспрессируют молекулы суперсемейства иммуноглобулинов, регулирующие их цитотоксическую активность. Продукты некоторых аллелей НLA класса I могут защищать клетки-мишени от НК, продукты других же, напротив, усиливают их ннтолитическое действие. Так, например, некоторые экспрессируемые клеткой-мишенью молекулы HLA класса I (А, В и С), связавшись с «рецепторами для ингибиторов киллерных клеток» (РИК; например, р58 или р70) на НК, предотвращают цитолиз. Экспрессируемые НК «рецепторы для активаторов киллерных клеток» (например, р50.1. 50.2, 50.3) также могут связываться с продуктами различных аллелей HLA на клетках-мишенях. Эти взаимодействия сами по себе или вместе с другими, в частности со связыванием CD2/LFA-1, вызывают активацию НК. Например, клетки К562, используемые обычно для изучения функции НК, не экспрессируют молекулы HLA и, следовательно, не имеют лигандов для РИК. Однако они обладают LFA-1, что достаточно для осуществления НК-клетками, несущими CD2, своего действия. Каждая нормальная киллерная клетка несет по крайней мере один РИК, специфичный к собственным антигенам МНС, поэтому аутологичные НК не поражают собственные нормальные клетки. Уничтожение этих клеток нормальными киллерами возможно при модификации РИК-специфичных HLA-лигандов в случае спонтанной малигнизации или вирусной инфекции.
Рис. 2.16. Нормальная клетка-киллер (НК) атакует клетку- мишень (М). х 4500. (Фото любезно предоставлено д-ром G. Aranda и Malorni, Рим.)
Нормальные клетки-киллеры способны также поражать клетки-мишени, нагруженные антителами IgG, при участии своих рецепторов для IgG (FcγRIII, или CD16). Эта активность названа антителозависимой клеточноопосредованной цитотоксичностью (АЗКЦ). Активированные НК выделяют у-интерферон (ИФγ) и другие цитокины (в частности, ИЛ-1 и ГМ-КСФ), которые могут играть важную роль в регуляции гемопоэза и иммунного ответа.
Активация В- и Т-клеток
В- и Т-клетки активируются, связываясь со специфическими антигенами. Т-клеткам для этого требуется «увидеть» антиген связанным с молекулами МНС на антигенпрезентируюших клетках, тогда как В-клетки могут связываться с нативными антигенами, но для активации им необходима помощь Т-клеток (в случае некоторых полимерных антигенов дли митогенных по своей природе молекул эта помощь В-клеткам не требуется).
Помимо специфичного связывания антигена рецепторами, для эффективной активации Т- и В-клеток необходимо межклеточное взаимодействие с участием других компонентов поверхности, например, в случае Т-клеток, CD28 (см. гл. 11). Индуцированная антигеном активация и дифференцировка Т- и В-клеток обычно происходит в лимфоидных тканях и может быть воспроизведена in vitro при культивировании лимфоцитов в присутствии активирующего агента. Такими агентами могут служить:
✵ антиген, распознаваемый поверхностным антигенсвязывающим рецептором клетки;
✵ моноклональные антитела к ТкР — СD3-комплексу и
✵ лектины [например, фитогемагглютинин (ФГА), конканавалин А (КонА) и митоген лаконоса].
Лектины — это белки растительного и бактериального происхождения, связывающие углеводы. Некоторые из них способны активировать лимфоциты, перекрестно взаимодействуя с ВкР или ТкР, и служить митогенами (индукторами пролиферации). Считается, что митогенная стимуляция лимфоцитов in vitro довольно близко воспроизводит активацию специфическими антигенами. Лектины ФГА и КонА стимулируют Т-лимфоциты мыши и человека. Бактериальный липополисахарид (ЛПС) стимулирует В-клетки мыши, а митоген лаконоса вызывает пролиферацию и В-, и Т-клеток человека (рис. 2.17).
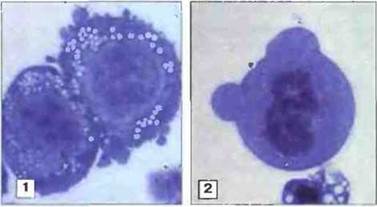
Рис. 2.17. Бласттрансформация лимфоцитов, индуцированная митогеном или антигеном. Представленные на фотографии Т- и В-клетки человека активированы митогеном лаконоса. 1. Усиление базофилии цитоплазмы и увеличение объема клеток. 2. При клеточном делении происходит конденсация хромосом, и они становятся хорошо видны. Окраска по Гимза. х 1500. По Zucker-Franklin D., Greaves M.F., Grossi С.Е. et al. 1988. Atlas of Blood Cells: Function and Pathology. Vol. II. 2nd edn. Milan: E.E. Ermes, Philadelphia: Lea and Febiger.
Исследования in vitro с применением этих агентов показали, что активация Т- и В-клеток вызывает синтез цитокинов и рецепторов для них. Взаимодействие цитокинов с рецепторами индуцирует вступление клеток в цикл деления (пролиферация) и их последующее созревание с образованием эффекторных клеток или клеток иммунологической памяти. В условиях in vitroклетки памяти рециркулируют и в итоге расселяются по Т- и В-зависимым областям лимфоидных тканей, где они в дальнейшем остаются, сохраняя готовность к ответу при новой встрече с тем же антигеном.
Сигнал активации передают «вторые посредники». В результате взаимодействия покоящихся лимфоцитов с антигеном индуцируется цепь биохимических процессов, приводящих к образованию внутри В- или Т-клетки «вторых посредников». Эти посредники ответственны за последующие изменения на уровне генов. Существует несколько основных механизмов активации лимфоцитов, но до конца они пока не ясны. Как в Т-, так и в В-клетках в передаче сигнала активации участвует гуанозинтрифосфат-связывающий (ГТФ-зависимый) белок (G-белок), который стимулирует метаболизм фосфатидилинозитола. В результате образуются два вторых посредника — инозйтол-1,4,5-трифосфат (IP3) и диацилглицерол (ДАГ). Посредник IP3 индуцирует выход ионов Са2+ из внутриклеточных депо, а ДАГ активирует протеинкиназу С, которая вместе с другими киназами фосфолирует ряд компонентов плазматической мембраны, что приводит к появлению факторов транскрипции и последующей экспрессии определенных генов. Таким образом, сразу после контакта Т-лимфоцитов с антигеном на их поверхности экспрессируется ряд молекул, в том числе gp39 и рецептор для ИЛ-2. Дальнейшие межклеточные взаимодействия с участием этих молекул вызывают пролиферацию и дифференцировку лимфоцитов.
Дифференцировка В-клеток приводит к образованию плазматических клеток и клеток иммунологической памяти. После активации митогеном или антигеном Т- и В-клетки претерпевают характерные ультраструктурные изменения, превращаясь в лимфобласты (рис. 2.8 и 2.18). Впоследствии многие В-лимфобласты созревают в антителообразующие клетки (АОК), которые in vivoразвиваются затем в окончательно дифференцированные плазматические клетки. В некоторых В-лимфобластах не образуется цистерн шероховатого эндоплазматического ретикулума (ЭР). Такие клетки присутствуют в центрах размножения внутри лимфоидных фолликулов; они названы иентральными клетками фолликула, или центроцитами (рис. 2.19).
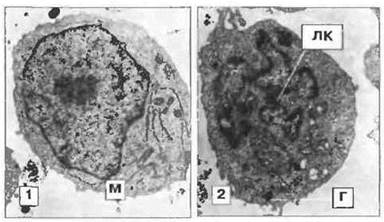
Рис. 2.18. Ультраструктура Т-лимфобластов. Т-лимфобласты, возникающие из Т-лимфоцитов после стимуляции антигеном или митогеном, - это крупные клетки с развитой цитоплазмой, содержащие разнообразные органеллы, в том числе митохондрии (М) и свободные полирибосомы. Лимфобласты могут быть «негранулярными» (1) или гранулярными (2) в зависимости от присутствия или отсутствия электроноплотных гранул (Г). В цитоплазме гранулярного лимфобласта видны также липидные капли (ЛК), х 3200.
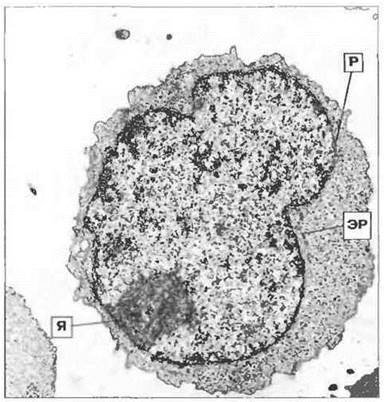
Рис. 2.19. Центральная клетка лимфоидного фолликула. Видна развитая цитоплазма, содержащая полирибосомы (Р) и несколько канальцев шероховатого эндоплазматического ретикулума (ЭР), однако стопки цистерн (параллельные ряды ЭР) отсутствуют. Заметно крупное эксцентрично расположенное ядрышко (Я), прилегающее к оболочке ядра. Возможно, такие клетки представляют собой В-клетки иммунологической памяти Сходную морфологию имеют клетки некоторых лимфом, называемых центробластными или центроцитарными. х 8500.
Как показывает световая микроскопия, цитоплазма плазматических клеток базофильна, т. е. обладает сродством к основным красителям. Это свойство цитоплазмы объясняется присутствием в ней больших количеств РНК, обеспечивающей синтез антител на рибосомах шероховатого ЭР (рис. 2.20). С помощью электронного микроскопа в плазматических клетках можно наблюдать параллельные ряды шероховатого ЭР (рис. 2.21). Эти клетки редко появляются в кровотоке, составляя не больше 0,1% циркулирующих лимфоцитов. В норме плазматические клетки встречаются только во вторичных лимфоидных органах и тканях, и, кроме того, их довольно много в красном костном мозге. Антитела, образуемые одной плазматической клеткой, обладают одной антигенной специфичностью и принадлежат к одному изотипу иммуноглобулинов. Их можно выявить в цитоплазме этих клеток с помощью меченных флуорохромом антиглобулиновых антител (рис. 2.22). Плазматические клетки имеют короткую продолжительность жизни; просуществовав лишь несколько дней, они погибают в процессе апоптоза (рис. 2.23).
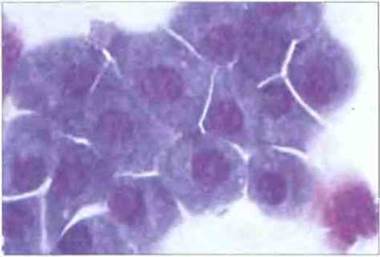
Рис. 2.20. Морфология плазматических клеток. Для зрелой плазматической клетки характерны эксцентричное расположение ядра и развитая базофильная цитоплазма (базофилия обусловлена высоким содержанием РНК, необходимой для синтеза белка). В несколько более светлой околоядерной области расположен комплекс Гольджи. Окрашивание по Маю-Грюнвальду Гимзе. х 1000. rioZucker-Franklin D., Greaves M.F., Grossi С.Е. et al. 1988. Atlas of Blood Cells: Function and Pathology. Vol. II. 2nd end. Milan: E.E. Ermes, Philadelphia: Lea and Febiger.
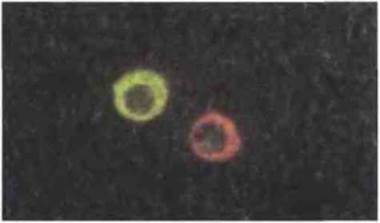
Рис. 2.22. Иммунофлуоресцентное окрашивание иммуноглобулина в цитоплазме плазматических клеток. Фиксированные плазматические клетки человека окрашены меченными флуоресцеином антителами к IgMчеловека (зеленое свечение) и меченными родамином антителами к IgG человека (красное свечение). Видна интенсивная внутрицитоплазматическая флуоресценция. Разный характер окраски двух плазматических клеток свидетельствует о том, что в норме каждая из них образует антитела только одного класса или подкласса (изотипа), х 1500. Пo Zucker-Franklin D., Greaves M.F., Grossi С.Е. et al. 1988. Atlas of Blood Cells: Function and Pathology. Vol. II. 2nd edn. Milan: E.E. Ermes, Philadelphia: Lea and Febiger.
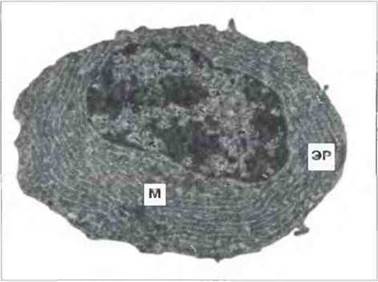
Рис. 2.21. Ультраструктура плазматической клетки. Видны характерные параллельные ряды шероховатого эндоплазматического ретикулума (ЭР). В зрелых клетках цистерны ЭР заполнены иммуноглобулинами. Видны также митохондрии (М). х 5000. По Zucker-Franklin D., Greaves M F., Grossi С.Е. et al. 1988. Atlas of Blood Cells: Function and Pathology. Vol. II. 2nd edn. Milan:
E.E. Ermes, Philadelphia: Lea and Febiger.

Рис. 2.23. Апоптотическая гибель плазматической клетки. Плазматические клетки живут недолго и погибают в результате апоптоза (запрограммированного самоуничтожения). Видны характерные для апоптоза изменения ядерного хроматина, х 5000.
Маркеры активации на лимфоцитах. Активация Т- и В-клеток вызывает синтез de novo ряда поверхностных маркеров и увеличение экспрессии других.
К этим маркерам активации относятся молекулы межклеточной адгезии, обеспечивающие более эффективное взаимодействие активированных клеток с другими, а также рецепторы факторов роста и дифференцировки, необходимые для постоянной пролиферации и созревания клеток. Один из них — рецептор для ИЛ-2 (ИЛ-2Р), экспрессируемый Т-клетками после активации; он состоит из трех субъединиц. В состоянии покоя Т-клетки постоянно экспрессируют γ-цепь (CD134) этого рецептора, а некоторые из них (БГЛ) образуют также его β-цепь (CD122). Активация вызывает синтез α-субъединицы ИЛ-2Р (CD25) и образование гетеротримерного высокоаффинного ИЛ-2Р. Временно активация Т-клеток вызывает также экспрессию gp39 (CD40L) и рецепторов трансферрина (CD71, важен для пролиферации), CD38 и CD69. Эти маркеры появляются в ранней фазе онтогенеза Т-клеток, но исчезают в ходе внутритимусного развития (см. гл. 12). Поздними маркерами активации Т-клеток человека служат молекулы МНС класса II (на Т-клетках мыши не выявляются). На Т-клетках, в частности Т-клетках иммунологической памяти, экспрессируется как поздний маркер активации CD29 (β1-цепь VLA). Поэтому функцию «памяти» субпопуляции Т-клеток CD4+CD29+можно интерпретировать как индуцированное активацией увеличение числа различных молекул межклеточной адгезии, которые облегчают взаимодействие этих Т-клеток с другими, если организм встречается сданным антигеном вновь.
К маркерам активации В-клеток относятся высокоаффинный ИЛ-2Р и другие рецепторы для факторов роста и дифферецировки, таких как ИЛ 3, ИЛ-4, ИЛ-5 и ИЛ-6 (см. гл. 10). Все эти рецепторы изучены методами молекулярного клонирования и секвенирования. Кроме того, на активированных В-клетках экспрессируются рецепторы трансферрина (CD71) и в повышенной концентрации мембранные антигены МНС класса II. Экспрессируемый на активированных В-клетках человека и мыши маркер CD23 (FcεRII, низкоаффинный рецептор для IgE) участвует в индукции клеточного деления. Маркер CD38 отсутствует па зрелых В-клетках человека, но обнаруживается на конечной сталии дифференцировки плазматических клеток и клеток центров размножения, а также на В-клетках очень ранних стадий созревания. Молекулы специфического плазмоцитарного антигена-1 найдены на В-клетках человека только в плазмоцитарной стадии их дифференцировки. Клетки иммунологической памяти, выявляемые в центрах размножения внутри вторичных лимфоидных фоликулов (см. гл. 12), не экспрессируют ни IgD, ни CD22.
К маркерам активации НК-клеток относятся молекулы МНС класса II.