ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 6. Антитела и клеточные рецепторы для них
СТРОЕНИЕ АНТИТЕЛ
Основная четырехцепочечная структурная единица (мономер) иммуноглобулиновых молекул (рис. 6.5) образована полипептилными цепями двух разных типов. Меньшие по размерам (легкие. L— от англ. light) цепи имеют мол. массу 25 кДа и одинаковы у всех классов, тогда как более крупные (тяжелые, Н — от англ. heavy) цепи, мол массой 50—77 кДа, структурно различны у разных классов и подклассов иммуноглобулинов. Полипептидные цепи удерживаются вместе ковалентными и нековалентными связями.
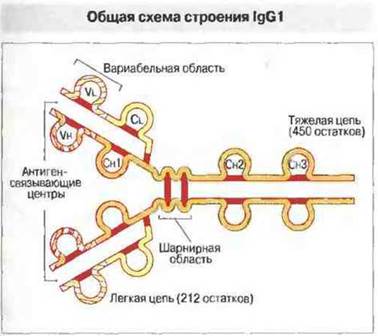
Рис. 6.5. N-концевой последовательности как легких (L), так и тяжёлых (Н) цепей lgG1 свойственна вариабельность (V), поэтому эти области названы соответственно Vl и Vh. Остальные части молекулы имеют относительно неизменную (константную - С) структуру. Константная область легкой цепи обозначается Cl. Константная область тяжелой цепи подразделяют еще на три структурно обособленные области - Сн1, Сн2 и Сн3. И вариабельные, и константные области легких и тяжелых цепей образуют стабилизированные внутрицепочечными дисульфидными связями (показаны красным цветом) глобулярные структуры, называемые доменами. Антигенсвязывающие центры молекулы иммуноглобулина образованы вариабельными доменами Vl и Vh. Отрезок тяжелой цепи между доменами Сн1 и Сн2 называют «шарнирной» областью; она обладает гибкостью, которая позволяет обоим антигенсвязывающим центрам функционировать независимо один от другого. За исключением домена Сн2, домены одной тяжелой цепи тесно прилежат к гомологичным (V и С) доменам легкой цепи и к Сн3-области другой тяжелой цепи (см. рис 6.7). К Сн2-доменам присоединяются углеводные компоненты.
Каждая цепь содержит вариабельную и константную области. У большинства позвоночных легкие цепи существуют в двух различных изотопических формах, обозначенных каппа (k) и лямбда (λ.). В молекуле иммуноглобулина могут объединяться пары легких и тяжелых цепей любого типа, но обе цепи в парс относятся к одному типу.
Как установили Хильшманн, Крейг и др. (1965 г.), легкие цепи состоят из двух различных областей. С-концевая половина (приблизительно 107 аминокислотных остатков) цепи одинакова (константна) у легких цепей всех типов (исключая некоторые аллотипические и изотопические варианты, см. ниже); она названа константной, или Cl-областью (от англ. constant light chain). В то же время N-концевая половина этой цепи имеет множество вариантов аминокислотной последовательности, из та чего названа вариабельной, или Vl-областью (от variable light chain).
Молекулы IgG имеют «типичную» для антител структуру
В качестве «типичного» антитела можно рассматривать молекулу IgG (рис. 6.5). В ней имеется две внутрицепочечные дисульфидные связи в каждой легкой цепи — по одной в вариабельной и константной областях (рис. 6.6) - и четыре таких связи в каждой тяжелой (γ) цепи, которая вдвое длиннее легкой. Каждая дисульфилная связь замыкает пептидную петлю из 60—70 аминокислотных остатков; при сравнении аминокислотных последовательностей этих петель выявляется удивительно высокая степень их гомологии. В основном поэтому каждая полипептидная цепь иммуноглобулина образует несколько глобулярных доменов с весьма сходной вторичной и третичной структурой. Это иллюстрирует на примере легкой цепи рис. 6.6.
Пептидная петля, замкнутая дисульфидной связью, — это центральная часть «домена», в котором всего насчитывается примерно 110 аминокислотных остатков. Как в легких, так и в тяжелых цепях первые от N-конца домены образованы соответственно вариабельными областями Vl и Vh (рис. 6.7). Тяжелые цепи IgG, IgA и IgD имеют еще три домена — Сн1, Сн2 и Сн8, составляющих константную область. В цепях μ и ε непосредственно за Сн1 следует один дополнительный домен (см. рис. 6.10), поэтому С-концевые домены тяжелых цепей IgM и IgC (обозначаемые Сμ4 и Сε4) гомологичны Сн3-домену IgG (Сγ3).
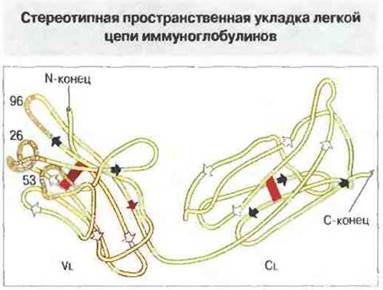
Рис. 6.6. Легкая цепь иммуноглобулина стереотипно свертывается так, что ее прямолинейные полипептидные отрезки формируют два домена - вариабельный и константный, располагаясь в них параллельно продольной оси домена и образуя два слоя со взаимно противоположным направлением аминокислотной последовательности. В пространство между слоями обращены многочисленные гидрофобные боковые цепи аминокислот. Один из слоев в каждом домене сформирован четырьмя отрезками полипептидной цепи (отмечены белыми стрелками), другой - тремя (отмечены черными стрелками); эти два слоя соединены одной дисульфидной связью (красная полоса). Отрезки Vl-домена уложены так, что гипервариабельные участки выступают на поверхность тремя отдельными (но пространственно сближенными) петлями. В каждом гипервариабельном участке указан номер позиции одного из аминокислотных остатков.
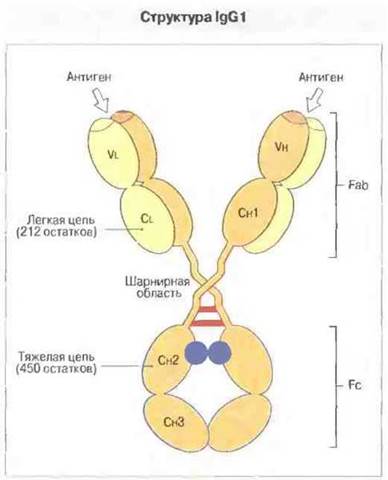
Рис. 6.7. Модель молекулы IgG1 с изображением глобулярных доменов тяжелой (Н) и легкой (L) цепей. Обратите внимание на взаимное сближение доменов Сн3 и разделение доменов Сн2, между которыми расположены углеводные компоненты (показаны синим). На этом рисунке (а также на рис. 6.10) дисульфидные связи между Н- и L-цепями не показаны.
По данным рентгеноструктурного анализа удалось реконструировать α-углеродный скелет и построить компьютерные модели целых молекул IgG (рис. 6.8). Модельные IgG имеют вид Y- и Т-образных структур, и аналогичные формы IgG выявлены с помощью электронной микроскопии.
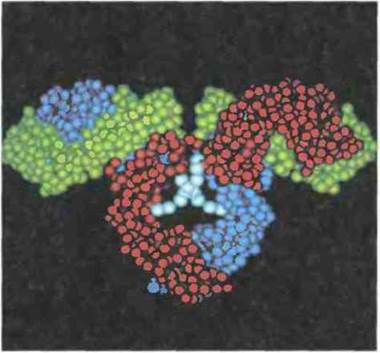
Рис. 6.8. Компьютерная модель IgG1 человека, построенная по данным рентгеноструктурного анализа белка Dob, лишенного шарнирной области. Молекулы белков такого типа не обладают гибкостью, характерной для нормальных молекул IgG человека. Именно жесткость их структуры позволяет получить при анализе более высокое разрешение. Одна тяжелая цепь окрашена синим, другая - красным, а обе легкие цепи - зеленым цветом. Углеводные цепи, присоединяющиеся к полипептидным в Fc-части молекулы, показаны бирюзовым цветом. Согласно этой модели, Сγ2-домены весьма слабо взаимодействуют друг с другом, а Сγ3-домены довольно сильно. (По David R. Davies et al. 1977. Proc. Natl. Acad. Set. USA 74. Компьютерная графика получена с использованием системы, разработанной Richard J. Feldmann(Национальные институты здоровья, США).
В Fab-области молекулы иммуноглобулина гомологичные домены легких и тяжелых цепей располагаются парами (как показано на рис. 6.7); Сγ3-домены двух тяжелых цепей также образуют пару, но Сγ2-домены разделены углеводными компонентами.
Несмотря на структурное сходство гомологичных доменов, междоменные взаимодействия в разных парах существенно различаются. Например, вариабельные домены контактируют друг с другом слоями, состоящими из трех сегментов цепи, а константные - слоями из четырех сегментов (схему двуслойной укладки сегментов легкой цепи в двух ее доменах см. на рис. 6.6). Модель молекулы IgG1, представленная на рис. 6.7, в общем адекватно отражает структуру элементарных единиц в составе иммуноглобулинов всех изотипов, однако каждый класс и подкласс имеет свои характерные отличия в деталях строения.
IgG. Четыре подкласса IgG человека лишь слегка различаются по аминокислотной последовательности тяжелых цепей. Этими различиями, относящимися в основном к шарнирной области, обусловлены изотипические вариации расположения и числа межцепочечных дисульфидных связей. Из четырех подклассов наиболее выраженной структурной особенностью — удлиненной шарнирной областью — обладает IgG3, чем объясняется его более высокая мол. масса и, отчасти, повышенная биологическая активность (рис. 6.9).
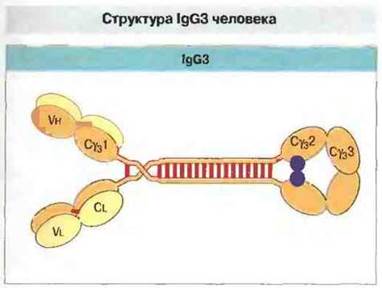
Рис. 6.9. Схематическое изображение молекулы IgG3 человека. Обратите внимание на удлиненную шарнирную область тяжелых цепей.
IgМ. У человека IgM обычно обнаруживается в виде пентамера основной четырехцепочечной структурной единицы (рис. 6.10). Отличие его μ-цепи от γ-цепей IgG состоит в иной аминокислотной последовательности и наличии дополнительного константного домена с С-концевым пептидом из 18 аминокислотных остатков. Субъединицы пентамера соединены дисульфидными связями между Сμ3-доменами и, вероятно, между С-концевыми пептидами. По данным электронной микроскопии молекула IgM имеет плотно сложенный центр, от которого расходятся пять ветвей.
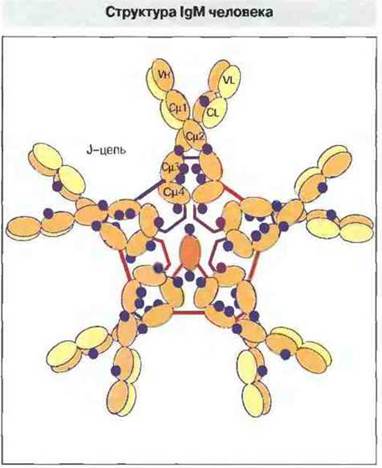
Рис. 6.10. Тяжелые цепи IgM пространственно свертываются с образованием пяти доменов, причем Сμ3- и Сμ4-домен каждой цепи соединен дисульфидной связью с аналогичным доменом соседнего мономера. Показаны также участки присоединения углеводных боковых цепей (синим цветом) и возможное расположение J-цепи. В молекуле IgM нет протяженных шарнирных областей, однако они способны изгибаться в области Сμ2-доменов.
На микрофотографиях антитела IgM, связавшиеся с бактериальным жгутиком (или с полиовирусным вирионом, как на рис. 6.11), видны в «крабовидной» конфигурации. Такая форма молекулы IgM свидетельствует о том, что тяжелые цепи в области между Сμ2 и Сμ3 могут легко изгибаться, хотя по структуре эта область не гомологична шарнирной области IgG. Взаимное расположение разных частей молекулы IgM, при мявшей «крабовидную» конфигурацию, по-видимому, связано с активацией ею комплемента.
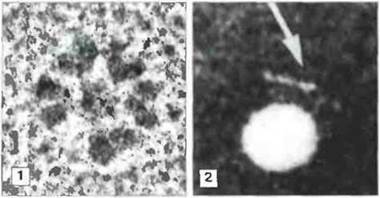
Рис. 6.11. Электронные микрофотографии молекул IgM. 1. Молекула IgМ оленя в растворе принимает характерную форму звезды. х 195 000. (Фото любезно предоставлено д-рами Е. Holm и Nielson Р. Storgaard и проф. S.-E. Svehag.) 2. Связавшаяся с полиовирусным вирионом молекула IgM кролика (под стрелкой) в «крабовидной» конфигурации; частично видна центральная округлая часть молекулы, х 190 000. (Фото любезно предоставлено д-ром В. Chesebro и проф. S.-E. Svebag.)
Молекулу IgM характеризуют сиге два свойства: многочисленные присоединенные к μ-цепи олигосахариды и добавочная пептидная J-цепь (от англ. joining — соединение), которая предположительно принимает участие в полимеризации мономерных единиц, предшествующей выходу IgM из синтезирующей его клетки. J-цепь представляет собой полипептид из 137 аминокислотных остатков, образующий домен иммуноглобулинового типа. Каждая молекула IgM содержит только одну J-цепь. Она соединена дисульфидными связями с С-концевыми, состоящими из 18 аминокислотных остатков пептидами тяжелых цепей отдельных мономеров (дисульфидную связь образует остаток цистеина в пред послед ней позиции). Имеется наблюдение, что в клетках, секретирующих IgM преимущественно в форме гексамера, отсутствуют свободные J-цепи.
IgA. Состоящая из 472 аминокислотных остатков α-цепь свертывается с образованием четырех доменов: Vh, Cα1, Cα2 и Сα3 (рис. 6.12). Аналогично IgM тяжелая цепь IgA содержит дополнительный С-концевой пептид из 18 аминокислотных остатков с остатком цистеина в предпоследней позиции. Этот остаток способен ковалентно взаимодействовать с J-цепью, соединяющей две молекулы с образованием димера. На электронных микрофотографиях димеры IgA выглядят как двойные Y-формы, что свидетельствует о соединении двух мономерных субъединиц конец-в-конец и об участии в этом соединении С-концевых областей Сα3 (рис. 6.13).
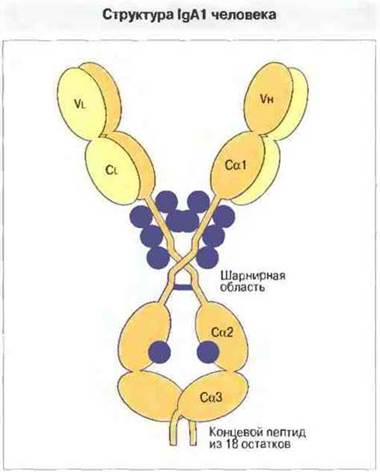
Рис. 6.12. Доменная структура IgA1 и вероятное расположение углеводных цепей (показаны синим). Отмечен «хвостовой» пептид из 18 аминокислотных остатков на С-конце (общий признак с IgM) и шарнирная область.
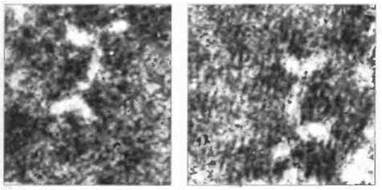
Рис. 6.13. Электронные микрофотографии димерных молекул IgA человека. Сдвоенные Y-формы свидетельствуют о соединении двух мономерных субъединиц конец-в конец в области Сα3-домена. х 250 000. (Фото любезно предоставлено проф. S.-E. Svehag.)
Секреторный IgA (sIgA) представлен главным образом димерной формой с коэффициентом седиментации 11S (мол. масса 380 кДа). Полностью собранная молекула состоит из двух мономеров IgA, одного секреторного компонента (мол. масса 70 кДа) и одной J-цепи (мол. масса 15 кДа) (рис. 6.14). Как все эти пептидные цепи связаны между собой, до конца не ясно. В противоположность J-цепи секреторный компонент синтезируется не в плазматических, а в эпителиальных клетках. Молекулы IgA, удерживаемые в димерной конфигурации J-цепью и секротируемые субэпителиальными плазматическими клетками слизистых оболочек, при прохождении через эпителиальный покров активно связывают секреторный компонент. Он способствует доставке антител sIgA в выделения организма, а также защищает эти антитела от протеолиза.
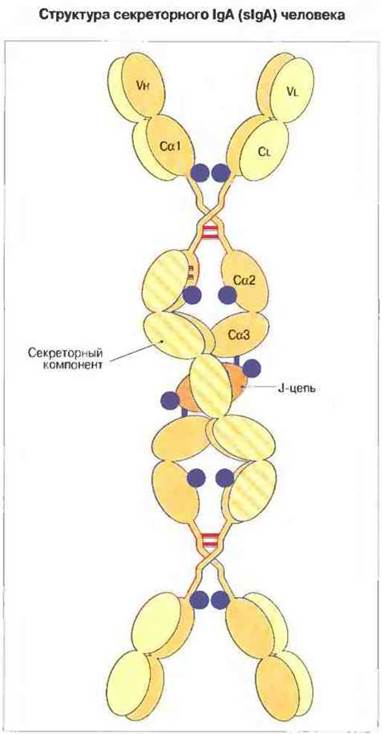
Рис. 6.14. Секреторный компонент, вероятно, обвивается вокруг димера sIgA, присоединяясь двумя дисульфидными связями к Сα2-домену одного из мономеров J-цепь необходима для соединения двух мономеров вместе.
Преобладающий подкласс IgA, как в сыворотке, так и в выделениях организма (носовой секрет, слюна, слезы, молоко), — это IgA1 (~90% и 70-95% соответственно). Однако в просвете толстой кишки около 60% IgA составляет подкласс IgA2. Многие бактерии в микрофлоре верхних дыхательных путей, приспособленные к условиям обитания, выделяют протеазы, расщепляющие IgA1.
IgD. К IgD относится меньше 1% иммуноглобулинов сыворотки. Этот белок гораздо более чувствителен к протеолизу, чем IgG1, IgG2, IgA или IgM и, кроме того, проявляет тенденцию к спонтанному протеолизу. По-видимому, его δ-цепи удерживаются вместе всего одной дисульфидной связью и соединены с большим количеством углеводных (олигосахаридных) цепей (рис. 6.15).
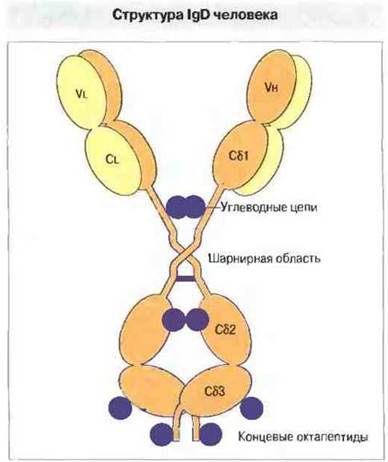
Рис. 6.15. Доменная структура IgD с типичным для этого изотипа большим числом олигосахаридных цепей. Отмечена шарнирная область и короткие С-концевые октапептиды.
IgЕ. Молекула IgE (рис. 6.16) состойз из более крупных (по сравнению с другими изотипами) ε-цепей (72,5 кДа), содержащих большее число аминокислотных остатков (приблизительно 550) и образующих пять доменов (Vh, Cε1, Сε2, Сε3, и Сε4).
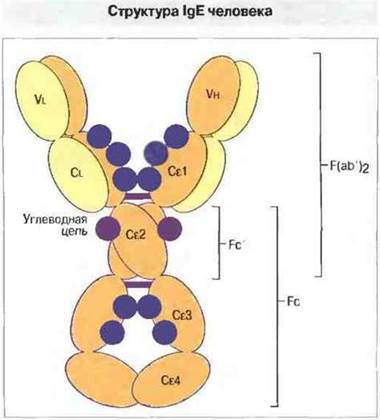
Рис. 6.16. Молекула IgE может расщепляться под действием ферментов на фрагменты F(ab')2. Fc и Fc'. Шарнирная область отсутствует.