ИММУНОЛОГИЯ - Ройт А. - Мир 2000
Глава 17. Иммунитет к бактериальным и грибковым инфекциям
■ О механизмах защиты против той или иной бактериальной инфекции можно судить по строению клеток возбудителя, особенно клеточной стенки, и типу патогенности.
■ Нейтрализующие антитела могут полностью обеспечивать защиту, если патогенность возбудителя Связана только с токсином или адгезином.
■ Неспецифические, филогенетически древние механизмы иммунитета - фагоцитоз, альтернативная активация комплемента и выделение цитокинов - действуют вследствие распознавания консервативных бактериальных структур.
■ Комплемент может уничтожать некоторые бактерии, в первую очередь - грамотрицательные, т. е. имеющие наружный липидный бислой, или наружную мембрану, в составе клеточной стенки.
■ Фагоциты способны уничтожать клетки большинства бактерий, осуществляя последовательно хемотаксис, связывание, поглощение и лизис.
■ Патогенные микроорганизмы обладают разнообразными свойствами для обхода защитного действия комплемента и фагоцитов или для направления Т-зависимой активации фагоцитоза по ложному пути.
■ Избыточное выделение цитокинов, вызываемое микробами, может быть причиной иммунопатологических синдромов, таких как эндотоксический шок и реакция Шварцмана.
■ Хроническую иммунопатологию с повреждением тканей (как, например, при туберкулезе) вызывает, вероятно, дисбаланс в выделении цитокинов, приводящий к неадекватным эффектам.
■ Иммунитет к грибам, вероятно, опосредован клетками и сходен с антибактериальным.
ИММУНИТЕТ К БАКТЕРИЯМ
Защитные механизмы, действующие при той или иной бактериальной инфекции, соответствуют структуре клеток возбудителя (направлены на их уязвимые участки) и факторам его патогенности.
Механизм иммунитета зависит от типа поверхности бактериальных клеток
Существуют четыре основных типа строения бактериальной клеточной стенки (рис. 17.1), и по этому признаку бактерии распадаются на следующие группы:
✵ грамположительные бактерии;
✵ грамотрицательные бактерии;
✵ микобактерии;
✵ спирохеты.
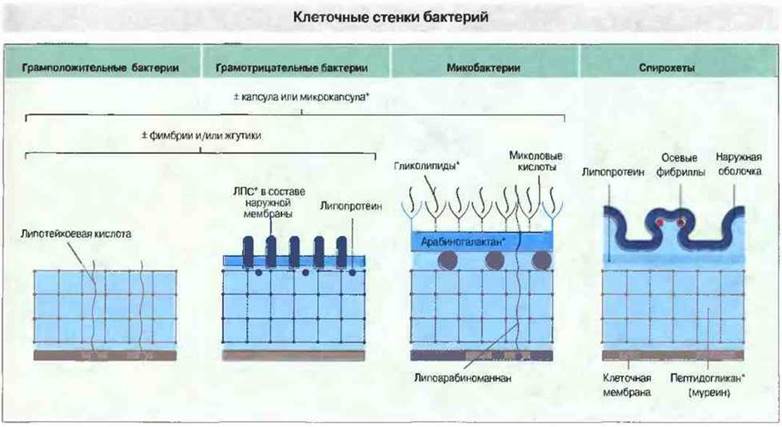
Рис. 17.1. Существуют различные иммунологические механизмы для разрушения клеточных стенок различных микроорганизмов. Микробы всех типов обладают цитоплазматической мембраной и пептидогликановой клеточной стенкой. Грамотрицательные бактерии, кроме того, имеют наружную мембрану, внешний слой которой содержит липополисахарид (ЛПС). Лизосомные ферменты и лизоцим разрушают структуру пептидогликана, а катионные белки и комплемент - наружную мембрану грамотрицательных бактерий. Клеточная стенка микобактерий чрезвычайно устойчива к различным воздействиям; по-видимому, ее разрушение возможно только при участии действующих изнутри ферментов самой бактериальной клетки. Некоторые бактерии имеют фимбрии и жгутики, компоненты которых могут служить мишенями для антител. Часть бактерий обладает наружной капсулой, повышающей устойчивость к фагоцитозу или к комплемент-зависимому лизису. Компоненты клеточных стенок, обозначенные на рисунке звездочкой, обладают иммуноадъювантными свойствами, т. е. воспринимаются иммунной системой как неспецифический сигнал, усиливающий иммунный ответ.
Наружная мембрана в составе клеточной стенки грамотрицательных бактерий чувствительна к литическому действию комплемента и некоторых цитотоксических клеток. Бактерии с другим строением клеточной стенки могут быть уничтожены только путем фагоцитоза.
Некоторые бактерии несут на поверхности фимбрии или жгутики, многие покрыты защитной капсулой. Эти поверхностные структуры могут препятствовать фагоцитозу или действию комплемента, но они же являются мишенью для антител, роль которых рассмотрена ниже.
Механизмы иммунитета соответствуют факторам патогенности бактерий
Двумя крайними формами патогенности бактерий можно считать:
✵ токсигенность без инвазивности и
✵ инвазивность без токсигенности (рис. 17.2). Однако в реальности большинство бактерий занимает по характеру патогенности промежуточное положение между этими полюсами, например проявляя в некоторой степени инвазивность, обусловленную, как правило, локальным действием своих токсинов и разрушением тканей ферментами (факторы распространения).
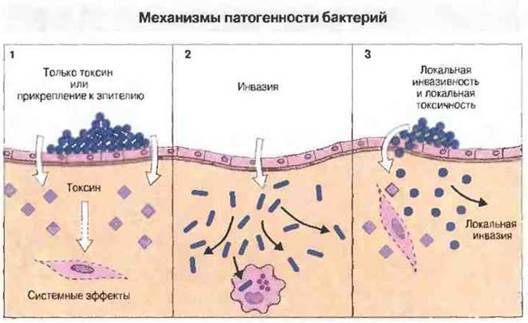
Рис. 17.2.
1. Некоторые бактерии способны вызывать болезнь, не проникая из очага инфекции в ткани организма. Патогенность их обусловлена выделением одного токсина, как например у Carynebacterium diphtheriae и Clostridium tetani, либо способностью прикрепляться к клеткам эпителия и выделять целый ряд токсинов и ферментов, как у стрептококков группы А, вызывающих, в частности, ангину. Для иммунитета в этих случаях может быть достаточно антител, нейтрализующих основной фактор патогенности.
2. Другие бактерии, напротив, не обладают токсигенностью, но вызывают заболевание в результате проникновения в ткани, а иногда и в клетки организма, повреждая их главным образом в результате интенсивного размножения или вследствие иммунопатологических реакций (например, при лепроматозной проказе). Для уничтожения бактерий, проникших в клетки, действуют механизмы клеточного иммунитета.
3. Большинство бактерий занимает промежуточное положение между этими крайними типами патогенности, обладая одновременно локальной инвазивностью, локальной токсигенностью и ферментами, разрушающими внеклеточный матрикс (примеры - Staphilococcus aureus и Clostridium perfringens). В защите против них принимают участие как антитела, так и механизмы клеточного иммунитета.
Примером бактерий, которые считаются токсигенными, но не инвазивными, могут служить Corynebacierium diphtheriae и Vibrio cholerae1. Поскольку патогенность этих возбудителей почти полностью обусловлена образованием токсина, для защиты от них, вероятно, вполне достаточно действия антител, нейтрализующих токсин, хотя при этом могут быть важны и антитела, которые связываются с бактериями и предотвращают таким образом их прикрепление к эпителию.
Патогенность высокоинвазивных бактерий, напротив, не обусловлена, как правило, каким-либо одним токсином, поэтому механизмы иммунитета против них направлены на уничтожение самих клеток возбудителя.
Первая линия обороны от бактерий не связана с распознаванием антигенов
Самую первую линию защиты от патогенных бактерий создает барьер, образуемый наружными покровами тела; он препятствует проникновению микроорганизмов или развитию инфекции. Так, кожа и находящиеся в контакте с внешней средой слои эпителия снабжены неспецифическими, или врожденными, механизмами зашиты от внедрения микробов (см. рис. 1.1) Неповрежденная кожа просто непроницаема для большинства бактерий. Кроме того, для многих из них токсичны выделяемые кожей жирные кислоты. Патогенность некоторых штаммов бактерий коррелирует с их способностью выживать на коже. Эпителиальные покровы очищаются от бактерий благодаря, например, движению ресничек в трахее и току мочи в мочевыводящих путях. Во влагалище и желудке многие бактерии погибают вследствие кислой реакции среды. Влагалищный эпителий секретирует гликоген, который ряд бактерий-комменсалов метаболизирует с образованием молочной кислоты. Вообще комменсалы способны препятствовать инвазии патогенных бактерий, продуцируя антибактериальные белки, названные колицинами. Поэтому нарушение нормальной микрофлоры антибиотиками может привести к инфекциям, вызываемым Candida или Clostridium difficile.
В действительности лишь ничтожной части окружающих нас потенциально патогенных микробов в редких случаях удается проникать в ткани организма.
Действие второй линии обороны связано с распознаванием общих для разных бактерий клеточных компонентов
Проникшие в ткань клетки бактерий вначале могут быть атакованы действующими во внутренней среде организма механизмами врожденного иммунитета. Множество компонентов бактериальных клеток иммунная система распознает без участия антигепспецифичных рецепторов В- или Т-клеток — благодаря действию филогенетически древних механизмов грубого распознавания, появившихся в эволюции раньше антигенспецифичных Т-клеток и иммуноглобулинов. В результате такого распознавания вызывают иммунный ответ общие для разных бактерий клеточные компоненты. Многие бактерии, например непатогенные кокки, по-видимому, устраняются из тканей организма в результате действия именно таких механизмов, без формирования специфического (адаптивного) иммунного ответа. Пули грубого распознавания и его мишени - общие микробные компоненты - перечислены на рис. 17.4. Примечательно, что используемый для определения примеси бактериального липополисахарида (ЛПС) в лекарственных препаратах «ли-
мул юс-тест» основан на одном из таких механизмов распознавания, обнаруженном у беспозвоночных: в гемолимфе мечехвоста Limulus polyphe- mus следовые количества ЛПС вызывают образование фибрина, волокна которого обездвиживают ЛПС-содержащий инфекционный агент.
Механизм реакции на ЛПС Он включает нейтрализацию ЛПС (путем связывания липопротеиновыми частицами) и, кроме того, перенос этого бактериального продукта на клеточную мембрану лейкоцитов, а также, вероятно, эндотелиальных клеток. Взаимодействуя с молекулами их поверхности, ЛПС может активировать соответствующие эффекторные функции этих клеток
(рис. /7.3). Подобным образом могут распознаваться и вызывать ответ и другие филогенетически древние (консервативные) компоненты бактериальных клеток.
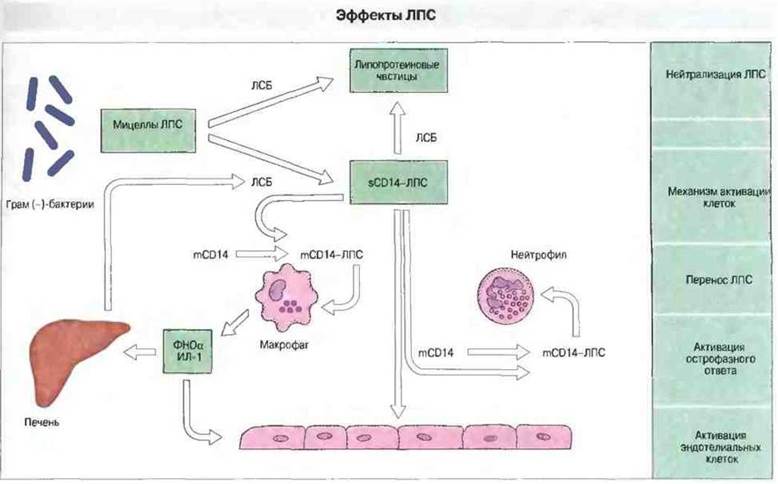
Рис. 17.3. Липополисахарид (ЛПС) - компонент наружной мембраны грамотрицательных бактерий - связывается в плазме крови с растворимым маркером CD 4 (sCD14) и липопротеиновыми частицами. Катализатором этого взаимодействия служит липид-переносящий белок, названный ЛПС-связывающим (ЛСБ). Связывание липопротеиновой частицей приводит к нейтрализации ЛПС, связывание же sCD14 вызывает клеточную активацию, поскольку CD14 присутствует в организме также и в форме GPI-связанного мембранного белка (mCD14) нейтрофилов и макрофагов, и ЛПС из комплекса с растворимым CD14 переходит в комплекс с его мембраносвязанной формой. Комплекс mСD14-ЛПС, ассоциируя с другими мебраносвязанными факторами, передает внутрь клетки сигналы, повышающие экспрессию интегринов (молекул межклеточной адгезии) и выделение ФНОα и ИЛ-1. В свою очередь эти цитокины активируют эндотелиальные клетки и вызывают острофазный ответ в печени. Один из продуктов острофазного ответа - это ЛСБ.
Независимое от лимфоцитов распознавание бактерий вызывает ряд событий
Активация комплемента по альтернативному пути (см. гл. 4). Этот механизм обеспечивает уничтожение некоторых бактерий, в первую очередь грамотрицательных, поскольку они обладают чувствительной к мембранолитическому комплексу (С5b-9) наружной мембраной. Такая активация приводит также к образованию фрагментов комплемента С3а и С5а, вызывающих сокращение гладкомышечных волокон и дегрануляцию тучных клеток (кроме того, С5а связывается с нейтрофилами и активирует их). Последующее высвобождение из клеток гистамина и лейкотриена (LTB4) еще сильнее повышает сосудистую проницаемость (рис. 17.4). Опсонизация бактерий продуктами расщепления С3 важна для последующего поглощения их фагоцитами.
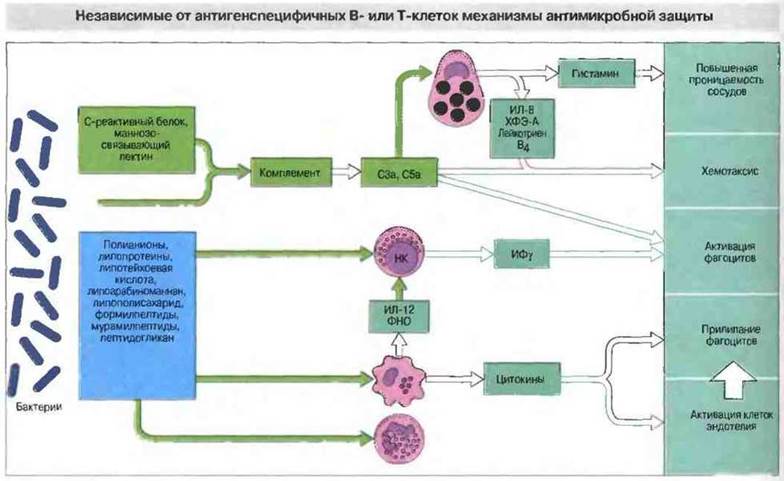
Рис. 17.4. Некоторые общие для разных бактерий структурные компоненты распознаются определенными молекулами плазмы крови и клеточными рецепторами. Это распознавание вызывает следующие эффекты: 1) альтернативную активацию комплемента (при участии С3, В, D, Р) с высвобождением С3а и С5а, 2) активацию нейтрофилов, макрофагов и НК-клеток с выделением цитокинов, 3) дегрануляцию тучных клеток, обеспечивающую усиление местного капиллярного кровотока, и 4) стимуляцию адгезии циркулирующих клеток крови и фибрина к эндотелию. Действие этих механизмов и повреждение тканей бактериями вызывают локальное свертывание крови, и образовавшийся фибрин создает преграду для распространения бактерий. (ХФЭ-А - хемотаксический фактор А эозинофилов.)
Хемотаксис. За счет хемотаксиса в очаг инфекции поступает больше фагоцитов. Бактериальные продукты могут вызывать хемотаксис непосредственно и через активацию комплемента.
Выделение цитокинов макрофагами. Фактор некроза опухолей (ФНО) и интерлейкин-1 (ИЛ-1) вызывают системную активацию фагоцитарных клеток и усиление их прилипания к эндотелию, что способствует миграции в воспаленную ткань. Фагоцитарные клетки выделяют также низкомолекулярные хемотаксические пептиды, называемые «хемокинами», которые усиливают ненаправленную подвижность клеток (см. гл. 5).
Выделение цитокинов нормальными киллерами (НК-клетками). НК-клетки мыши, стимулированные ИЛ-12 или ФНО, могут выделять γ-интерферон (ИФγ), который в свою очередь способен активировать макрофаги. Благодаря действию этого Т-независимого механизма мыши с тяжелым комбинированным иммунодефицитом (нарушение созревания лимфоцитов) неожиданно проявляют устойчивость, например к Listeria monocytogenes.
Адъювантные эффекты. Термин «адъювант» происходит от латинского adiuvare — помогать. В эксперименте иммунизация растворимыми антигенами вызывает более сильный Т- и В-клеточный ответ в случае их введения вместе с бактериальными продуктами, действующими как адъюванты. На рис. 17.1, эти компоненты клеток бактерий отмечены звездочкой. Наиболее известен полный адъювант Фрейнда, применяемый только для иммунизации лабораторных животных; он представляет собой масляную суспензию убитых клеток Mycobacterium tuberculosis; перед введением животному этот препарат эмульгируют в водном растворе антигена. Адъювантный эффект, по-видимому, обусловлен именно тем, что антигенспецифический иммунный ответ развивается в лимфоидной ткани, уже содержащей упомянутые фармакологически активные бактериальные продукты. Ответ на введенный без них, чистый бактериальный антиген можно рассматривать как искусственную ситуацию, которая не встречается в природе.
«Выбор» необходимого лимфоцитарного ответа. Решающая роль в этом «выборе» принадлежит «адъювантным» компонентам бактерий и механизму раннего выделения цитокинов. Разные виды бактерий оказывают оптимальный адъювантный эффект в отношении различных компонентов иммунной системы. Это может отражать необходимость примерного «таксономического определения» микроба для активации соответствующих эффекторных механизмов иммунного ответа. Вызываемое бактериями выделение цитокинов также вносит свой вклад в выбор адекватной формы иммунного ответа на этом этапе (подробнее он описан в гл. 11).
Выбор неадекватных форм иммунного ответа. Некоторые микробы за счет своих адъювантных свойств способны направлять иммунный ответ по пути неэффективных в данном случае механизмов. Как правило, адъювантные свойства возбудителей полезны для организма-хозяина, но в отдельных случаях они вызывают нарушения иммунорегуляции, в частности активируя неподходящую субпопуляцию Т-хелперов (Тх-клеток). Наиболее наглядный пример этого можно наблюдать при экспериментальном заражении мышей патогенным простейшим Leishmania major. При активации Тх2-клеток развивается болезнь со смертельным исходом, тогда как активированные Тх1-клетки обеспечивают полную защиту (см. гл. 18).
Шоковые синдромы. Если происходит слишком быстрое и обильное высвобождение цитокинов, возможно развитие различных, потенциально смертельных синдромов острого повреждения тканей.
Антитела обеспечивают антигенспецифическую защиту
Защитный эффект взаимодействия антител с бактериями зависит от механизма патогенности данного возбудителя. Когда она обусловлена действием бактериального токсина, антителам принадлежит решающая роль в иммунном ответе. Они, например, нейтрализуют дифтерийный токсин, блокируя прикрепление к клеткам-мишеням связывающего участка его молекул. Подобным же образом антитела могут инактивировать локально действующие токсины и ферменты (бактериальные факторы распространения), которые разрушают межклеточное вещество соединительной ткани, а также обездвиживать бактерии, связываясь с их жгутиками.
В защите слизистых оболочек от многих инфекций существенная роль принадлежит секреторному IgA (sIgA; см. гл. 3). Этот иммуноглобулин блокирует прикрепление бактерий к эпителиальным клеткам. Например, эффекторным механизмом иммунитета при стрептококковой ангине является образование антител к М-белкам стрептококков группы А. Возможно также, что антитела к определенным антигенам бактериальной поверхности способны ингибировать, например, такие важные для роста микробов процессы, как связывание хелатов железа или поглощение других питательных веществ (рис. 17.5).
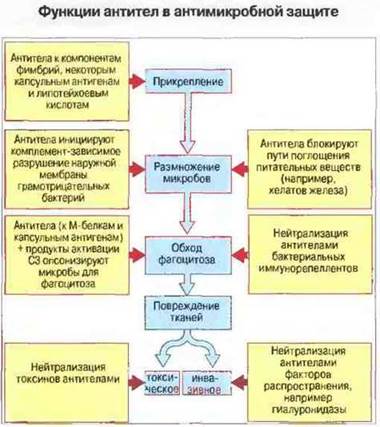
Рис. 17.5. Стадии бактериальной инвазии (синий цвет) и защитные эффекты антител (желтый цвет). Антитела к антигенам фимбрий, некоторым капсульным антигенам и липотейхоевым кислотам блокируют прикрепление бактерий к плазматической мембране клеток хозяина. Активированный антителами комплемент разрушает наружную мембрану грамотрицательных бактерий. Антитела непосредственно блокируют белки бактериальной поверхности, ответственные за поглощение питательных веществ из внешней среды. Антитела к М-белкам и капсульным антигенам бактерий опсонизируют бактериальные клетки для фагоцитоза, осуществляемого при участии Fc- и С3-рецепторов фагоцитов. Кроме того, антитела нейтрализуют иммунорепелленты (бактериальные факторы, нарушающие нормальный хемотаксис или фагоцитоз), токсины бактерий, а также выделяемые ими факторы распространения, которые способствуют инвазии, например путем разрушения межклеточного вещества соединительной ткани или фибрина.
В то же время в случае инфекции, вызванной нетоксигенными микробами, основная функция антител состоит в том, чтобы наиболее эффективно превращать возбудителя инфекции в мишень для комплемента. При участии антител комплемент повреждает бактерии, даже устойчивые к альтернативному (т. е. врожденному) механизму его бактериолитического действия (см. ниже). Кроме того, антитела усиливают связывание и поглощение нагруженных С3b и iC3b бактерий фагоцитами (рис. 17.6 и 17. 7). Самой высокой комплемент-связывающей активностью у человека обладают антитела изотипов IgG1, IgG3 и IgM. Помимо этого, IgG1 и IgG3 имеют наибольшую аффинность к клеточным Fc-рецепторам.
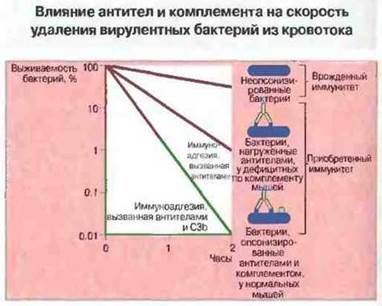
Рис. 17.6. Микробные клетки, не покрытые антителами и продуктами альтернативной активации комплемента, поглощаются фагоцитами очень медленно, тогда как нагруженные антителами и комплементом — во много раз интенсивнее. У животных, временно лишенных комплемента, это связывание происходит менее интенсивно, чем в норме.
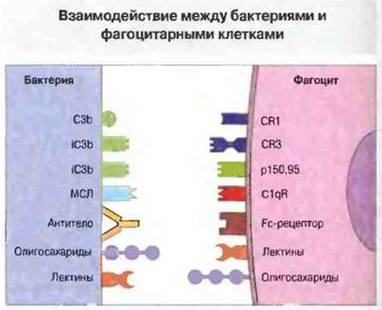
Рис. 17.7. Связыванию бактерий с мембраной фагоцита способствует ряд молекул. Произойдет ли поглощение микробной клетки фагоцитом и ее последующий лизис, зависит от характера этого взаимодействия. За исключением компонентов комплемента, антител и маннозосвязывающего лектина (МСЛ), которые присоединяются к бактериальной поверхности, все остальные молекулы на поверхности бактерий, участвующие в связывании, относятся к конститутивно экспрессируемым бактериальным компонентам.
Патогенные бактерии способны избегать разрушающего действия комплемента. Капсулы некоторых видов бактерий почти не вызывают альтернативной активации комплемента (рис. 17.8). В то же время длинные боковые полисахаридные цепи (О-антиген) бактериального липополисахарида могут связывать СЗЬ, но на некотором удалении от чувствительного к действию комплемента липидного бислоя мембраны, так что лизиса не происходит. Подобным этому механизмом обладают клетки гладких вариантов грамотрицательных бактерий (Escherichia coli, Salmonella и Pseudomonas) — они способны связывать, но затем быстро отщеплять лизирующий мембрану комплекс C5b—С9.
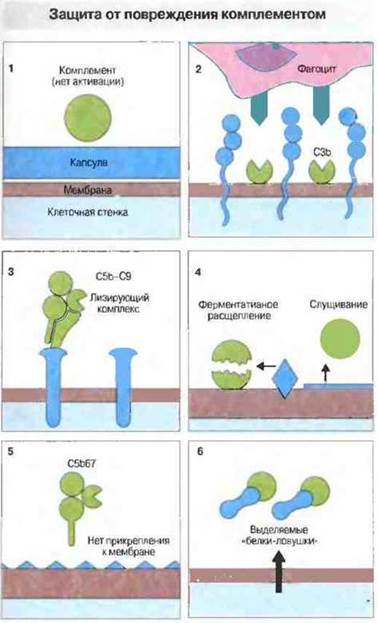
Рис. 17.8. Пути «ускользания» бактерий от комплемент-зависимого лизиса. 1. Капсула или наружный покров предотвращает активацию комплемента. 2. Конфигурация наружной поверхности микробной клетки может препятствовать доступу фагоцитов к фиксированному на ней С3b. 3. Особые поверхностные структуры отвлекают на себя лизирующий мембрану комплекс, предохраняя от его действия наружную мембрану микробной клетки. 4. Бактериальные мембраносвязанные ферменты разрушают фиксированный комплемент или вызывают его слущивание. 5. Наружная мембрана микробной клетки может быть устойчивой к внедрению литического комплекса. 6. Возможно выделение бактериями «белков-ловушек», связывающих комплемент.
Другие бактерии используют физиологические механизмы организма-хозяина, защищающие собственные клетки от комплемента. Как известно, связывание С3b с клеточной поверхностью может приводить либо к дальнейшему образованию этого фрагмента в результате взаимодействия с фактором В, либо к его инактивации факторами Н и I. Бактериальные капсулы с высоким содержанием сиаловой кислоты (сходные этим с клеточными мембранами хозяина), по-видимому, стимулируют взаимодействие С3b с факторами Н и I. Именно благодаря этому механизму Neisseria meningitidis, Е. coli K1 и стрептококки группы А совершенно неуязвимы для комплемента. Более того, М-белок стрептококков группы А действует как акцептор фактора Н, усиливая тем самым диссоциацию комплекса С3bВ. Эти бактерии обладают также геном С5а-протеазы.
Большинство бактерий уничтожают фагоциты
Как описано выше, некоторые бактерии, главным образом грамотрицательные, непосредственно лизируются комплементом. Опубликованы также данные о способности НК-клеток и даже цитотоксических Т-клеток (Тц) при простом контакте лизировать ряд бактерий некоторых видов, в большинстве грамотрицательных.
Однако большую част бактерий уничтожают фагоциты. Процесс фагоцитоза состоит из нескольких стадий (см. рис. 1.15).
Хемотаксис. Компоненты бактериальных клеток, например f-Met-Lеu-Phe (формил-мстионин-лейцин-фенилаланин — хемоаттрактант для лейкоцитов), продукты активации комплемента, например С5а, и локально выделяемые цитокины и хемокины привлекают фагоцитарные клетки в очаг инфекции и воспаления (см. гл. 5).
Связывание фагоцитов с микробными клетками. От этой важной стадии фагоцитоза зависит последующее поглощение микробов фагоцитами и сопряженная с поглощением активация механизмов лизиса. В связывании может участвовать ряд молекул.
✵ Лектины микробных клеток, например специфичный к маннозе лектин, Присутствующий па поверхности фимбрий у Е. coli.
✵ Лектины фагоцитарных клеток. Особенно важны в качестве лектинов при фагоцитозе рецепторы комплемента CR3 и CR4 (pl50,95), а также структурно близкий к ним лейкоцитарный функциональный антиген-1 (LFA-1), относящийся к иитегринам. Все эти молекулы поверхности обладают большим числом активных центров, специфичных к различным углеводным компонентам клеточных полимеров, и могут, в частности, связываться с β-глюканами и ЛПС грамотрицательных бактерий.
✵ Компоненты комплемента, связавшиеся с микробной поверхностью благодаря классической или альтернативной активации. Недавно было установлено, что комплемент может связываться со специфичным к маннозе сывороточным лектином, фиксированным на бактериальной клетке и аффинным, кроме того, к рецепторам для CIq фагоцитов.
✵ Fc-рецепторы фагоцитарных клеток способны взаимодействовать с антителами, связавшимися с бактериальным и клетками (см. рис. 17.7).
Запуск поглощения. Связывание микробной клетки с рецептором на плазматической мембране макрофага не обязательно приводит к поглощению. Например, частицы, образованные зимозаном (дрожжевой полисахарид), при связывании с глюканспецифичным центром рецептора CR3 поглощаются макрофагом, тогда как эритроциты, нагруженные iC3b, не поглощаются, хотя эти компоненты комплемента также взаимодействуют с CR3.
Запуск бактерицидных механизмов. Подобно тому как связывание мембранных рецепторов фагоцита с бактерией не гарантирует ее поглощения, само поглощение также необязательно ведет к запуску бактерицидных механизмов. В частности, клетки Yersinia pseudotuberculosis сами индуцируют свое поглощение фагоцитами, но при этом дерепрессируют синтез фактора, модулирующего сигнал эндоцитоза, так чтобы внутриклеточного разрушения микробных клеток не происходило.
Фагоцитарные клетки обладают разнообразными механизмами уничтожения микробов
Поглощенная фагоцитом микробная клетка подвергается действию нескольких бактерицидных механизмов.
Кислород-зависимые бактерицидные механизмы
Реакционноспособные метаболиты кислорода (РМК). Их образование связано с активностью фермента, локализованного в клеточной мембране фагоцита. Этот фермент восстанавливает О2 с образованием супероксидного анион-радикала (·О2-) — токсичного РМК. В свою очередь супероксидные радикалы превращаются в другие РМК (рис. 17.9). У больных хроническим гранулематозом фагоцитарные клетки не образуют РМ К и не способны поэтому уничтожать некоторые вилы микроорганизмов (см. рис. 21.14). Это заболевание характеризуется очагами хронического воспаления, которое вызывают возбудители гнойных инфекций, например стафилококки. В фагоцитарных клетках, содержащих пероксидазу, образуются гипохлорит и подобные ему токсичные оксиданты (рис. 17.9). При наследственном дефиците миелопероксидазы возможно нарушение бактерицидной активности фагоцитов. Тканевые макрофаги не содержат пероксидазу и поэтому дают отрицательный результат в цитохимических тестах, основанных на пероксидазпой активности.
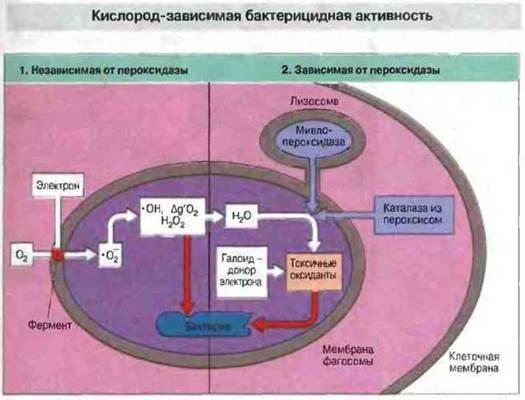
Рис. 17.9. 1. Фермент, присутствующий в мембране фагосомы, восстанавливает молекулярный кислород с образованием супероксидного анион-радикала (·О2-), из которого образуются потенциально токсичные гидроксильные радикалы (·ОН), синглетный молекулярный кислород (Δg'O2) и пероксид водорода (Н2O2). Этот этап бактерицидного действия еще не требует слияния лизосом с фагосомой, начинаясь спонтанно после образования фагосомы. 2. Под действием миело- пероксидазы (проникающей в фа- госому при ее слиянии с лизосома- ми), а в некоторых случаях и каталазы, содержащейся в пероксисомах, из пероксидов в присутствии галоидных соединений (прежде всего иодидов) образуются дополнительные токсичные оксиданты, например гипоиодит и гипохлорит (производные НIO и НСIO).
Реакционноспособные метаболиты азота (РМА). Другой бактерицидный механизм основан на образовании токсичного для бактерий и опухолевых клеток оксида азота NО (рис. 17.10). Для оптимального действия этого механизма в макрофагах мыши требуются активация их ИФγ и запуск механизма фактором некроза опухолей. Предположительно под действием N0 в этих клетках погибают микобактерии. Гораздо труднее получить образование значительного количества NО в макрофагах человека. Как правило, для этого необходима целая серия стимулов, например воздействие нескольких цитокинов с одновременной перекрестной сшивкой молекул CD23 (рецептор IgE). По данным иммуногистохимического анализа, у человека макрофаги воспалительного очага иногда экспрессируют в значительном количестве индуцибельную синтазу оксида азота (иСОА), но не содержат достаточное количество тетрагидробиоптерина — обязательного кофактора для образования NО.
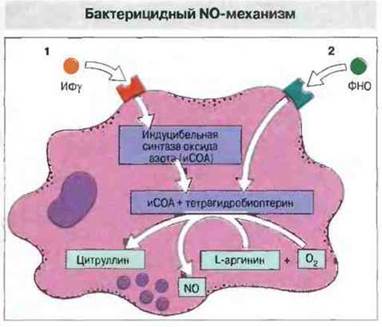
Рис. 17.10. Индуцибельная синтаза (лиаза, синтетаза) оксида азота (иСОА) катализирует присоединение кислорода к атомам азота гуанидиновой группы в составе L-аргинина с образованием токсичного для бактерий и опухолевых клеток оксида азота NO. В результате его взаимодействия с активными метаболитами O2 образуются еще более токсичные пероксинитриты. Для продукции NO необходим кофактор тетрагидробиоптерин. Активацию этого механизма в макрофагах мыши вызывает ИФγ (1); затем ФНО стимулирует его до оптимального уровня активности (2). В макрофагах человека запуск этого механизма происходит более сложным образом и требует обычно перекрестного связывания молекул CD23 на клеточной мембране. Иногда макрофаги способны экспрессировать иСОА, но при этом не содержат достаточного для ее активности количества тетрагидробиоптерина, и для максимального образования NO может быть необходимо взаимодействие с клетками других типов.
Важное значение могут иметь кислород-независимые бактерицидные механизмы
Роль этих механизмов, возможно, более существенна, чем предполагалось ранее. Так, фагоциты больных хроническим гранулематозом неспособны продуцировать РМК, а в случае наследственного дефицита миелопероксидазы - иодноватистую и хлорноватистую кислоты, но тем не менее они могут уничтожать разнообразные микроорганизмы. Частично это может быть обусловлено действием NО, но многие бактерии уничтожаются в анаэробных условиях, что указывает на существование других, не зависимых от кислорода бактерицидных механизмов, и некоторые из них идентифицированы.
Катионные антибиотико-подобные белки фагоцитарных клеток. В макрофагах кролика и полиморфно-ядерных гранулоцитах человека обнаружены дефензины — богатые остатками цистеина и аргинина катионные пептиды из 30-33 аминокислотных остатков. Они составляю! в этих клетках от 30 до 50 % всех белков гранул. Дефензины вызывают образование ионных каналов в мембране микробной клетки. Вероятно, они начинают действовать сразу после образования фаголизосомы, ещё до подкисления ее содержимого (рис. 17.11). Дефензины могут уничтожать самые разнообразные микробы, например Staphylococcus aureus, Pseudomonas aeruginosa, E. coli. Cryptococcus neoformans и обладающий оболочкой вирус простого герпеса. Кроме того, в фагоцитарных клетках обнаружены катионные белки с различными рН-оптимумами, в частности катепсин G и азуроцилин, родственные эластазе, но обладающие неферментативной антибиотической активностью в отношении грамотрицательных бактерий.
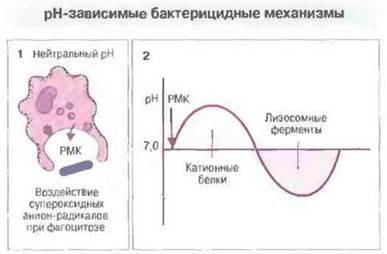
Рис. 17.11. При фагоцитозе на бактерии непосредственно действуют реакционноспособные метаболиты кислорода (РМК) (1). Это вызывает кратковременное подщелочение среды (повышение pH), способствующее эффективному действию катионных белков (2). Затем pH падает в результате «закачивания» в фаголизосому ионов Н+; при низком pH начинают действовать лизосомные ферменты с pH-оптимумом в кислой области. Кроме того, бактерицидная активность включает действие лактоферрина, хелатирующего свободное железо как в кислой, так и в щелочной среде.
Другие антимикробные механизмы. После слияния лизосом содержимое фаголизосомы временно — на 10—15 мин — подщелачивается, после чего pH падает, т. е. происходит подкисление. Возможно, низкий pH сам по себе обеспечивает уничтожение некоторых микробов, но более вероятно, что он необходим для действия лизосомных ферментов, имеющих оптимум pH в кислой области. Некоторые грамположительные бактерии могут погибать под действием лизоцима — он разрушает легкодоступный пептилогликановый слой их клеточной стенки. В уничтожении бактерий участвует и ряд других молекул, например лактоферрин, продуцируемый полиморфноядерными гранулoцитами. Он связывает железо, недоступное в такой форме для поглощения бактериями даже в кислой среде (при избытке железа полиморфно-ядерные гранулоциты теряют обусловленную лактоферрином способность уничтожать бактерии некоторых видов). Возможно, все эти антимикробные механизмы функционируют только после слияния фагосом с лизосомами (рис. 17.11 и 17.12).
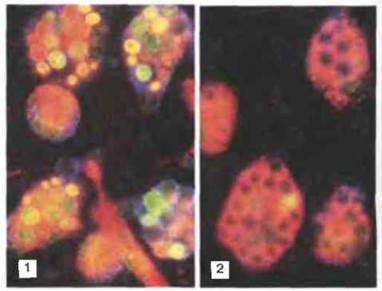
Рис. 17.12. Блокада хлористым аммонием слияния вторичных лизосом с фагосомами, содержащими дрожжевые клетки. Культивируемые перитонеальные макрофаги мыши инкубировали с красителем акридиновым оранжевым, который накапливается во вторичных лизосомах. Затем в культуру добавили живые клетки дрожжей, что вызвало образование темных «лунок» на поверхности макрофагов. В нормепри фагоцитозе вторичные лизосомы сливаются с фагосомами и в них поступает акридиновый оранжевый, флуоресцирующий зеленым, желтым или оранжевым в зависимости от концентрации, в результате чего «лунки» исчезают (1). Однако в присутствии хлористого аммония слияния не происходит, и лунки остаются темными (2). Такую же блокаду слияния лизосом с фагосомами, возможно, осуществляют клетки Mycobacterium tuberculosis и отдельные виды лейшманий, выделяющие соединения аммония. Кроме того, аналогичный эффект вызывают некоторые полианионы, например полиглутаминовая кислота или сурамин. (Иллюстрация любезно предоставлена г-ном R. Young и д-ром P.D. Hart).
Покоящиеся макрофаги способны уничтожать микробов, но активация стимулирует этот процесс, вызывая экспрессию новых механизмов
Активация макрофагов происходит под действием микробных продуктов и лимфокинов, секретируемых Т-клетками. Пониженную активность недельной культуры макрофагов можно восстановить с помощью соответственного активирующего фактора (рис. 17.13).
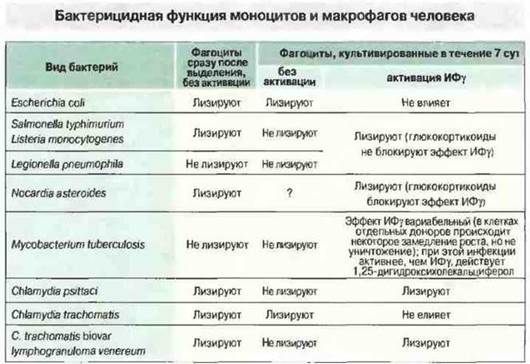
Рис. 17.13. Моноциты и макрофаги, свежевыделенные из донорской крови, способны лизировать различные бактерии. При культивировании в течение 7 сут они частично утрачивают эту способность, но под действием ИФγ она восстанавливается. Данный лимфокин, очевидно, активирует несколько различных бактерицидных механизмов; одни из них подавляются глюкокортикоидами, другие - нет. Некоторые бактерии могут быть уничтожены только после активации фагоцитов лимфокинами, другие устойчивы ко всем защитным механизмам хозяина. Этим обусловлено большое разнообразие бактерицидных механизмов.
Отдельные микробные продукты могут активировать макрофаги в отсутствие распознавания лимфоцитами. Ряд микробных компонентов активирует моноциты и макрофаги прямо или опосредованно, инициируя выделение цитокинов самими макрофагами или НК-клетками. Цитокины затем активируют фагоциты. Это рассмотрено выше (с. 320) в связи с не зависимым от лимфоцитов распознаванием бактерий.
Макрофаги дополнительно активируются лимфокинами
Для полной активации макрофагов in vivo необходимо воздействие на них лимфокинов, выделяемых Т-клетками в ходе иммунного ответа. Чаще всего на макрофаги воздействует ИФγ, стимулирующий кислород-зависимые и другие бактерицидные механизмы. Имеются также сообщения об активации фагоцитов под действием ИЛ-2, гранулоцитарно-макрофагального колониестимулируюшего фактора (ГМ-КСФ) и других цитокинов. Как описано более подробно в гл. 10, для активации определенных функций фагоцитарных клеток требуется воздействие различных комбинаций цитокинов.
Лимфокины оказывают на фагоциты in vivo два основных эффекта — привлечения и активации, причем относительное значение каждого из них варьирует в зависимости от микроорганизма. Например, для иммунитета к L. monocytogenes наиболее важен эффект привлечения фагоцитов в очаг инфекции, поскольку клетки этой бактерии погибают под действием РМК внутри неактивированных моноцитов и нейтрофилов. Для устранения М. tuberculosis, напротив, требуется прежде всего активация нейтрофилов и моноцитов, так как эти микобактерии способны выживать внутри них.
Макрофаги человека и мыши различаются по бактерицидной активности. Большинство экспериментальных работ в области иммунологии инфекций выполнено на макрофагах мыши, однако они существенно отличны от тех же клеток человека по ряду активностей. Примером различий может быть активность макрофагов в отношении микобактерий. У мыши активация макрофагов ИФγ обеспечивает полное разрушение фагоцитированных микобактерий, по-видимому посредством NO-зависимого механизма. Воздействие же ИФγ на макрофаги человека лает в лучшем случае едва заметное подавление роста М. tuberculosis, а в худшем значительно усиливает рост микобактерий. Причиной таких особенностей могут быть видовые различия по способности к образованию NO, описанные выше (см. рис. 17.10).
В то же время клетки человека обладают свойствами, пока не обнаруженными у мыши. В макрофагах человека ИФγ вызывает экспрессию 1-α-гидролазы, которая превращает циркулирующую неактивную форму 25-гидроксихолекальциферола (витамин D3) в активный метаболит — 1,25-дигидроксихолекальциферол. Этот метаболит активирует макрофаги для уничтожения микобактерий гораздо эффективнее, чем сам ИФγ (см. рис. 17.13).
Патогенные микроорганизмы способны избегать уничтожения фагоцитами. Поскольку фагоциты обладают способностью уничтожать большинство микробов, патогенные микроорганизмы должны иметь свойства, обеспечивающие им защиту от фагоцитоза (рис. 17.14).
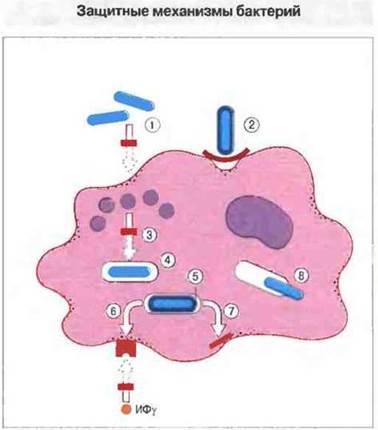
Рис. 17.14. Бактерии, особенно высокоприспособленные внутриклеточные паразиты, способны избегать действия бактерицидных механизмов фагоцитарной клетки.
1. Некоторые микробы могут выделять репелленты или токсины, подавляющие хемотаксис. 2. Другие виды обладают капсулами или оболочками, препятствующими связыванию бактерий фагоцитами. 3. Третьи не препятствуют поглощению, но затем выделяют факторы, блокирующие запуск бактерицидных механизмов, например М. tuberculosis ингибирует слияние лизосом с фагосомами, а также подкисляющий содержимое фагосом протонный «насос», и в результате pH в них не снижается. 4. Кроме того, бактерии могут выделять каталазу, которая разрушает образуемый фагоцитами пероксид водорода. 5. Некоторые бактерии, например М. leprae, покрыты снаружи высокоустойчивой к повреждению оболочкой. Клетки М. leprae окружены слоем молекул фенольного гликолипида, который связывает свободные радикалы и тем самым инактивирует их. 6. Микобактерии выделяют также липоарабиноманнан, который блокирует способность макрофагов отвечать активацией на воздействие ИФγ. 7. Инфицированные бактериями фагоциты могут, помимо всего, утратить функцию презентации антигена. 8. Некоторые виды бактерий (в частности, М. leprae) способны выходить из фагосом и размножаться в цитоплазме фагоцита, который в результате погибает (как, например, при инфицировании М. tuberculosis).
Внутриклеточные возбудители инфекций могут «скрываться» в клетках иммунной системы
Инфицированные клетки уничтожаются цитотоксическими Т-клетками. Некоторые бактерии способны выживать и активно размножаться внутри поврежденных или метаболически неадекватных фагоцитов хозяина. Кроме того, они могут избегать уничтожения, перемещаясь внутри макрофагов из фагосом в цитоплазму. Так, клетки Listeria monocytogenes выходят из фагосом, так как выделяют ферменты, разрушающие мембрану этих органелл. Другие возбудители, например Mycobacterium leprae, способны вызывать свое поглощение клетками, которые обычно не относятся к фагоцитарным и не обладают достаточной антибактериальной активностью. В этом случае микробные клетки не могут быть уничтожены активированными фагоцитами или другими бактерицидными механизмами, прежде чем будут освобождены из клеток, где они «спасаются». Их высвобождение осуществляют Тц-клетки, разрушающие инфицированные клетки. Если исключить Т-клеточное распознавание молекул МНС класса I, устранив методом генного нокаута из мышиного генома ген β2-микроглобулина, мыши становятся чрезвычайно чувствительны к М. tuberculosis. Это указывает на существенную роль цитотоксических Т-клеток в иммунитете к микобактериям.
γδ-Т-лимфоциты, как правило, обладают цитотоксичностью и способны разрушать инфицированные клетки. Значительная часть Т-клеток, несуших γδ-рецептор, по-видимому, пролиферирует в ответ на бактериальные антигены. Некоторые субпопуляции этих лимфоцитов избирательно заселяют («хоминг») эпителиальные покровы (см. гл. 2). Поэтому можно предполагать, что им принадлежит существенная, пока не выясненная, роль в антимикробном иммунитете. Обычно они обладают цитотоксичностью и, возможно, разрушают инфицированные клетки.
Клетки некоторых тканей могут обладать антимикробными механизмами. Убежищем для бактерий, таких как М. leprae, инвазивные виды Shigella, Salmonella, а также Rickettsia и Chlamydia, могут становиться клетки тканей, не относящихся к иммунной системе. Как указано выше, такие инфицированные клетки, возможно, уничтожаются цитотоксическими Т-клетками. Наряду с этим, рост внутриклеточно локализованных возбудителей может подавляться в результате активации фибробластов ИФγ; вероятно при этом действует NO-механизм, которым обладают не только фагоцитарные клетки.
Антимикробный ответ может приводить к иммунологическому повреждению тканей
Чрезмерный выброс цитокинов может привести к эндотоксическому шоку. Эндотоксический (септицемический) шок возникает при септицемии как следствие вызванного бактериальными продуктами обильного поступления в циркуляцию цитокинов. Как правило, шок вызывает эндотоксин — ЛПС грамотрицательных бактерий, хотя аналогичный синдром возможен и при грамположительной септицемии. Шоковый синдром представляет угрозу для жизни и проявляется как лихорадка, циркуляторный коллапс, диссеминированное внутрисосудистое свертывание крови и геморрагический некроз; эти процессы приводят к недостаточности многих органов и систем (рис. 17.15).
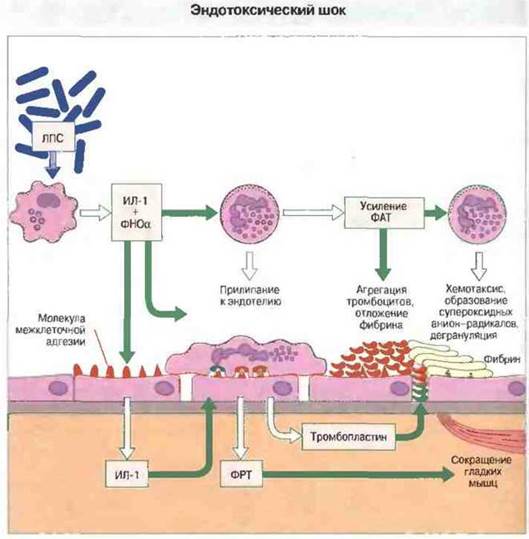
Рис. 17.15. Избыточный выброс цитокинов, под действием чаще всего эндотоксина (ЛПС) грамотрицательных бактерий, может приводить к диссеминированному внутрисосудистому свертыванию крови с последующей недостаточностью ее свертывания, к нарушениям сосудистой проницаемости, утечке жидкой части крови в ткани, падению артериального давления, циркуляторному коллапсу и геморрагическим некрозам, особенно в слизистой оболочке пищеварительного тракта. На рисунке представлены отдельные ключевые этапы развития эндо- токсического шока на клеточном уровне. Цитокины ФНОα и ИЛ-1 активируют эндотелиальные клетки для экспрессии молекул межклеточной адгезии и тканевого тромбопластина, которые вызывают соответственно прилипание циркулирующих клеток и отложение фибрина. Эти процессы дополнительно усиливает фактор, активирующий тромбоциты (ФАТ). В эксперименте развитие шока удается блокировать антителами, нейтрализующими ФНОα, и значительно ослабить антителами к тканевому тромбопластину либо ингибиторами образования ФАТ или оксида азота. Грамположительные бактерии могут вызывать шок в результате того, что их суперантигены инициируют массированный выброс цитокинов (см. ниже в тексте). (ФРТ - фактор роста из тромбоцитов, образуемый и тромбоцитами, и эндотелием.)
Реакция Шварцмана - одна из форм повреждения тканей цитокинами в очагах воспаления без заметного участия Т-клеток. Если ввести кролику суспензию клеток грамотрицательных бактерий, сначала внутрикожно и через 24 ч внутривенно, в месте первой инъекции появится геморрагический некроз. Этот эффект назван по имени исследователя, наблюдавшего его впервые, реакцией Шварцмана. Кроме того, Шварцманом было установлено, что две внутривенные инъекции с интервалом 24 ч вызывают системную реакцию, которая обычно приводит к циркуляторному коллапсу и двухстороннему некрозу корковой части почек. Этот феномен, описанный также Санарелли, называют системной реакцией Шварцмана или реакцией Санарелли-Шварцмана. Иногда она сопровождается некрозами в поджелудочной железе, гипофизе, надпочечниках и слизистой пищеварительного тракта. Для нее характерно острое диссеминированное внутрисосудистое свертывание крови и тромбоз.
Как теперь известно, и многие другие инфекционные агенты, в том числе стрептококки, микобактерии, представители рода Haemophilus, коринебактерии и вирус коровьей оспы, способны «подготавливать» кожу таким же образом. «Разрешающий» эффект внутривенной инъекции обусловлен действием эндотоксина (ЛПС). Повреждение тканей при реакции Шварцмана в ранних публикациях связывали с альтерацией эндотелия, отложением фибрина, скоплениями и дегрануляцией нейтрофилов и тромбоцитов. Эти процессы действительно имеют место, но позднее выяснилось, что ключевыми медиаторами описанных реакций служат ФНОα, ИФγ, ИЛ-12 и ИЛ 1 (см. гл. 11). Введение ФНОα в очаг воспаления (вызванного предварительной инъекцией бактерий) дает некроз аналогичного типа; по всей вероятности, введенный ФНОα действует так же, как в том случае, когда он доставляется кровотоком после внутривенного введения ЛПС.
Реакцией Шварцмана объясняется появление характерной геморрагической сыпи у детей, больных менингококковым менингитом. Первый эпизод септицемии вызывает в разных тканях рассеянные очаги воспаления, которые вначале настолько малы, что клинически не проявляются, сохраняя, однако, исключительную чувствительность к цитокинам. Второй, более массированный выход возбудителя в кровь инициирует выброс цитокинов, достаточный чтобы вызвать некроз тканей в таких очагах.
Феномен Коха - вызванная Т-клетками некротическая реакция в очагах микобактериального поражения и при внутрикожной туберкулиновой пробе. Некротическую реакцию на антигены М. tuberculosis впервые наблюдал Роберт Кох у морских свинок, зараженных туберкулезом (рис. 17.16). Этот феномен по меньшей мере отчасти обусловлен высвобождением цитокинов в очагах вызванного Т-клетками воспаления (проявление гиперчувствительности замедленного типа, см. гл. 26) и, по-видимому, имеет отношение к патогенезу туберкулеза у человека и животных. Как и при реакции Шварцмана, эти очаги могут быть чрезвычайно чувствительны к тканеповреждаюшим эффектам цитокинов, особенно, когда активность Тх1- и Тх2-клеток проявляется одновременно.
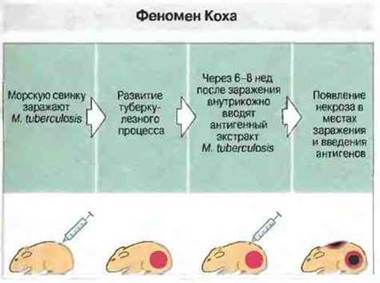
Рис. 17.16. Роберт Кох впервые обнаружил, что введение клеток Mycobacterium tuberculosis или их растворимых антигенов в кожу зараженной туберкулезом морской свинки вызывает некротическую реакцию как в месте инъекции, так и в очаге туберкулезного поражения. По меньшей мере отчасти эта реакция обусловлена тем, что ткани, реагирующие на антигены микобактерий по механизму гиперчувствительности замедленного типа, проявляют также высокую чувствительность к токсическому действию цитокинов, подобно тканям в месте инъекции ЛПС при реакции Шварцмана. Выделение цитокинов, возможно, происходит и в месте внутрикожной инъекции антигенов. Подобная реакция на антигены микобактерий наблюдается и у больных туберкулезом, и у лиц, перенесших его в прошлом. Внутрикожное введение микобактериальных антигенов дает воспалительную реакцию и после вакцинации БЦЖ, но, как правило, без некроза.
На рис. 17.17 для отдельных видов бактерий указан патогенез вызываемых заболеваний, включая иммунопатологию, и механизм протективного иммунного ответа.
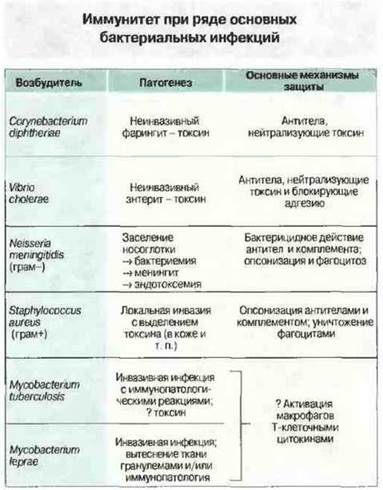
Рис. 17.17. Зная природу возбудителя и патогенез инфекции, можно предсказать тип протективного иммунного механизма.
Новые направления в изучении антимикробного иммунитета
Суперантигены распознаются без процессинга и презентации. Суперантигенами названы недавно идентифицированные компоненты бактерий, связывающиеся непосредственно (т. е. без процессинга) с вариабельными областями β-цепей (Vβ) антигенспецифичных рецепторов некоторых субпопуляций Т-клеток и одновременно с молекулами МНС антигенпрезентируюших клеток (АПК) (см. рис. 11.15). В результате такого связывания все Т-клетки, экспрессирующие соответственный продукт Vβ-гена, становятся активированными в отсутствие процессинга антигена и его презентации в виде пептидов в пептидсвязывающей полости молекул МНС, т. е. в отсутствие того, что требуется для нормальной Т-клеточной активации. Суперантигены обнаружены у стафилококков, стрептококков, микоплазм и других инфекционных агентов. Биологическая роль суперантигенов в качестве инструментов бактериальной адаптации остается неясной, но одним из основных их эффектов может быть интоксикация, вызванная массированным выбросом цитокинов (лимфокинов) многочисленными, одновременно стимулированными Т-клетками. По-видимому, именно таков патогенез синдрома токсического шока, вызываемого стафилококковыми токсинами, в частности TSST-1 (toxic shock syndrome toxin).
Белки теплового шока - высококонсервативные иммунодоминантные антигены. Найденные у всех эукариотических и прокариотических клеток белки теплового шока выполняют важные функции в сборке, укладке и транспорте других молекул. Эти белки образуются в значительном количестве в клетках при аномально высокой температуре или при стрессе иной природы, что в частности отражает их роль в стабилизации белковых структур. Аминокислотные последовательное! и белков теплового шока высококонсервативны (однотипны) у различных организмов; в связи с этим высказано предположение, что поскольку бактериальные белки теплового шока настолько сходны с аналогичными белками человека, они могут вызывать аутоиммунный ответ. Парадоксальным образом при протективном иммунном ответе белки теплового шока многих патогенных микроорганизмов воcпринимаются иммунной системой вопреки такому сходству как иммунодоминантные (целевые) антигены. Это, однако, можно рассматривать как эволюционное преимущество, поскольку с помощью Т-клеток, распознающих набор консервативных эпитопов белков теплового шока, организм-хозяин способен, по-видимому, распознавать любой патогенный организм.
1 Известны нетоксигенные, но инвазивные штаммы С. diphtheriae, вызывающие тяжелую патологию. В некоторых случаях С. diphtheriae и V. cholerae проникают из очага первичной колонизации через кровоток в другие внутренние органы, обнаружены присущие этим бактериям факторы инвазивности. Все эго едва ли позволяет называть возбудителен дифтерии и холеры неинвазивными в строгом смысле слова. — Прим, перев.