Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Анализ белков с помощью низковольтного электрофореза
Низковольтный электрофорез на бумаге
Низковольтный электрофорез на бумаге
Принцип метода. Компоненты белковой смеси, нанесенные на специальную фильтровальную бумагу, смоченную буферным раствором, мигрируют в электрическом поле в направлении и со скоростью, зависящими от заряда их молекул. В результате смесь делится на фракции, которые можно выявить специальными методами окрашивания и измерить количественно.
Область применения: качественный и количественный анализ белковых смесей; качественный и количественный анализ белков сыворотки, мочи, спинномозговой и тканевой жидкостей.
Аппарат для электрофореза. Схема электрофоретического аппарата представлена на фиг. 1. Он состоит из пластмассовой камеры с плотно прилегающей стеклянной крышкой 1. Обе электродные камеры перегородкой из пластика 2 разделены на два отсека. В наружных отсеках 3 расположены платиновые электроды диаметром 0,5—0,8 мм. В каждый из двух внутренних отсеков погружаются концы фильтровальной бумаги 4. В середине перегородки, которая разделяет наружный и внутренний отсеки электродной камеры, на высоте 40 мм расположено соединяющее их отверстие. Это отверстие (0,5 см в диаметре) неплотно закрыто стеклянной ватой.
В электрофоретической камере находится съемная пластмассовая рамка 5, на которую укладываются полоски фильтровальной бумаги.
Источник тока. Стабилизированный источник питания дает постоянный ток 100 мА и напряжение до 300 В.
Сосуд для окрашивания. Окрашивание полосок фильтровальной бумаги проводят в стеклянном сосуде с крышкой размером 7 x 38 см.
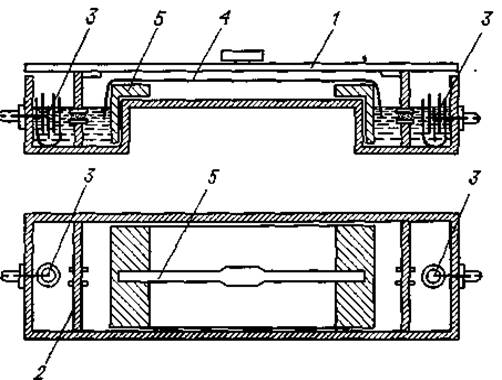
Фиг. 1. Схема прибора Грассмана—Ханнига для электрофореза на бумаге [11]. Описание см. в тексте.
ПРОВЕДЕНИЕ ЭЛЕКТРОФОРЕЗА
1. Приготовление буферного раствора. 29, 43 г веронала и 19,43 г CH3COONa ∙ 3Н2О растворяют примерно в 1 л дистиллированной воды, затем прибавляют 180 мл 0,1 н. НСl и дистиллированной водой доводят объем до 3 л. Буферный раствор должен иметь pH 8,6.
2. Заполнение электрофоретической камеры буферным раствором. В каждый отсек электрофоретической камеры заливают примерно по 500 мл буферного раствора. Во всех отсеках аппарата буферный раствор должен достигать одного и того же уровня.
3. Смачивание полосок фильтровальной бумаги буферным раствором. Перед смачиванием на полоске фильтровальной бумаги карандашом отмечают место, соответствующее концу рамки и место нанесения образца. После этого бумажные полоски равномерным движением погружают и проводят через буферный раствор, заполняющий стеклянный сосуд. Для погружения концы полоски берут пинцетами, правый конец погружают в буферный раствор, а затем медленно вытягивают его наверх, постепенно погружая в раствор левый конец полоски. Полоску нужно продвигать со скоростью, с которой происходит ее смачивание буферным раствором. После смачивания полоску извлекают из буферного раствора в вертикальном положении и некоторое время ждут, пока стекут последние капли. Затем полоску с обеих сторон промокают несколькими слоями фильтровальной бумаги, лишь слегка прикасаясь к ней, чтобы не выдавить влагу. Мокрые полоски укладывают на рамку согласно ранее сделанным отметкам.
4. Нанесение исследуемого материала (сыворотки). На отмеченную стартовую линию смоченной полоски пипеткой наносят 0,01 мл нормальной сыворотки, содержащей 5,6—8% белка.
Способ нанесения сыворотки. Анализируемый материал наносят пипеткой поперек полоски, на 3 мм отступая от каждого ее края. Для этого пипетку медленно и равномерно передвигают по стартовой линии, слегка прикасаясь кончиком к бумаге. Кончик пипетки должен быть гладким, чтобы не поцарапать бумагу; осторожного прикосновения к бумаге вполне достаточно для того, чтобы исследуемый материал впитался.
5. Электрофорез. Полоску фильтровальной бумаги кладут на рамку в электрофоретической камере таким образом, чтобы оба ее конца, выходящие за рамку, были погружены в буферный раствор (фиг. 1). После укладывания полосок камеру закрывают стеклянной крышкой и аппарат включают в электросеть. Электрофорез продолжается от 12 до 16 ч при 110 В и силе тока около 1 мА на полоску.
6. Извлечение и высушивание бумажных электрофореграмм. Когда закончится разделение фракций, электрический ток выключают и осторожно поднимают стеклянную крышку аппарата. Нужно следить, чтобы скопившийся на внутренней поверхности крышки конденсат не попал на полоски бумаги. Рамку с полосками извлекают из электрофоретической камеры и помещают в проволочную корзинку так, чтобы концы полосок, ранее лежавшие у края рамки, теперь располагались бы на краях корзинки. Затем корзинку с полосками ставят в сушильный шкаф с температурой 110° С до тех пор, пока не высохнет бумага. При этой температуре белки денатурируют и фиксируются на бумаге.
7. Окрашивание бумажных электрофореграмм. Разделенные при электрофорезе белковые фракции выявляют на бумажных полосках с помощью окрашивания амидовым черным.
Окрашивающий раствор. Готовят насыщенный на холоду раствор амидового черного в растворителе, содержащем смесь ледяная уксусная кислота — метанол (1:9). Для этого примерно 13,0 г амидового черного растворяют в 100 мл уксусной кислоты и прибавляют 900 мл метанола. Смесь тщательно перемешивают встряхиванием и оставляют отстаиваться на ночь; на следующий день ее фильтруют. Одна и та же порция красителя может быть использована несколько раз.
Отмывающий раствор: уксусная кислота — метанол (1:9).
Методика окрашивания. Сосуд для окрашивания заполняют раствором красителя и погружают в него бумажные электрофореграммы, фиксированные нагреванием. Окрашивание проводят в течение 10 мин при постоянном перемешивании, затем раствор красителя заменяют на отмывающий раствор. В течение примерно 4 ч несколько раз производят смену раствора до тех пор, пока свежая его порция не останется бесцветной.
ПРИМЕЧАНИЯ ЭЛЕКТРОФОРЕТИЧЕСКАЯ КАМЕРА
Кроме прибора Грассмана — Ханнига, применяются также электрофоретические камеры других типов. Схемы двух из них представлены на фиг. 2 и 3.
А. Камера Даррема [6]. Этот прибор удобен для серийных анализов (фиг. 2).
Б. Камера Канкеля — Тизелиуса [18]. В этом приборе полоски бумаги для электрофореза помещаются между двумя силиконированными пластмассовыми пластинами, которые устраняют нежелательное испарение буферного раствора, что препятствует изменению его концентрации. Кроме того, этот прибор пригоден и для двумерного электрофореза (фиг. 3).
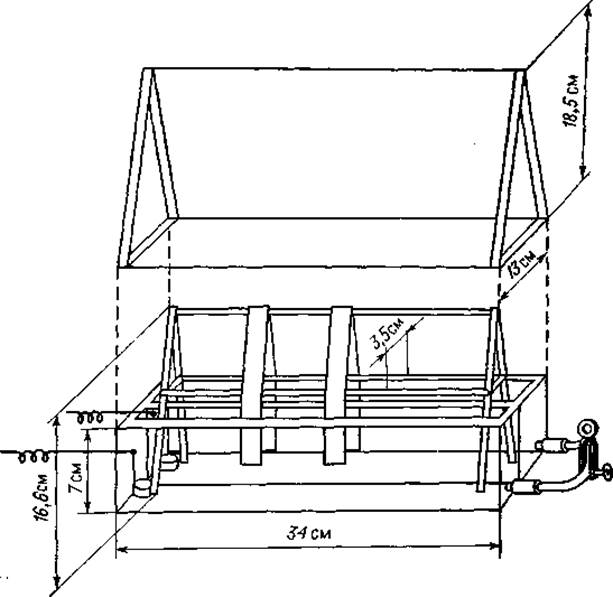
Фиг. 2. Прибор Даррема для электрофореза на бумаге [6].
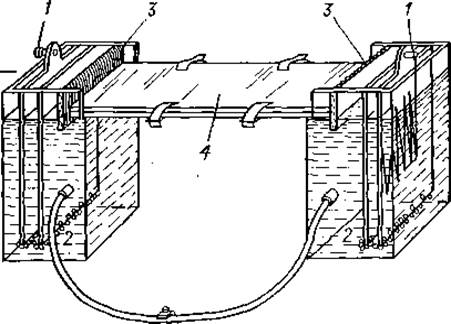
Фиг. 3. Прибор Кинкеля—Тизелиуса для электрофореза на бумаге [18].
1 — электроды; 2 — слой стеклянной ваты в щели между отсеками; 3 — фитиль из фильтровальной бумаги; 4 — плексигласовая пластинка.
В. Камера “Элфор” (Bender-Hobein, ФРГ). Пластмассовая камера “Элфор” широко используется для повседневной работы в клинических лабораториях. Прибор обеспечивает постоянную величину pH в ходе электрофореза. Этому способствует специально подобранное соотношение объемов электродных и аналитической камер, особый способ укладки бумажных полосок и оригинальное лабиринтное устройство вокруг электродов. Укладка бумажных полосок производится очень просто: они сами прилипают ко всей поверхности поддерживающего съемного мостика.
БУФЕРНЫЕ РАСТВОРЫ
A. Буферные растворы, которые используются для электрофореза сывороточных белков, должны иметь pH между 8,0 и 9,0. Именно при этих значениях pH белки мигрируют к аноду (изоэлектрические точки разных белков сыворотки находятся в диапазоне pH от 4,7 до 7,0).
Б. Ионная сила буферных растворов должна быть в пределах 0,06—0,1 μ. Разбавленные растворы с ионной силой ниже 0,06 μ не обладают достаточной буферной емкостью и не обеспечивают четкого разделения белковых фракций.
B. С практической точки зрения важно отметить, что, повышая напряжение при электрофорезе, можно работать с растворами низкой ионной силы. Это снизит теплообразование под влиянием электрического тока, но разделение белков будет не очень четким. При повышении ионной силы разделение проходит гораздо лучше.
Г. Помимо указанных выше буферных растворов, для электрофореза белков и пептидов можно использовать следующие:
1) Буферный раствор барбитурат натрия — барбитуровая кислота: 10,3 г барбитурата натрия растворяют в 1000 мл дистиллированной воды и прибавляют 1,84 г барбитуровой кислоты, также растворенной в 1000 мл дистиллированной воды; при этом получается буферный раствор pH 8,6, μ = 0,06.
2) Буферный раствор барбитурат натрия — уксуснокислый, натрий: 7,36 г барбитурата Na и 3,86 г CH3COONa∙3H2О растворяют в 1100 мл дистиллированной воды; pH 9,0, μ = 0,06.
3) Боратный буферный раствор: 8,8 г борнокислого натрия и: 4,05 г борной кислоты растворяют в 1000 мл дистиллированной воды; pH 8,6.
4) Буферный раствор трис — ЭДТА [1]. Этот раствор лучше других подходит для разделения белков сыворотки. В нем можно выделить 9 фракций: преальбумин, альбумин, три фракции а-глобулинов, три фракции ß-глобулинов и у-глобулин.
Приготовление буферного раствора. 60,5 г три(оксиметиламино- метана (трис), 6,0 г ЭДТА и 4,6 г борной кислоты растворяют в дистиллированной воде и доводят до конечного объема 1000 мл. Молярности растворенных веществ соответственно составляют 0,5; 0,021 и 0,075 М, а pH равен 8,9.
Д. Буферные растворы легко прорастают плесневой или бактериальной флорой. Следует тщательно избегать бактериального загрязнения и не применять проросшие растворы.
Е. Буферные растворы следует хранить в холодильнике. Нецелесообразно запасаться готовыми растворами в объеме, превышающем недельную потребность, так как срок их хранения не более 8—10 дней. После каждого сеанса электрофореза необходимо сменить полюса либо тщательно перемешать в бутыли буферные растворы из анодного и катодного отсека и вновь залить в аппарат. Даже выполняя это требование, не следует использовать одну и ту же порцию буферного раствора более 3—4 раз.
НАНЕСЕНИЕ АНАЛИЗИРУЕМОГО ОБРАЗЦА
Ниже описаны два весьма удобных способа нанесения анализируемого образца на полоску фильтровальной бумаги.
А. Капиллярной пипеткой исследуемый раствор белка переносят на шлифованный край предметного стекла, затем быстрым движением прикладывают этот край стекла к полоске бумаги и держат До тех пор, пока весь раствор не впитается в бумагу. С помощью предметного стекла шириной 2,5 см можно нанести 0,05 мл исследуемого раствора.
Б. Из плексигласа или другого подходящего пластика изготовляют U-образную вилку, ветви которой на 6—8 см расходятся друг от друга. Между концами ветвей натягивают две платиновые проволочки толщиной 0,1 мм так, чтобы между ними остался зазор 0,5 — 1,0 мм. Капиллярной пипеткой заполняют пространство между проволочками исследуемым раствором и, перевернув вилку, быстрым движением прикасаются проволочками к поверхности смоченной полоски бумаги.
НАПРЯЖЕНИЕ ПРИ ЭЛЕКТРОФОРЕЗЕ
А. В стандартных условиях опыта (те же самые бумага, буферный раствор и аппарат) миграция белков в электрическом поле зависит от напряжения.
Б. Обычно для фракционирования белков сыворотки используют рекомендованное выше напряжение 110 В, при котором разделение длится от 14 до 16 ч, и охлаждения не требуется. Для особых целей напряжение может быть увеличено, но, согласно закону Джоуля, при этом соответственно увеличится теплообразование. Выделение тепла можно уменьшить, если снизить ионную силу раствора. При достаточной влажности фильтровальной бумаги, на которой ведут электрофорез, и не очень высокой температуре окружающего воздуха можно повысить напряжение на полоске до 250—300 В, не принимая специальных мер для охлаждения. Однако при дальнейшем увеличении напряжения требуются специальные приспособления для охлаждения.
НЕКОТОРЫЕ ФАКТОРЫ, ВЛИЯЮЩИЕ НА ЭЛЕКТРОФОРЕЗ
А. Электроосмос. При прохождении электрического тока в капиллярной системе (фильтровальная бумага), заполненной буферным раствором, наблюдается явление электроосмоса, т. е. движение буферного раствора к катоду навстречу миграции белков.
Б. Факторы, влияющие на перетекание буферного раствора:
1) После погружения концов полоски влажной фильтровальной бумаги в буферный раствор, заполняющий отсеки электрофоретического аппарата, начинается перетекание этого раствора из отсека в отсек по смоченным полоскам, которое продолжается от 30 до 60 мин, пока не наступит равновесие. Если полоски бумаги были предварительно хорошо смочены, то период уравновешивания может быть короче.
Чтобы полностью устранить влияние этого процесса на разделение белков, следует уложить смоченные буферным раствором полоски бумаги на рамку, поместить их в электрофоретическую камеру и закрыть крышку. Только после того как равновесие установится, т. е. примерно через 30 мин, можно наносить исследуемый образец.
2) Возникающее по закону Джоуля тепло увеличивает испарение буферного раствора с поверхности бумаги. Испарение приводит к концентрированию буферного раствора, увеличение ионной силы повышает его удельную электропроводность, а это в свою очередь опять-таки ведет к нагреванию и испарению раствора. Испарившийся буферный раствор восполняется раствором из отсеков аппарата, поступающим благодаря капиллярным силам, т. е. начинается движение раствора по направлению от концов полоски к ее центру. На одном конце полоски направление этого потока совпадает с миграцией белков, а на другом конце увлекает их в противоположную сторону.
Нежелательные эффекты и интенсивность этих противоположно направленных потоков в принципе минимальны, так как в герметизированном приборе для электрофореза быстро создаются условия влажной камеры. Кроме того, конструкция некоторых аппаратов для электрофореза предусматривает впускной штуцер для введения пара в электрофоретическую камеру, что позволяет начать электрофорез в насыщенной паром атмосфере.
В результате испарения буферного раствора на внутренней поверхности стеклянной крышки, закрывающей электрофоретическую камеру, происходит конденсация воды и образование капель. Опасности попадания капель воды на электрофореграмму во время опыта или при удалении крышки можно легко избежать, если внутреннюю поверхность крышки покрыть листом фильтровальной бумаги.
3) Если заполняющий отсеки электрофоретической камеры буферный раствор находится на разных уровнях, то из отсека с более высоким уровнем он перетекает по бумажным полоскам в отсек с более низким уровнем. Этот поток буферного раствора в зависимости от направления может либо тормозить, либо ускорять миграцию белков.
Чтобы избежать перетекания, следует тщательно выравнивать уровни буферного раствора во всех отсеках электрофоретической камеры до внесения в нее бумажных полосок. Обычно отсеки приборов для электрофореза снабжены отводными кранами, которые соединяются резиновым шлангом. После заполнения прибора буферным раствором отводные краны открывают (или, если кранов нет, снимают зажим с соединяющего отсеки резинового шланга), и происходит выравнивание уровней.
Еще проще добиться одинаковых уровней с помощью Т- или Y-образной трубки, имеющей на концах резиновые шланги и заполненной буферным раствором. Два ее конца погружают в буферные отсеки электрофоретической камеры, а через третий отвод насасывают буферный раствор. Когда раствор заполнит трубку, этот отвод перекрывают зажимом.
4) Прежде чем начинать работу с данным прибором для электрофореза, следует эмпирически установить, в какое место бумажной полоски нужно наносить исследуемый образец, чтобы получать наилучшее разделение.
ВЫБОР ФИЛЬТРОВАЛЬНОЙ БУМАГИ
Хорошо себя зарекомендовали на практике следующие фирменные марки фильтровальной бумаги для электрофореза: Шляйхер- Шуль 2043а, Шляйхер-Шуль 2043b, Ватман 1, Ватман 4, Мунктель 20, Махери-Нагель 214.
АДСОРБЦИЯ БЕЛКОВ НА ФИЛЬТРОВАЛЬНОЙ БУМАГЕ
A. Во время электрофореза некоторые белки адсорбируются на фильтровальной бумаге. Адсорбция белка бывает значительной при кислом pH и низкой ионной силе раствора, но наблюдается также и при pH 8,6. Адсорбция происходит в результате взаимодействия положительно заряженных молекул белка и отрицательно заряженных волокон фильтровальной бумаги. Степень адсорбции разных белков широко варьирует; например, липопротеиды сыворотки крови адсорбируются сильнее, чем сывороточный альбумин.
Б. В результате адсорбции некоторые мигрирующие белки связываются с бумагой, что приводит к образованию “хвостов”.
B. Из-за образования “хвостов” белковые фракции, полученные при электрофорезе, нельзя считать чистыми, так как они могут содержать следы других фракций. Образование “хвостов” снижает точность количественной оценки электрофореграмм и значительно затрудняет анализ малых количеств белка. В последнем случае рекомендуется проводить электрофорез исследуемого белка в смеси с другим белковым раствором. Например, можно смешать раствор альбумина низкой концентрации с сывороткой и провести электрофорез этой смеси и отдельно сыворотки на двух соседних полосках. Разница между содержанием альбумина на двух полосках будет соответствовать его концентрации в исследуемом растворе.