Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Анализ белков с помощью низковольтного электрофореза
Электрофорез в полиакриламидном геле
Зональный электрофорез в полиакриламидном геле
Принцип метода. Под влиянием электрического поля происходит миграция белков в геле, образованном при сополимеризации акриламида и N, N'-метиленбисакриламида.
Область применения: электрофоретическое фракционирование белков. Зональный электрофорез в полиакриламидном геле является наилучшим методом электрофоретического фракционирования белковых смесей. Он позволяет разделить белки сыворотки человека примерно на 20 отчетливо различаемых фракций.
ПРИБОРЫ
1. Приспособление для приготовления геля. Гель готовят в простом приборе, который можно сделать в любой подсобной мастерской. Модель, изображенная на фиг. 10, изготавливается фирмой Sartorius Membranfilter Ltd. (ФРГ). Образование геля происходит в прямоугольной камере 3, в которую вставляется сосуд 2, с крышкой 1. Два отверстия, сделанные в дне камеры, могут плотно закрываться резиновыми пробками. Прокладки 5 и 6 изготовлены из плексигласа, и их длина несколько превышает высоту сосуда.
Закрытый крышкой сосуд вместе с прокладками вставляют в камеру.
Затем сосуд до краев наполняют гелеобразующей жидкостью и осторожно закрывают крышкой 4, избегая образования пузырьков воздуха.
Прокладки, а также отверстия в нижней части камеры значительно облегчают извлечение сосуда из камеры после окончания гелеобразования.
2. Резервуары для буферного раствора (фиг. 11). Резервуары для буферного раствора закрепляются на штативе, который не показан на фиг. 11. Сосуд 2, наполненный гелем, располагается вертикально, так что нижняя не закрытая крышкой 1 часть геля (см. фиг. 10) контактирует с буферным раствором, в то время как контакт верхнего конца пластинки геля с буферным раствором верхнего резервуара обеспечивается с помощью фитилей из фильтровальной бумаги.
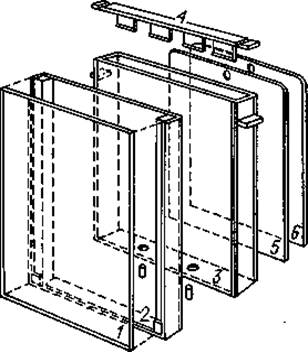
Фиг. 10. Прибор для приготовления полиакриламидного геля (описание см. в тексте).
МЕТОДИКА
1. Приготовление буферного раствора pH 8,6, μ = 03. Основной раствор: 17,94 г диэтилбарбитурата натрия растворяют в 129 мл 0,1 н. НСl и прибавляют 871 мл дистиллированной воды. Буферный раствор: основной раствор разбавляют дистиллированной водой в соотношении 1:2.

Фиг. 11. Резервуары для буферного раствора и контейнер с гелем прибора для электрофореза в полиакриламидном геле (описание см. в тексте).
Гель, а) 2,5 г N, N'-метиленбисакриламида растворяют в 400 мл буферного раствора при осторожном нагревании в водяной бане, после чего объем раствора доводят тем же буферным раствором до 500 мл (конечная концентрация N, N'-метиленбисакриламида должна быть 0,5%); б) 17,5 г акриламида растворяют в 133,6 мл раствора (а), буферным раствором доводят объем до 350 мл и фильтруют. Полученный раствор остается жидким до тех пор, пока в него не добавят катализатор. Катализатор следует добавлять непосредственно перед заполнением сосуда, в котором происходит гелеобразование. В качестве катализатора гелеобразования можно применять раствор персульфата аммония (приготовленный раствор годен к применению не более недели) или раствор диметиламинопропионитрила.
После добавления катализатора гелеобразующий раствор следует тщательно перемешать и заполнить им сосуд.
Образование геля происходит примерно через 20—30 мин.
2. Заполнение камеры и образование геля. Закрытый крышкой 1 сосуд 2 вместе с прокладками 5 и 6 вдвигают в камеру 3; отверстия в нижней части камеры плотно закрывают резиновыми пробками. Сосуд 2 до краев заливают гелеобразующим раствором и закрывают крышкой 4.
3. Подготовка прибора для электрофореза. Как только произойдет образование геля, резиновые пробки в нижней части камеры 3 вынимают, осторожно выдвигают прокладки 5 и 6 и, наконец, извлекают сосуд 2, содержащий гель. Его монтируют вертикально таким образом, чтобы наполняющий нижний резервуар прибора буферный раствор мог свободно контактировать с поверхностью геля. С помощью соответствующего штатива закрепляют верхний резервуар прибора и соединяют его с верхней частью сосуда 2. Крышку 4 осторожно приподнимают. Благодаря выступам на ее внутренней поверхности (см. фиг. 10) в верхнем слое геля образуются углубления правильной формы, которые могут служить лунками для внесения образца. Избегая образования пузырьков воздуха, эти углубления заполняют буферным раствором с помощью капиллярной пипетки. Электрический контакт между буферным раствором, содержащимся в верхнем резервуаре, и верхним концом столбика геля осуществляется за счет полоски фильтровальной бумаги соответствующей формы, смоченной буферным раствором. Исследуемую сыворотку (или любую другую смесь белков) вносят в заполненные буферным раствором углубления верхней части геля, причем 0,03 мл сыворотки подслаивают на дно углубления, и она оказывается между гелем и буферным раствором, покрывающим гель до начала электрофореза.
4. Электрофорез. При толщине блока полиакриламидного геля 6 мм электрофорез продолжается 36 ч при напряжении 100 В и силе тока 25—30 мА. За это время белки успевают мигрировать на расстояние до 23 см. После окончания электрофореза сосуд, содержащий гель, вынимают из прибора, осторожно снимают крышку и, стараясь не повредить гель, переносят его в окрашивающий раствор.
5. Окрашивание полиакриламидного геля. Окрашивающий раствор: 1,0 г амидового черного 10В растворяют в 200 мл смеси уксусная кислота—метанол—дистиллированная вода (1:5:5), оставляют на ночь и затем фильтруют. Окрашивающий раствор можно использовать несколько раз, но предварительно его каждый раз необходимо фильтровать. Дифференцирующие растворы: 1) раствор, содержащий смесь уксусная кислота—метанол—дистиллированная вода (1:5:5) и 2) 7%-ный раствор уксусной кислоты.
После 30 мин окрашивания гель несколько минут промывают водопроводной водой, помещают сначала на 24 ч в первый дифференцирующий раствор, а затем во второй до полного обесцвечивания тех частей, которые не содержат белка.
6. Количественная оценка. Количественный анализ пластинок геля проводят с помощью денситометра (см. стр. 63).
Примечания. 1. 7,5 %-ный полиакриламидный гель имеет поры со средним размером около 50 Å. Белки, диаметр молекул которых не превышает 40 Å, должны мигрировать в нем без задержки.
2. Удаление красителя из геля можно производить электрофоретическим способом.
3. При денситометрии пластинок геля толщиной 6 мм могут возникнуть затруднения, для устранения которых приходится вносить изменения в устройство денситометра.