Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Анализ белков с помощью низковольтного электрофореза
Электрофорез в крахмальном геле
Горизонтальный электрофорез в крахмальном геле
В нашей лаборатории горизонтальный электрофорез в крахмальном геле проводят по методу Смитиса [26] в камере для зонального полумикроэлектрофореза следующим образом.
Буферный раствор: боратный буфер pH 8,6. Приготовление буферного раствора, заполняющего камеры прибора: 45,65 г Н3ВО3 и 7,2 г NaOH растворяют в дистиллированной воде в конечном объеме 5 л. Приготовление буферного раствора для крахмального геля. Основной раствор: 30,92 г Н3ВО3 и 8,0 г NaOH растворяют в дистиллированной воде и доводят конечный объем до 1 л. Перед приготовлением крахмального геля 60 мл основного раствора разводят дистиллированной водой до 1000 мл.
МЕТОДИКА
Приготовление крахмального геля. Берут такую навеску гидролизованного картофельного крахмала, чтобы конечная его концентрация составляла примерно 13—14%. Взвешенный крахмал суспендируют с размешиванием в 1/4 конечного объема буферного раствора. Остальной объем буферного раствора нагревают до кипения и затем охлаждают до тех пор (примерно до 96° С), пока не исчезнут пузырьки пара и воздуха. В горячий буферный раствор вливают суспензию крахмала и осторожно перемешивают, избегая образования пузырьков. Легче всего избавиться от пузырьков воздуха, поместив крахмальную суспензию в вакуум. Появление стекловидной прозрачности геля свидетельствует о том, что размешиванием достигнута определенная степень гомогенности.
Полученный гель выливают в горизонтальную ванну, прикрытую стеклянной пластинкой. Эта ванна входит в комплект прибора для электрофореза. Гель должен полностью закрывать обеспечивающие электрический контакт фитили. Подготовку ванны с крахмальным гелем необходимо закончить в течение 3—5 мин. Примерно через час после этого в гель можно вносить исследуемый образец, как это описано в п. 4 разд. 1.
Электрофорез продолжается 6 ч при 140 В и 70 мА. Закончив электрофорез, крахмальный блок горизонтально разрезают на две половины, одну из которых окрашивают амидовым черным 10 В (см. стр. 87).
ПРИМЕЧАНИЯ
1. Гидролиз картофельного крахмала. 500,0 г имеющегося в продаже картофельного крахмала гидролизуют в смеси НСl и ацетона (10 мл химически чистой НСl и 990 мл ацетона) при 37° С в течение 6—18 ч. Для прекращения гидролиза добавляют, тщательно перемешивая, 250 мл 1 М раствора уксуснокислого натрия (134,0 г на 1000 мл).
Гидролизованный крахмал отмывают обычно на воронке Бюхнера 5 л дистиллированной воды, пропускают через него под вакуумом 300—350 мл ацетона для подсушивания и окончательно высушивают под инфракрасной лампой 3—4 ч, не допуская перегрева выше 60° С. После высушивания крахмал на 24 ч оставляют на воздухе.
2. Если для приготовления геля использовать частицы крахмала определенного размера, то электрофорез в таком геле может дать лучшее разделение белков, чем на бумаге.
3. Описанные выше методы электрофореза в крахмальном геле позволяют одновременно анализировать несколько белковых растворов (например, сразу несколько сывороток), если использовать более широкую ванну для геля. Например, в ванне шириной 124 мм можно одновременно параллельно фракционировать 8—10 сывороток.
4. Кроме описанного, существует также другой простой способ внесения исследуемого образца в гель. Необходимое количество белкового раствора наносят на полоску фильтровальной бумаги и погружают эту полоску в узкую щель, вырезанную скальпелем или шпателем в крахмальном блоке. Затем гель осторожно уплотняют вокруг полоски, чтобы обеспечить более тесный контакт ее с крахмалом.
5. Локализация фракций с помощью окрашивания. Можно определить положение белковых фракций в крахмале, окрашивая непосредственно сам гель, например амидовым черным 10 В.
Приготовление окрашивающего раствора: 2,0 г амидового черного 10 В растворяют в 500 мл метанола и оставляют на 24 ч, затем добавляют 100 мл уксусной кислоты и 400 мл дистиллированной воды. Через 24 ч раствор красителя готов для использования.
Дифференцирующий раствор: смешивают 500 мл метанола, 100 мл уксусной кислоты и 400 мл дистиллированной воды. Окрашивают 20 мин, дифференцируют дважды по 20 мин.
6. Толщина слоя крахмального геля не должна превышать 5—10 мм. В более толстом слое геля миграция белков происходит неравномерно.
7. Фракции белка, разделившиеся в крахмальном геле, можно идентифицировать в реакции преципитации со специфической антисывороткой. Для этого Шёрлен и Голь [25] предложили комбинировать электрофорез в крахмальном геле с иммунодиффузией в агаровом геле.
Методика. Закончив электрофорез, крахмальный блок горизонтально разрезают на две половины. Одну половину окрашивают обычным образом, другую переносят на стеклянную пластинку и располагают колонки крахмала так, как показано на фиг. 9. Затем вокруг них наливают горячий раствор агара (приготовление см. на стр. 127), при застывании которого образуется слой толщиной 3 мм. Агар не должен закрывать крахмальный гель; на расстоянии 12—16 мм от колонок крахмала в нем делают прорези шириной 1 мм (фиг. 9). Через 6—12 ч после нанесения на пластинку агара в эти прорези заливают специфическую антисыворотку к фракционируемым белкам. В результате диффузии белков и антител в агаре через 2—4 дня появляются линии преципитации (см. иммуноэлектрофорез, стр. 137).
8. Электрофорез в крахмальном геле, содержащем мочевину. Эффективность разработанного Пуликом и Эдельманом [22] метода анализа Н- и L-цепей иммуноглобулинов с помощью электрофореза в крахмальном геле, содержащем мочевину, была подтверждена в нашей лаборатории.
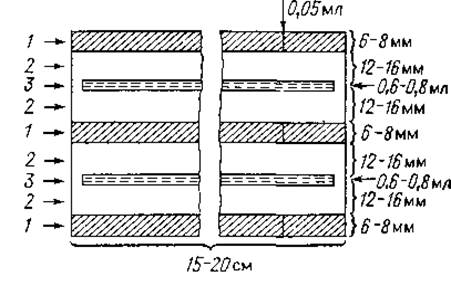
Фиг. 9. Комбинация электрофореза в крахмальном геле с иммунодиффузией в агаре [25].
1 — крахмальный гель; 2 — агаровый гель; 3 — иммунная сыворотка.
Буферный раствор для приготовления геля: 240,0 г мочевины и 1,35 г муравьиной кислоты растворяют в дистиллированной воде в конечном объеме 500 мл.
Буферный раствор для заполнения камер прибора: 9,6 г NaOH и 32,7 г муравьиной кислоты растворяют в дистиллированной воде в конечном объеме 3 л.
Крахмал суспендируют в 270 мл буферного раствора, предназначенного для геля, в котором растворено 40,0 г мочевины. Все остальные процедуры проводят так же, как и при обычном горизонтальном электрофорезе в крахмальном геле (стр. 80).
9. Препаративный электрофорез в крахмальном блоке. Принцип метода. Под влиянием электрического поля происходит миграция белков в крахмальном блоке, в результате которой белки разделяются, а после разделения их можно элюировать из крахмала.
Область применения: препаративное выделение индивидуальных белков из белковых смесей, очистка белковых фракций.
Приборы. 1. Источник тока. Для этого метода необходим источник постоянного тока со стабилизированным напряжением от 0 до 500 В.
2. Аппарат для электрофореза в крахмальном блоке. В продаже имеется ряд специальных аппаратов для электрофореза в крахмальном блоке. Вместе с тем некоторые изменения конструкции позволяют приспособить для этой цели почти любой лабораторный прибор для электрофореза. Аппарат для электрофореза в крахмальном блоке имеет: а) резервуары для буферного раствора и электродов (см. стр. 46), б) ванну для крахмального блока, которую можно сделать самостоятельно следующим образом. Вырезают две одинаковые пластинки из плексигласа (например, размером 50 х 13 х 0,5 см). По кромке одной из них наклеивают плексигласовый бортик высотой 0,5 см. Вторая пластинка служит крышкой для этой ванны. По краям пластинок на расстоянии примерно 10 см одно от другого высверливают отверстия для того, чтобы крышку и ванну можно было скрепить винтами.
Методика. 1. Приготовление крахмального геля. В колбе на 1 л смешивают примерно 300 мл вероналового буферного раствора pH 8,6 (см. стр. 47) с равным объемом очищенного (не гидролизованного!) картофельного крахмала. Размешав, густую пасту выливают на плексигласовую пластинку с бортиком и оставляют на 10 мин. Фильтровальной бумагой удаляют избыток буферного раствора и затем поверхность крахмальной пасты разглаживают лопаточкой или другим подходящим инструментом. На одном конце готового блока вырезают желобок размером 1 х 9 см и в него вносят исследуемый раствор белков (например, 3 мл сыворотки крови), предварительно смешанный с сухим крахмалом до консистенции густой пасты. Из фильтрованной бумаги соответствующего размера делают фитили и, смочив их буферным раствором, накладывают на оба конца крахмального блока так, чтобы они обеспечили контакт в электрической цепи с буферными растворами в резервуарах аппарата. Ванну с крахмальным гелем закрывают крышкой, которую закрепляют винтами.
2. Электрофорез. Смоченные фитили обеспечивают контакт в электрической цепи крахмального блока с буферным раствором в резервуарах аппарата. Систему на 15 мин оставляют для уравновешивания и затем проводят электрофорез при напряжении 300 В и силе тока 30 мА в течение 24—30 ч, желательно с охлаждением.
3. Выделение фракций. Закончив электрофорез, блок извлекают из ванны и, слегка подсушив, разрезают на фрагменты шириной 1 см. Каждый фрагмент переносят в центрифужную пробирку соответствующего размера и размешивают с 3 мл буферного раствора. Осадок крахмала отделяют центрифугированием, а в надосадочной жидкости определяют содержание белка и на основании этих данных строят кривую фракционирования. В соответствии с этой кривой нужные фракции объединяют.
Примечания. 1. В зависимости от конкретных условий размеры крахмального блока могут варьировать. Однако следует помнить, что при толщине геля, значительно превышающей 0,5 см, начинает проявляться действие силы тяжести; при этом буферный раствор может скапливаться в нижних слоях крахмального блока, что ухудшает разделение.
2. Перед заполнением ванны крахмалом ее рекомендуется выстлать жиронепроницаемой бумагой, пленкой “парафильм” или нейлоном; этими же материалами следует покрыть блок, прежде чем закрывать крышку ванны.
3. Для непрерывного наблюдения за миграцией белков при фракционировании сыворотки к ней рекомендуется добавить бромфеноловый синий.
4. Вместо крахмала весьма удобно использовать певикон, который следует обрабатывать так же, как и крахмал.