Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Методы средне- и высоковольтного электрофореза
Аппарат для средневольтного горизонтального электрофореза и его использование
Электрофорез осуществляется при низкой температуре в небольших объемах буферного раствора на расположенной горизонтально фильтровальной бумаге при градиенте напряжения 30—40 В/см.
1. Описание аппарата. На фиг. 15 схематически изображен изготовленный в мастерской аппарат для горизонтального электрофореза с охлаждающей плитой из плексигласа размером 44х44 см. Циркуляция охлаждающей жидкости внутри плиты направляется особыми перегородками. В качестве такой жидкости применяют 50%-ный этанол, охлаждаемый в специальном резервуаре смесью льда с ацетоном или с помощью холодильного агрегата. Температура охлаждающей плиты должна быть примерно +6° С. На плиту кладут смоченный буферным раствором лист фильтровальной бумаги, соединенный с электродными отсеками прибора бумажными фитилями, покрытыми целлофаном. Сверху лист фильтровальной бумаги закрывают пластинкой из плексигласа толщиной 15 мм, которая в трех точках плотно прижимается к охлаждающей плите.
Электродный отсек аппарата представляет собой прямоугольную камеру из плексигласа, разделенную на две части. В наружной части расположен электрод, изготовленный из платиновой проволоки 0,3 мм толщины; во внутреннюю часть погружаются фитили, соединяющие отсек с фильтровальной бумагой. Обе части электродного отсека соединяет мостик из влажной фильтровальной бумаги.
Источник тока снабжен плавным реостатом и обеспечивает максимально напряжение 2000 В и силу тока 150—200 мА.
Охлаждающая жидкость циркулирует в системе под действием небольшого насоса.
2. Приготовление буферных растворов. 1) Буферный раствор pH 4,3— 5,0 (величина pH определяется чистотой уксусной кислоты): смешивают 10 мл уксусной кислоты и 10 мл пиридина и разводят дистиллированной водой до 1000 мл.
2) Буферный раствор pH 6,5: смешивают 100 мл пиридина и 4 мл уксусной кислоты и разводят дистиллированной водой до 1000 мл.
3) Буферный раствор pH 2,0: смешивают 100 мл уксусной кислоты и 35 мл муравьиной кислоты и разводят дистиллированной водой до 1000 мл.
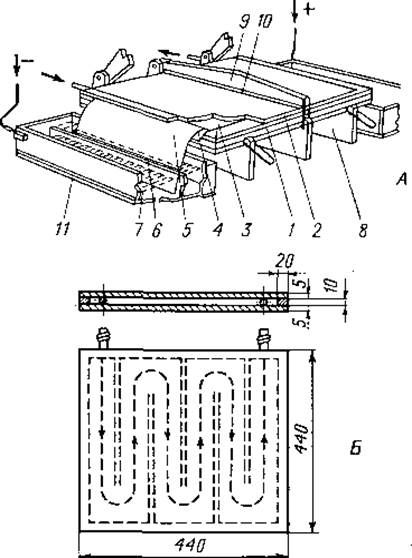
Фиг. 15. Схема прибора для горизонтального средневольтного электрофореза на бумаге с охлаждением.
А. 1 — охлаждающая плита (см. Б); 2— пластинка, которая служит крышкой; 3 — лист фильтровальной бумаги; 4 — целлофановая мембрана; 5 — фитиль из фильтровальной бумаги; 6 — мостик из фильтровальной бумаги; 7 — электродный отсек; 8 — держатели охлаждающей плиты; 9 — деталь крепления; 10 — полоска губчатой резины, 11 —платиновые электроды.
3. Обработка фильтровальной бумаги. На листе фильтровальной бумаги делают необходимую разметку и смачивают его соответствующим буферным раствором. Осторожно отжав избыток буферного раствора между несколькими слоями фильтровальной бумаги, этот лист накладывают на охлаждающую плиту. Затем, прикрыв сухим листом бумаги, распрямляют его резиновым валиком, используемым в фотографических лабораториях. На обращенные к электродам концы листа фильтровальной бумаги накладывают полоски целлофана, длина которых несколько превышает ширину листа. Целлофановую полоску сгибают таким образом, чтобы она сверху и снизу охватывала конец бумажного фитиля (фиг. 16), который другим своим концом погружается в буферный раствор.
При нанесении слишком большого объема исследуемого материала может произойти его размывание на линии “старта”. Для предотвращения размывания следует наносить небольшой объем достаточно концентрированного раствора пептидов.
Если приходится фракционировать значительный объем материала, желательно наносить его на сухую, а не на влажную бумагу. Большой объем наносимого материала, естественно, пропитывает значительную площадь бумаги. Если подсушивать место “старта”, можно частично ограничить растекание наносимого раствора. Правда, в этом случае создается опасность необратимой адсорбции некоторых пептидов на бумаге; особенно это относится к большим пептидам, и поэтому такого подсушивания следует избегать. Однако, если область старта действительно занимает слишком большую площадь, наносимый материал можно сконцентрировать следующим способом. Сразу после нанесения образца бумагу кладут на чистое стекло. Увлажненную область “старта” с помощью двух стеклянных палочек приподнимают так, чтобы она не касалась стекла. Продвигая кончик пипетки параллельно линии “старта” примерно на расстоянии 1 см от увлажненной области, смачивают буферным раствором бумагу вокруг нее. Буферный раствор должен свободно выходить из пипетки и впитываться в бумагу. Увлажнение повторяют несколько раз по обе стороны стартовой зоны, пока она полностью не пропитается буферным раствором. После этого смачивают всю остальную площадь листа фильтровальной бумаги. Очень важно, чтобы нанесенный материал в стартовой области имел pH используемого буферного раствора. Особенно это существенно в тех случаях, когда лиофилизированный образец наносится в растворе аммиака. Поскольку этот раствор имеет более высокое значение pH, чем обычно используемый буферный раствор, важно, чтобы последний был достаточно емким. Обеспечить нужный pH в месте нанесения образца можно довольно простым приемом. Для этого бумагу вокруг стартовой зоны смачивают буферным раствором и оставляют для легкого подсушивания (но не полного высушивания!). Достаточно проделать это три раза, чтобы в области нанесения образца установился pH буферного раствора. После этого избыток буферного раствора отжимают между слоями фильтровальной бумаги и кладут лист на охлаждающую плиту.
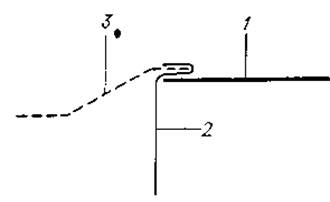
Фиг. 16. Укладка фильтровальной бумаги в приборе для горизонтального электрофореза. Чтобы предотвратить слишком интенсивный электроэндоосмотический поток буферного раствора, фильтровальная бумага (1) контактирует с фитилем (3) через целлофановую мембрану (2).
Подобное смачивание буферным раствором следует применять и при использовании приема “пришивания”. Буферный раствор пипеткой наносят вдоль шва по обе стороны пришитого отрезка бумаги, пока оба фронта смачивания не сомкнутся. При этом содержащийся на пришитом отрезке бумаги материал будет впитываться на чрезвычайно узкой области “старта”. Таким путем можно сконцентрировать материал на полоске шириной до 10—15 см. На бумагу Ватман 3 или 3 ММ можно нанести от 1 до 5 мг/см, а на бумагу Ватман 1 — от 1 до 5 мг на 10 см. В методе “отпечатков пальцев” на бумагу Ватман 3 и 3 ММ на линию старта шириной 1 см можно наносить максимально 3—4 мг исследуемого материала.
4. Электрофорез. После нанесения образца бумагу помещают в прибор, крышку плотно закрывают и включают ток. Для эффективного охлаждения очень важно, чтобы бумага была достаточно плотно прижата к охлаждающей плите. При использовании приема “пришивания” покрывающую стеклянную или плексигласовую пластинку 2 (фиг. 15,А) нельзя непосредственно приложить к бумаге, так как в местах, где пришиты полоски электрофореграммы, имеются утолщения. В этом случае между фильтровальной бумагой и покрывающей пластинкой прокладывают слой пенопласта, который нивелирует неровности и обеспечит равномерное прижатие бумаги. Разумеется, слой пенопласта следует изолировать от бумаги тонкой полиэтиленовой пленкой или же можно поместить пенопластовую прокладку в полиэтиленовый мешок. Электрофорез продолжается 90—120 мин, после этого прибор выключают, открывают крышку, стеклянными палочками вынимают влажную электрофореграмму и сушат ее в потоке теплого воздуха при 40—50°С.
5. Окрашивание электрофореграммы. В аналитическом варианте мотода высушенную электрофореграмму погружают в 0,5%-ный ацетон-нингидриновый или кадмий-нингидриновый раствор (см. стр. 192) и затем сушат 2—3 ч при 40—50°С.
Когда электрофорез ставят в препаративном варианте, на электрофореграмме окрашивают только края зон, как показано на фиг. 17. Согласно этим окрашенным полоскам, размечают остальные части электрофореграммы и проводят элюирование фракций.
После окрашивания электрофореграмм ацетон-нингидриновым раствором их необходимо зафиксировать. Для приготовления фиксатора смешивают 10 мл водного насыщенного раствора CuNО3, 0,2 мл азотной кислоты и 200 мл ацетона и полученную смесь фильтруют. Окрашенную электрофореграмму погружают в этот фиксатор и затем высушивают на воздухе.
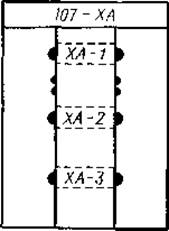
Фиг. 17. Электрофореграмма, на которой показано, как нужно отрезать край листа с разделенными фракциями для микропрепаративного выделения.
Отрезанную полоску окрашивают; руководствуясь ею, делают соответствующую разметку и проводят элюирование фракций.
6. Качественное разделение аминокислотных смесей. Разделение и идентификацию всех аминокислот в полных кислотных гидролизатах белков и пептидов нельзя провести, используя лишь один метод электрофореза на бумаге. Например, весьма затруднительно в одних и тех же условиях идентифицировать как кислые (глутаминовая, аспарагиновая и цистеиновая), так и основные (гистидин, аргинин и лизин) аминокислоты. При pH 5,0 можно получить хорошее разделение глутаминовой, аспарагиновой и цистеиновой кислот, но в этих условиях плохо фракционируются основные аминокислоты и, очевидно, вовсе не разделяются нейтральные аминокислоты, так как при этом pH заряд их молекул близок к нулю.
В то же время основные аминокислоты благодаря различным рК вполне удовлетворительно фракционируются в буферном растворе с pH 6,5, поскольку в этих условиях гистидин протонирован в незначительной степени. Кислые аминокислоты, наоборот, плохо разделяются при pH 6,5. Однако кислые и основные аминокислоты могут быть разделены одновременно на одной электрофореграмме с помощью электрофореза в двойной буферной системе [3]. Лист фильтровальной бумаги делят стартовой линией на две половины. Катодную половину, которая является областью миграции основных аминокислот, смачивают буферным раствором, имеющим pH 6,5, а анодную пропитывают буферным раствором с pH 5,0 (фиг. 18).
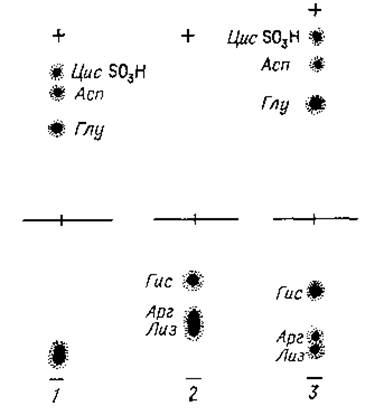
Фиг. 18. Одномерный электрофорез на бумаге.
1 — при pH 5,0; 2 — при pH 6,5; 3 — в системе с обоими буферными растворами.
Нейтральные аминокислоты не разделяются ни в одном из этих буферных растворов, но их фракционирование можно осуществить при последующем электрофорезе в других условиях, а также с помощью хроматографии. Перенос фракции нейтральных аминокислот в другую систему очень удобно сделать путем пришивания (фиг. 19). Для полной идентификации аминокислот гидролизаты наносят на сухую фильтровальную бумагу. Чем меньше площадь, которую занимает нанесенный образец на бумаге, тем лучше будет разделение. Поэтому, чтобы уменьшить растекание образца, нанесение сопровождается подсушиванием. В центре листа бумаги размечают линию старта и через 3 см друг от друга наносят исследуемые образцы 1, 2 и 3 (фиг. 19,А). По обе стороны от них наносят по два контрольных образца (К). На первом этапе анализа проводят электрофорез с двумя буферными растворами. Катодную часть электрофореграммы смачивают буферным раствором, имеющим pH 6,5, а анодную — pH 5,0. Средневольтный электрофорез проводят около 1,5 ч, затем электрофореграмму извлекают из аппарата, сушат и с двух сторон отрезают полоски фильтровальной бумаги, на которых фракционировались контрольные образцы. Эти полоски 4 окрашивают нингидрином (фиг. 19,А). На окрашенных контрольных электрофореграммах можно идентифицировать кислые и основные аминокислоты исследуемых гидролизатов и установить локализацию нейтральных аминокислот. Из исходной электрофореграммы по пунктирным линиям (фиг. 19,Б) вырезают полоску 5, содержащую только нейтральные аминокислоты. Обе оставшиеся части листа, обозначенные цифрой 6, окрашивают нингидрином и идентифицируют содержащиеся в них кислые и основные аминокислоты путем сопоставления с контрольными электрофореграммами. Полоску бумаги, содержащую нейтральные аминокислоты, на швейной машине зигзагообразным швом пришивают к новому листу фильтровальной бумаги.
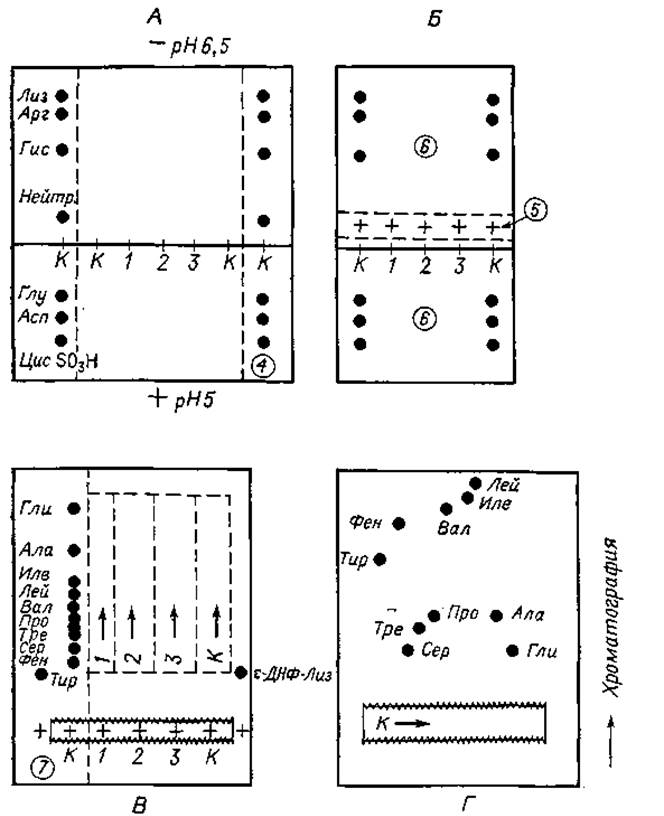
Фиг. 19. Трехэтапное разделение аминокислот.
А и Б. Электрофорез в системе с двумя буферными растворами. В. Электрофорез при pH 1,9. Г. Хроматография.
Следующий этап электрофореза проводится в буферном растворе, имеющем pH 1,9 или 2,0. Поэтому полоску бумаги с нейтральными аминокислотами нужно пришить на анодном краю листа так, чтобы она служила стартовой зоной. При pH 1,9—2,0 диссоциация всех карбоксильных групп аминокислотных молекул подавлена, и в связи с этим все нейтральные компоненты смеси ведут себя как катионы. Пришив полоску бумаги, лист переворачивают и лезвием бритвы осторожно вырезают тот его участок, который расположен под пришитой полоской. Это необходимо делать осторожно, чтобы не повредить швы и саму полоску. Затем фильтровальную бумагу смачивают буферным раствором, имеющим pH 1,9 или 2,0, как описано выше. В качестве маркера рядом с пришитой полоской наносят ε-ДНФ-лизин. Электрофорез проводят до тех пор, пока этот маркер не мигрирует на 8—10 см по направлению к катоду.
По окончании электрофореза бумагу вновь высушивают, вырезают одну из контрольных полосок 7 (фиг. 19,В) и окрашивают ее. С ее помощью можно определить, как далеко мигрировали нейтральные аминокислоты. Установив это, разрезают электрофореграмму (по пунктирным линиям) на полоски, содержащие нейтральные аминокислоты из образцов 1—3, а также из контрольного образца К. Каждую из этих полосок в свою очередь пришивают к новому листу фильтровальной бумаги и подвергают хроматографии в системе бутанол — уксусная кислота — вода (фиг. 19,Г) в направлении, перпендикулярном направлению электрофореза. Такая трехэтапная система анализа позволяет надежно идентифицировать каждую из аминокислот, содержащихся в исследуемом гидролизате.
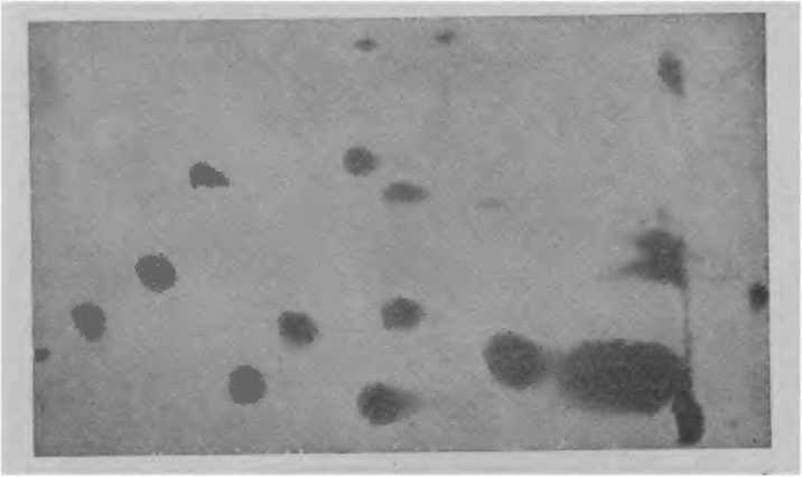
Фиг. 20. Пептидная карта триптического гидролизата D-глицеральдегид-3-фосфатдегидрогеназы.
Гидролизаты коротких пептидов, в составе которых имеются аминокислоты одного-двух видов, можно анализировать по сокращенной программе, проводя вместо трехэтапного двухэтапное разделение.
7. Анализ ферментативных гидролизатов белков. В 1957 г. Ингрэм [61 впервые показал, что двухэтапным разделением с помощью хроматографии и электрофореза на бумаге можно анализировать сложные пептидные смеси, ферментативные гидролизаты и т. п. Такой анализ выявляет самые незначительные различия, с которыми можно встретиться, например, при изучении видовой специфичности или в других сравнительных исследованиях. Метод “отпечатков пальцев” можно назвать одним из важнейших методов современной биохимии, молекулярной биологии и иммунохимии, так как он позволяет выделить в чистом виде определенный пептид или провести микропрепаративное разделение сложной смеси.
В качестве классического примера метода “отпечатков пальцев” на фиг. 20 приведена картина, полученная в результате фракционирования триптического гидролизата D-глицеральдегид-3-фосфатдегидрогеназы.
На первом этапе проводят горизонтальный электрофорез при pH 4,3—5,0. 3—4 мг исследуемого материала наносят на бумагу в зоне шириной 1 см перпендикулярно направлению миграции. Электрофорез продолжается 2—3 ч, затем бумагу высушивают и, повернув на 90°, проводят восходящую хроматографию. В качестве растворителя используют смесь изоамиловый спирт — пиридин — вода (35 : 35 : 30). Хроматографию заканчивают, когда фронт растворителя достигает верхнего края бумаги. Хроматограмму высушивают и окрашивают так же, как и электрофореграмму при горизонтальном электрофорезе.
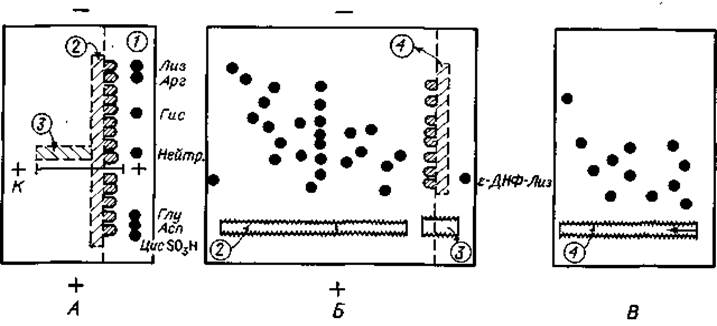
Фиг. 21. Трехэтапиый анализ белкового гидролизата.
А. Электрофорез при pH 6,5. В. Электрофорез при pH 1,9. В. Хроматография. См. текст.
В последнее время метод “отпечатков пальцев” все чаще осуществляют в три этапа, комбинируя два электрофоретических разделения с хроматографией. Дело в том, что двухэтапный метод “отпечатков пальцев” не всегда дает полное разделение, особенно при анализе ферментативных гидролизатов высокомолекулярных белков, поэтому возникает необходимость дополнительного электрофоретического фракционирования (фиг. 21).
На первом этапе лучше всего провести электрофорез в буферном растворе с pH 6,5 или 5,0 либо в двухбуферной системе. Весьма трудно дать определенные рекомендации относительно величины pH буферного раствора, так как вариации электрофоретической подвижности у белков и пептидов гораздо значительнее, чем у аминокислот. Поэтому на первом этапе разделения величину pH буферного раствора следует подобрать эмпирически. Опытным путем необходимо также определить наиболее подходящее месторасположение стартовой зоны и оптимальную продолжительность электрофореза, поскольку компоненты разделяемой смеси могут иметь весьма варьирующую электрофоретическую подвижность. Анализ неизвестной смеси пептидов следует начинать с предварительного электрофоретического опыта, который позволит установить эти параметры.
После электрофоретического разделения на первом этапе контрольную полоску 1 (фиг. 21,А) окрашивают и, используя ее как образец для сравнения, из неокрашенной части бумажного листа вырезают полоску 2 шириной примерно 1 см (фиг. 21,А). Эту полоску пришивают на новый лист бумаги для второго электрофоретического разделения (фиг. 21,Б), которое обычно проводят при pH 2,1 или 1,9. При pH 1,9 нельзя ожидать полного разделения ферментативных белковых гидролизатов из-за сложного состава зоны 3 нейтральных аминокислот. Поэтому, установив месторасположение этой зоны на первой электрофореграмме, ее вырезают и пришивают рядом с полоской 2 (фиг. 21,Б). Электрофорез продолжается до тех пор, пока нанесенный в качестве маркера ε-ДНФ-лизин не продвинется примерно на 10—13 см в сторону катода. После высушивания бумагу окрашивают почти целиком, за исключением полоски 4 (фиг. 21,Б), которая содержит мигрирующие из отрезка 3 нейтральные компоненты. Полоску 4 пришивают к новому листу и подвергают хроматографии в соответствующей системе (фиг. 21, В). Трехэтапный анализ позволяет с наибольшей достоверностью установить количество пептидных компонентов, возникающих в результате ферментативного гидролиза высокомолекулярных белков. Такого рода данные чрезвычайно важны, например, при определении аминокислотной последовательности.
ПРИМЕЧАНИЯ
1. Чем меньше буферного раствора содержится в фильтровальной бумаге, тем выше разрешающая способность горизонтального электрофореза. Поэтому перед нанесением образца следует особенно тщательно удалять избыток буферного раствора промоканием.
2. Если образуются зоны неправильной формы с краевой деформацией или если фронт миграции не параллелен электродам, необходимо проверить правильность закрепления крышки. Под недостаточно прижатой или искривленной крышкой бумага становится неравномерно смоченной, так как высыхает в некоторых участках, а это может быть причиной подобных аномалий. Если крышка закреплена хорошо, но тем не менее эти явления не исчезают, следует проверить правильность укладки полосок целлофана. При слишком коротких целлофановых прокладках фильтровальная бумага с одной или с обеих сторон может контактировать непосредственно с фитилем. Это вызовет усиленный поток буферного раствора в месте контакта и как следствие этого — нарушение формы зон. При высоковольтном горизонтальном электрофорезе эффект электроэндоосмоса менее выражен, поэтому можно обходиться без целлофановых прокладок.
3. При анализе методом “отпечатков пальцев” рекомендуется хроматографию так же, как и электрофорез, проводить при низкой температуре, если это возможно. Исходя из нашего опыта, можно отметить, что самая высокая разрешающая способность наблюдается при + 4°С.