Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Хроматография аминокислот и пептидов на бумаге
Принцип метода. Благодаря различиям в коэффициентах распределения аминокислоты и пептиды можно разделить с помощью насыщенных водой органических растворителей на фильтровальной бумаге в закрытой камере соответствующей формы и размеров.
Область применения. Качественное и полуколичественное определение аминокислот, получение пептидных карт (метод отпечатков пальцев), микропрепаративное разделение и очистка пептидов.
МЕТОДИКА
1. Хроматографическая камера. Для восходящей хроматографии, при которой фронт растворителя движется вверх по бумаге, можно использовать стеклянный цилиндр подходящего размера. Максимальные размеры листа бумаги примерно 45 х 50 см, поэтому высота такого цилиндра должна быть немного больше 50 см. Лист бумаги сворачивают в повторяющий форму цилиндра рулон. Для сохранения этой формы два конца листа сшивают нейлоновой нитью. Обычно диаметр рулона не превышает 12—15 см. При таких размерах в одном и том же стеклянном цилиндре можно либо провести анализ материала методом “отпечатков пальцев”, либо получить одномерные хроматограммы 8—10 разных образцов одновременно.
Нанеся на края цилиндра слой вакуумной смазки, его закрывают стеклянной пластинкой, которую сверху придавливают каким-нибудь грузом, например заполненной жидкостью бутылью. В таком герметично закрытом цилиндре удается, создать атмосферу равномерно насыщенных паров растворителя. Она поддерживается за счет испарения жидкости, налитой в 50-миллилитровый сосуд, который ставят на дно цилиндра внутрь рулона. Следует позаботиться о том, чтобы бумага не касалась ни стенок цилиндра, ни краев сосуда с уравновешивающей жидкостью, иначе в местах контакта фронт растворителя изменит скорость своего движения.
Для одновременного получения нескольких хроматограмм в одинаковых условиях более пригодна прямоугольная камера, которую можно использовать как для восходящей, так и для нисходящей хроматографии. В качестве такой камеры можно использовать, например, деревянный ящик со стеклянными стенками размером 70 х 70 х 70 см, по верхнему краю которого прикреплена полоска пористой резины. Сверху эту камеру накрывают толстым (тяжелым) стеклом, обеспечивающим герметичность системы. При восходящей хроматографии нижний край фильтровальной бумаги зажимают между двумя стеклянными палочками, погруженными в одну из стеклянных кювет, которые размещают на дне камеры. Для нисходящей хроматографии необходимы пластмассовые или стеклянные кюветы. Верхний край фильтровальной бумаги погружают в такую кювету, расположенную в верхней части камеры, и закрепляют там с помощью тяжелой стеклянной палочки.
В продаже имеются хроматографические камеры подобной конструкции, которые можно использовать для самых разнообразных целей.
2. Выбор фильтровальной бумаги. Для качественного и полуколичественного хроматографического анализа обычно используют бумагу Шляйхер-Шуль 20436 и Ватман 1. Микропрепаративное выделение пептидов лучше всего проводить на бумаге Ватман 3 и Ватман 3 ММ. Наиболее четкая картина пептидных карт получается на бумаге Ватман 3 ММ.
При микропрепаративном выделении следует обратить особое внимание на способ элюирования фракций. Бумага Ватман позволяет проводить элюирование дистиллированной водой, поэтому фон в измеряемых пробах довольно низкий. В то же время элюирование фракций при хроматографии на бумаге Шляйхер-Шуль можно проводить только разбавленным раствором уксусной кислоты, что приводит к весьма высокому фону.
Таблица 9 Состав стандартных растворов аминокислот
Раствор А |
Концентрация, мг/10 мл |
Раствор Б |
Концентрация, мг/10 мл |
Цистеиновая кислота |
70 |
Лизин |
59 |
Гистидин |
62 |
Аргинин |
69 |
Аспарагиновая |
53 |
Серин |
42 |
кислота |
|||
Глицин |
30 |
Глутаминовая |
59 |
кислота |
|||
Треонин |
47 |
Аланин |
35 |
Пролин |
46 |
Метионинсульфон |
59 |
Тирозин |
72 |
Лейцин |
54 |
Валин |
46 |
||
Фенилаланин |
55 |
3. Стандартные растворы аминокислот. При качественной и полуколичественной хроматографии аминокислот используют два стандартных раствора, состав которых приведен в табл. 9. Из-за нестабильности цистеина, цистина и метионина вместо них в состав стандартных растворов входят окисленные производные, т. е. цистеиновая кислота и метионинсульфон.

Фиг. 38. Расположение аминокислот на бумаге при нисходящей хроматографии в бутанольной системе.
А и Б — смеси аминокислот; H — нейтральный красный; 1 — Цис SО3Н; 2 — Гис; 3 — Асп; 4 — Гли; 5 — Тре; 6 — Про; 7 — Феи; 8 — Лиз; 9 — Apr; 10 — Мет SO2; 11 — Сер; 12 — Глу; 13 — Ала; 14 — Тир; 15 — Вал; 16 — Лей.
Относительное расположение различных аминокислот при хроматографии стандартных аминокислотных смесей показано на хроматограмме, представленной на фиг. 38. В пятне, обозначенном буквой Н, содержится нейтральный красный. Этот индикатор имеет идентичную С лейцином величину Rf, и поэтому по нему можно следить, когда наиболее быстро мигрирующий компонент стандартной смеси—лейцин—достигнет нижнего края хроматограммы при нисходящей хроматографии.
4. Нанесение исследуемого образца. Исследуемый образец можно нанести на хроматографическую бумагу микропипеткой, градуированным капилляром или с помощью так называемого метода полиэтиленовой пленки.
При полуколичественном анализе на хроматографическую бумагу необходимо наносить точно известный объем исследуемого раствора. Проще всего и наиболее точно это можно сделать с помощью микропипетки. В продаже имеются микропипетки нескольких типов с постоянным или произвольно задаваемым объемом. В связи с тем что фабрично изготовленные микропипетки довольно дороги, исследователи часто пользуются самодельными капиллярами, которые можно приготовить следующим образом.
Из расплавленных на огне стеклянных трубок или пробирок вытягивают тонкие капилляры длиной около 12 см и производят их калибровку на 0,05 или 0,01 мл. Обезжиренные и хорошо высушенные капилляры калибруют с помощью градуированной микропипетки на 0,1 мл. Для этого из микропипетки в капилляр переносят точно 0,05 или 0,01 мл воды и на стенке капилляра карандашом по стеклу или цветной пастой отмечают положение мениска. Обладая некоторым опытом, можно довольно точно произвести эту калибровку. Важно проследить, чтобы конец пипетки был достаточно чистым, сам капилляр — обезжиренным и чтобы во время переноса воды и капилляр, и микропипетка находились в горизонтальном положении.
При своеобразном способе нанесения исследуемого материала на хроматографическую бумагу с помощью полиэтиленовой пленки дном нагретой на пламени стеклянной пробирки в пленке делают несколько углублений, в которые вносят примерно по 0,05 мл исследуемого материала, например кислотного гидролизата белка. На одной пленке можно разместить 3—5 проб (фиг. 39). Очень осторожно, остерегаясь размазать капли, пленку переносят для высушивания в вакуумный эксикатор. Примерно через 10—15 мин, когда капли подсохнут, пленку извлекают и на край каждого высохшего пятна наносят маленькую каплю воды заостренным концом стеклянной палочки, с помощью которой растворяют весь материал в этой капле. Лист хроматографической бумаги кладут на чистое стекло и отмечают карандашом места нанесения материала. Затем к этому участку бумаги прикладывают полиэтиленовую пленку с исследуемым материалом и с обратной стороны прижимают ее к бумаге пальцем. Если при этом площадь смоченной бумаги будет не больше 1 см2, то в результате хроматографии исследуемый материал распределится небольшими пятнами правильной формы. Этот метод нанесения обладает большими преимуществами: в течение нескольких минут можно без потерь нанести 20—30 образцов. При этом отпадает необходимость готовить и мыть капилляры, применять при нанесении высушивание горячим воздухом и т. д.
Фиг. 39. Полоски полиэтиленовой пленки с исследуемыми образцами.
Образцы наносят в стартовой облаcте хроматограммы с помощью капиллярной пипетки или в виде отпечатка.
5. Микропрепаративная хроматография. Подлежащий фракционированию материал наносят на бумагу Ватман 3 или Ватман 3 ММ вдоль стартовой линии, длина которой не должна превышать 20 см. Максимально можно наносить 3—4 мг на 10 см. По окончании хроматографии хроматограмму высушивают, отрезают с обеих сторон полоски бумаги шириной 0,5 см и окрашивают их для того, чтобы установить положение зон, которые должны быть элюированы (см. фиг. 17); затем вырезают эти зоны и элюируют фракции.
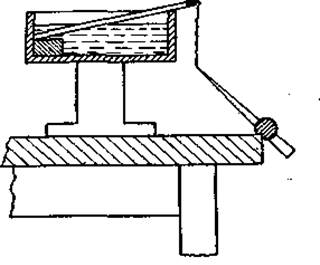
Фиг. 40. Элюирование компонентов из фильтровальной бумаги малыми объемами растворителя с помощью капилляра (подробное объяснение см. в тексте).
Для элюирования один конец вырезанного участка зажимают между двумя стеклянными пластинками, погруженными в кювету с дистиллированной водой, и, когда вся бумага увлажнится, к нижнему заостренному концу подводят закрепленный пластилином капилляр. Элюат начинает медленно поступать в капилляр (фиг. 40). Если длина капилляра равна 30 см, то заполняющий его объем жидкости вполне достаточен для элюирования полоски хроматограммы, имеющей размер 1x8 см. Из капилляра элюат переносят в маленький бюкс на 2—3 мл для высушивания в вакуумном эксикаторе.
Независимо от избранного способа нанесения образца (c использованием микропипетки, капилляра или полиэтиленовой пленки) исследуемый материал должен быть как можно более концентрированным и распределяться на минимальной площади. При слишком большом диаметре стартового пятна или при слишком широкой зоне нанесения материала на одномерной препаративной хроматограмме довольно трудно получить хорошее разделение, так как при этом фракции будут давать большие пятна и зоны, а расположенные рядом компоненты могут перекрывать друг друга. Идеальным было бы нанесение образца в виде точки. Это, конечно, вряд ли возможно, но, если стартовое пятно в диаметре не превышает 5—6 мм, а стартовая зона не шире 2—3 см, получаются вполне четкие хроматограммы. Очень часто при нанесении трудно обойтись без специальных приспособлений, таких, например, как столик для нанесения образцов, имеющийся в продаже. Для подсушивания проб при нанесении проще всего использовать обыкновенный фен для сушки волос. Горячий воздух, направляемый на бумагу, быстро высушивает содержащуюся в нанесенном материале воду. Это позволяет повторять нанесение, не увеличивая диаметра стартового пятна больше, чем на несколько миллиметров и ширины стартовой зоны больше, чем на несколько сантиметров.
6. Растворители. В литературе описано очень много самых разных растворителей, используемых для качественного и полуколичественного анализа, а также для микропрепаративных целей. Здесь мы приводим только, те из них, которые можно успешно применять во многих случаях.
Бутанол — вода — уксусная кислота (120:50:30) (по объему; гомогенная система, не требующая уравновешивающего раствора) |
С равным успехом этот растворитель можно использовать при качественном и полуколичественном анализе аминокислот, при микропрепаративном разделении и при получении пептидных карт. Свежеприготовленный растворитель можно использовать немедленно; его не следует хранить свыше 10—12 дней, так как по истечении этого срока происходит этерификация. |
Изоамиловый спирт — пиридин — вода (35:35:30) (по объему; гомогенная система, не требующая уравновешивающего раствора) |
Вначале смешивают изоамиловый спирт с пиридином и к этой смеси по каплям при постоянном перемешивании добавляют воду. Если полученный раствор опалесцирует, его следует профильтровать. Опалесценция вновь появляется через 8—10 дней и тогда растворитель становится негодным для использования. Это одна из лучших смесей для получения пептидных карт и микропрепа- ративных хроматограмм. |
Приведенные ниже растворители можно использовать при комбинации электрофоретического и хроматографического разделения исследуемого материала; бутанол—пиридин—уксусная кислота— вода (60 : 40 : 12; 48); вода, насыщенная фенолом, в атмосфере NH3; втор-бутиловый спирт — 3%-ный раствор аммиака (3; 1); м-крезол — фенол, насыщенный водой (1 : 1); изобутанол—вода—муравьиная кислота (695 : 295 : 10); изобутанол—метилэтилкетон — вода (40 : 30 : 20); н-пропанол—вода (70 : 30); этанол—вода (77 : 23).
7. Идентификация аминокислот и пептидов во фракциях. А. Нингидриновая реакция. Нингидрин реагирует со всеми аминокислотами, имеющими a-NH2-гpyппy, давая фиолетовое окрашивание, за исключением пролина или оксипролина, в реакции с которыми нингидрин дает желтое окрашивание. Некоторые примеси (медь, кадмий и др.) могут влиять на цвет пятен. Для проявления хроматограмм весьма удобен так называемый кадмий-нингидрин, реакция которого с аминокислотами довольно чувствительна и приводит к развитию стойкой красной окраски, а также коллидин-нингидрин, реагирующий с некоторыми аминокислотами избирательно и позволяющий дифференцировать их по цвету пятна.
1) Приготовление кадмий-нингидрина. 1,0 г нингидрина растворяют в 100 мл ацетона. 100 мл ацетата кадмия растворяют в 10 мл дистиллированной воды и прибавляют 5 мл уксусной кислоты. Оба полученных раствора объединяют и хранят в склянке из темного стекла.
Высушенную хроматограмму проводят через приготовленный раствор красителя, налитый в плоскую кювету, и высушивают на воздухе в темноте. При комнатной температуре максимальное окрашивание развивается приблизительно через 2 ч.
2) Приготовление коллидин-нингидрина. 5,0 г нингидрина растворяют в 955 мл ацетона, затем добавляют 25 мл уксусной кислоты и 20 мл коллидина.
Б. Определение гистидина при помощи реакции Паули.
1) Приготовление реактива Паули. Раствор I: 50,0 г сульфаниловой кислоты растворяют в 250 мл 10%-ного раствора КОН и добавляют 200 мл 10%-ного раствора NaNО2. Раствор II: к 80 мл концентрированной НСl прибавляют 40 мл дистиллированной воды.
К охлажденному до 0°С раствору ІІ по каплям при охлаждении и постоянном перемешивании прибавляют раствор I. Выпадающий при этом осадок отфильтровывают и высушивают при комнатной температуре.
2) 0,1 г реактива Паули растворяют в 100 мл 20%-ного раствора Na2CО3 и свежеприготовленным раствором опрыскивают хроматограмму. Чтобы водно-щелочной раствор не размывал пятен и зон на хроматограмме, следует добиться тонкодисперсного распыления реактива и равномерного опрыскивания. Пептиды, содержащие гистидин, и свободный гистидин дают красное окрашивание на желтом фоне. Пептиды, содержащие тирозин, и свободный тирозин дают фиолетовое или серо-голубое окрашивание, но их пятна в отличие от пятен, содержащих гистидин, быстро бледнеют.
В. Определение аргинина и пептидов, содержащих аргинин, в реакции Сакагуши. Раствор I: 0,01%-ный а-нафтол в 95 %-ном этаноле, содержащем 5% мочевины. Раствор II: 2,0 г брома в 100 мл 8%-ного раствора NaOH. Перед использованием к раствору I добавляют несколько гранул NaOH и после их растворения реактивом опрыскивают хроматограмму. Затем бумагу высушивают и опрыскивают раствором II. Аргинин и пептиды, содержащие аргинин, окрашиваются в красный цвет.
Г. Определение пролина и оксипролина. 100 мг изатина растворяют в 50 мл бутанола и прибавляют 5 мл уксусной кислоты. Проявляемую хроматограмму опрыскивают этим раствором и высушивают при 40°С в течение 5 мин. Пролин и пептиды, содержащие пролин в N-концевом положении, дают интенсивное голубое окрашивание. Фенилаланин и тирозин при этом окрашиваются в зеленовато-голубой цвет, что является помехой при определении пролина и оксипролина.
Д. Определение триптофана. 0,5 г п-диметиламинобензальдегида растворяют в 100 мл 95%-ного этанола, содержащего 2 мл концентрированной НСl. С полученным раствором триптофан дает фиолетовое окрашивание.
Е. Определение тирозина. 0,1 г а-нитрозо-ß-нафтола растворяют в 100 мл 75 %-ного этанола. После опрыскивания этим раствором хроматограмму высушивают и опрыскивают 10%-ным раствором азотной кислоты: Затем ее опять высушивают и в течение 3 мин выдерживают при 90°С. Тирозин и пептиды, содержащие тирозин, дают красное окрашивание на бледно-зеленом фоне.
Ж. Определение глицина. 1) 0,2 г фталевого альдегида растворяют в 100 мл ацетона; 2) 1,0 г КОН растворяют в 100 мл 96%-ного этанола.
Хроматограмму проводят через раствор 1 и высушивают при 100°С, затем проводят через раствор 2 и опять 10 мин сушат при 100°С. В результате реакции глицин дает зеленое окрашивание.
3. Определение N-ацилпроизводных и крупных пептидов в реакции с хлором. Сухую хроматограмму или электрофореграмму в течение 30 мин выдерживают в стеклянном цилиндре в атмосфере хлора, затем извлекают из цилиндра и опрыскивают 1 %-ным раствором крахмала, содержащим 1% КІ. Соединения с пептидными связями в молекуле проявляются темносиними зонами или пятнами.
Рекомендуемая литература
Zweig G., Whitaker J. R., Paper Chromatography and Electrophoresis. Vol. II, Academic Press, New York, London, 1971.