Аминокислоты, пептиды и белки - Дэвени Т., Гергей Я. 1976
Ионообменная хроматография в фиксированном слое ионообменника
Анионообменная хроматография на пластике “Фиксион”
В принципе в качестве тонкого слоя может быть использована любая ионообменная смола. В настоящее время уже началось опытное производство анионообменных пластинок со смолой, близкой по своим свойствам к смоле дауэкс 2x8. Как и для катионообменных пластинок, в данном случае используется сверхтонкая сферическая смола в ацетатной форме.
С точки зрения техники анионообменная хроматография отличается от катионообменной лишь выбором буферных растворов.
Уравновешивание анионообменных пластинок производят 0,01 М уксусной кислотой в тех же условиях, в которых уравновешивают катионообменные пластинки.
БЫСТРОЕ ОПРЕДЕЛЕНИЕ ЦИСТЕИНА И ЦИСТИНА В ФОРМЕ ЦИСТЕИНОВОЙ КИСЛОТЫ В ОБРАЗЦАХ РАСТИТЕЛЬНОГО ПРОИСХОЖДЕНИЯ [9]
С точки зрения питательной ценности кормов содержание цистина и Цис в веществах растительного происхождения имеет очень важное значение. Его можно определить прямым путем, но это требует огромных затрат труда, а полученные данные не позволяют рассчитать истинное содержание аминокислот, так как в условиях гидролиза они разлагаются. Обычно при количественном анализе цистина и Цис их предварительно окисляют надмуравьиной кислотой и затем определяют в смеси устойчивую цистеиновую кислоту.
Количество цистеиновой кислоты в кислотном гидролизате пропорционально сумме количеств цистина и Цис в исходном образце. Цистеиновая кислота на катионообменной колонке и пластинке движется впереди всех остальных компонентов, так как она не связывается смолой. Благодаря своему сильно кислому характеру она хорошо связывается с анионообменной смолой, в результате чего ее движение значительно задерживается и она отделяется от остальных кислых компонентов (Асп, Глу). Хроматографию цистеиновой кислоты проводят в буферном растворе пиридин—уксусная кислота pH 3,8. Чтобы его приготовить, смесь 10 мл пиридина и 100 мл уксусной кислоты разбавляют деионизованной водой до 1000 мл. Колебания pH буферного раствора под влиянием примесей не существенны для разделения. Поскольку гидролизованные образцы растворяют в 0,01 н. НСl, гидролизат можно фракционировать на катионообменной пластинке. На анионообменной пластинке адсорбция цистеиновой кислоты минимальна, поскольку она обладает самым низким значением Rf.
Анализ большого числа проб производится следующим образом.
ОКИСЛЕНИЕ НАДМУРАВЬИНОЙ КИСЛОТОЙ
50 мг растертого образца (семена, корм и т. д.) смешивают с 2 мл надмуравьиной кислоты и оставляют при комнатной температуре на 2 ч. Для приготовления надмуравьиной кислоты смешивают 1 объем перекиси водорода и 9 объемов муравьиной кислоты и инкубируют 30 мин при 4°С; в реакций используют свежеприготовленный раствор.
ГИДРОЛИЗ
Окисленный образец гидролизуют в течение 48 ч в 5 мл 6 н. НСl при 105°С. После гидролиза кислоту удаляют над КОН и P2O5.
ПОДГОТОВКА ХРОМАТОГРАФИИ
Хроматография может быть выполнена двумя различными способами в зависимости от того, в каком источнике нужно определить цистеиновую кислоту: 1) в корме или 2) в определенном белке.
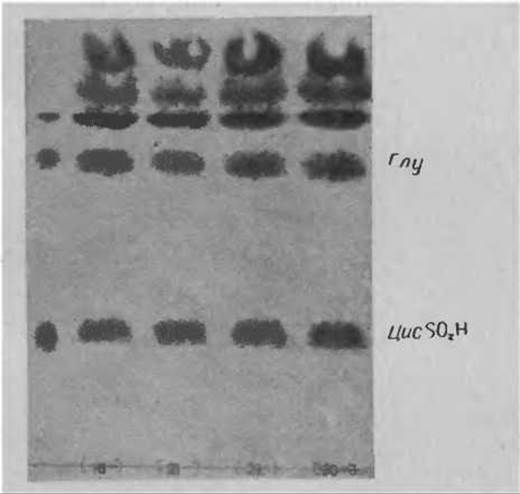
Фиг. 56. Определение цистеиновой кислоты в гидролизатах растительных белков на пластинке “Фиксион 50 x 8”.
В случае 1) на пластинку наносят равные в расчете на сухой вес исходного образца порции гидролизатов. В случае 2) должно быть известно содержание азота в каждом образце и на основании этих данных наносят на пластинку порции гидролизатов, эквимолярные по содержанию белка в исходных образцах. Например, если определяют содержание цистеиновой кислоты в образцах корма, целесообразно наносить гидролизаты полосками шириной в 1 см по 0,5 мг каждого образца в объеме 20 мкл. Если же определяют количество цистеиновой кислоты в образцах определенного белка, то гидролизаты разбавляют (после удаления кислоты) и из каждого наносят на пластинку (полосками шириной в. 1 см) порции, содержащие одинаковое количество азота (0,1 мг белка в 20 мкл раствора).
ХРОМАТОГРАФИЯ
Хроматографию проводят в буферном растворе пиридин — уксусная кислота. Проявление ничем не отличается от методики, описанной для катионообменной пластинки. Типичная хроматограмма представлена на фиг. 56.
Цитированная литература
1. Devenyi T, Single-column Procedure for the Automatic Analysis of Amino Acids, Acta Biochim. Biophys. Acad. Sci. Hung, 3, 429—432 (1968).
2. Devenyi T., Modified Single-column Procedure for the Automatic Analysis of Amino Acids, Acta Biochim. Biophys. Acad. Sci. Hung, 4, 297 (1969).
3. Devenyi T., Separation of Aromatic and Basic Amino Acids (Phenyl-ketonuri-test), Acta Biochim. Biophys. Acad. Sci. Hung, 5, 435 (1970).
4. Devinyi T., Amino Acid Analyser Programming for the Rapid Determination of Methionine and Lysine, Acta Biochim. Biophys. Acad. Sei. Hung, 6, 129—132 (1971).
5. Devenyi T., Bäti J., Fabian F., Detection and Determination of Tryptophan, Acta Biochim. Biophys. Acad. Sci. Hung, 6, 133 (1971).
6. Divenyi T., Hazai I., Ferenczi S., Bäti J., One Dimensional Separation of Amino Acids, Acta Biochim. Biophys. Acad. Sci. Hung, 6, 385 (1971).
7. Devinyi T., Bäti I., Kiss P., Kovacs J., Thin layer ion exchange chromatographic reining test for aminoacids in blood-samples dried on filter paper, Acta Biochim. Biophys. Acad. Sci. Hung, 7, 237 (1972).
8. Ferenczi S., Divenyi T., Rapid estimation of cysteic acid, Acta Biochim. Biophys. Acad. Sci. Hung, 6, 329 (1971).
9. Ferenczi S., Bati J., Devenyi T., Testing of Methionine and Lysine in Plant Seeds, Acta Biochim. Biophys. Acad. Sci. Hung, 6, 123 (1971).
10. Hrabak A., Ferenczi S., Determination of Ornithine in Biological Fluids, Acta Biochim. Biophys. Acad. Sci. Hung, 6, 383 (1971).
11. Kisfaludy L., Low M., Devenyi T., Enzymatic Degradation of Peptides Containing Alfa-aminooxycarboxylic Acids, Acta Biochim. Biophys. Acad. Sei. Hung, 6, 393 (1971).
12. Sajgo M., Devenyi T., Rapid Determination of C-terminal Sequences on the Nanomole Scale, Acta Biochim. Biophys. Acad. Sci. Hung, 7, 233 (1972).