Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Первичная структура белковой молекулы
Изучение последовательности аминокислотных остатков в пептидных цепях
После выделения отдельных полипептидных цепей можно приступать к изучению последовательности расположения аминокислот. Для этого необходимо прежде всего расщепить цепь на ряд фрагментов, что может быть осуществлено с помощью неполного гидролиза 12 н. соляной кислотой или протеолитическими энзимами. В первом случае в зависимости от времени гидролиза получают большое количество ди-, три-, тетра- и пентапептидов, многие из которых частично «перекрывают» друг друга. Расшифровка последовательности остатков в коротких (ди- и три-) пептидах осуществляется сравнительно легко — путем определения концевых групп. При анализе строения тетра- и пентапептидов этот прием оказывается уже недостаточным, и его необходимо сочетать с частичным гидролизом самих пептидов.
Проведем расшифровку последовательности гипотетического пентапептида (А, В, С, D, Е), где буквы обозначают отдельные аминокислоты. Прежде всего следует идентифицировать N-терминальную аминокислоту, которой является, например, D. Тогда последовательность выражается в виде D— (А, В, С, Е). После частичного гидролиза пептида D— (А, В, С, Е) изолированы дипептиды D—A, А—С, В—Е, С—В и два трипептида D— (А, С) и А— (В, С) и анализированы на аминокислотный состав и ДНФ-аминокислоты. Наличие в продуктах гидролиза дипептида D—А обнаруживает на N-конце пентапептида уже две аминокислоты в /последовательности D—А. Идентификация дипептида А—С и трипептида А— (В, С) позволяет расширить N-терминальную последовательность до D—А—С, а трипептид А— (В, С) расшифровать как А—С— В. Выделение дипептида С—В указывает на В как на ближайший соседний остаток в последовательности D—А— С—В. Остается только аминокислота Е, которая, очевидно, является С-терминальной аминокислотой. Тогда полная последовательность выражается как D—А—С—В—Е.
В изложенном выше примере каждая из аминокислот присутствует однократно, что в действительности бывает крайне редко. Если же аминокислота встречается в пептиде многократно, то нельзя с уверенностью предсказать размещение малых пептидов вдоль цепи, так как в этом случае образуются дополнительные области «перекрывания», которые могут относиться к совершенно различным участкам полипептида. Так, при наличии в гидролизате двух трипептидов А—В—В и В—В—D и трех дипептидов А—В, В—В и В—D вполне допустимо предполагать существование в исходной цепи кроме тетрапептида А—В—В—D трипептида А—В—D. С другой стороны, существование однократно встречающегося в цепи аминокислотного остатка часто позволяет обнаружить как бы некий центр, от которого легко распространять расстановку соседних аминокислот вдоль полипептидной цепи.
Расшифровка аминокислотной последовательности в пептидах, получаемых при неполном кислотном гидролизе, и сопоставление их иногда дают возможность воссоздать более крупные фрагменты. Однако чаще эти данные могут служить лишь подспорьем для анализа сравнительно больших участков, получаемых при энзиматическом расщеплении полипептидной цепи. Это расщепление осуществляется с помощью таких протеиназ, как трипсин, химотрипсин, пепсин и субтилизин. Как уже говорилось (гл. II), наиболее удобным из них является трипсин, ибо он обладает строгой специфичностью и расщепляет пептидные связи только по карбоксильным группам лизина и аргинина. Так как трипсин является эндопептидазой, то он рвет связи только внутри цепочки и не отщепляет свободных аминокислот. Менее специфичен химотрипсин, который расщепляет пептидные связи по карбоксильной группе тирозина, фенилаланина, триптофана и метионина. Специфичность пепсина и субтилизина относительно широка, и ими атакуются разнообразные связи (см. рис. 7).
В результате воздействия какого-либо одного фермента получают пептиды, которые уже не будут перекрываться друг с другом и длина которых будет зависеть от того, как расположены в исходной цепи аминокислоты, по которым рвет пептидные связи данный фермент. Следовательно, мы получим смесь, состоящую как из коротких, так и относительно длинных пептидов. Чтобы изучить строение этих пептидов, необходимо выделить каждый в чистом виде. 1
Разделение большого количества пептидов, как правило, не может быть достигнуто с помощью какого-то одного приема, и для получения их в очищенном виде необходимо сочетать несколько независимых методов. Ниже указываются вкратце наиболее употребительные из них. Так, наиболее простым, но и наиболее длительным и не всегда «чистым» методом является бумажная хроматография. Исходную смесь разделяют в каком- то одном растворителе на несколько групп, каждая из которых содержит несколько различных пептидов. Затем каждую группу элюируют с бумаги и снова разделяют, но уже в другой системе растворителей. Получаемые из нее фракции снова хроматографируют, каждую в новой системе растворителей; и так до получения гомогенных пептидов. Процесс разделения очень длителен и требует значительного количества исходного материала вследствие неизбежных его потерь при хроматографии и последующих элюциях.
Более быстрым методом разделения пептидов энзиматического гидролизата является метод пептидных карт («отпечатка пальцев», или «фингерпринта»), сочетающий высоковольтный электрофорез и хроматографию на бумаге. С помощью этого метода возможно сопоставление пептидных смесей, получаемых при расщеплении различных белков, и выявление столь малых различий в аминокислотном составе отдельных пептидов, как замещение единичной аминокислоты какой-либо другой. Такие различия имеют большое значение при сравнительном изучении гомологичных белков различных видов растений и животных, а также при определении генетических изменений в структуре белка, возникающих в результате точечной мутации.
Анализ этого тина состоит в параллельном ферментативном расщеплении сравниваемых белков и сопоставлении их электрохроматограмм. Для этого на угол большого листа хроматографической бумаги типа «ватман № 3» наносится образец гидролизата, который затем подвергают электрофорезу при напряжении около 1,5—3 кв в пиридин-ацетатных или ацетат-формиатных буферных растворах. При этом исходная смесь разделяется на ряд фракций на основании различия электрохимических свойств соответствующих фрагментов белка. Однако полного разделения пептидных осколков электрофорез дать не может. Поэтому по окончании электрофореза лист высушивают и пятна подвергают хроматографическому разделению в перпендикулярном направлении с использованием различных систем растворителей. По окончании хроматографии лист высушивают я опрыскивают раствором нингидрина; пятна пептидов проявляются при кратковременном нагревании при 70° или при выдерживании листа в темноте в течение 12—24 часов. При соблюдении постоянства всех условий и стандартности материалов картина воспроизведения пептидных карт постоянна, и положения пятен от опыта к опыту совпадают с точностью от 3 до 5 мм.
Если один из сравниваемых белков обладает какими-то отличиями в аминокислотной последовательности определенного участка первичной цепи, то пептидные фрагменты этого участка будут передвигаться по электрохроматографическому полю с иными скоростями (а часто и в ином направлении) по сравнению с фрагментами такого же участка другого белка. В результате первые пептиды займут особое положение на пептидных картах, тогда как фрагменты из идентичных участков полипептидных цепей займут аналогичные места. Отличия в последовательности, таким образом, будут обнаружены в пятнах, имеющихся на одной электрохроматограмме и не появляющихся на другой. Элюция и количественный аминокислотный анализ «лишних» пептидных пятен позволяет далее установить наличие специфических для данного белка аминокислот, характеризующих эти фрагменты. В частности, методом пептидных карт для триптического гидролизата удалось выявить особенности структуры различных гемоглобинов. Гемоглобин S отличается от нормального гемоглобина А по электрофоретической подвижности и частично замещает последний у больных серповидно-клеточной анемией. Исследования методом пептидных карт позволили локализовать различие в первичной структуре между гемоглобинами А и S в одной точке полипептидной цепи:

При сопоставлении пептидных карт триптического гидролизата видно у гемоглобина S обособление пептида 4 от пептидов 1, 2, 3, что обусловлено появлением валина вместо глютаминовой кислоты в его составе (рис. 10).
Иногда для разделения пептидов энзиматического гидролизата применяется и метод гель-фильтрации. Принцип этого метода уже излагался выше (гл. I). Поэтому следует указать только, что наиболее подходящим для этой цели является сефадекс Г-25.
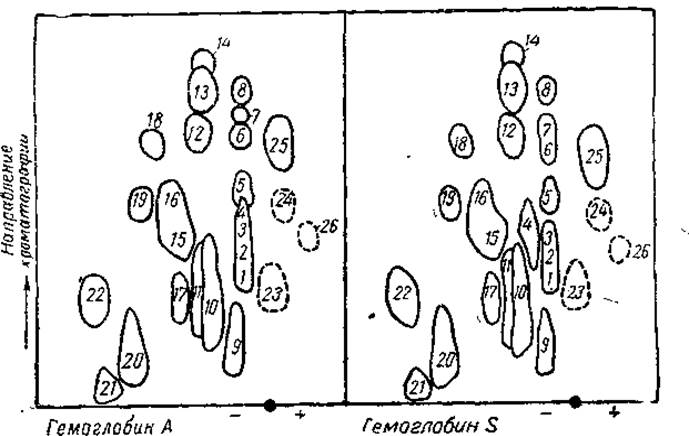
Рис. 10. Карты распределения пептидов триптического гидролизата гемоглобинов А и S (из Бэйли, 1965).
Пунктирными линиями обозначены те пептиды, которые появляются только после нагревания хроматограммы.
Для уравновешивания колонки и элюции пептидов используются самые разнообразные растворы: вода, растворы хлористого натрия, аммиака, уксусной кислоты и различные буферные растворы. Этим способом были фракционированы пептиды триптического гидролизата гемоглобина человека, а-казеина, тропомиозина скелетной мышцы и автолизата трипсина.
Однако необходимо отметить, что фракции, элюируемые с сефадекса, как правило, не являются гомогенными и содержат несколько пептидов (до 10 и более). Поэтому этот метод разделения необходимо сочетать с такими приемами фракционирования, как фингернринт и ионообменная хроматография.
Метод ионообменной хроматографии является наиболее совершенным приемом разделения пептидов. Как и при хроматографии аминокислот, для этой цели используют полистирольные смолы типа Дауэкс, причем тип избираемой смолы (анионо- или катионообменник) зависит от характера разделяемых пептидов. Хроматографию кислых и нейтральных пептидов лучше проводить на сильных аниопообменниках (Дауэкс-1, активная ионогенная группа—четвертичное аммониевое основание), тогда как для нейтральных и основных пептидов предпочтительнее использовать сильные катионообменники (Дауэкс-50, активная ионогенная группа — SО3H). Часто для выбора типа смолы пептидную смесь разделяют электрофоретически и определяют, какие пептиды — кислые или основные — преобладают в ней. Таким образом, подбор смолы в значительной мере является эмпирическим.
Фракционирование пептидов на ионообменных смолах основано на целом ряде принципов, о которых уже говорилось выше (гл. I и II). Сюда входят и различия в электрохимических свойствах разделяемых фрагментов, и различное сродство неполярных радикалов к бензольным кольцам матрицы смолы, и изменение концентрации конкурирующих ионов в буферном растворе. Поэтому элюция пептидов со смолы достигается путем пропускания через колонку буферных растворов изменяющейся ионной силы и pH. Это изменение концентрации ионов и pH может осуществляться линейно или ступенчато. Элюируемые компоненты идентифицируют нингидриновой колориметрией, лиофилизуют (высушивают из замороженного состояния) и проверяют на гомогенность с помощью хроматографии на бумаге и методом пептидных карт. Негомогенные пики фракционируют дополнительно. В качестве примера можно привести разделение пептидов, полученных триптическим гидролизом окисленной (т. е. лишенной дисульфидных мостиков) рибонуклеази (рис. 11).
Итак, после расщепления полипептидной цепи каким-либо энзимом (например, трипсином) и разделения продуктов гидролиза перечисленными методами можно получить большое количество гомогенных пептидных фрагментов. Затем следует определить аминокислотную последовательность в этих фрагментах. Если пептиды короткие, то эта задача выполняется сравнительно легко, путем определения аминокислотного состава и последовательности нескольких аминокислот с N- или С-конца фрагмента. Если же пептид состоит из большого числа аминокислот, то его приходится дополнительно расщеплять на более мелкие участки с помощью второго протеолитического фермента (например, химотрипсина). Дозируя глубину расщепления в каждом опыте путем подбора длительности реакции, величины pH и температуры, можно получить ряд пептидов различного размера, причем многие из них будут частично перекрывать друг друга. Сопоставляя эти фрагменты, можно воспроизвести последовательность аминокислотных остатков в исходном большом пептиде. Конкретный пример такого анализа приводится ниже.
Так, один из пептидов триптического гидролизата рибонуклеазы состоял из 20 аминокислотных остатков и имел N- и С-концевыми аминокислотами соответственно гистидин и валин:
Н—Гис—(Вал3, Илей2, Цис, Асп-NН2, Глю∙NH2, Гли,
Ала2, Про2, Тир, Гис, Фен, Асп, Сер)—Вал—ОН

Рис. 11. Разделение пептидов триптического гидролизата окисленной рибонуклеази на колонке с катионообменником Дауэкс 50-Х2 (из Гарриса и Ингрема, 1963):
Размер колонки 150 х 2 см. Пики 1, 2, 3, 4, 9, 13 + 14 — неидентифицированные пептиды, 5 — (Цис, Acп∙NH2, Ала, Вал)—Лиз, 6 — (Глю, Гли, Сер2, Тре)—Лиз. 7 — Аси, Apr, 8 — (Асп∙NH2, Глю∙NH2, Ала, Тре2)—Лиз, 10 — Лиз—Глю—Тре—Ала—Ала—Ала—Лиз, 11 — (Acп∙NH2, Леи, Тре) — Лиз, 12 — Сер-Арг, 15 — (Глю∙NН2, Фен) — Apr.
При регулируемом гидролизе этого фрагмента химотрипсином и пепсином был получен целый набор перекрывающихся пептидов (области перекрывания показаны пунктиром), сопоставление которых позволило установить аминокислотную последовательность в исходном осколке (рис. 12).
Аналогичными приемами была установлена последовательность и для всех других пептидов, получаемых при расщеплении рибонуклеази трипсином. Однако это еще не давало возможности установить порядок чередования аминокислот во всей полипептидной цепи рибонуклеази, ибо оставалось неясным местоположение каждого пептида в самой цепи.
Для решения этой задачи было необходимо заново подвергнуть всю полипептидную цепь рибонуклеази ферментативному гидролизу, но уже с помощью другого фермента. Если вначале использовался трипсин, то далее расщепление проводилось химотрипсином. Полученые в ходе химотриптического гидролиза пептиды выделяли в чистом виде и исследовали па чередование аминокислотных остатков. Цель этой гигантской работы состояла в получении нескольких серий пептидов, частично перекрывающих друг друга. Располагая такими сериями перекрывающихся пептидов, можно определить не только последовательность аминокислотных остатков в отдельных пептидах, но и места «сшивок» самих пептидов в единой полипептидной цепи. Говоря иными словами, удается установить порядок чередования остатков в первичной цепи целого белка. Заметим при этом, что часто приходится прибегать к гидролизу цепи с помощью третьего (пепсин), а иногда и четвертого (папаин) фермента. Именно этим путем была расшифрована первичная структура А- и В-цепей инсулина (рис. 13, 14), рибонуклеазы, цитохрома С и других белков.