Химия белка - Часть 1 - Общая химия белка - Ашмарин И. П 1968
Выделение и очистка белков
Разделение белковых смесей
Хроматография белков на ионообменниках
Уже давно для очистки белков и их разделения применяли методы, основанные на неодинаковом сродстве белков к некоторым адсорбентам. В последнее время это направление получило дальнейшее развитие в адсорбционной хроматографии белков. Примером может служить хроматография белковых смесей на колонках из гидроксилапатита (Са5(РО4)3ОН). Однако наибольшее развитие и практическое применение получила ионообменная хроматография белков, которая и будет здесь рассмотрена.
Метод основан на применении ионообменных полимеров. Они состоят из нерастворимого высокополимерного каркаса и связанных с ним групп, способных к ионизации, — ионогенных групп. Цепочки молекул, входящих в состав каркаса, сшиты друг с другом естественными или искусственными мостиками. Частота сшивки влияет на способность полимера к набуханию и на возможность проникновения различных ионов в глубь частицы полимера. В отличие от сефадексов большинство ионообменных полимеров, применяемых для хроматографии (смолы типа «Дауэкс»), имеют столь частую сшивку, что молекулы белков не проникают внутрь частицы и взаимодействуют лишь с ее поверхностью.
Лишь немногие из известных ионообменников пригодны для хроматографии белков. Лучше всего для этой цели подходят ионообмонники на сефадексной и целлюлозной основе. Типичными примерами последних являются карбоксиметилцеллюлоза (КМ-целлюлоза) и диэтиламиноэтилцеллюлоза (ДЕАЕ-целлюлоза). В первой часть гидроксильных групп целлюлозы заменена на группы —ОСН2СООН, которые после обработки щелочью переходят в солевую форму, например, —ОСН2СООNa. Катион натрия может обмениваться на другие катионы, в том числе и на катионы белковой природы. Поэтому ионообменные полимеры этого типа называют катионообменниками. В ДЕAЕ-целлюлозе часть гидроксильных групп целлюлозы замещена на группы —О—СН2—СН2—N(C2H5)2. Их можно перевести в ОН- или Сl--форму, обрабатывая ионообменник щелочью или кислотой ([—О—СН2—СН2— —HN+(C2H5)2]∙OH- или [—O—СН2—СН2—HN+(C2H5)2]∙Сl-). Анионы гидроксила или хлора могут обмениваться на другие ионы, в том числе и белковой природы. Полимер этого типа — пример анионообменника.
Для фракционирования белков основного характера с небольшими молекулярными весами с успехом применяются и такие катионообменники, как поликарбоксильная ионообменная смола амберлит ИРЦ-50. Смолы этого типа являются сополимерами метакриловой кислоты и вещества, образующего поперечные мостики:
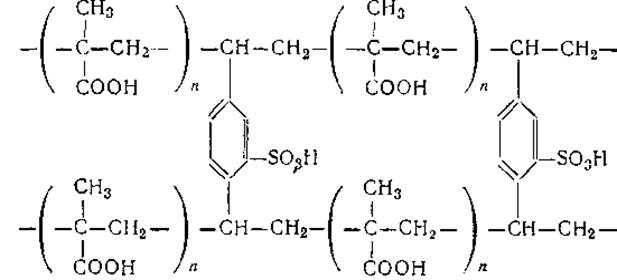
Активной ионогенной группой смол этого типа является группировка SO-3H+, которая может легко обменивать ион водорода на любой другой катион.
Поскольку белки являются амфолитами и могут содержать как положительно, так и отрицательно заряженные боковые группировки, оба типа ионообменников пригодны, в принципе, для их фракционирования. Однако анионообменники более эффективны для разделения кислых и нейтральных белков, ибо последние в широком интервале значений pH относительно богаты отрицательно заряженными группами. Напротив, для разделения основных белков удобнее катионообменники.
Следует иметь в виду, что хотя электростатическое взаимодействие между заряженными группами белка и ионообменника является основным видом сил, действующих при хроматографии, определенное значение имеет также образование водородных связей и Ван-дер-Ваальсово взаимодействие белка л «каркаса» — матрицы ионообменника.
Схема процесса хроматографии белков сводится к следующему. Колонку заполняют гранулированным ионообменником, переведенным в солевую форму и отмытым от примесей избыточной кислоты или щелочи. Забуференный белковый раствор медленно вводят в колонку. Начинается процесс частичного замещения подвижных ионов ионообменника ионами белков. Белки, обладающие большей способностью вытеснять подвижные ионы (Na+, ацетата и др.) и связываться с функциональными группировками полимера, задерживаются в первую очередь. Белки, в меньшей мере способные конкурировать с подвижными ионами, задерживаются позже. Обычно все белки разделяемой смеси фиксируются при этом в верхней части колонки.
Причиной различной способности белков вытеснять подвижные ионы может быть неодинаковое количество и природа заряженных групп в молекулах разных белков, а также влияние общих размеров и конфигурации белковой молекулы на прочность образующихся связей. Таким образом, уже на этой стадии происходит частичное фракционирование белковой смеси. Однако наиболее эффективным этапом разделения является следующая стадия процесса — элюция белков. Элюция достигается обычно введением раствора с высокой концентрацией солей (хлористого натрия, например). Ионы соли вытесняют связанные белки, причем в первую очередь элюируются белки, обладающие меньшим сродством к ионообменнику. В результате начальный эффект разделения белков резко усиливается. Наконец, можно еще больше усилить фракционирование, производя элюцию раствором с постепенно (или ступенчато) нарастающей концентрацией соли (градиентная элюция). Собирая элюат небольшими порциями, можна весьма полно разделить фракции. Для этого широко применяют автоматические приемники элюата.
Элюировать белки можно не только с помощью концентрированных солевых растворов. Изменяя pH элюирующей жидкости, можно изменить соотношения между числами заряженных групп белка и ионообменника так, что взаимодействие будет ослаблено. Этот способ элюции применяют обычно в сочетании с первым.
Как правило, эффективность хроматографического фракционирования белков очень велика. Хорошим примером тому являются результаты разделения пепсина и пепсиногена на ДЭАЭ-целлюлозе, представленные па рис. З (по Л. М Гинодману). Пепсин и пепсиногси — кислые белки, этим определяется выбор именно анионообменпика. Хроматография велась при pH 5,6 в ацетатном буфере. При этом оба белка заряжены отрицательно. Элюция велась раствором с нарастающей концентрацией хлористого натрия. Как видно, достигнуто очень четкое разделение, несмотря на то, что различия между пепсином и пепсиногеном по количеству и характеру полярных групп, молекулярному весу и многим другим свойствам очень незначительны.

Рис. 3 Хроматограмма смеси пепсина и пепсиногена (градиентная элюция) на колонке с ДЭАЭ-целлюлозой (по Гинодману, 1964).
Ионообменная хроматография белков при всех своих достоинствах обладает и серьезными недостатками. Многие белки неполностью элюируются с ионообменника, что ведет иногда к существенным потерям. Ряд лабильных белков денатурируется при взаимодействии с ионообменником, как полагают, в результате взаимодействия углеводородных радикалов с матрицей ионообменника и развертывания пептидных цепей, составляющих белковую молекулу. Поэтому наилучшие результаты дает обычно хроматографическое разделение относительно устойчивых низкомолекулярных белков.