Химия белка - Часть 2 - Избранные разделы частной химии белка - Ашмарин И. П 1968
Склеропротеины
Фиброин
Обычный шелк, вырабатываемый тутовым шелкопрядом Bombyx mori, представляет собой нити кокона, которые состоят более чем наполовину (2/3) из фиброина.* Фиброин — нерастворимый фибриллярный белок, образующий основу обычного шелка, — является самым простым из склеропротеинов. Простота его проявляется и в аминокислотном составе, и во вторичной структуре, и в ограниченности его функций.
Аминокислотный состав, отношение к воде. Около 90% всех аминокислотных остатков фиброина представлены всего лишь четырьмя аминокислотами (см. табл. 1). Почти половина из них приходится на глицин, что и определяет относительно небольшое число боковых групп в полипептидных цепях фиброина. Особенно беден фиброин аминокислотами, боковые группировки которых легко ионизируются. Этим объясняется гидрофобность фиброина, инертность его ко многим воздействиям и наибольшая, по сравнению с другими склеропротеинами, трудность растворения. Только такие специфические агенты, как водный раствор дихлоруксусной кислоты и медные комплексы этилендиамина, оказываются удовлетворительными растворителями фиброина. Растворимость возникает также после обработки его растворами бромида, иодида или тиоцианата лития. Переходящие в раствор молекулы или фрагменты молекул фиброина имеют молекулярный вес около 33 000 или более, в зависимости от метода его растворения.
* Остальная часть нити состоит почти исключительно из серицина — белка, легко удаляемого благодаря растворимости в горячен воде
Элементы первичной структуры. Преобладание остатков глицина, аланина, серина и незначительное содержание основных аминокислот приводит к тому, что фиброин лишь частично гидролизуется и переводится в раствор трипсином. Значительная его часть остается в осадке, что обусловлено наличием пептида, содержащего в своем составе глицин, аланин и серин. Растворимый же остаток содержит все другие аминокислоты, присутствующие в фиброине, а именно: тирозин, валин, лейцин, аргинин, фенилаланин, аспарагиновую и глютаминовую кислоты и пролив. Наличие пептидных фрагментов с периодически повторяющейся последовательностью типа Ала—Гли—Ала—Гли—X—Гли (где X чаще всего соответствует серину) и пептидных фрагментов без такой периодичности легло в основу представления о существовании либо двух компонентов в фиброине, либо двух фаз в его молекуле — кристаллической и аморфной.
Вторичная структура. Рентгенограммы фиброина шелка позволили выявить в его структуре элементарную ячейку, для которой было рассчитано содержание четырех остатков аминокислот; было найдено, что эта ячейка не может вмещать («упаковывать») аминокислоты с относительно большими радикалами. По-видимому, такие радикалы образуют как раз аморфную фазу молекулы, не отраженную в рентгенограмме, что является существенной особенностью вторичной структуры фиброина.
Рентгеноструктурный анализ показал далее, что фиброин состоит из полипептидных цепей (возможно, единственной цепи), которые очень близки к предельно вытянутой ß-конфигурации
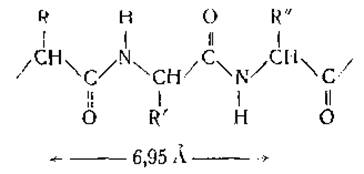
Меридианальные рефлексы позволяют считать период идентичности вдоль оси равным 6,95 Å, т. е. лишь немного меньшим 7,27 Å, предсказываемого теорией для идеальной ß-структуры Анализ инфракрасных спектров подтверждает правильность такого представления о вторичной структуре фиброина, свидетельствуя о перпендикулярном расположении С = О- и X—Н-связей к оси цепочки. Такая структура стабилизируется межцепочечными водородными связями.
Механические свойства. Именно фиброин определяет исключительную прочность шелка на разрыв (около 35 кг/мм2) и относительно небольшую набухаемость его в воде Однако растяжимость шелкового волокна нельзя связать с какими-либо изменениями вторичной структуры его полипептидных цепочек, подобно тому, как это показано для кератина. Рентгенограммы фиброина при растяжении его не меняются. Растяжимость и эластичность связаны с наличием примеси какого-то иного белкового вещества.
Интересно отметить, что один из главных принципов строения фиброина — наличие в пептидных цепях значительных участков, свободных от каких-либо боковых радикалов, — лежит в основе структуры такого, например, синтетического заменителя шелка, как нейлон, продукта полимеризации адипиновой кислоты и гексаметилендиамина:
![]()