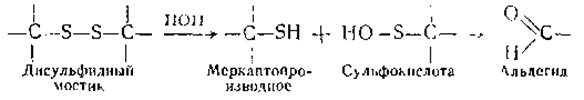Химия белка - Часть 2 - Избранные разделы частной химии белка - Ашмарин И. П 1968
Склеропротеины
Кератины
Кератины образуют основу целого ряда покровных образований — волос, шерсти, перьев, копыт, рогов и чешуи рыб. Они найдены также в яичной скорлупе и нервной ткани. В дальнейшем мы будем рассматривать преимущественно кератины шерсти и волос, как наиболее изученные.
Аминокислотный состав в связи с характерными свойствами кератина. В отличие от фиброина кератин характеризуется полным набором аминокислот, среди которых немало аминокислот с полярными боковыми группами Особенности первичной структуры кератина определяются большим содержанием цистина и цистеина (10—14%), а также пролина и оксипролина (9%) (см табл. 1).
Трудности растворения кератина, его устойчивость, инертность к ряду воздействий (в том числе к действию ряда протеолитических энзимов) нельзя объяснить высоким содержанием аминокислот с неполярными радикалами, т. е так, как это сделано в отношении фиброина У кератина эти свойства определяются относительно высоким содержанием цистеина, за счет SH-групп которого образуются многочисленные поперечные дисульфидные мостики, связывающие полипептидные цепочки Отсюда следуют и соответствующие методы растворения кератина Уже при механическом измельчении шерсти происходит разрыв части дисульфидных мостиков. Ряд химических воздействий помогает с еще большей полнотой осуществить этот же процесс. Широко применяется воздействие таких восстановителей, как сульфиды металлов, тиогликоль и меркаптоэтанол, окислителей — надмуравьиной и надуксусной кислот, а также гидролитических агентов, например растворов карбоната натрия. В практических целях эти воздействия используются для временного или постоянного изменения механических свойств волоса (в частности, при завивке волос) и для удаления волос и шерсти (при выделке кож).
Растворение кератина. Субъединицы. При достаточно полном разрушении дисульфидных мостиков путем химических и механических воздействий кератин становится растворим и подвержен действию протеолитических энзимов.
Переходящие в раствор компоненты кератина неоднородны но составу, хотя и характеризуются примерно одинаковым молекулярным весом — 55 000—75 000. Они представляют собой субъединицы, сохраняющие исходную структуру. После расщепления дисульфидных мостиков окислением получаются частицы, состоящие из цепей с a-конфигурацией, что, по-видимому, свидетельствует об отсутствии денатурации субъединиц при таком способе их получения. Субъединицы могут быть также получены воздействием мочевины. Наличие больших структурных единиц в этой группе белков было доказано электронно-микроскопическими исследованиями и рентгенографическим анализом. Минимальное их число, приходящееся на одну исходную молекулу кератина, можно определить, анализируя соотношение фрагментов, различающихся по N-концевым аминокислотам. Так, на один фрагмент с концевым остатком аспарагиновой кислоты приходится 36 фрагментов с другими N-концевыми аминокислотами. Отсюда минимальный молекулярный вес кератина можно полагать равным 37х55 000 = 2 ∙ 106 (если, разумеется, все эти фрагменты имеют в качестве источника один и тот же белок).
Вторичная и третичная структуры в связи с механическими свойствами. Вторичную структуру полипептидных цепочек кератина можно рассматривать только в связи с различными состояниями кератина, обусловленными воздействием механической нагрузки, влажности и температуры. Волосы и волокна шерсти весьма эластичны, причем их растяжимость возрастает с увеличением влажности и температуры. На этом, как известно, основано устройство волосяных гигрометров. На холоде и при комнатной температуре сухие волокна шерсти растягиваются на 20%, а при высокой влажности и повышении температуры волокно шерсти можно растянуть до 100% и даже более. При снятии нагрузки начальная длина влажного волокна восстанавливается. С увеличением растяжения, его длительности, а также с повышением влажности или температуры возникает так называемое состояние «застывания», которое характеризуется уменьшением скорости сокращения при снятии нагрузки. Наконец, если после растяжения на холоде волокно поместить ненадолго в атмосферу пара, то при снятии нагрузки оно претерпит так называемое сверхсокращение — до 2/3 первоначальной длины. Последнее явление, природа которого мало изучена, используется, например, при некоторых способах завивки волос и образовании складок глажением на изделиях из шерстяной материи.
Как оказалось, трем состояниям шерстяного волокна — естественному, растянутому и сверхсокращенному — соответствуют определенные конфигурации полипептидных цепей кератина.
Обычное исходное состояние характеризуется а-конфигурацией (см. гл. V части I). Об этом свидетельствуют определенные с помощью рентгеноструктурного анализа периоды идентичности вдоль оси цепочки, которые составляют 5,1 Å, и периодичность— 1,5 Å. Эти показатели, так же как и значение экваториального рефлекса 9,8 Å, соответствуют значениям, предсказываемым теорией для а-спирали.
Растянутое состояние характеризуется периодом идентичности вдоль оси, равным 6,7 Å. Оно несколько отличается от значения, предсказываемого теорией для идеальной ß-структуры, — 7,27 Å. Однако различие не столь велико, чтобы предполагать какую-либо иную структуру. Возможно, эти отклонения обусловлены большими, чем в случае фиброина, искажающими влияниями боковых радикалов на идеальную ß-структуру. Высказывается также предположение, что эти данные еще лучше согласуются с гипотетической слоистой структурой, состоящей не из параллельно расположенных, а из антипараллельных ß-цепей, В этом случае иной характер взаимного расположения СО- и NH-гpyпп разных цепей обусловливает несколько иные значения периода идентичности — около 6,5 Å. Наиболее сильный экваториальный рефлекс, характеризующий растянутое состояние, составляет 4,65 Å и удовлетворительно согласуется с теорией.
Изложенные представления о вторичной структуре кератина подтверждаются инфракрасными спектрами: направленность СО- и большинства NH-групп вдоль оси в случае нерастянутого кератина и перпендикулярность к оси в случае растянутого кератина. Кроме того, инфракрасные спектры свидетельствуют об участии КН-групп в образовании водородных связей.
Очень своеобразны результаты рентгеноструктурного анализа сверхсокращенного кератина: появляется сильный меридиональный рефлекс 4,65 Å, подобный экваториальному рефлексу растянутого кератина. По-видимому, это свидетельствует или об образовании складок полипептидных цепей, поперечных оси волокна, или об образовании очень отлогих спиралей большого диаметра. Пока, однако, представления о вторичной структуре сверхсокращенного кератина вызывают разногласия между исследователями.
Три характерных состояния волокна кератина — обратимо растянутое, застывшее и сверхсокращенное — рассматривались и с точки зрения роли поперечных связей, образованных дисульфидными мостиками (—S—S—) между полипептидными цепями. Обратимость обычного процесса растяжения — сокращения кератина говорит о сохранности ковалентных связей, о том, что переход а-конфигурации в ß-конфигурацию возможен без разрыва мостиков —S—S—. Вместе с тем явление застывания (при длительном и интенсивном растяжении, а также длительном воздействии пара) можно объяснить разрушением ранее существовавших связей —S—S— и установлением новых. С этой точки зрения сверхсокращение можно толковать как процесс, возникающий в промежуточном состоянии, когда старые связи —S—S— нарушены, новые еще не установились, а нагрузка уже снята. Однако было бы неосторожным ограничиваться признанием исключительной роли —S—S— или иных ковалентных связей в вышерассмотренных процессах. В них участвуют и водородные связи. Об этом свидетельствуют опыты с мочевиной и другими реагентами, влияющими на водородные связи. Под их влиянием состояние застывания делается частично обратимым. Было также замечено, что при предварительном дезаминировании или блокировании аминогрупп (динитробензолом) способность к застыванию уменьшается. На этом основании было сделано предположение, что в результате гидролиза групп —S—S образуются новые связи между NН2-группами лизина или аргинина с альдегидными группами, возникающими после распада сульфокислоты по реакции