Химия белка - Часть 2 - Избранные разделы частной химии белка - Ашмарин И. П 1968
Склеропротеины
Коллаген
Функции, источники. Коллагены выполняют важные опорно-механические функции, являясь главными белками соединительных тканей и костей млекопитающих. Видимо, белки, родственные коллагену, входят и в состав ряда клеточных мембран.
Характерными свойствами коллагенов являются прочность на разрыв, устойчивость к действию ряда денатурирующих агентов и некоторых протеиназ, способность при длительном нагревании и воздействии щелочей к образованию желатины, высокое содержание оксипролина (см. табл. 1), наличие особенно характерной для него аминокислоты — оксилизина и, наконец, определенная, отличная от всех других белков, периодичность вторичной структуры.
Коллагены соединительных тканей входят обычно в состав сложных надмолекулярных образований. Высшим из них является волокно, состоящее из многих сотен фибрилл, которые в свою очередь формируются из протофибрилл. Последние слагаются из нитевидных молекул так называемого тропоколлагена, повторяющихся по длине протофибриллы и связанных друг с другом концами. Молекула тропоколлагена имеет размеры порядка 15х3000 Å и молекулярный вес около 350 000. Она состоит из трех спиральных полипептидных цепей, скрученных друг с другом в виде шнура вокруг общей оси. Некоторые характеристики элементов структуры коллагенового волокна представлены в табл. 2.
Таблица 2 Структура и примерные характеристики элементов коллагенового волокна
|
Элемент структуры |
Диаметр, Å |
Длина, Å |
Молекулярный вес М 104 |
Из каких более простых элементов состоит |
|
Волокно соединительной ткани |
1000 |
Из фибрилл |
||
|
Фибрилла |
50-100 |
« протофибрилл |
||
|
Протофибрилла |
15 |
« молекул тропоколлагена |
||
|
Троноколлаген |
15 |
3000 |
35-37,5 |
« трех полипептидных цепей |
Аминокислотный состав. Набор аминокислот в коллагене является неполным, в нем отсутствуют цистеин, цистин и триптофан. Подобно фиброину очень велика доля глицина (см. табл.1) — около трети всех аминокислотных остатков; не случайно коллаген является классическим источником глицина. Относительно высокое содержание оксиаминокислот, и особенно пролина и оксипролина (22—29 мол.%), в значительной мере определяет характерные особенности вторичной структуры коллагена. Упоминавшийся выше специфический компонент — оксилизин интересен тем, что появляется в коллагене не в процессе биосинтеза белка, а образуется уже после включения обычного лизина в состав белка. Аналогичные данные появились недавно и в отношении оксипролина. Для коллагена характерно отсутствие N-концевых аминокислот. Очевидно, они либо ацитилированы, либо блокированы углеводами, либо включены в состав каких-то циклопептидных образований.
Растворимость, предшественники. Нерастворимость коллагенов носит менее обязательный характер, нежели у других склеропротеинов. В определенной мере это связано с особенностями их аминокислотного состава. Так, доля аминокислот, лишенных боковых радикалов или с неполярными радикалами, у них существенно меньше, чем у фиброина, хотя но сравнению с другими белками она велика — около 50% (см. табл. 1). Такого «фактора нерастворимости», характерного для кератина, как цистин, коллагены не содержат вовсе. При экстрагировании соединительнотканных волокон холодными растворами нейтральных солей в раствор переходят фрагменты коллагена, являющиеся либо предшественниками зрелого коллагена, либо продуктами его деградации. Далее, с помощью разбавленных растворов лимонной и уксусной кислот можно извлечь еще менее растворимый фрагмент коллагена — проколлаген, который также считают близким предшественником нерастворимого коллагена. Проколлаген отличается от коллагена по аминокислотному составу и расщепляется всеми протеазами. Основная часть соединительнотканного волокна — собственно коллаген (метаколлаген) практически нерастворим в обычных реагентах, так как между составляющими его субъединицами — молекулами тропоколлагена — существуют особенно тесные связи. Очевидно, все эти компоненты волокна соответствуют последовательным этапам биосинтеза наиболее устойчивой к механическим и иным воздействиям формы белка. Об этом говорит, в частности, наибольшая интенсивность обновления аминокислот наиболее растворимой фракции и наименьшая обновляемость аминокислот нерастворимого коллагена. Нерастворимость коллагена неожиданным образом сочетается с очень высокой набухаемостью. По набухаемости он превосходит, например, такой хорошо растворимый белок, как альбумин.
Вторичная и третичная структура. Представления о вторичной и третичной структурах коллагена пока еще не вполне однозначны, несмотря на наличие вполне определенных, хорошо воспроизводимых и строго специфичных для этого белка рентгеноструктурных данных. Наиболее характерен его меридианальный рефлекс 2,86 Å. Попытки дать истолкование такой периодичности структуры основаны преимущественно на высоком содержании в коллагене пролина и оксипролина. Последние вызывают искривление полипептидной цепочки, которое можно объяснить влиянием углеводородного мостика на связь между азотом и а-углеродным атомом и которое отличается от кривизны, характерной для a-структуры. Кроме того, атомы азота остатков пролина и оксипролина не могут участвовать в образовании водородных связей. И по этой причине полипептидные цепочки не способны к образованию как а-спиралей, так и ß-структур обычного типа. Лучше всего ряд свойств коллагена объясняется наличием повторяющихся трипептидов Гли—Про—Про. Кроме того, в состав полипептидных цепочек коллагена входит некоторое количество своеобразно связанных остатков глютаминовой кислоты. Одну из пептидных связей они образуют обычным способом — через аминогруппу, а другую за счет у-карбоксила. Это тоже искажает вторичную структуру. В результате полипептидные цепи коллагена представляют собой весьма растянутые спирали. Наклон их таков, что проекция на ось спирали одного аминокислотного остатка составляет в среднем 2,86 А, т. е. значительно больше таковой для а-спирали (1,5 Å) и существенно меньше, чем в ß-цепи (3,5—3,6 Å). Цепи стабилизируются сложной системой поперечных внутримолекулярных связей, причем образуются трехтяжевые образования. Модель такой структуры представлена на рис. 1.
Три полипептидные цепочки в виде весьма растянутых спиралей располагаются как бы на поверхности цилиндра. Имеются данные, что две из этих цепочек идентичны, а третья несколько отличается по аминокислотному составу. Молекулярный вес каждой из цепочек близок к 115 000 —125 000. Помимо упомянутой системы внутримолекулярных поперечных связей между полипептидными цепочками тропоколлагена существует и система межмолекулярных поперечных связей.
На природе всех этих поперечных связей в коллагене следует остановиться особо. Прежде всего, это межцепочечные водородные связи, образуемые между NH-группой глицина и СО-группой второго остатка пролина упомянутых выше трипептидных последовательностей Гли—Про—Про.
Кроме водородных связей, именно для коллагена характерно наличие необычных для других белков ковалентных поперечных связей. Число их по разным данным варьирует от 6 до 15 на каждую полипептидную цепочку тропоколлагена. Во-первых, к ним относятся сложноэфирные связи, замыкающиеся, по-видимому, между карбоксилами аспарагиновой кислоты и ОН-группами оксипролина или оксилизина. Во-вторых, такие связи образуются через остатки гексоз (глюкозы, галактозы), которые связаны с карбоксилами аминокислот также сложноэфирными связями. Заметим кстати, что именно для коллагена характерно довольно высокое содержание — около 1% гексоз, прочно связанных, неудаляемых при тщательной очистке. В третьих, за счет образования пептидных связей ε-аминокислотными остатками лизина могут возникать разветвления полипептидных цепей в коллагене. Это было доказано выделением пептида ε-глицин-а-глутамил-лизина в условиях неполного гидролиза коллагена.
Наконец, кроме поперечных связей существуют (возможно, не непосредственные) соединения между концами молекул трооколлагена, объединяющие их в длинные протофибриллы. В результате коллаген образует надмолекулярные сетевидные структуры, общее представление о которых дает электронная микрофотография (рис. 2).
Механические свойства коллагена, устойчивость к энзимам.
Все это обусловливает весьма значительную прочность коллагеновых волокон на разрыв, а также незначительную растяжимость — лишь до 7%. Следует отметить также довольно высокую инертность неизмельченных препаратов к ряду химических и энзиматических воздействий. Так, из числа протеолитических энзимов млекопитающих только пепсин расщепляет нативным коллаген. Однако ряд микроорганизмов, способных к развитию в тканях, богатых коллагеном (например, такие анаэробы, как Clostridium perfringens), вырабатывают мощные специфические коллагеназы.
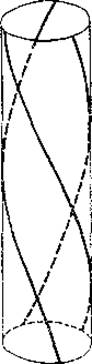
Рис. 1. Модель расположения полипептидных цепей коллагена (Crick а. Rich, 1957).
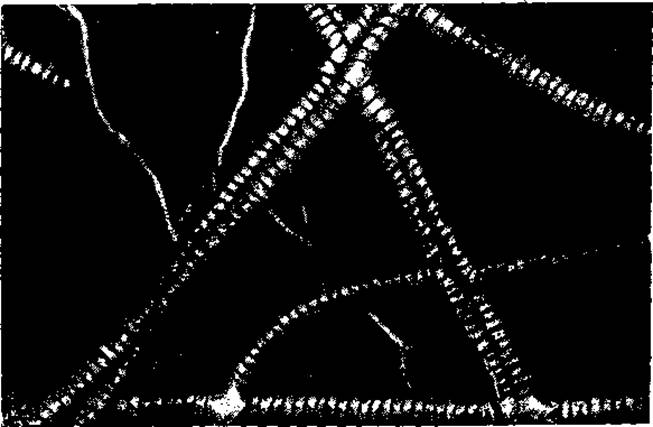
Рис. 2 Электронная микрофотография волокон коллагена (Schmitt a Gross, 1944)
Существенное изменение механических свойств коллагена происходит в результате нагревания при 62—65° С. Волокна сокращаются по длине в 3—4 раза и приобретают каучукоподобную эластичность. Это явление связывают с разрушением при нагревании межцепочечных связей.
Большое практическое значение имеет обратный процесс - формирование дополнительных поперечных связей между полипептидными цепями коллагена. Именно к этому сводятся различные методы дубления кожи, повышающие прочность коллагена, сообщая ему еще большую инертность к самым различным химическим воздействиям и резко снижая его набухаемость. Для дубления используются агенты, образующие поперечные мостики различной природы. Так, формальдегид образует мостики между ε-аминогруппами лизина и гуанидиновыми группами аргинина, ионы хрома связывают электростатические боковые карбоксильные группы разных цепей и, наконец, такие агенты, как таинин, образуют мостики за счет новых водородных связей.
Практическое значение имеет также получение из коллагена клея и более очищенного продукта — желатины Желатина образуется путем длительного нагревания очищенного коллагена (или исходных продуктов — кожи, костей и т. п.) при 60° С с водой или в слабо щелочных растворах. В результате расщепляется значительная часть внутри- и межмолекулярных поперечных связей и небольшая часть пептидных связей, разрушаются амидные группировки, а также часть гуанидиновых группировок (с выделением мочевины) При этом освобождаются отсутствующие у исходного коллагена N-концевые аминокислоты Растворимые фрагменты коллагена, полученные в этих условиях, и называют желатиной. Они имеют средний молекулярный вес около 60 000 с колебаниями от 15 000 до 250 000. Желатина в низких концентрациях (порядка десятых долей процента) образует очень вязкие золи, а уже при концентрации около 1% и температурах 40°С и ниже — гели. Помимо практического применения желатины в пищевой промышленности, фотопромышленности и других областях, она сыграла важную роль в первичных исследованиях состава и структуры коллагена, а также оказалась полезным продуктом во многих аналитических процедурах белковой химии, физической химии и микробиологии.