Химия белка - Часть 2 - Избранные разделы частной химии белка - Ашмарин И. П 1968
Сократительные белки мышечной ткани
Сократительные белки в составе миофибриллы. Их выделение и очистка
Сократительные белки входят в состав миофибрилл — нитевидных образований диаметром 0,5—0,2 мк и длиной 0,01 — 0,1 мм, входящих, в свою очередь, в состав мышечных волокон. В зависимости от типа мышечной ткани миофибриллы различаются по наличию или отсутствию поперечной исчерченности. Скелетные мышцы, составляющие большую часть мускулатуры млекопитающих (так называемой произвольной мускулатуры, обеспечивающей все движения животного и выполнение им физической работы), обладают поперечной исчерченностью. Напротив, гладкие мышцы, входящие в состав таких образований, как стенки желудка, кишечника, кровеносных сосудов и некоторых других внутренних органов, выглядят под микроскопом однородными. Лишь мышца сердца занимает по ряду признаков промежуточное положение и обладает слабо выраженной исчерченностью.
Сократительные белки находятся в миофибрилле в виде полукристаллического геля, сухой остаток которого составляет 15—20%. Большая часть сократительных белков представлена миозином (55—60% от общего количества). За ними следует актин (как правило, 20—25%), и наконец, тропомиозин (4— 30%). Содержание последнего обычно невелико в поперечнополосатых и. напротив, значительно в гладких мышцах. Установлена неравномерность распределения миозина, актина и тропомиозина вдоль миофибриллы. Причина поперечной исчерченности скелетных мышц заключается в том, что эти белковые вещества обладают различными показателями преломления. Оптические свойства волокон мышц подробно изучены методами фазоконтрастной и электронной микроскопии, а также с помощью рентгеноструктурного анализа.
На рис. 3 представлена схема, в которой элементы поперечной исчерченности миофибриллы, наблюдаемые под обычным микроскопом, сопоставлены с данными по локализации сократительных белков. Как видно, миозин большей частью сосредоточен в диске А, обладающем двойным лучепреломлением — анизотропностью. Наиболее четко это свойство выражено в периферических зонах диска А, где миозин находится в сочетании с актином. Извлечение миозина из миофибриллы солевыми растворами ведет к исчезновению анизотропных дисков. Предполагают, что Н-диски состоят только из палочковидных компонентов молекул миозина и не содержат актина. Оптически однородные во всех направлениях І-диски состоят из актина и трономиозина. Последний находится, видимо, и в мембранах Z, которые служат границами повторяющихся структурных элементов миофибриллы, так называемых саркомеров. Длина саркомера — около 2,5 мк, из которых около 1,5 мк приходится на диск А. Природа так называемых мембран М пока неясна.
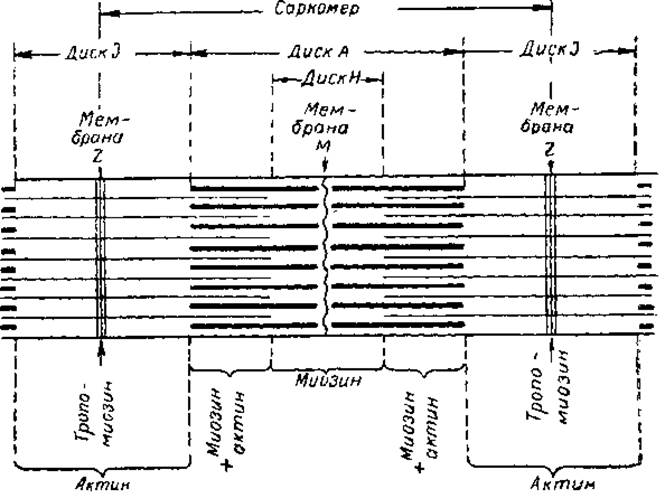
Рис. 3. Элементы поперечной исчерченности миофибриллы и вероятное распространение в ней сократительных белков.
Толстые горизонтальные отрезки — предполагаемое расположение молекул миозина, тонкие — актина.
Прежде чем обратиться к рассмотрению состава, строения и свойств сократительных белков мышц, следует познакомиться с принципиальной схемой их выделения и очистки. Основана она на следующих особенностях растворимости и устойчивости этих белков.
Миозин, а также продукт его взаимодействия с актином — актомиозин, растворимы лишь при относительно высокой ионной силе μ, превышающей 0,3, и при рН>6,5. Эти особенности миозина и актомиозина позволяют удалять при ионной силе, равной 0,1—0,15, легкорастворимые белки, находящиеся преимущественно вне миофибрилл, в так называемой саркоплазме, и составляющие по весу около 25—35% общего белка мышечной ткани.
Растворимость миозина и соответственно быстрота и полнота его извлечения из гомогената мышечной ткани больше, чем у актомиозина. Это обстоятельство создает возможность уже на первой стадии извлечения, ограничив время экстракции из гомогената 10—20 мин и при ионной силе μ 0,5 и pH 6,65—7,0 (0,3 М хлористый калий и 0,15 М калийфосфатный буфер), получить раствор миозина, содержащий незначительные (менее 2%) примеси актомиозина. При этих условиях, однако, миозин извлекается не полностью. Особенно важны различия растворимости миозина и актомиозина при ионной силе, близкой к 0,28, когда удается почти полностью избавиться от примеси актомиозина, выпадающего при этом в осадок.
Для лучшего разделения миозина и актина уже на стадии извлечения рекомендуется учитывать то, что при высоких значениях ионной силы АТФ вызывает диссоциацию актомиозина. Поэтому необходимо тщательное охлаждение исходной ткани и ее гомогената до 0-:-+4° для предотвращения энзиматического расщепления собственной АТФ мышцы. Охлаждение необходимо и на последующих стадиях очистки миозина, так как он особенно подвержен тепловой денатурации. Кроме того, следует принимать меры, чтобы предотвратить преждевременный распад АТФ в мышце еще до извлечения ткани. Надо иметь в виду, что это происходит при судорогах животного в момент его умерщвления. Поэтому умерщвление животного лучше проводить в условиях, исключающих судороги (например, иод наркозом, вызываемым введением хлористого магния).
На заключительных этапах очистки при постепенном снижении ионной силы до 0,05—0,1 миозин, освобожденный от примеси актина, осаждается из концентрированных растворов в виде псевдокристаллов (похожие на кристаллы короткие волоконца, видимые под микроскопом при увеличении около х90).
Если задача исследователя состоит не в разделении миозина и актина, а в извлечении продукта их взаимодействия — актомиозина (так называемого миозина В), то экстракцию гомогената ткани проводят при больших значениях pH = 8,0—8,5 и μ = 0,6—0,7 в течение длительного времени — 24 часов. При этом миозин извлекается полностью, а актин приблизительно на 50% (отношение миозин: актин в извлеченном таким способом актомиозине равно 5:1).
Актин, находящийся в составе мышечной ткани, весьма устойчив к денатурирующему действию такого органического растворителя, как ацетон. При обработке ацетоном гомогената ткани (до или после извлечения миозина), с одной стороны, денатурируется большая часть сопутствующих белков, а с другой стороны, частично извлекаются липидные компоненты, которые в исходной мышечной ткани связывают актин, препятствуя его извлечению. Из обработанного ацетоном и высушенного гомогената актин легко извлекается водой, а затем очищается дополнительно осаждением из водного экстракта в изоэлектрической точке (pH 4,7).

Примечание. Узловые этапы выделены шрифтом.
Тропомиозин характеризуется чрезвычайно высокой устойчивостью к действию этанола и эфира. Это обстоятельство (так же, как устойчивость актина к ацетону) позволяет освободить его от примесей других белков при выделении и очистке. Кроме того, обработка этанолом и эфиром гомогената мышечной ткани необходима для нарушения связей тропомиозина с какими-то компонентами миофибриллы, мешающими его извлечению. После этого возможно полное его извлечение водой или разбавленными солевыми растворами при рН>6,5. Далее тропомиозин легко кристаллизуется из концентрированных растворов при pH 5,8—6,0 и ионной силе 0,37.
Принципиальная схема выделения и очистки миозина, актина, актомиозина и тропомиозина, основанная на перечисленных выше характерных свойствах белков, дана на стр. 20.