Химия белка - Часть 2 - Избранные разделы частной химии белка - Ашмарин И. П 1968
Сократительные белки мышечной ткани
Актин
Актин может существовать в форме мономера — глобулярного актина (G-актина) и в форме полимера — фибриллярного актина (F-актина). G-актин — белок с относительно невысоким молекулярным весом — 56 000—57 000 и довольно асимметричной молекулой размером 290х24 Å. Аминокислотный состав актина не имеет особенностей, заслуживающих специального упоминания; он содержит все известные аминокислоты. G-актин состоит из единственной полипептидной цепочки. N-концевая группа в актине принадлежит аспарагиновой кислоте, причем она ацетилирована. На карбоксильном конце белковой частицы была определена последовательность гистидил—изолейцил—фенилаланин. Вторичная структура актина характеризуется тем, что около 40% составляющих полипептидных цепей находятся в виде а-спирали.
G-актин хорошо растворим в воде. Вязкость его растворов незначительна. В области изоэлектрической точки (pH 4,7) он легко выпадает в осадок. Молекула нативного G-актина содержит обычно одну молекулу АТФ, связанную с ним довольно прочно (АТФ может быть удалена лишь длительным диализом).

Рис. 7. Электронная микрофотография препарата F-актина (Hanson a. Lowey, 1963).
Полимеризация G-актина и F-актин. В присутствии нейтральных солен (в широком интервале концентраций) происходит быстрая полимеризация G-актина, выражающаяся в резком повышении вязкости его растворов, возникновении тиксотропии и значительного двойного лучепреломления в потоке Процесс начинается через несколько минут после введения солеи и завершается уже к 10-й минуте, если условия оптимальны — при наличии 0,1—0,15 М хлористого калия или хлористого натрия; полимеризации способствуют также соли хлористого магния Ионы кальция тормозят полимеризацию, вызванную катионами калия, натрия, магния, хотя в их отсутствие он сам .может вызывать полимеризацию. При полимеризации сначала образуются димеры актина с молекулярным весом 112000—117000 которые затем объединяются в нитевидные полимеры — F-актин с молекулярным весом, равным или превышающим 3∙106.
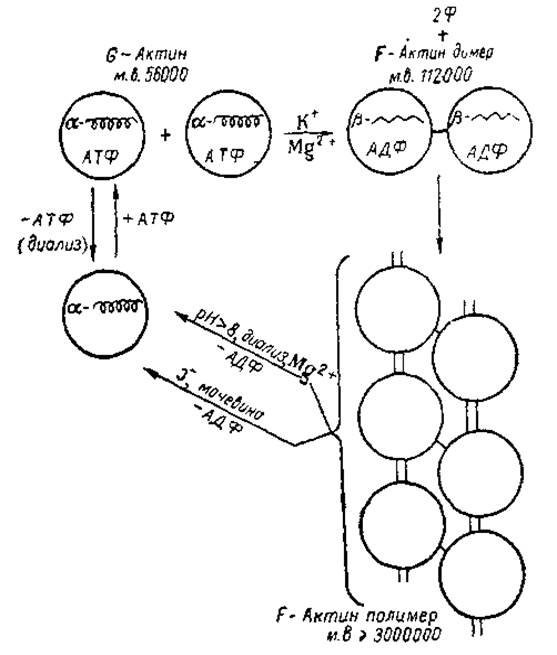
Рис. 8. Схема полимеризации и деполимеризации актина.
Нити F-актина хорошо видимы под электронным микроскопом (рис. 7), толщина их около 80 Å, а длина очень значительна — более 3000 Å и непостоянна. Мономеры в F-актине связываются друг с другом водородными связями, образуемыми между атомами азота полипептидных цепочек, с одной стороны, и SH- и ОН-группами — с другой. Кроме того, при образовании F-актина a-структуры превращаются в ß-структуры. Особого внимания заслуживает тот факт, что при полимеризации АТФ, содержащаяся з нативном G-актине, превращается в АДФ. При этом прочность связи между нуклеотидом и белком возрастает. Из F-актина АДФ не удается полностью отделить даже длительным диализом. Это превращение АТФ не является сопутствующим процессом, оно обязательно для полимеризации. Предварительное удаление АТФ из G-актина делает его не способным к полимеризации. Обратный процесс — деполимеризация F-актина может протекать при добавлении реагентов, разрушающих водородные связи, например, мочевины. Деполимеризация происходит и при добавлении йодистого калия (0,5 М), а также при длительном диализе в слабощелочном растворе в присутствии ионов магния Однако, если при этом не добавляется АТФ, то образуется неполноценный G-актин, не способный, в свою очередь, полимеризоваться. Заметим, что если рассмотреть весь цикл полимеризации и деполимеризации актина, то в конечном счете возвращение к исходному состоянию достигается при расщеплении одной молекулы АТФ до АДФ в расчете на один мономер. В этом процессе не принимает участия какая-либо внешняя АТФ- и актин, следовательно, можно рассматривать как своеобразный энзим (его называют иногда полуферментом). Общая схема взаимных превращений G- и А-актина представлена на рис 8.