Химия белка - Часть 2 - Избранные разделы частной химии белка - Ашмарин И. П 1968
Сократительные белки мышечной ткани
Актомиозин
Важным свойством как миозина, так и актина является их способность взаимодействовать друг с другом с образованием прочного комплексного соединения — актомиозина. При смешивании растворов миозина и актина в 0,35—1,5 М хлористом калии вязкость резко возрастает до значений, существенно превосходящих суммарную вязкость исходных компонентов. Особенно значительно нарастание вязкости в пределах концентраций 0,35— 0,5 М хлористого калия (рис. 9). Зона осаждения при малых концентрациях солей расширяется, охватывая интервал от 0 до 0,25—0,3 М хлористого калия. Характерная для миозина пропорциональность между вязкостью и концентрацией белка сменяется криволинейной зависимостью — вязкость растет быстрее, чем концентрация. Появляется также тиксотропия. Возрастает двойное лучепреломление в потоке. Все это свидетельствует об образовании больших удлиненных молекул, склонных к взаимодействию друг с другом.
Наиболее прочные комплексы миозина и актина образуются при достаточно определенных количественных соотношениях этих белков — от 2,5 : 1 до 3,7 : 1 по весу. При этом на одну молекулу миозина приходится два-три мономера актина. Это соответствует примерно их соотношению в миофибрилле, близкому 3:1.
Гель актомиозина, в отличие от миозина, обладает способностью резко изменять свои свойства при взаимодействии с АТФ. Уже при добавлении АТФ в весьма малых концентрациях (0,5—1,0∙10-4 М) к суспензии актомиозина в 0,02--0,15 М хлористом калии наблюдается быстрое и четко выраженное съеживание, уплотнение частиц суспензии. Полупрозрачные, довольно объемистые, медленно оседающие в исходной суспензии, они становятся непрозрачными, четко контурированными, уменьшаются в размере и быстро оседают после введения АТФ. Явление это называют часто сверхосаждением (суперпреципитацией) актомиозина. Частицы актомиозинового геля при этом претерпевают значительное обезвоживание. Если до введения АТФ они содержат 98% воды и даже более, то после сверхосаждения в них остается не более 50% воды. Легко подсчитать, что при сверхосаждении из геля выжимается не менее 97% воды.
Уже такие сравнительно поверхностные наблюдения над частицами геля актомиозина ведут к невольным аналогиям с явлениями мышечного сокращения. Еще больше ассоциаций такого рода возникает при наблюдениях над актомиозиновыми нитями, получающимися при выдавливании концентрированных растворов актимиозина (1 — 2% по весу) через капилляр (d ≈ 0,2 мм) в раствор 0,05-0,15 М хлористого калия. Молекулы актомиозина располагаются в таких нитях менее беспорядочно, чем в частицах обычной суспензии, — в этом случае преобладает ориентация вдоль оси нити. Если добавить АТФ в раствор, окружающий нить, то через несколько десятков секунд можно наблюдать ее сокращение до трети исходной длины.
Однако несмотря на большее, чем в случае суспензии, сходство сокращения нити и мышцы, можно заметить и ряд существенных отличий. Из них главным является то, что очень трудно наблюдать способность такой нити к осуществлению механической работы. Более того, актомиозиновые нити с подвешенным к ним небольшим грузом под влиянием АТФ не только не сокращаются, но, напротив, растягиваются. Лишь в опытах с нанесением на один из концов нити металлического порошка удавалось выявить их некоторую работоспособность. Очевидно, неполноценность таких актомиозиновых нитей в качестве молекулярной модели элементарного механизма сокращения связана с недостаточной еще ориентированностью молекул актомиозина вдоль оси нити. Для повышения их ориентированности в последнее время была разработана техника получения так называемых пленочных нитей. Они готовятся из тонких пленок актомиозина, нанесенных па поверхность 0,05 М раствора хлористого калия. Нить образуется при сжатии пленки между двумя барьерами. Такая нить при добавлении АТФ оказывается способной к осуществлению довольно значительной механической работы, а именно поднятию груза в 20 мг на высоту до 50% исходной длины нити. Показательно также, что приготовленные тем же методом нити из миозина, свободного от актина, не способны к такому сокращению с поднятием груза.
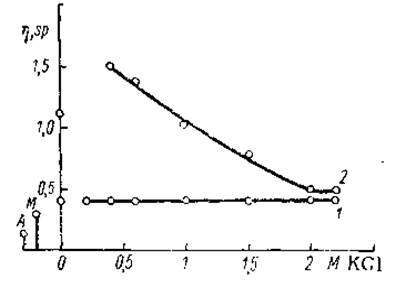
Рис. 9. Зависимость вязкости актомиозина от концентрации хлористого калия (Сцент-Дьерди, 1947).
1 — в присутствии ЛТФ, 2 — без АТФ.
Во всех опытах такого рода присутствие в растворе 0,001 — 0,002 М хлористого магния способствует процессу сверхосаждения и сокращения. Ионы кальция и в этом случае являются антагонистами ионов магния — они подавляют эти процессы. Заметим, что влияние ионов магния и кальция на сокращение актомиозина обратно их действию па АТФ-азную активность миозина. Как указывалось ранее, последняя усиливается под влиянием ионов кальция и подавляется ионами магния. Однако следует особо отметить, что отношение энзиматической активности миозина к влиянию магния претерпевает важные изменения при образовании комплекса с актином. Так, в присутствии малых концентраций хлористого калия (0,01—0,03 М) ион магния не только не подавляет, но даже усиливает АТФ-азную активность актомиозина. Правда, при больших концентрациях хлористого калия (0,1 М) вновь выявляется подавляющее действие ионов магния. В остальном энзиматическая активность актомиозина и миозина не имеет существенных различий.
Весьма своеобразно реагирует актомиозин на добавление АТФ не только к гелям, но и к растворам его в 0,35—2 М хлористом калии. В последнем случае наблюдается быстрое падение вязкости раствора до величин, близких к суммарной вязкости миозина и актина, входящих в состав данного препарата актомиозина. Далее, по мере расщепления АТФ миозином вязкость постепенно возвращается к исходному уровню. По-видимому, это явление объясняется диссоциацией актомиозина па миозин и актин, наступающей в результате связывания АТФ теми же группировками миозина, которые необходимы для взаимодействия с актином и которые представляют собой, по-видимому, специализированные SH-группы.
Сверхосаждение суспензий геля актомиозина, сокращение нитей актомиозина и феномен падения вязкости растворов актомиозина при добавлении АТФ являются характернейшими свойствами актомиозина.
Интимный механизм взаимодействия актомиозина с АТФ, приводящий к вышеописанным эффектам, является пока областью гипотез, подчас противоречивых. Внимание исследователей, естественно, привлек вопрос о том, меняется ли конфигурация и укладка полипептидных цепочек актомиозина при сверхосаждении и сокращении.
Весьма привлекательной представлялась попытка объяснить эти явления переходом растянутой полипептидной цепочки — β-структуры в спиральную a-структуру. Однако рентгенографическое исследование изменений, возникающих в актомиозиновых гелях под действием АТФ, привело к обратному заключению. Вместо характерного для a-структуры меридианального рефлекса 5,1 Å появляется меридианальный рефлекс 4,65 Å, характерный для сверхсокращенного кератина (см. гл. I). Происходит, видимо, переход а-структуры в ß-структуру, причем последняя, кроме того, образует поперечные складки, которые и обусловливают в конечном счете укорочение частицы. Участки полипептидных цепочек в складках связываются водородными связями. Естественно, что такие поперечные складки образуются именно ß-, а не а-структурами, ибо последние обладают большим сопротивлением к изгибу, а большая часть водородных связей в них замыкается не между отдаленными участками полипептидных цепочек, а между близлежащими компонентами. Принципиальная схема таких изменений представлена на рис. 10.
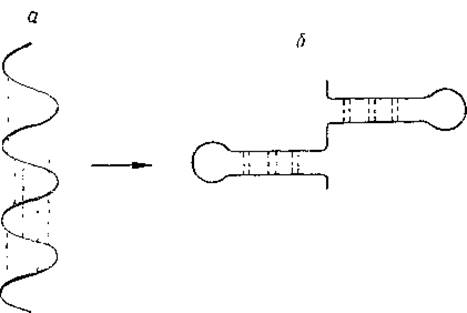
Рис. 10. Схема предполагаемых изменений конфигурации полипептидной цепочки при сокращении актомиозина.
а — а-структура, б — вариант поперечной β-структуры.
Каковы же факторы, которые могут вызывать такие изменения в конфигурации полипептидных цепочек? Особое внимание исследователей привлекают представления об изменении зарядов на различных участках цепи под влиянием АТФ. Так, высказывалось предположение о том, что исходное растянутое состояние актомиозина поддерживается взаимным отталкиванием положительно заряженных боковых радикалов, расположенных вдоль полипептидных цепочек. Вводимая АТФ, напротив, заряжена отрицательно и может нейтрализовать эти заряды, вызывая переход цепочки в складчатую форму. Энзиматическое расщепление АТФ вновь освобождает положительно заряженные группировки, и цепочка возвращается в исходное состояние.
В молекулах актомиозина при физиологических концентрациях ионов водорода, калия, магния и кальция действительно преобладают положительно заряженные группировки. Однако такая гипотеза заставляет считать, что энергия, освобождающаяся при распаде АТФ, используется для растягивания молекулы, т. е. на стадии, уподобляемой расслаблению мышцы. Сокращение же должно осуществляться тогда за счет энергии, аккумулированной предварительно в растянутой молекуле. Имеется ряд указаний на то, что в действительности распад АТФ непосредственно связан с процессом сокращения, а не расслабления. В частности, актомиозин, сократившийся под влиянием малых концентраций АТФ, остается в этом состоянии и после полного расщепления последней. Если бы приведенная выше гипотеза была справедлива, то следовало бы ожидать при этом быстрого самопроизвольного набухания геля и удлинения нитей. Далее, многие факторы, подавляющие АТФ-азную активность (например, снижение температуры, некоторые SH-реагенты и др.), тормозят и процесс сокращения. Правда, влияние ионов кальция и магния не полностью соответствует этому положению, хотя и не отвергает его, так как в условиях, особенно благоприятных для сокращения, при малых концентрациях хлористого калия, ионы магния, как уже упоминалось, усиливают АТФ-азную активность актомиозина.
Рассматривая связь между АТФ-азной активностью миозина и сокращением актомиозина, следует подчеркнуть, что трансформация энергии, заключенной в макроэргических связях АТФ, в энергию сокращения — очень сложный многоэтапный процесс. Расщепление АТФ до АДФ и неорганического фосфата — это лишь конечный, суммарный результат. Имеется немало данных, полученных пока с помощью ряда косвенных методов, о том, что первый результат взаимодействия АТФ с миозином состоит в переносе остатка ортофосфата па одну из функциональных групп белка, опять-таки с образованием новой макроэргической связи, существующей весьма малый промежуток времени. Миозин, таким образом, формируется, образуя так называемый фосфорилмиозин. Химическая энергия, заключенная в этой связи, расходуется для изменения конфигурации полипептидных цепей актомиозина или для изменения взаимного положения компонентов сократительного комплекса. Важно, что при этом миграция энергии происходит в пределах одной молекулы. Одновременно происходит и освобождение неорганического фосфата.
Замечательные превращения актомиозина при реакции с АТФ, охарактеризованные выше, послужили основой для ряда гипотез о механизмах мышечного сокращения. Однако следует подчеркнуть, что. несмотря на соблазнительность прямых аналогий между процессом сокращения мышцы и изменениями актомиозина под действием АТФ, здесь необходима крайняя осторожность. Несомненно, взаимодействие актомиозина с АТФ является определяющей, ключевой реакцией сокращения мышцы. Но между этой реакцией и сокращением мышцы в целом стоит очень сложный механизм, представления о котором рассматриваются в заключительном параграфе настоящей главы.