Основы биохимии - А. А. Анисимов 1986
Ферменты (энзимы)
Множественные молекулярные формы ферментов и изоферменты
Под множественными молекулярными формами ферментов (ММФФ) понимают группу ферментов, выполняющих идентичную каталитическую функцию у одного биологического вида, но отличающихся по структуре и ряду физико-химических свойств. Для разделения ММФФ наиболее часто используют различные варианты метода электрофореза с последующим специфическим выявлением зон, обладающих одинаковой ферментативной активностью. На электрофореграммах зоны активности ММФФ обозначают арабскими цифрами в порядке уменьшения анодной подвижности.
Наличие ММФФ имеет определенное биологическое значение. Показано, например, что при изменении условий существования спектр ММФФ в клетке может меняться, в результате чего организм лучше приспосабливается к внешним условиям. Различные молекулярные формы ферментов играют важную роль в процессе дифференцировки, развития. Таким образом, сдвиги в соотношении ММФФ (их число, активность каждой из форм, стабильность) являются одним из механизмов регуляции обменных процессов.
Первые исследования по выявлению ММФФ выполнены на лактатдегидрогеназе (ЛДГ), катализирующей окислительно-восстановительные превращения лактата в пируват и обратно. При электрофоретическом исследовании этого фермента обнаруживается в большинстве случаев пять фракций (1—5), обладающих ЛДГ-активностью (рис. 3.22). Все пять молекулярных форм обладают почти одинаковой молекулярной массой (М 134 000) и состоят из четырех полипептидных цепей, каждая с относительной молекулярной массой 33 500.
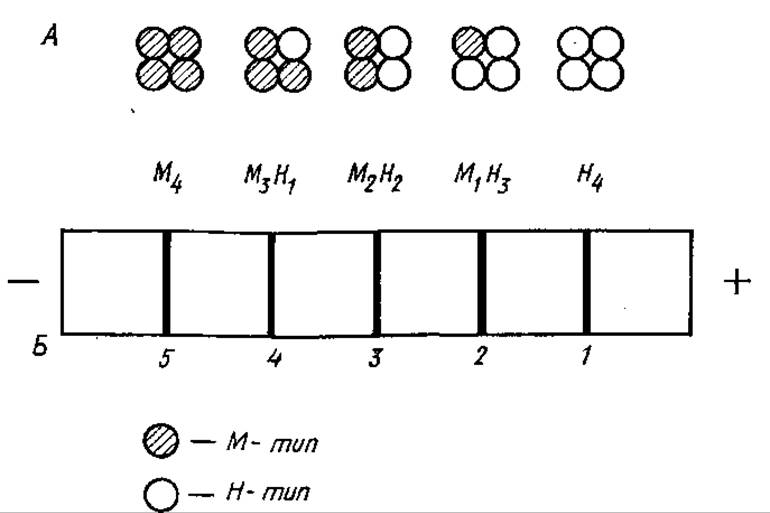
Рис. 3.22. Множественные молекулярные формы лактатдегидрогеназы (Л) и их разделение при электрофорезе (5)
Полипептидные цепи, несмотря на близкие молекулярные массы, неидентичны и могут быть двух типов: М и Н (от англ. muscle— мышца и англ. heart — сердце). Оба типа цепей содержат кофермент НАД(Н+), но отличаются по ряду аминокислот, что и определяет их неодинаковую электрофоретическую подвижность.
М- и Р-типы полипептидных цепей кодируются различными генами. Единичные цепи лишены ферментативной активности, образование тетрамера в результате различной комбинации цепей двух типов дает активный фермент. В мышечной ткани преобладает тетрамер М4, характеризующийся наименьшей анодной подвижностью, в сердечной — Н4, обладающий наибольшей подвижностью, по направлению к аноду. Остальные три ММФ ЛДГ обозначают как М3Н1, М2Н2 и М1Н3. Формы М4 и М3Н1 содержатся преимущественно в тканях, где источником энергии является гликолиз (скелетные мышцы, эмбриональные ткани), a MH3 и Н4 — в тканях, для которых характерен аэробный метаболизм (сердечная мышца).
В настоящее время известно большое число ферментов, представленных в организме несколькими молекулярными формами. Причины, приводящие к появлению ММФФ, могут быть различными, в соответствии с чем Международной комиссией по биохимической номенклатуре разработана классификация молекулярных форм ферментов, среди ММФФ есть как генетически детерминированные, их принято называть изоферментами или изоэнзимами (отличаются друг от друга по первичной структуре), так и формы, возникшие в результате эпигенетических изменений (на посттрансляционйом уровне).
Все ММФФ делят на шесть классов.
1. Генетически независимые белки. Это ферменты, синтезирующиеся на разных генах. У многоклеточных организмов они часто характеризуются различной внутриклеточной, тканевой локализацией: например, пируваткиназа, енолаза, фруктозодифосфат-альдолаза в тканях мышц и печени, малатдегидрогеназа и ряд амино-трансфераз — в митохондриях и цитозоле.
2. Гетерополимеры (гибриды) двух и более полипептидных цепей, связанных нековалентно. Примерами молекулярных форм ферментов этого класса являются ЛДГ, алкогольдегидрогеназа, креатинкиназа.
3. Генетические варианты (аллелозимы). Аллелозимы встречаются у организмов, гетерозиготных по генам, кодирующим данный фермент. В этот класс входят мутантные формы ферментов. Это очень многочисленный класс молекулярных форм ферментов, сюда относятся, например, глюкозо-6-фосфат — дегидрогеназа человека, аденозиндезаминаза и многие другие.
4. Сопряженные или производные белки. К этому классу ММФФ принадлежат формы ферментов, образующиеся в результате ковалентного присоединения или отщепления специфических групп к (от) белку. Такие модификации, как правило» сопровождаются изменениями ферментативной активности и некоторых физико-химических свойств фермента. Модификация может заключаться в фосфорилировании — дефосфорилировании (гликоген-фосфорилаза, гликоген-синтаза, фруктозо-дифосфатаза), аденилировании — деаденилировании (глутамин-синтетаза из Е. coli), окислении сульфгидрильных групп (ксантиноксидаза, липоилдегидрогеназа), гликозилировании (варьирование числа углеводных остатков показано для ß-глюкуронидазы из печени быка, глюкозооксидазы из Penicillium vitale, ДНКазы и РНКазы из поджелудочной железы быка), амидировании остатков асп и глу (неодинаковая степень амидирования обнаружена у щелочной протеазы из Streptomyces rectus), расщеплении пептидных связей протеазами (альдолаза).
5. Олигомеры единственной субъединицы. При наличии у фермента четвертичной структуры различные молекулярные формы могут возникать за счет объединения в четвертичную структуру разного числа одинаковых полипептидных цепей. Так, ß-глюкозидаза активна в виде моно-, ди-, тетра- и октамера. Различная степень олигомерности как причина появления ММФФ была установлена для глутаматдегидрогеназы, холинэстеразы и ряда других ферментов.
6. Конформационно различающиеся формы (конформеры). Конформерами называют белки, отличающиеся по конформации при одной и той же аминокислотной последовательности. Различия в пространственной структуре белка, связанные с числом заряженных групп на поверхности молекулы, приводят к неодинаковой электрофоретической подвижности, к 6-му классу будут относиться и все аллостерически модифицируемые ферменты.
Итак, термин ММФФ может быть использован как наиболее общий для группы ферментов, встречающихся у одного биологического вида и обладающих одинаковой специфичностью действия. Его следует использовать независимо от причины их появления. Термин изофермент, или изоэнзим, применим только к тем ММФФ, появление которых связано с генетически детерминированными различиями в первичной структуре (классы 1—3), а не с теми, которые обусловлены другими причинами при одинаковой первичной структуре (классы 4—6).