Основы биохимии - А. А. Анисимов 1986
Нуклеиновые кислоты
Ферменты синтеза и превращений нуклеиновых кислот
4.6.1. ДНК-полимеразы. В бактериальных клетках содержится несколько ДНК-полимераз. ДНК-полимераза I была открыта первой в экстрактах Е. coli группой А. Корнберга (1956). Этот фермент катализирует полимеризацию нуклеотидов на одноцепочечной матрице. Для синтеза необходима ДНК-затравка (праймер). Полимеризация протекает путем присоединения мононуклеотидов к 3'-ОН- группе ДНК-затравки. Матрица определяет выбор ферментом нуклеотида соответственно правилам комплементарности: А спаривается с Т, Г — с Ц. Рост цепи происходит в направлении 5'→3'. ДНК-полимераза специфически нуждается в 5'-трифосфатах дезоксирибонуклеозидов, 5'-дифосфаты и 5'-монофосфаты неактивны. Неактивны также 5'-трифосфаты рибонуклеозидов. Для реакции требуются ионы Mg2+.
В процессе репликации ДНК синтетическая активность ДНК-полимеразы I играет вспомогательную роль — этот фермент «застраивает» бреши, образующиеся между фрагментами ДНК после удаления РНК-затравок (см. разд. 4.7-2). ДНК-полимераза I выполняет также функцию коррекции, т. е. отщепляет неправильно включенные в ДНК нуклеотиды. В этом случае фермент проявляет 3'→5'-экзонуклеазную активность.
ДНК-полимераза I играет важную роль в репарации, т. е. в устранении повреждений участков ДНК. В отличие от других ДНК-полимераз ДНК-полимераза I может вести синтез ДНК на матрице, имеющей несколько разрывов. Это связано с присущей ей 5'-3'-экзонуклеазной активностью: ДНК-полимераза I проводит отщепление ряда нуклеотидов, увеличивает размер бреши до величины, при которой она может служить «стартовой площадкой» для синтеза.
Важная роль принадлежит ДНК-полимеразе I в вырезании тиминовых димеров, образующихся в результате ультрафиолетового облучения клеток, и в застройке образовавшихся пробелов. Катализируя одновременно включение нуклеотида по 3'-концу и удаление нуклеотида с 5'-конца, ДНК-полимераза I вызывает продвижение однонитевого разрыва вдоль молекулы ДНК. Такое перемещение разрыва или «трансляция ника» (от англ. nick — насечка), по-видимому, происходит и при репарации повреждений, возникающих в результате ультрафиолетового облучения клеток. Таким образом, роль в клетке ДНК-полимеразы I очень велика.
В клетках Е. coli содержится также ДНК-полимераза II. Роль ее сводится к восстановлению повреждений в участках молекулы ДНК. Если в ДНК существует пробел в 2—100 нуклеотидов, то ДНК-полимераза II заполняет его путем встраивания нуклеотидов с 3'-ОН-конца пробела. Если пробел больших размеров, то ДНК- полимераза II не может проводить репарацию, или проводит ее частично. Если в клетке отсутствует ДНК-полимераза I, то ДНК-полимераза II достраивает фрагменты ДНК, образующиеся при репликации ДНК.
В 1972 г. Т. Корнберг и сотрудники выделили из клеток Е. coli ДНК-полимеразу III. Она играет главную роль в репликации ДНК. Как и другие полимеразы, фермент проводит полимеризацию только в 5'-3'-направлении. Матрицей in vitro служит двухцепочечная молекула ДНК, имеющая большое число коротких пробелов и в связи с этим свободных 3'-ОН-концов. Однако активный комплекс ДНК-полимеразы III с двумя специфическими белками в присутствии кополимеразы III работает только на длинной матрице. Активность ДНК-полимеразы III в 15 раз выше, чем ДНК-полимеразы І, и в 300 раз выше, чем ДНК-полимеразы II.
Эукариотические клетки, так же как и клетки Е. coli и других прокариот, содержат несколько ДНК-полимераз. В отличие от прокариотических, эукариотические ДНК-полимеразы не обладают экзонуклеазной активностью, поэтому они не могут выполнять функцию коррекции. Преобладающий фермент называется а-ДНК-полимераза. Особенно часто она встречается в быстро растущих клетках, осуществляет репликацию ядерной ДНК. Второй фермент — ß-ДНК-полимераза — участвует в репарации ядерной ДНК, не встречается у низших эукариот (дрожжи, низшие растения). Третья — у-ДНК-полимераза обнаружена в митохондриях. Она отличается от а- и ß-ферментов по свойствам и, видимо, катализирует репликацию митохондриальной ДНК.
4.6.2. ДНК-зависимая РНК-полимераза. Все типы РНК в клетке — матричная, рибосомная, транспортная — синтезируются на матрице ДНК. Они образуются благодаря действию ДНК-зависимой РНК-полимеразы. Последовательность дезоксирибонуклеотидов цепи ДНК при этом транскрибируется, как бы переписывается буквами другого языка (поэтому сам процесс называется транскрипцией, см. разд. 4.8.1) в последовательность рибонуклеотидов в РНК. В упрощенном виде РНК-полимеразную реакцию можно записать следующим образом:
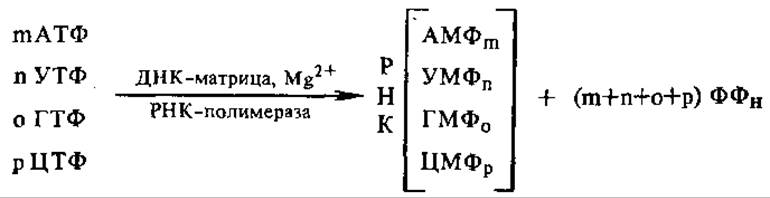
Мононуклеотиды присоединяются по принципу комплементарности один за другим к 3'-гидроксильному концу цепи РНК, цепь растет в направлении 5'→3', нуклеотиды связываются 3'—5'-фосфодиэфирными связями. Для реакции нужны все четыре вида рибонуклеозидтрифосфатов и ионы Mg или Мn. Хотя обычно матрицей служит двухцепочечная ДНК, транскрибируется одна ее цепочка, несущая антикодоновые последовательности, так что образующаяся мРНК содержит кодоны. Обычно копируется только определенный участок ДНК, кодирующий один определенный фермент или группу ферментов.
РНК-полимеразы найдены в животных, растительных и бактериальных клетках. Наиболее хорошо изучена РНК-полимераза у Е. coli и некоторых бактериофагов. У Е. coli РНК-полимераза обладает сложным строением, большой молекулярной массой (М = 480 000). В ее состав входят следующие субъединицы: две а—(39 000), ß—(155 000), ß'—(165 000), а—(95 000). Комплекс, содержащий только a2-, ß-, ß'-субъединицы, называется соr-ферментом (т. е. сердцевина фермента). Он катализирует синтез РНК, но без σ-субъединицы делает это беспорядочно, σ-частицы стабилизируют комплекс фермента с определенными участками ДНК. После присоединения σ к корферменту образуется холофермент.
Кроме транскрипционной РНК-полимеразы у Е. coli существует еще одна РНК-полимераза. Ее функция — синтез коротких РНК- затравок, необходимых для инициации репликации и синтеза фрагментов ДНК (см. разд. 4.7.2). В клетках прокариот обнаружены также мелкие РНК-полимеразы фагов. Они синтезируют мРНК, кодирующие фаговые белки, на матрицах ДНК фагов.
У всех эукариот, от дрожжей до млекопитающих, обнаружена система множественных РНК-полимераз. РНК-полимеразы эукариотических клеток выделены из тимуса теленка, культуры клеток человека, печени крысы и дрожжей. В каждом объекте обнаружено три различных фермента: высокомолекулярные белковые комплексы, содержащие сложный набор субъединиц. Все они являются ядерными ферментами.
РНК-полимераза 1 обнаружена в ядрышке и катализирует синтез рибосомных РНК. Этот фермент существует в двух формах, одна из которых состоит из 5—6 субъединиц, другая содержит на одну субъединицу меньше. РНК-полимераза II присутствует в нуклеоплазме, транскрибирует все гены эукариот, кодирующие белки, а также основные гены вирусов животных. Состоит из пяти субъединиц. РНК-полимераза III также локализована в нуклеоплазме, считается, что она отвечает за синтез 5S РНК и тРНК; состоит из 10 и более субъединиц. Молекулярная масса субъединиц перечисленных РНК-полимераз колеблется в широких границах.
Митохондрии эукариот имеют самостоятельный аппарат для матричного синтеза. Из них выделена самая простая из известных РНК-полимераз — мономер с М≈64 000.
4.6.3. Обратная транскриптаза. Необычное внимание привлекала к себе обратная транскриптаза, или ревертаза, или РНК-зависимая ДНК-полимераза. Она была обнаружена в составе РНК-содержащих онкогенных вирусов саркомы Рауса, птичьего миелобластоза, лейкемии Раушера, в ряде опухолей человека. До ее открытия полагали, что генетическая информация передается только с ДНК на РНК (транскрипция). Этот фермент синтезирует ДНК на РНК, переносит генетическую информацию с РНК на ДНК, в связи с чем получил название обратной транскриптазы или ревертазы. Ревертаза обладает тремя ферментативными активностями.
Первая из них — РНК-зависимая ДНК-полимеразная. Она обеспечивает синтез одноцепочечной комплементарной ДНК (кДНК) по матрице РНК; требует затравки, которой может служить гомо- или гетерополимер длиной от 4 до 200 нуклеотидов, построенный либо из рибо-, либо из дезоксирибонуклеотидов, т. е. обязательно содержащий 3'-ОН-группу.
Вторая активность — ДНК-зависимая ДНК-полимеразная, обеспечивающая синтез второй цепи ДНК (анти- кДНК) и отвечающая за превращение одноцепочечной ДНК в двухцепочечную форму на матрице ДНК. Третья — активность РНКазы Н, гидролизирующей РНК в составе РНК-ДНК-гибрида. Сначала обратная транскриптаза синтезирует на матрице РНК комплементарную цепь ДНК, в результате чего образуется двухцепочечная гибридная молекула РНК-ДНК. Исходная молекула РНК разрушается. На оставшейся цепи ДНК обратная транскриптаза достраивает вторую цепь ДНК, получается двухцепочечная молекула.
Образовавшаяся таким образом двухцепочечная вирусная ДНК может встраиваться в геном (хромосому) клетки-хозяина. В дальнейшем это приводит либо к размножению онкорнавируса (РНК-овый онкогенный вирус), либо к образованию опухоли. Ген, кодирующий синтез обратной транскриптазы, содержится в геноме онкорнавируса.
Изучение свойств обратной транскриптазы показало, что она не обладает избирательностью в отношении матрицы и затравки. Это позволило использовать фермент в генетической инженерии для синтеза генов, для изучения разных участков вирусных геномов, а также числа генов в эукариотических клетках, их первичной структуры, процессинга РНК.
4.6.4. ДНК-лигазы. Единичные разрывы в цепи ДНК устраняются ферментами ДНК-лигазами. Они катализируют образование фосфодиэфирной связи между 3'-ОН и 5'-фосфорилом, между фрагментами ДНК, сближенными на расстояние одного нуклеотидного звена. Синтез происходит сопряженно с расщеплением пирофосфатной связи в НАД+ (E. coli и другие прокариоты) или АТФ (эукариоты). Так образуются ковалентно замкнутые нити ДНК.
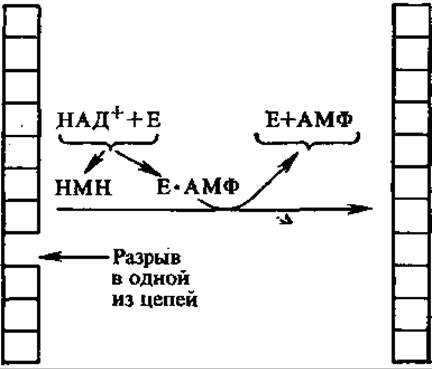
При этом от НАД+ отщепляется НМН (никотинамидмононукле- отид), а от АТФ — Н4Р2О7. Образующийся в обоих случаях АМФ присоединяется сначала к ферменту, а затем к сшиваемому 5'-концу ДНК, активируя его и выделяясь после завершения лигазной реакции. Лигазы играют важную роль в метаболизме нуклеиновых кислот, участвуют в процессах репликации, репарации и рекомбинации. В генетической инженерии лигазы используют для «сшивания» молекул ДНК.
4.6.5. Репликаза. Репликацию РНК РНК-содержащих вирусов проводит РНК-зависимая РНК-полимераза (РНК-репликаза). Образование этого фермента в зараженной вирусом клетке индуцирует вирусная РНК. Репликаза использует нуклеозидтрифосфаты для синтеза одноцепочечной вирусной РНК. На первой стадии синтеза фермент образует на матрице РНК вируса комплементарную РНК с противоположной полярностью (репликативная форма). На второй стадии эта цепь служит матрицей для синтеза множества новых вирусных цепей РНК. Обе стадии синтеза катализируются одним и тем же ферментом, но в каждой из них участвуют различные белковые факторы.
4.6.6. Полинуклеотидфосфорилаза. Полинуклеотидфосфорилаза катализирует синтез РНК из рибонуклеозиддифосфатов: PHKn + НДФ⇄РНКn+1 + Фн. Для синтеза требуется затравочная цепь РНК со свободной 3'-ОН-группой, к которой присоединяются мононуклеотиды. Состав продукта полностью определяется соотношением рибонуклеозиддифосфатов в исходной смеси, что позволяет получить in vitro полимеры с заданным нуклеотидным составом. В связи с этим полинуклеотидфосфорилаза была использована для построения матриц с целью расшифровки генетического кода (см. разд. 5.3.5). Поскольку реакция, катализируемая полинуклеотидфосфорилазой, обратима, считают, что в клетке с ее помощью происходит разрушение короткоживущих мРНК.
4.6.7. ДНК-(цитозин-5)-метилтрансферазы (ДНК-метилазы). Известно, что в ДНК наряду с основными азотистыми основаниями содержатся минорные компоненты — метилированные, глюкозилированные и иным образом модифицированные основания. Они наряду с особенностями первичной структуры обеспечивают видовую специфичность ДНК. Модификация обычных азотистых оснований протекает после того, как цепи ДНК уже построены. Например, метилируются 6-аминогруппа аденина и С-5 цитозина. Метильная группа с S-аденозилметионина переносится на адениновый или цитозиновый остаток в цепи ДНК. Процесс катализирует фермент ДНК-метилаза. Метилирование происходит в строго определенных точках молекулы ДНК, где находятся специфические последовательности нуклеотидов. Метилирование защищает ДНК от расщепляющего действия ДНК-рестрикционных ферментов.
4.6.8. Нуклеазы. Ферменты, расщепляющие фосфодиэфирные связи в молекулах нуклеиновых кислот, называются нуклеазами. Расщепление фосфодиэфирной связи может осуществляться двумя способами: в одном случае образуются продукты, фосфорилированные на 5'-конце, в другом — на 3'-конце. Различают эндонуклеазы и экзонуклеазы. Эндонуклеазы гидролизуют фосфодиэфирные связи внутри молекулы одновременно во многих точках с образованием обломков различной величины. Экзонуклеазы отделяют один нуклеотид за другим от одного из концов полинуклеотидной цепи. В зависимости от специфичности к субстрату нуклеазы делят на две группы: рибонуклеази (РНКазы) и дезоксирибонуклеазы (ДНКазы).
Функции РНКаз в клетке разнообразны. Например, РНКаза I расщепляет РНК разных типов до мононуклеотидов, которые используются впоследствии для синтеза новых РНК. РНКазы II, III IV, Р участвуют в процессинге мРНК, рРНК, тРНК, которые образуются сначала в виде молекул-предшественников. РНКаза специфически расщепляет РНК в ДНК-РНК гибридных комплексах. Она может участвовать в расщеплении РНК-затравок при синтезе ДНК, а также в расщеплении РНК при работе обратной транскриптазы.
Группа ДНКаз также представлена разнообразными ферментами. К эндо-ДНКазам относятся ДНКазы I и II. ДНКаза I выделена из поджелудочной железы, она расщепляет внутренние фосфодиэфирные связи в одной из цепей ДНК с образованием олигонуклеотидов, имеющих фосфорильную группу на 5'-конце. ДНКаза II содержится в селезенке и тимусе. Она катализирует разрывы обеих цепей ДНК, в результате ее действия на ДНК образуются 3'-фосфоолигонуклеотиды. Несколько ДНКаз выделено из бактерий.
Большое внимание исследователей привлекли ДНКазы, расщепляющие ДНК в строго определенных участках, где расположены специфические последовательности нуклеотидов, обычно палиндромные, длиной 4—6 нуклеотидов. Эти ферменты называют рестриктазами (ДHК-рестрикционные ферменты). Рестриктаза и метилаза «узнают» в ДНК одну и ту же последовательность из нескольких нуклеотидов. Рестриктаза расщепляет двухцепочечную ДНК в том случае, если ни в одной из цепей основания узнаваемой последовательности не метилированы.
С помощью рестриктаз бактерии могут разрушать чужеродные ДНК, попавшие в клетку в результате конъюгации или вирусной инфекции. Таким образом, рестриктазы защищают бактериальную клетку от внедрившейся в нее чужеродной ДНК. Чтобы остаться в клетке нерасщепленной, чужеродная ДНК должна быть определенным образом метилированной. Рестриктазы обладают специфичностью к: I) узнаваемой последовательности, 2) месту рестрикции (расщепление), 3) метилированию оснований узнаваемой последовательности.
Название рестриктаз трехбуквенное, его образуют первая буква названия рода микроорганизма-продуцента и первые две буквы названия вида. Если рестриктаза кодируется геном плазмиды или фага, то указывают символ этого нехромосомного элемента, например EcoR. Если штамм содержит несколько рестриктаз, то они обозначаются римскими цифрами: Hind І, Hind II, Hind IIІ. Если несколько штаммов бактерий одного вида содержат разные рестриктазы, то к трем буквам названия добавляют цифровое или буквенное обозначение штамма: Есо В, Есо К.
Рестриктазы делят на три типа. Ферменты І и ІІІ типов обнаруживают две активности: рестрикционную и метилирующую. Оба типа ферментов узнают специфическую неметилированную последовательность нуклеотидов в ДНК. Рестриктазы І типа (например, Есо К, Есо В) характеризуются относительно малой специфичностью к точкам рестрикции. Ферменты III типа (Есо PI, Hind III) «разрезают» ДНК в специфических точках, но не доводят расщепление до конца, так как одновременно с расщеплением катализируют метилирование, препятствующее первому. Ферменты обоих типов обладают большой молекулярной массой (200 000—400000).
Рестриктазы II типа состоят из двух отдельных белков — собственно рестриктазы и метилазы. Эти ферменты «узнают» определенную последовательность в ДНК, которая обычно представляет собой палиндром из 4 или 6 пар нуклеотидов. Рестриктаза, имеющая небольшую молекулярную массу (около 60 000), «разрезает» либо эту последовательность, либо последовательность, расположенную рядом. Например, EcoRІ-эндонуклеаза узнает гексануклеотидную последовательность и разрезает ее в точках, указанных стрелками (звездочками указаны места метилирования) : Участки расщепления представляют собой палиндромы. EcoRІ-эндонуклеаза расщепляет две цепи ДНК в разных точках; поэтому продукты расщепления имеют «липкие» концы.
Эндонуклеаза Hind II (рестриктаза бактерии Hemophilus influenzae) расщепляет ДНК, образуя «тупые» концы, в следующих участках:
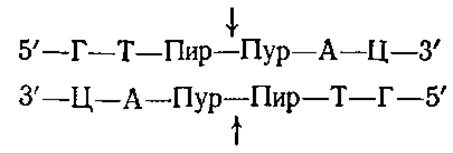
Метилазы модифицируют основания ДНК в этих же специфических участках.
Наиболее отчетливая разница между ферментами I и III типов, с одной стороны, и II типа, с другой, проявляется в природе продуктов расщепления. В результате действия на ДНК рестриктаз типа I образуются гетерогенные продукты, а типа III — продукты неполного расщепления субстрата. Только рестриктазы II типа специфично и полно расщепляют ДНК на фрагменты, соответствующие по длине расстояниям между узнаваемыми последовательностями. Поэтому именно рестриктазы II типа широко используют в генетической инженерии. Поскольку рестриктазы расщепляют цепи ДНК в участках, имеющих строго специфичную последовательность нуклеотидов, их используют в экспериментах по определению первичной структуры ДНК.
4.6.9. Топойзомеразы. ДНК-топоизомеразы — это ферменты, изменяющие число супервитков в кольцевой замкнутой ДНК. Известны топоизомеразы, воздействующие на одноцепочечные и на двухцепочечные молекулы ДНК. Среди них обнаружены ферменты, которые объединяют две или более молекул ДНК в катенаны (зацепленные кольца). Топоизомераза I разрывает одну из цепей кольцевой суперспирализованной ДНК, тогда цепи раскручиваются, уменьшается число супервитков, затем этот же фермент устраняет разрыв.
К этому же классу ферментов относится фермент гираза (топоизомераза ІІ). Гираза превращает расслабленную несверхспирализованную замкнутую кольцевую ДНК в суперспираль, т. е. проявляет действие, противоположное топоизомеразе I. На эту реакцию затрачивается большое количество АТФ. Если вывести из строя гиразу, то в клетке нарушаются самые важные процессы, в частности репликация ДНК.