Основы биохимии - А. А. Анисимов 1986
Нуклеиновые кислоты
Генетическая инженерия
Давней мечтой генетиков и биохимиков было получение живых организмов с заранее известными наследственными свойствами, с определенным обменом веществ. Эту задачу ставит перед собой новое направление в науке — генетическая инженерия. Ее основная цель — получение рекомбинантных молекул ДНК in vitro, их размножение и введение в организм с целью получения новых наследственных свойств. В основе генетической инженерии лежит универсальность свойств генетического материала, что позволяет создавать рекомбинантные молекулы ДНК из молекул ДНК разных организмов, например из клеток бактерий и клеток эукариот, и вводить такие рекомбинантные молекулы в живые клетки. Пока генетическая инженерия делает первые шаги, тем не менее успехи ее поразительны. Она открывает путь для создания в короткие сроки высоко продуктивных промышленных штаммов бактерий, повышения урожайности растений и лечения генетических заболеваний человека. На ее основе разработан ряд проектов, имеющих практическое значение, например включение в клетки сельскохозяйственных растений генов, ответственных за фиксацию атмосферного азота. В этом направлении достигнуты определенные успехи; гены азотфиксирующего оперона бактерий Klebsiella перенесены в клетки Е. coli. Другой проект — введение нормальных генов в клетки людей, страдающих наследственными заболеваниями.
В настоящее время методы генетической инженерии успешно применяют для создания бактериальных штаммов — продуцентов биологически активных соединений, в том числе гормонов (инсулина, соматостатина), противовирусного препарата интерферона. С развитием генетической инженерии стало возможным изучение особенностей структуры и функции генетического материала эукариот.
Для проведения работ по генетической инженерии требуется прежде всего получение определенных фрагментов ДНК, т. е. генов. С этой целью используют ряд методов. Первые гены были синтезированы химическим путем. В 1969 г. группа X. Кораны синтезировала ген аланиновой тРНК дрожжей, в котором была к тому времени полностью расшифрована последовательность из 77 нуклеотидов. Химическим путем синтезировали мелкие фрагменты ДНК (от 4 до 13 пар нуклеотидов), а затем соединяли их в нужном порядке с помощью лигазы. Полученный ген не имел регуляторных участков и был функционально неактивным.
В 1976 г. в той же лаборатории был синтезирован отрезок ДНК кишечной палочки, кодирующий тирозиновую супрессорную тРНК. Ген тРНК состоит из 126 пар нуклеотидов, к нему примыкает на одном конце промоторный участок из 52 пар нуклеотидов, а на другом — терминаторный участок из 21 пары нуклеотидов, к концам отрезка были присоединены тетрануклеотиды ААТТ и ТТАА. Синтетический ген оказался полностью активным. После введения такого гена в мутантный штамм бактериофага Т4, у которого этот ген отсутствовал, бактериофаг хорошо размножался в клетках Е. coli, т. е. становился полноценным.
Группа Г. Бойера синтезировала химическим путем ген гормона соматостатина. Синтез проводили, учитывая последовательность аминокислот в полипептиде. Соответствующие аминокислотам триплеты синтезировали и соединяли химическим путем. Полученную двухспиральную ДНК — ген вводили в геном Е. coli рядом с геном ß-галактозидазы. В результате бактерия стала вырабатывать белок, в котором одна часть была ß-галактозидазой, другая — соматостатином. Эти блестящие результаты показали возможность создания химическим путем генов, не отличимых от природных.
Позднее для синтеза генов стали применять менее трудоемкий и более быстрый метод — синтез при помощи обратной транскриптазы. Изучение этого фермента показало, что матрицей для образования ДНК может служить любая РНК, даже синтетический полирибонуклеотид. Это открыло путь для синтеза разнообразных генов по матричным РНК. Работу начинают с очистки мРНК определенного гена. На мРНК обратная транскриптаза синтезирует ДНК-копию (кДНК).
Этим способом в лабораториях разных стран, в том числе и СССР, синтезированы гены, кодирующие глобины человека, кролика, мыши, белок хрусталика быка, гены вируса осповакцины, некоторых бактериофагов. Однако следует учитывать, что при использовании мРНК в качестве матрицы для синтеза ДНК получается не сам ген, а только его структурная информационная часть, в то же время регуляторные участки, необходимые для работы многих генов, отсутствуют. К тому же гены эукариот устроены сложно, иногда состоят из ряда отдельных участков, расположенных в разных местах генома. Это обусловливает ограниченность использования указанного метода. Поэтому широко используют выделение природных генов из генома. С этой целью ДНК расщепляют, интересующий фрагмент ДНК включают в состав вектора, с помощью которого нужный фрагмент ДНК может быть размножен во многих экземплярах и введен в клетки-реципиенты.
Вектор — это молекула ДНК, способная переносить в клетку чужеродную ДНК любого происхождения и обеспечивать там ее умножение. Широко применяются векторы, способные к автономной репликации. Ими служат умеренные бактериофаги или чаще всего плазмиды. Такие векторы позволяют получать многочисленные копии чужеродного гена. Их используют с целью клонирования, т. е. получения гомогенной популяции молекул ДНК. Гомогенность обусловлена тем, что все молекулы являются прямыми потомками единственной молекулы ДНК.
Включение чужеродного фрагмента ДНК в плазмиду проводят in vitro. Сначала оба объекта переводят в линейную форму. ДНК высшего организма фрагментируют чаще всего с помощью ферментов — рестриктаз. Некоторые рестриктазы образуют фрагменты ДНК с «липкими» концами. Комплементарность оснований в «липких» концах позволяет соединять друг с другом любые фрагменты ДНК, полученные при помощи одной рестриктазы. Это дает возможность включить фрагмент ДНК в вектор. Если фрагмент ДНК имеет «тупые» концы, то с помощью фермента полинуклеотидтрансферазы к ним можно пристроить последовательности адениловых и тимидиловых нуклеотидов. Длина этих «липких» поли (А) и поли (Т) равна 50—100 нуклеотидов, что достаточно для образования гибридных структур двумя разными ДНК.
Вектор «вскрывают» обычно той же рестриктазой, с помощью которой получали фрагмент ДНК. Специально подбирают условия для того, чтобы «вскрыть» вектор только в одном определенном месте. Объединение фрагмента ДНК и вектора производят обычно по «липким» концам, фосфодиэфирную связь между соседними нуклеотидами замыкают при помощи ДНК-лигазы.
Иногда проводят объединение ДНК по «тупым» концам с помощью специального фермента. В ряде случаев с целью соединения молекул ДНК применяют так называемые линкеры и адаптеры — короткие фрагменты ДНК, с одной стороны имеющие конец, полученный при помощи одной рестриктазы, а с другой стороны — другой рестриктазы. Это позволяет соединять фрагменты ДНК; так получается рекомбинантная молекула ДНК. Она содержит полный набор плазмидных генов, необходимых для автономной репликации, и чужеродную ДНК.
В зависимости от задач и целей экспериментов в генетической инженерии используют разные плазмиды, но в большинстве случаев их конструируют in vitro из фрагментов плазмид различного происхождения. Были отобраны такие плазмиды, которые расщепляются определенной рестриктазой только в одном участке и быстро размножаются, давая 1000—3000 копий на клетку. В результате клонирования с помощью этих плазмид получаются специфические фрагменты ДНК высокой чистоты и в больших (миллиграммовых) количествах (рис. 4.22). Полученную рекомбинантную молекулу ДНК вводят в специально обработанные бактерии. Чтобы отобрать бактерии, получившие вектор, последний метят, вводя в него ген антибиотикорезистентности.
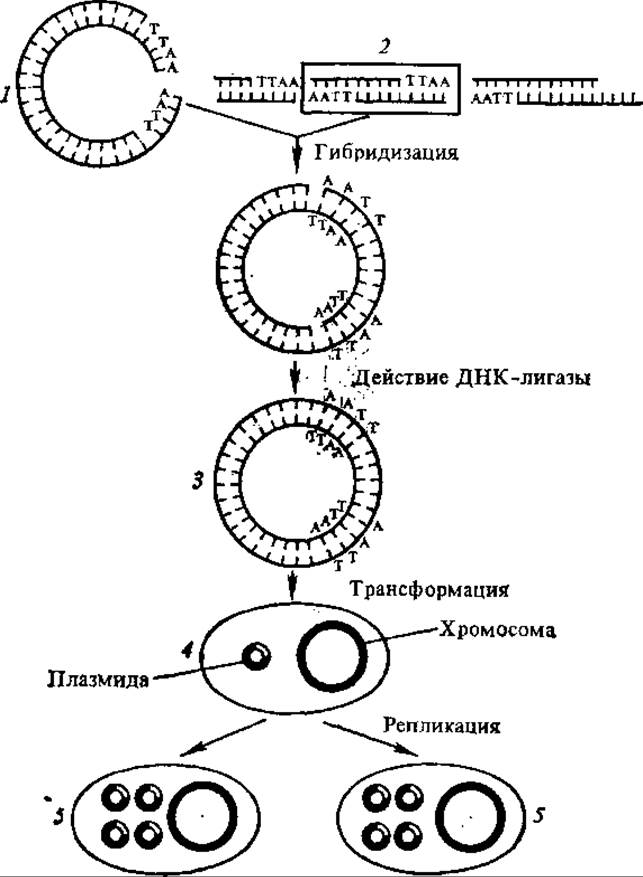
Рис. 4.22. Схема опыта по генетической инженерии (по С. Г. Инге-Вечтомову, 1983):
1 — плазмида, обработанная рестриктазой, 2 — фрагменты ДНК, обработанные той же рестриктазой, 3 — химерная плазмида, 4 — трансформированная бактерия, 5 — трансформированные дочерние клетки
Поскольку выделение и очистка отдельных генов — очень сложная и трудоемкая работа, широкое распространение получил метод «дробового ружья», в котором этот начальный трудоемкий этап отсутствует. Работа начинается с того, что ДНК, содержащую ген, нужный для введения в вектор, механически или рестриктазами дробят на многочисленные фрагменты, их соединяют с молекулами ДНК вектора (например, плазмидами), обработанными рестриктазой для превращения в линейные и для придания им «липких» концов. Образовавшиеся гибридные молекулы вводят в кишечную палочку, и затем отыскивают те бактерии, в которые попал нужный ген. При использовании огромного числа бактериальных клонов, несущих случайные фрагменты ДНК, искомый ген обязательно находится в каком-то клоне. Сначала отбирают те клоны бактерий, в которые попали плазмиды. Если плазмида несет ген устойчивости к какому-либо антибиотику, то бактерии высевают на среду с антибиотиком, и выживают только те, которые получили плазмиду. Затем необходимо идентифицировать интересующий ген.
Легко обнаруживаются гены, кодирующие ферменты, которые участвуют в метаболизме низкомолекулярных веществ. Если ген, введенный в плазмиду, будет работать в клетке хозяина, то на селективной среде выделяются клоны бактерий, получившие плазмиду с данным геном. Однако природные гены высших и низших эукариот очень редко проявляются в Е. coli. Чтобы их обнаружить, нередко используют векторы, устойчивые к двум антибиотикам, например к стрептомицину и ампициллину, и встраивают клонируемый ген в один из генов устойчивости. По потере устойчивости отыскивают клон бактерий, содержащий рекомбинантную плазмиду.
Можно отыскать клон, несущий ДНК изучаемого гена, по способности нуклеиновых кислот к гибридизации. С этой целью нередко используют мРНК, синтезируемую на данном гене. Другой путь — проведение гибридизации с ДНК-пробой, т. е. одноцепочечным фрагментом ДНК, последовательность нуклеотидов в котором мало отличается от последовательности в одной из нитей ДНК клонируемого гена. Поскольку ДНК-проба комплементарна второй цепи, она специфически гибридизируется с искомой ДНК. Если ДНК-пробу пометить радиоактивным изотопом, то клон бактерий, содержащий нужный фрагмент ДНК, можно обнаружить с помощью метода радиоавтографии.
Последний этап в работах по генетической инженерии — адаптация введенного гена в новом для него генетическом и физиологическом окружении и его экспрессия, т. е. синтез специфического белка. При введении ДНК эукариот в геном бактериальной клетки возникает ряд затруднений. Чтобы обеспечить функционирование встроенного гена, в плазмиду включают впереди него «сильный», высокоэффективный промотор. Другой метод, использованный еще X. Кораной, — слияние генов. На границах между генами «вырезают» знаки начала и конца генов. При этом сливаются любые гены, объединяются их продукты. Образованные полипептиды укладываются в третичную структуру, как правило, самостоятельно, и пептидный мостик, объединяющий продукты разных генов, можно расщепить каким-либо способом.
Например, ген, кодирующий гормон пептидной природы — соматостатин, был синтезирован искусственным путем и не содержал регуляторных участков. Чтобы обеспечить его работу в кишечной палочке, его встроили в вектор вместе с хорошо изученным геном Е. coli, кодирующим ß-галактозидазу. Последовательность нуклеотидов синтетического гена транскрибировалась, а затем транслировалась как С-концевой фрагмент ß-галактозидазы. Синтезированный активный соматостатин отделяли от ß-галактозидазы путем расщепления полипептидной цепи специфическим реагентом. Таким образом, регуляторные сигналы гена ß-галактозидазы использовались для работы синтетического гена.
В последние годы предпринимаются попытки использования в генетической инженерии новых векторов. Так, нашли применение рекомбинантные векторы, обеспечивающие интеграцию чужеродного фрагмента ДНК непосредственно в хромосому хозяина. К ним относятся некоторые фрагменты хромосомной ДНК Вас. subtilis, а также фрагмент умеренного фага к, кодирующий синтез интеграционного фермента. При использовании этих векторов сразу появляются трансформированные клетки, что чрезвычайно важно; однако количество этих клеток невелико.
Предпринимают попытки использования эукариотических векторов, построенных на основе онкогенных вирусов. В клетках низших эукариот — дрожжей — обнаружены плазмиды, которые можно использовать как векторы. Использование новых векторов открывает перспективы работы с эукариотическими клетками.
Интересные и большие работы по генетической инженерии проводятся в Советском Союзе под руководством академиков А. А. Баева и Ю. А. Овчинникова. В Институте биоорганической химии АН СССР созданы разновидности бактерий, вырабатывающих ряд гормональных препаратов, завершаются работы по получению высокопродуктивных бактерий, синтезирующих такие важные для медицины вещества, как инсулин и интерферон человека.
Синтез интерферона человека типа a-F штаммами Е. coli, полученными генно-инженерным путем, явился результатом огромной работы, проведенной Ю. А. Овчинниковым и его сотрудниками. Суммарная мРНК интерферона была выделена из лейкоцитов человеческой крови (из 105 клеток лейкоцитов получали 400 мкг мРНК). Эту мРНК использовали в качестве матрицы для обратной транскрипции, возникала однонитевая ДНК длиной 650—900 нуклеотидов.
Вторую цепь ДНК синтезировали с помощью ДНК-полимеразы I, получали двухцепочечную ДНК — ген человеческого лейкоцитарного интерферона. К нему химическим путем присоединяли линкеры, которые позволили встроить его в плазмиду, расщепленную рестриктазой. Плазмиды вводили в клетки Е. coli. Колонии, содержащие плазмиды со встроенной ДНК, были отобраны путем гибридизации с синтетическим олигонуклеотидом, меченным 32Р.
Из 30 000 колоний было отобрано 40. Их подвергали дальнейшему анализу, так как необходимо было выбрать те клоны, в которых находился полный ген. Затем, используя еще ряд методов молекулярной биологии и генетической инженерии, выбрали один клон бактерий, из него выделили рекомбинантную плазмиду, а из нее получили фрагмент ДНК размером 575 нуклеотидов. Секвенирование показало, что структура фрагмента почти полностью совпадала со структурой гена человеческого лейкоцитарного интерферона F.
Чтобы обеспечить экспрессию гена интерферона в клетках Е. coli, его необходимо было снабдить регуляторными элементами транскрипции и трансляции. Регуляторные участки были получены также благодаря использованию ряда методов генетической инженерии (расщепление рестриктазами, клонирование и др.), а затем присоединены к гену интерферона. В результате этой работы был получен ряд рекомбинантных клонов E. coli, содержащих ген IFN—F под контролем различных промоторов. Наиболее эффективным оказался триптофановый промотор. Экстракты из бактерий обладали высокой противовирусной активностью.
Под руководством В. Г. Дебабова впервые в мире создан штамм микроба, синтезирующий в больших количествах незаменимую аминокислоту треонин. Методы генетической инженерии позволили сделать это за три года, тогда как обычными методами новые штаммы получают за несколько десятилетий. Полученный штамм вырабатывает 30 г/л треонина за 1 сутки.
У клубеньковых бактерий способность к азотфиксации определяет геном плазмид (и только частичный контроль—хромосомой), специфичность родства к растению-хозяину — тоже плазмидой. Методами генетической инженерии, для которой плазмиды являются удобным объектом, в последние годы удалось существенно увеличить способность к азотфиксации Rhizobium, вызывать образование клубеньков у сельскохозяйственных растений, которым раньше это не было свойственно.
В 1972 г. ген азотфиксации удалось ввести в Е. coli, а в последние годы начаты работы по генетической инженерии сельскохозяйственных растений с целью ввести им ген азотфиксации. У агробактерий есть онкогенные Ti-плазмиды (Т-ДНК). Они встраиваются в геном хозяина, вызывая раковую опухоль. Из таких опухолей можно регенерировать методом культуры тканей полноценные растения, в геноме которых есть Т-ДНК. Удалось встраивать в Т-ДНК разные специфичные гены, и тогда они обнаруживаются у регенерированных растений. Таким путем сейчас пытаются встроить ген азотфиксации зерновым злакам.
Достигнутые в генетической инженерии успехи дают возможность ученым манипулировать геномами и преодолевать межвидовые барьеры. Это открывает возможность для перемещения генов между организмами, которые до этого практически никогда не вступали в генетический контакт. Однако следует иметь в виду, что манипулирование с некоторыми генами может привести к возникновению опасных организмов с непредсказуемой инфекционностью и экологическими свойствами. Например, можно представить, что штамм Е. coli, несущий плазмиду, в которую вставлен геном патогенного для человека вируса, заселит кишечник человека, что может привести к распространению этого заболевания. В связи с этим в 1975 г. была проведена Международная конференция с целью обсуждения и предотвращения возможных вредных последствий бесконтрольного использования генетической инженерии. Участники конференции пришли к соглашению о том, что опыты по созданию рекомбинантных молекул ДНК должны продолжаться, но необходимо обеспечить биологические и физические барьеры, препятствующие распространению вновь созданных организмов. В частности, в экспериментах определенной категории разрешается использовать и создавать только такие бактерии и плазмиды, которые не способны выживать за пределами лаборатории (погибают при температуре выше +35°С, т. е. в организме человека, и т. п.).