Основы биохимии - А. А. Анисимов 1986
Обмен белков и аминокислот
Синтез белка
5.3.1. Стадии синтеза белка. Биосинтез белка осуществляется в два этапа. 1. Транскрипция — образование матричной РНК на ДНК (см. разд. 4.8.1). 2. Трансляция — биосинтез белка на рибосомах с участием тРНК и мРНК.
Трансляция — это перевод информации, заложенной в последовательности нуклеотидов мРНК, в последовательность аминокислотных остатков полипептидных цепей. В ходе трансляции синтезируются все белки клетки. Сначала происходит активирование аминокислот и присоединение их к соответствующим тРНК. Затем протекает сборка полипептидной цепи на рибосомах, что иногда называют собственно трансляцией. (При этом триплеты мРНК определяют чередование аминокислотных остатков. Как и другие матричные процессы, трансляция протекает в три этапа: инициация, элонгация, терминация.
Система для синтеза белка, т. е. полипептидной цепи с определенной первичной структурой, включает в себя около 200 типов макромолекул. Среди них около 100 молекул участвуют в активировании аминокислот и их переносе на рибосомы, более 60 входят в состав рибосом, около 10 принимают участие в процессах, происходящих на рибосоме. Ниже приведены стадии синтеза полипептидной цепи и требующиеся для них компоненты.
Стадия |
Необходимые компоненты |
Активирование аминокислот |
Аминокислоты Транспортные РНК Аминоацил-тРНК — синтетазы АТФ, Mg2+ |
Инициация синтеза полипептидной цепи |
У прокариот Инициирующий кодон АУГ или (редко) ГУГ Формилметионил-тРНК МРНК, ГТФ, Mg2+ Рибосомные 30S- и 50S-субчастицы Факторы инициации (ІF-l, ІF-2, ІF-З) |
У эукариот Инициирующий кодон АУГ Метионил-тРНК мРНК, ГТФ, Mg2+ |
|
Элонгация |
Рибосомные 40S- и 60S-cyбчастицы Факторы инициации (eІF-2, elF-3, eIF-5) Различные аминоацил-тРНК ГТФ, Mg2+ |
Терминация |
Факторы элонгации У прокариот EF - Т, EF - G У эукариот EF - 1, EF - 2 Терминирующий кодон в мРНК (один из триплетов УАА, УАГ, УГА) |
Факторы терминации У прокариот RF - 1, RF - 2, RF - 3 у эукариот eRF |
Различают цитоплазматические, митохондриальные и пластидные белоксинтезирующие системы. Все они имеют сходную структурно-биохимическую организацию, хотя и содержат большое число модификаций.
5.3.2. Активирование аминокислот. На этой стадии происходит активирование аминокислот за счет энергии АТФ, «узнавание» (рекогниция) тРНК своих аминокислот с помощью специальных ферментов, акцептирование этих аминокислот. Реакции протекают в растворимой части цитоплазмы. Аминокислоты активируются особыми ферментами — аминоацил-тРНК — синтетазами (иногда их называют сокращенно АРСазами) и присоединяются к определенным тРНК.
Каждый из этих ферментов обладает двойной специфичностью: к определенной аминокислоте и к соответствующей ей тРНК. Реакция активирования протекает в каталитическом центре фермента в два этапа. Сначала в результате взаимодействия АТФ и аминокислоты образуется связанный с ферментом промежуточный продукт — аминоациладенилат. СООН-группа аминокислоты связывается ангидридной связью с 5'-фосфатной группой АМФ с выделением пирофосфата, при этом аминоациладенилат приобретает от АТФ часть энергии, необходимой для образования пептидной связи.
Затем во второй реакции происходит перенос аминоацильного остатка на специфическую тРНК. СООН-группа аминокислоты образует сложноэфирную связь с 3'-ОН-группой концевого аденозинового остатка тРНК:
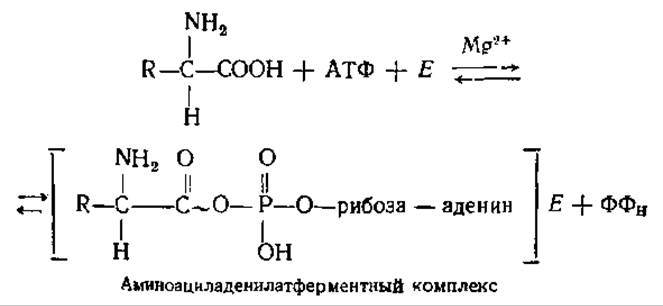
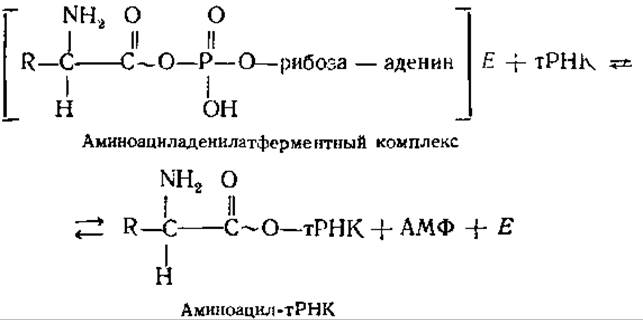
Суммарный итог реакции заключается в этерификации каждой аминокислоты соответствующей молекулой тРНК, т. е. в образовании аминоацил-тРНК. В ходе этого процесса каждая аминокислота активируется и связывается со специфичной для нее «своей» тРНК.
Аминоацил-тРНК — синтетазы по структуре делят на три группы. Некоторые АРСазы состоят из одной полипептидной цепи, например валиновая, изолейциновая и лейциновая (M≈100 000). Вторую группу составляют ферменты, состоящие из одинаковых субъединиц. Например, метиониновая синтетаза состоит из четырех субъединиц с М≈45 000, сериновая — из двух субъединиц с М≈45 000. В третью группу входят АРСазы, содержащие неодинаковые субъединицы, например глициновая, триптофановая, которые состоят из двух разных субъединиц. АРСаза «узнает» только тРНК, специфичные для данной аминокислоты. Этот процесс протекает с высокой точностью, определяя тем самым правильность чередования аминокислот при синтезе полипептидной цепи, т. е. точность всего процесса синтеза белка. В связи с этим В. А. Энгельгардт назвал эти ферменты кодазами, что подчеркивает их роль в реализации генетического кода.
У Е. coli для каждой из 20 аминокислот существует по одной аминоацил-тРНК — синтетазе, но может быть несколько тРНК. В то же время в цитоплазме эукариотических микроорганизмов может присутствовать несколько АРСаз для одной аминокислоты. Например, Neurospora crassa содержит три фенилаланил-тРНК — синтетазы. В гиалоплазме прокариот АРСазы распределены диффузно. У эукариот полный набор ферментов сосредоточен в одном мультиэнзимнэм комплексе.
Нагруженные аминокислотами тРНК далее переносятся к рибосомам, на которых и образуется полипептидная цепочка. Молекулы тРНК при этом играют роль адапторов, т. е. приспособлений, при помощи которых аминокислоты включаются в определенном порядке в растущую полипептидную цепь.
5.3.3. Инициация трансляции. Инициация — это одна из наиболее сложных стадий трансляции. На этой стадии из отдельных компонентов собирается аппарат для синтеза белка и протекают подготовительные реакции.
Организующими центрами процесса трансляции являются рибосомы. Если рибосома не связана с мРНК, она диссоциирует на составляющие ее субъединицы (у прокариот — 30S и 50S, в эукариотических клетках — 40S и 60S). В ходе инициации происходит сборка рибосом.
В процессе трансляции полипептидная цепь начинает строиться с N-конца и завершается С-концом, т. е. имеет направление NH2→СООН. Началом синтеза белка в мРНК является сочетание трех нуклеотидов; АУГ. Если эти нуклеотиды стоят внутри цепи мРНК, то они кодируют аминокислоту метионин. Предполагают, что в некоторых случаях инициирующим кодоном может быть ГУГ (будучи внутренним, он кодирует аминокислоту валин).
В клетках прокариот существуют две метиониновые тРНК. Одна из них — тРНКметф акцептирует остатки аминокислоты метионина и включает их в полипептидные цепи. Вторая — тРНКметф служит для инициации синтеза белков, т. е. является инициаторной. Обе эти тРНК акцептируют аминокислоту метионин, образуя метионил-тРНК. Если метионин соединился с инициаторной транспортной РНК — тРНКметф, то он вступает в реакцию трансформилирования. При этом формильная (формальдегидная) группа переносится от N10-формилтетрагидрофолиевой кислоты на метионил- тРНКметф: N10-формилтетрагидрофолиевая кислота + метионил-тРНКметф→тгетрагидрофолиевая кислота + формил метионил-тРНКметф. Блокирование аминогруппы метионина формильным остатком позволяет этой аминокислоте первой встать в рибосому, начать рост полипептидной цепи. Формилметионил-тРНКметф имеет следующую формулу:
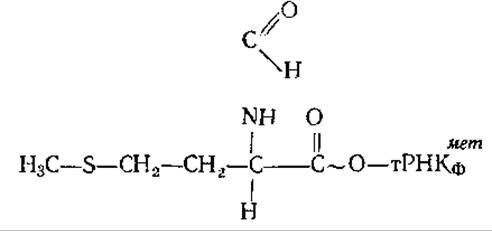
В связи с тем, что формилметионин приходит в рибосому первым, все полипептиды у прокариот начинаются с формилметионина. После окончания синтеза белка формильная группа отщепляется от него ферментом деформилазой, а в ряде случаев отщепляется и метиониновый остаток ферментом пептидазой. Иногда этот фермент отщепляет от вновь образовавшегося полипептида несколько десятков первых аминокислот.
Кроме инициаторной тРНК, мРНК, 30S- и 50S-рибосомных субчастиц для процесса инициации у прокариот необходимы еще ГТФ и три белка. Они не входят обычно в состав рибосомы, называются факторами инициации и обозначаются как IF-1, 1F-2 и IF-3.
Инициация протекает следующим образом. Инициирующий фактор IF-3 соединяется с меньшей 30S-субчастицей рибосомы. Белковый фактор IF-2 соединяется с ГТФ. К комплексу IF-2-ГТФ присоединяется формилметионил-тРНКметф. На второй стадии с образовавшимся комплексом реагирует 30S-субчастица, содержащая IF-3, получается комплекс: 30S-IF-3-ГТФ-IF-2-формилметионил- тРНКметф. К этому комплексу присоединяется мРНК своим 5'-концом при участии инициирующего фактора IF-1 (рис. 5.3). На заключительном этапе присоединяется 50S-субчастица, при этом высвобождаются все три фактора инициации, а также ГДФ и Фн. В результате указанных процессов рибосома «собрана» и готова для синтеза полипептидной цепи.
Важную роль в синтезе белка играют функциональные центры рибосом. В рибосомах находятся полости, в которых специфически связываются молекулы, участвующие в белковом синтезе. За выбор из среды и специфичность связывания аминоацил-тРНК в присутствии матрицы отвечает 30S-субчастица. На ней находятся участки связывания матрицы, кодон-антикодоновых пар и ацилированных тРНК.
Участок связывания ацилированной тРНК ограничивается поверхностями 30S- и 50S-субчастиц рибосом, а также соответствующим кодоном мРНК, вследствие чего участок обладает специфичностью только для определенной молекулы тРНК. Аминоацил-тРНК связывается в A-сайте (аминоацил-тРНК-связывающий участок) 30S-субчастицы. Аминоацил «свешивается» на 50S-субчастицу, замыкающую полость, при этом он поступает в А-(аминоацильный) участок пептидилтрансферазного центра рибосомы, находящегося на 50S-субчастице. Рядом с A-участком на 30S-субчастице располагается Р-(пептидил-тРНК-связывающий) участок (P-сайт), в котором помещается пептидил-тРНК. Пептидил также «свешивается» на 50S-субчастицу, помещается в Р-(пептидильный) участке пептидилтрансферазного центра. На 50S-субчастице обнаружен еще E-участок (от англ. exit — выход), в котором неспецифически связывается деацилированная тРНК в отсутствие матрицы.
В результате инициаторных процессов формилметионил-тРНКметф встает сразу в P-участок. При этом ее антикодон 3'-УАЦ-5' видимо, связан с метиониновым кодоном мРНК 5'-АУГ-3'. А-Участок свободен, в него встает следующий кодон мРНК, этот кодон считывается соответствующей аминоацил-тРНК.
У эукариот инициаторной (первой) также является метионил-тРНК, однако в отличие от таковой прокариот она не формилируется, а реагирует с факторами инициации eIF-5, eIF-2, eIF-3, с 40S- субчастицей рибосом и мРНК. Реакции идут по той же схеме, что и у прокариот.
Синтез пептидов в митохондриях и хлоропластах идет так же, как у прокариот: инициация осуществляется с помощью формил-метионил-тРНКметф.

Рис. 5.3. Инициация белкового синтеза (пояснение см. в тексте): фМет — формилметионин
Так на стадии инициации собирается весь аппарат для синтеза полипептидной цепи. Факторы инициации повторно иопользуютзя для инициации синтеза новых цепей.
5.3.4. Элонгация полипептидной цепи и терминация синтеза. По окончании стадии инициации в P-участке рибосомы находится ини- циаторная формилметионил-тРНКметф. A-Участок свободен, но в нем уже находится следующий кодон мРНК. Вновь поступающая комплементарная очередному кодону аминоацил-тРНК связывается с А-участком. Для этого процесса у бактерий требуются ГТФ и специфический цитоплазматический белок — фактор элонгации EF-T, состоящий из двух субъединиц EF-Tu и EF-Ts. Соответствующий фактор элонгации у эукариот обозначают EF-1. ГТФ гидролизуется на ГДФ и Фн. Каждый раз специфическая тРНК узнается благодаря взаимодействию кодон-антикодон. Предполагают, что при образовании правильной кодон-антикодоновой пары изменяется конформация тРНК. На поверхность ее выходит последовательность ТψЦ, которая образует водородные связи с последовательностью ЦГАА, находящейся в 16S рРНК. Таким образом, аминоацил-тРНК помещается в A-участке рибосомы.
Затем происходит образование пептидной связи. В пептидил-трансферазном центре, располагающемся на 50S-субчастице рибосомы, происходит перенос формилметионинового остатка (или пептидильного остатка в последующих стадиях трансляции) на аминогруппу аминокислотного остатка, расположенного в А-участке (рис. 5.4). В результате взаимодействия аминогруппы вновь поступившей в рибосому аминокислоты с карбоксилом предыдущей аминокислоты образуется пептидная связь. Эта реакция, видимо, протекает по механизму нуклеофильного замещения (вытесняетcя тРНК предыдущей аминокислоты) и катализируется ферментом пептидилтрансферазой, являющимся одним из белков 50S-субчастицы рибосомы.
Так образуется пептидная связь. Затем осуществляется транслокация (передвижение) в рибосоме мРНК на один кодон. Процесс транслокации очень сложен, для него требуются ГТФ, второй фактор элонгации — EF-G (или EF-2 у эукариот), а также энергия гидролиза ГТФ. В результате транслокации мРНК перемещается на один триплет. При этом дипептидил-тРНК поступает в P-участок, а вытесненная инициаторная тРНКметф уходит с рибосомы. В A-участке встает следующий кодон. Цикл повторяется при поступлении следующей аминоацил-тРНК. мРНК передвигается, ее кодоны «переводятся» на «язык» белков. Считывание информации с мРНК идет в направлении 5'→3'. Цикл элонгации повторяется многократно — 100, 200 раз, т. е. столько, сколько аминокислотных остатков входит в состав полипептидной цепи.
Элонгация заканчивается тогда, когда в рибосому на мРНК приходят сигналы окончания синтеза белка. Ими являются один или несколько следующих триплетов УАА, УАГ, УГА. Они называются терминирующими. Наличие их в любом участке мРНК приводит к окончанию белкового синтеза. В терминации участвуют белковые факторы. У Е. coli это белок RF-І, который узнает кодоны УАА и УАГ, и белок RF- 2, который узнает УАА и У ГА кодоны. Белковые факторы терминации присоединяются к терминирующим кодонам и блокируют дальнейшую элонгацию цепи. RF-3-Фактор освобождает полипептидную цепь от последней тРНК при взаимодействии с RF-1 и RF-2. Считают, что терминирующие кодоны и белковые факторы индуцируют пептидилэстеразную активность белков 50S-субчастицы рибосомы, при этом гидролизуется связь между пептидом и тРНК, пептид и тРНК покидают рибосому. В процессе терминации еще одна молекула ГТФ расщепляется на ГДФ и Фн. Терминацию синтеза белка у эукариот обозначают те же самые кодоны, в процессе участвует белковый фактор терминации eRF. Рибосома диссоциирует на субчастицы.
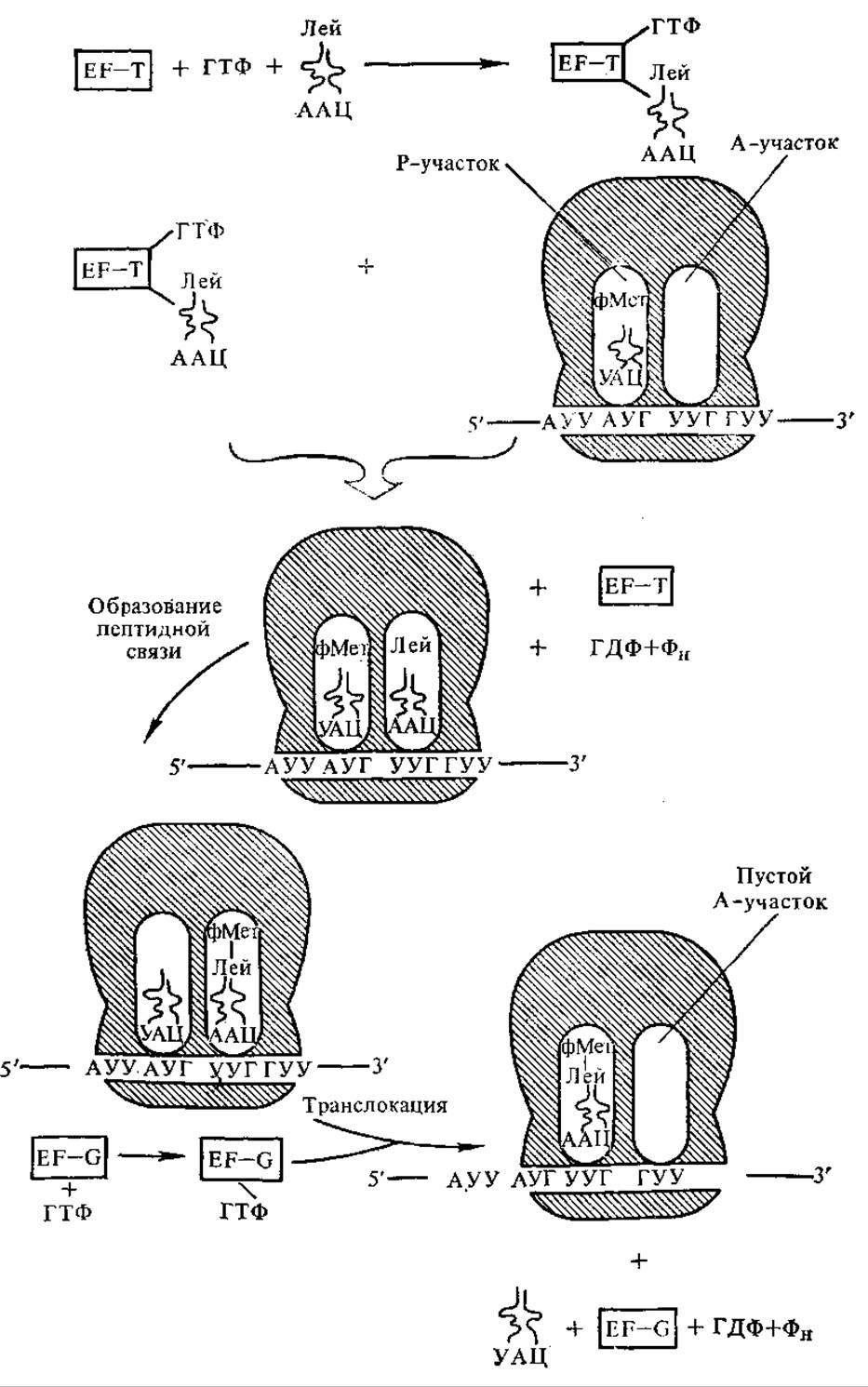
Рис. 5.4. Стадии роста полипетидной цепи (пояснение см. в тексте)
Все освободившиеся компоненты белоксинтезирующей системы (субчастицы рибосом, тРНК, белковые факторы трансляции) используются вновь в очередном цикле. Реакции белкового синтеза протекают по типу конвейера, они синхронизированы, что обеспечивает максимальную скорость и эффективность. Почти всегда на одной молекуле мРНК трансляцию осуществляют несколько рибосом, образуя полирибосомы или полисомы. У бактерий трансляция 5'-конца мРНК нередко идет уже тогда, когда еще не закончен синтез 3'-конца самой мРНК. Скорость роста полипептидной цепи очень велика. У бактерий она достигает 500 аминокислотных остатков в 1 мин, в клетках животных — примерно в 10 раз меньше.
Достаточно большими являются и затраты энергии на образование пептидных связей. Одна молекула АТФ расходуется на активацию каждой аминокислоты и образование аминоацил-тРНК. Вторая молекула макроэрга — ГТФ расходуется для связывания аминоацил-тРНК с рибосомой. Третий эквивалент — также ГТФ — затрачивается на транслокацию на стадии элонгации. Для инициации и терминации на всю синтезируемую молекулу белка требуются дополнительные макроэрги. Таким образом, на синтез одной пептидной связи расходуется несколько более трех эквивалентов АТФ. Энергия пептидной связи составляет около 21 кДж, а на ее образование расходуется энергии свыше 100 кДж. Большие затраты энергии на синтез полипептидов связаны, видимо, с необходимостью строгой упорядоченности, определенной последовательности включения аминокислот.
5.3.5. Генетический код. Исследования показали, что последовательность аминокислот в белке коллинеарна последовательности кодонов в кодирующей ДНК, т. е. последовательность нуклеотидов нуклеиновой кислоты однозначно определяет порядок расположения аминокислотных остатков в полипептидной цепи. В то же время химическая природа мономеров (нуклеотиды и аминокислоты) совершенно различна, так что они не могут непосредственно взаимодействовать друг с другом. К тому же в нуклеиновых кислотах содержится всего 4 нуклеотида, а в белке — 20 аминокислот. Белок можно рассматривать как линейный текст, записанный при помощи алфавита из 20 букв, роль которых играют аминокислоты. Этот текст определяется (кодируется) другим текстом, записанным при помощи алфавита из 4 «букв» молекулы ДНК. Следовательно, для каждой аминокислоты существует свой кодон в молекуле ДНК, т. е. последовательность нуклеотидов, кодирующая аминокислоту.
Простые математические расчеты показывают, что каждая аминокислота кодируется более чем одним нуклеотидом. Если кодон для каждой аминокислоты содержит два нуклеотида, то возможно 42 =16 сочетаний, такого числа кодонов недостаточно для кодирования 20 аминокислот. Если взять комбинации по три нуклеотида, то получается 43 = 64 кодона. Таким образом, триплетный код достаточен для кодирования всех 20 аминокислот, входящих в состав природных белков.
Свойства генетического кода были исследованы экспериментально. Ф. Крик и его сотрудники изучили свойства кода на мутантах бактериофага Т4 Е. coli. При воздействии некоторых химических мутагенов (акридины, фенантрен) единичные нуклеотиды в ДНК бактериофага либо выпадают — делеция, либо встраиваются — инсерция, вставка. Это приводит к синтезу дефектного белка оболочки вируса, так как сдвигается считывание кодонов. Такие мутации получили название мутаций со сдвигом рамки. Например, исходный бактериофаг содержит последовательность, в которой нуклеотиды считываются по три: АВС.АВС.АВС... В результате делеции одного нуклеотида С рамка считывания сдвигается: АВА.ВСА.ВСА...
Если в одном и том же гене происходят две мутации со сдвигом рамки, причем одна из мутаций — вставка, а другая — делеция, то правильное считывание восстанавливается. Если в одном и том же гене произойдут три мутации одного знака (делении или вставки), то после третьей мутации правильное считывание восстанавливается. Эти эксперименты подтвердили, что код белкового синтеза триплетный и что существует точка начала считывания. Считывание осуществляется непрерывно в одном направлении, т. е. код не имеет «запятых».
После доказательства триплетности кода стала возможной расшифровка кода, т. е. определение триплетов, характерных для каждой аминокислоты. Важнейшее значение имели эксперименты М. Ниренберга и И. Маттеи (1961). Эти исследователи разработали метод, позволяющий определять состав кодонов, и впервые определили состав двух кодонов. В их экспериментах полиуридиловую кислоту (РНК-подобный полимер) инкубировали в серии пробирок, содержащих рибосомы Е. coli, 18 видов аминокислот и другие компоненты, необходимые для синтеза белка. В каждой пробирке «меченой» была только одна аминокислота из 18. В этой системе в кислотонерастворимый материал (полипептид) включалась только одна аминокислота — фенилаланин. Образовывался полипептид, построенный из остатков аминокислоты фенилаланина, — полифенилаланин. Следовательно, триплет УУУ кодирует фенилаланин. Вскоре после этого М. Ниренберг и И. Маттеи обнаружили в аналогичных экспериментах, что ЦЦЦ кодирует пролин.
Впоследствии М. Ниренберг, С. Очоа и их сотрудники провели детальные исследования кода, используя полирибонуклеотиды известного состава, синтезированные с помощью фермента полинуклеотидфосфорилазы. К 70-м годам удалось выяснить генетический «словарь» полностью (табл. 5.1).
Генетический код однозначен, т. е. каждый кодон кодирует только одну аминокислоту. Исключение представляют инициаторные кодоны АУГ и ГУГ. В начале трансляции они кодируют включение формилметионина, а находясь внутри цепи, АУГ кодирует метионин, а ГУГ — валин. Вместе с тем генетический код вырожден, т. е. одной аминокислоте соответствует более чем один кодон. Например, для серина существует шесть, для глицина и аланина — по четыре, для многих других аминокислот — по два кодона. Исключение представляют триптофан и метионин, они имеют по одному кодону.
Таблица 5.1. РНК-аминокислотный код
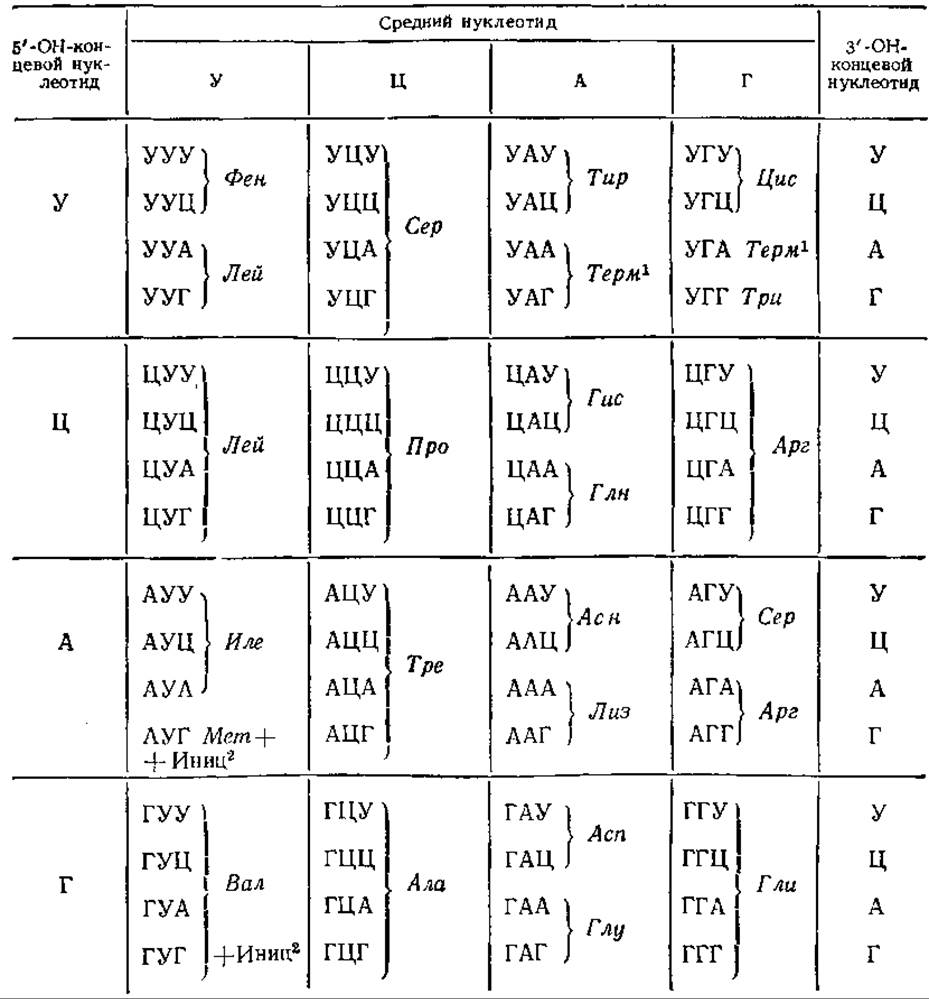
1 Терм — терминирующий кодон.
2 Инид — инициирующий кодон.
Во многих случаях вырожденность кода затрагивает только третий нуклеотид в кодоне, например, в кодонах треонина первые два нуклеотида одинаковы, отличается только третий. Соответственно нескольким триплетам в мРНК для одной аминокислоты существует несколько различных тРНК, отличающихся по антикодонам. В других случаях одна тРНК может транслировать не один, а несколько кодонов. Так, тРНКглиІІІ может транслировать ГГУ и ГГЦ, но не может транслировать два других кодона глицина. С другой стороны, тРНКглиІІ транслирует только кодоны ГГА и ГГГ, а тРНКглиІ — один кодон ГГГ. В том случае, когда одна тРНК может узнавать более чем один кодон, эти кодоны отличаются одним нуклеотидом, стоящим на 3'-конце. Это явление объясняется так называемой гипотезой качаний, согласно которой третий нуклеотид кодона может давать необычные пары, которые лишь приблизительно соответствуют стандартным парам. Например, У спаривается с А или Г, Г — с У или Ц. Таким образом, третий нуклеотид менее существен.
Важным свойством генетического кода является его неперекрываемость, независимость отдельных триплетов. Исключений из этого правила пока известно очень мало. Если бы код был перекрывающимся, то должны существовать определенные сочетания аминокислот, одинаковые во всех белках. Например, аргинину соответствует триплет АГА. Значит, перед ним во всех белках должна стоять аминокислота, кодируемая триплетом с окончанием АГ (лизин или глутамин). Статистика первичной структуры белков говорит о том, что таких универсальных для всех белков сочетаний аминокислот нет.

В 1975 г. сотрудники лаборатории Ф. Сэнгера обнаружили исключение из правила неперекрываемости кода белкового синтеза. Оказалось, что у бактериофага φХ 174 ген D полностью расположен на участке гена Е и составляет 60% протяженности последнего. Разница между ними определяется сдвигом рамки считывания: первая буква в кодоне гена D является последней в кодоне гена Е и т. д. Область гена А считывается трижды: один раз как полный белок А, второй как укороченный белок А с сохранением последовательности, третий — как новый белок В в результате сдвига рамки считывания.
Одно из существенных свойств кода — его универсальность. Код в основном одинаков у организмов, стоящих на разных уровнях развития: у человека, растений, бактерий, вирусов. Вследствие этого рибосомы и молекулы тРНК из Е. coli, например, могут осуществлять трансляцию цепи мРНК, кодирующей синтез гемоглобина, и синтезировать при этом полноценный гемоглобин. Благодаря универсальности кода возможна генетическая инженерия. Универсальность кода свидетельствует о древности его происхождения и консервативности, в результате которой даже при длительной эволюции сохраняются неизменными важнейшие особенности метаболизма. Сходство кода у разных организмов является веским доказательством в пользу того, что все живые организмы произошли от единого предка.
Следует заметить, что большинство аминокислот определяется первыми двумя нуклеотидами в кодоне. Может быть, на самых ранних этапах эволюции только два нуклеотида принимали участие в узнавании, но и тогда, по мнению Ф. Крика, код был уже триплетным, хотя третий нуклеотид был незначащим. Позднее, с появлением новых аминокислот — метионина, тирозина и триптофана, для их кодирования потребовались триплеты. Если это предположение справедливо, то можно говорить о том, что эволюция генетического кода имела место на самых ранних этапах развития жизни на Земле.
Небольшим исключением из правила универсальности кода является код синтеза белков в митохондриях человека и в дрожжевых клетках. Код митохондрий человека похож на «универсальный», только четыре кодона имеют иной смысл: УГА — кодирует триптофан, АУА — метионин, а АГА и АГГ — терминирующие.
Дрожжевые клетки обладают своим генетическим кодом. К тем изменениям, которые существуют в митохондриях человека, добавляется еще одно: все четыре кодона лейцина, начинающиеся с ЦУ, перешли к треонину, так что у лейцина стало два, а у треонина — восемь кодонов. Кодон АУА «вернулся» к изолейцину, как в «универсальном» коде. Особенности кода у некоторых объектов позволяют высказывать предположения об эволюции как разных живых организмов, так и самого кода. Неоднократно высказывалось мнение, что митохондрии — это потомки одноклеточного организма, очень давно вступившего в симбиоз с эукариотической клеткой. В пользу этого предположения говорит и существование у митохондрий особого кода.
Механизмы репликации ДНК, синтеза РНК и белка в основном одинаковы у всех организмов. Эволюция шла не путем изменения основных биосинтетических процессов, а путем образования дополнительных генов для синтеза новых ферментов, новых белков, обладающих иными структурами и функциями. Это и привело к бесконечному разнообразию живых организмов.
5.3.6. Ингибиторы биосинтеза белков. Ингибиторы биосинтеза белков приобретают все большее значение и как инструмент в научных исследованиях, и как средство решения ряда проблем медицины. Эти соединения широко используют в молекулярной биологии благодаря их способности избирательно воздействовать на строго определенные звенья механизма синтеза белков. В то же время многие антибиотики, с большим успехом применяемые в медицине, также относятся к ингибиторам биосинтеза белка. Более того, перспективы развития ряда направлений биологии и медицины, например экспериментальной онкологии, тесно связаны с поисками, изучением и использованием новых ингибиторов биосинтеза белка.
Узкая избирательность действия позволяет классифицировать ингибиторы биосинтеза белка по функциональным признакам (И. П. Ашмарин, 1975): ингибиторы синтеза РНК-полимеразы, транскрипции, трансляции, рекогниции и т. д.
Ингибиторы транскрипции. Наиболее изученным ингибитором этой группы является актиномицин D. Он не только представляет собой сильный бактерицид, но обладает также противоопухолевым действием, хотя не используется в медицине из-за своей большой токсичности и находит применение в биохимических исследованиях. Актиномицин D связывается с двухцепочечной ДНК в участках, содержащих гуанин, внедряется между парами Г : Ц, блокирует действие РНК-полимераз, вследствие чего прекращается синтез всех типов РНК в клетке.
Способностью к интеркаляции — нековалентному встраиванию плоских ароматических колец между парами оснований ДНК обладают некоторые антибиотики и ряд лекарственных препаратов (например, гикантон), бромистый этидий, акридины (хинакрин, акридиноранил, профлавин), а также производные хинолина (например, хлорокин). Хинакрин и хлорокин широко известны как лнтималярийные агенты и иммунодепрессанты.
Непосредственно взаимодействует с РНК-полимеразой, а не с матричной ДНК гликопротеин гепарин. Он предотвращает присоединение фермента к матрице. Рифампицин — ингибитор бактериальной РНК-полимеразы. Он воздействует на ее ß-субъединицу, ингибирует инициацию транскрипции, но не влияет на связывание РНК-полимеразы с ДНК.
Непосредственными ингибиторами РНК-полимеразы на стадиях инициации (а затем и элонгации) являются яды гриба поганки, октапептиды — аманитины. К ингибиторам транскрипции относятся также алкалоиды винкристин и винбластин. Механизм их действия пока недостаточно изучен. Они обладают некоторым противораковым действием не только в эксперименте, но и в лечебной практике.
Ингибиторы трансляции. В настоящее время известны ингибиторы любой реакции, любого этапа трансляции. Так, реакцию присоединения мРНК к 30S- и 40S-субчастицам рибосом подавляет производное трифенилметана — ауринтрикарбоксиловая кислота. Следующую реакцию инициации — присоединение формилметионил-тРНК и ГТФ тормозят алкалоид эдеин А1 и антибиотик косугомицин (последний только у прокариот).
Описано подавление присоединения мРНК к инициирующему комплексу некоторыми алифатическими альдегидами — глицеральдегидом, метилглиоксалем. Последний (и его производные) известен некоторой противовирусной активностью. Заключительные реакции инициации нарушает антибиотик пактамицин.
Целый ряд широко применяемых в исследовательской и лечебной практике веществ ингибирует связывание аминоацил-тРHК при инициации и особенно при элонгации. Достаточно специфично эта реакция подавляется солями — фторидами (0,02 М) и катионами Ni, Zn (0,0001 М).
Блокирование синтеза белка на рибосомах патогенных бактерий лежит в основе действия многих наиболее эффективных антибиотиков. Высокий уровень их эффективности объясняется тем, что эти антибиотики подавляют синтез белка на 70S-рибосомах бактерий — возбудителей болезней и не влияют на 80S-рибосомы организма человека.
К ингибиторам связывания аминоацил-тРНК относится ряд антибиотиков — стрептомицин, неомицин, канамицин. Стрептомицин и родственные ему антибиотики не только подавляют синтез белка, но и вызывают ошибки в считывании генетического кода. За чувствительность бактерий к стрептомицину отвечает один из белков 30S-рибосомной субчастицы. Устойчивость и даже зависимость от стрептомицина возникают в результате мутационных изменений этого белка.
Стрептомицин-30S-комплекс менее эффективно образует инициаторный комплекс, он легко диссоциирует, и процесс трансляции прекращается. В присутствии стрептомицина нарушается связывание аминоацил-тРНК с кодоном в A-участке, что приводит к ошибкам трансляции.
Антибиотик пуромицин — один из наиболее мощных ингибиторов белкового синтеза. Он воздействует на стадии пептидилтрансферазной реакции. Механизм ингибирования связан с тем, что структура пуромицина имеет сходство со структурой концевого остатка АМФ в аминоацил-тРНК. В процессе элонгации полипептидной цепи пуромицин конкурирует с аминоацил-тРНК, встает в рибосому вместо очередной аминоацил-тРНК н принимает на себя растущую полипептидную цепь. Образующийся при этом пептидилпуромицин легко отделяется от рибосомы, поскольку молекула пуромицина невелика и не содержит антикодона. Рост полипептидной цепи прерывается, с рибосомы уходит неполная пептидная цепь, содержащая на С-конце пуромициновый остаток.
Тетрациклин прекращает элонгацию полипептидных цепей. Он блокирует вхождение аминоацил-тРНК в акцепторный участок 30S-субчастицы рибосомы и нарушает контакт фактора EF-T с 50S-субчастицей.
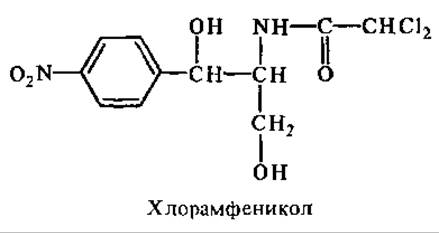
Хлорамфеникол связывается с 50S-субчастицами рибосом и ингибирует синтез белка на 70S-рибосомах клеток прокариот и митохондрий эукариот. Он не влияет на синтез белка на 80S-рибосомах. Подавляет образование пептидной связи, ингибируя пептидилтрансферазную активность рибосом.
Циклогексимид (актидион) ингибирует образование пептидной связи, ингибирует процесс транслокации. В отличие от хлорамфеникола он подавляет синтез белка на 80S-рибосомах эукариотических клеток.
Эритромицин и фусидовая кислота ингибируют транслокацию. Эритромицин связывается с одним из белков 50S-рибосомной субчастицы. Он блокирует стадию транслокации, задерживая пептидил-тРНК в A-участке. Фусидовая кислота — стероид, подавляет реакцию расщепления ГТФ, необходимую для транслокации.
Дифтерийный токсин также специфически ингибирует синтез белков у эукариот. Попадая в клетку, токсин подвергается протеолитическому расщеплению, при этом отделяется фрагмент токсина, который блокирует активность белка EF-2. В результате транслокация не осуществляется, растущая полипептидная цепь остается в Л-участке рибосомы.
5.3.7. Биосинтез олигопептидов. Механизм биосинтеза коротких цепей природных олигопептидов во многих случаях неизвестен. Вряд ли существуют такие короткие мРНК, которые могли бы кодировать синтез коротких пептидов. Более вероятно, что существуют длинные матрицы, в которых сигналы инициации и терминации расположены недалеко друг от друга, и на них синтезируются пептиды. Однако пока не известно ни одного случая такого синтеза.
Существуют сведения о трех других механизмах образования олигопептидов. Первый из них — специфический разрыв пептидных связей в белке, синтезированном при участии всей системы трансляции. Сначала синтезируется длинная полипептидная цепь, затем она разрезается на отдельные полипептиды. Таким способом синтезируются, например, пептидные гормоны гипофиза — вазопрессин и окситоцин, опиоидные пептиды.
Вторым путем пептиды синтезируются без мРНК и рибосом с участием только тРНК. Сначала аминокислота активируется и акцептируется своей тРНК, затем происходит ее перенос с тРНК на свободную NH2-гpyппy уже существующего белка. Например, фермент из печени кролика катализирует перенос аргинина на ряд белков, из которых лучшими акцепторами служат бычий сывороточный альбумин и бычий тиреоглобулин. Этим же способом синтезируются пептидные мостики муреина в стенках бактериальных клеток (см. разд. 6.4.4).
Третий способ — синтез полипептидов при действии специфических ферментов. Порядок чередования аминокислот в полипептидах определяется в этом случае специфичностью ферментов. Пептиды, которые синтезируются этим способом, обладают некоторыми особенностями. В них, как правило, присутствуют необычные аминокислоты. Например, в антибиотике грамицидине — L-орнитин, D-фенилаланин. В трипептиде глутатионе аминокислоты связаны необычной пептидной связью: она образуется между NH2-группой цистеина и у-СООН-группой глутаминовой кислоты.
Значительное число антибиотиков содержит остатки различных аминокислот или их производных. В биосинтезе антибиотиков нуклеиновые кислоты не участвуют, он также протекает под действием специфических ферментов. Так, из бактерий Bacillus brevis, синтезирующих грамицидин S, выделена соответствующая мультиэнзимная система. Для синтеза необходимы АТФ и Mg2+. Сначала аминокислоты активируются, образуя с АТФ аминоациладенилаты, а затем «нанизываются» одна на другую.
Таким образом, механизм синтеза антибиотиков пептидной природы более прост, чем синтез белков в системе трансляции. Предполагают, что именно таким способом могли образовываться полипептиды в пребиотический период.