Основы биохимии - А. А. Анисимов 1986
Обмен белков и аминокислот
Регуляция биосинтеза белка
В живых организмах происходит избирательный синтез белков, различные белки образуются с неодинаковой скоростью. Например, у Е. coli содержание одних белков не превышает 10 молекул на клетку, у других достигает 500 тыс.; наиболее велико количество рибосомных белков. Соматические клетки всех тканей и органов многоклеточного организма имеют одинаковую генетическую информацию, но отличаются друг от друга по содержанию тех или иных белков. Так, для клеток эритроцитов характерно высокое содержание гемоглобина, кожи — коллагена, клетки поджелудочной железы вырабатывают много ферментативных белков. В отдельных клетках, тканях и органах содержание разных белков меняется с возрастом, с фазой развития. Все это свидетельствует о том, что в живых организмах существуют механизмы регуляции скорости белкового синтеза. Они функционируют под действием внутренних и внешних факторов на каждой из стадий сложного процесса синтеза белка. Количество белка может изменяться в результате специфического увеличения числа некоторых генов, регуляций на стадии транскрипции, процессинга мРНК. Скорость белкового синтеза определяется и временем жизни мРНК, регуляцией синтеза на уровне трансляции, посттрансляционной модификации белков.
У прокариотических организмов механизмы регуляции белкового синтеза наиболее хорошо изучены на стадии транскрипции. На этой стадии происходит, в частности, регуляция синтеза индуцибельных ферментов у бактерий, т. е. таких ферментов, количество которых резко возрастает при добавлении в питательную среду субстрата этих- ферментов (индуктора). Например, у Е. coli усиленный синтез ферментов метаболизма лактозы происходит только на среде с лактозой, когда она является единственным источником углерода и энергии. В ее отсутствие содержание этих ферментов в клетках очень мало. Индукция их синтеза у Е. coli подробно исследована Ф. Жакобом и Ж. Моно. Синтез этих ферментов происходит на лактозном опероне (lас-оперон).
Лактозный оперон E. coli объединяет три структурных цистрона, кодирующих три фермента: галактозидпермеазу, ß-галактозидазу и тиогалактозид-ацетилтрансферазу. Фермент галактозидпермеаза участвует в переносе лактозы через мембрану внутрь клетки; ß-галактозидаза непосредственно осуществляет расщепление лактозы на глюкозу и галактозу; роль тиогалактозид-ацетилтрансферазы пока исследована недостаточно. В настоящее время известна полностью первичная структура lас-оперона Е. coli, число и порядок чередования нуклеотидных пар в каждом функциональном его участке.
Один из видов контроля синтеза ферментов lас-оперона на генетическом уровне осуществляется при участии регуляторного белка-репрессора, структура которого закодирована в гене-регуляторе (рис. 5.5), не входящем в состав оперона. В отсутствие лактозы lас-оперон не транскрибируется, так как оператор блокирован за счет присоединения к нему репрессора, препятствующего специфическому присоединению РНК-полимеразы к промотору и продвижению РНК-полимеразы по ДНК. В связи с этим структурные цистроны lac-оперона и других оперонов, находящиеся под контролем одной и той же регуляторной зоны, включаются в трансляцию я выключаются одновременно.
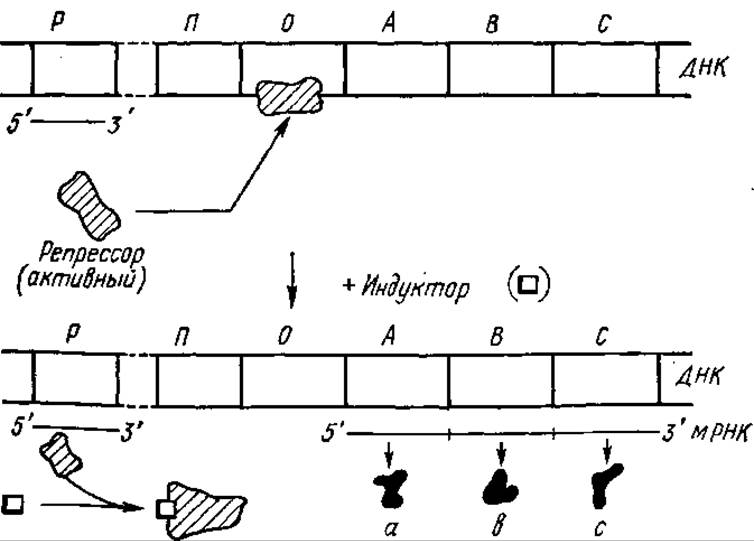
Рис. 5.5. Индукция синтеза ферментов метаболизма лактозы:
Р — ген-регулятор, П — промотор, О — оператор, A, В, С — структурные цистроны lac-оперона, а, b, с — ферменты, кодируемые структурными цистронами
Репрессор lac-оперона находится в связанном с ДНК состоянии, пока не вступит во взаимодействие с индуктором — лактозой.
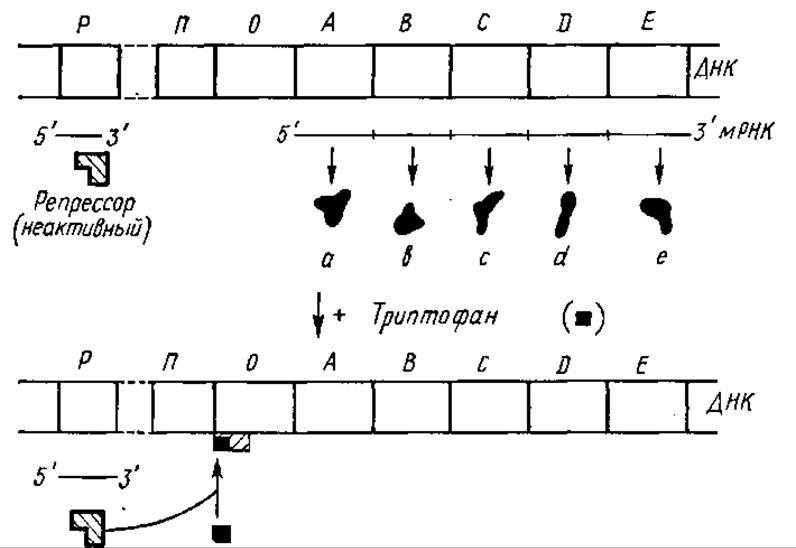
Рис. 5.6. Репрессия конечным продуктом триптофанового оперона:
А, В, С, D, Е - структурные цистроны триптофанового оперона; остальные обозначения те же, что на рис. 5.5
Лактоза связывается с белком-репрессором, меняет его конформацию, в результате чего он становится неспособным присоединяться к оператору. При таком состоянии оператора происходят транскрипция, трансляция, синтез ферментов катаболизма лактозы. При участии репрессора, образующегося изначально в активной, т. е. способной связываться с оператором, форме, и индуктора, переводящего репрессор в неактивную форму, происходит регуляция синтеза индуцибельных ферментов.
Известны также репрессируемые ферменты, их образование подавляется продуктом катализируемой ими реакции. Действие этих оперонов также контролируется с участием белков-репрессоров, но они синтезируются изначально в неактивной форме. Присоединение к ним накопившегося в значительном количестве продукта ферментативной реакции — корепрессора (например, триптофана, в случае триптофанового оперона) переводит их в активную форму, что сопровождается связыванием активированных репрессоров с оператором и прекращением синтеза белка (рис. 5.6). Таким образом, индукция и репрессия синтеза ферментов по своему механизму сходны. Отличие заключается в природе репрессора: у индуцибельных ферментов свободный репрессор активен, а у репрессируемых — неактивен и активируется в присутствии корепрессора.
В большинстве исследованных случаев индуцибельными являются опероны, ответственные за синтез ферментов, катализирующих катаболические реакции (сбраживание сахаров, распад аминокислот и др.). Индукторами таких оперонов, переводящими активный репрессор в неактивную форму, являются субстраты этих катаболических ферментов. Репрессируемые опероны, как правило, — системы синтеза анаболических ферментов, катализирующих реакции синтеза аминокислот, азотистых оснований и т. д. В качестве корепрессора, активирующего репрессор, выступают продукты, синтезируемые ферментами данного оперона.
Если ген-регулятор располагается перед группой оперонов, кодирующих ферменты, ответственные за разные промежуточные реакции синтеза одного и того же соединения, то он контролирует работу всех оперонов с участием единственного репрессора.
Помимо индуцибельных и репрессируемых ферментов в клетках существуют и конститутивные белки и в том числе конститутивные ферменты. Это такие белки и ферменты, количество которых несущественно изменяется в процессе жизнедеятельности организма. Они постоянно синтезируются клеткой, на скорость их синтеза существенно не влияет состав среды. Уровень конститутивного синтеза зависит от скорости синтеза мРНК, скорости прикрепления к ней рибосом, считывания матрицы и времени жизни мРНК. К конститутивным белкам относятся, например, ферменты, участвующие в расщеплении глюкозы у Е. coli. Оперон, отвечающий за синтез конститутивного белка, не содержит активно действующего оператора. Потеря активности оператором может произойти в принципе у любого оперона вследствие мутации. В таком случае действие репрессоров блокируется и идет неконтролируемый синтез белков.
Регуляция синтеза ферментов lac-оперона Е. coli на стадии транскрипции может происходить и при участии механизма ката- болитной репрессии, осуществляющейся под действием цАМФ (см. разд. 12.3). Катаболитную репрессию индуцибельных ферментов через цАМФ вызывают, как правило, субстраты конститутивных ферментов. Так, Е. coli не утилизирует лактозу и не синтезирует соответствующие ферменты в присутствии другого, более доступного энергетического субстрата — глюкозы, которая используется организмами при участии конститутивных ферментов. Объясняется это тем, что один из продуктов расщепления глюкозы (катаболит) снижает внутриклеточный уровень цАМФ. В отсутствие глюкозы содержание цАМФ в клетке существенно повышается, она связывается со специфическим белком клетки — БРЦ (белок-рецептор цАМФ) или CRP (от cAMP receptor protein).
Комплекс цАМФ-БРЦ способен взаимодействовать с промотором Іас-оперона, изменять пространственную структуру данного участка ДНК таким образом, что становится возможным присоединение к нему РНК-полимеразы. Это увеличивает скорость транскрипции оперона (рис. 5.7). Следовательно, транскрипция lac-оперона находится и под позитивным (с участием комплекса цАМФ-БРЦ) и негативным (через репрессор) контролем. При негативном контроле lac-оперон транскрибируется в отсутствие регуляторного белка-репрессора, в случае позитивного контроля для «запуска» оперона необходим регуляторный белок — комплекс цАМФ-БРЦ. В настоящее время установлено, что роль цАМФ в регуляции активности генома заключается не только в инициации транскрипции, но и в противодействии терминации транскрипции.
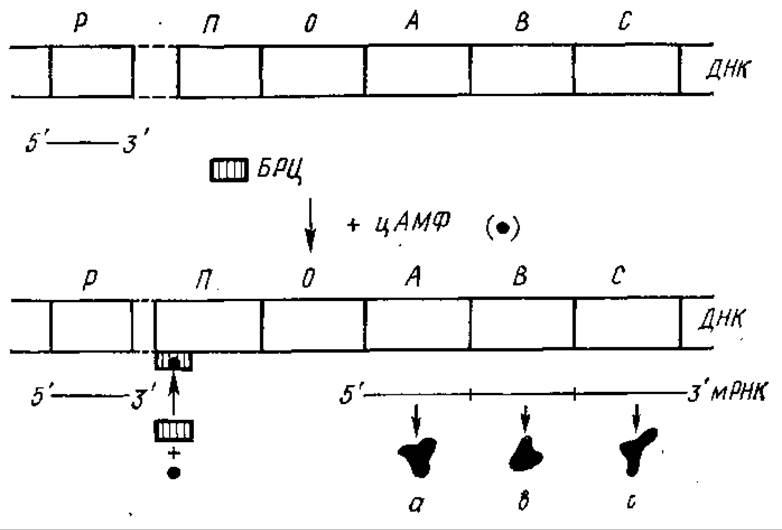
Рис. 5.7. Регуляция работы lас-оперона Е, coli с участием цАМФ (катаболитная репрессия):
БРЦ — рецептор цАМФ; остальные обозначения те же, что на рис. 5.5
В обеспечении селективности транскрипции, т. е. выборе транскрибируемого оперона, существенную роль играет σ-субъединица РНК-полимеразы. Она сама не обладает сродством к ДНК, но уменьшает неспецифическое присоединение РНК-полимеразы к ДНК. Установлено, что ß'-субъединица — единственный компонент РНК-полимеразы, имеющей сродство к ДНК.
Широкое распространение получила гипотеза сменных а-субъединиц, которые бы придавали РНК-полимеразе сродство к разным промоторам, направляя ее на транскрипцию разных участкoв генома. Однако «выбор» промоторов этот фермент может осуществлять и без σ-субъединицы, при условии присоединения к нему некоторых других дополнительных полипептидов.
В опытах с Е. coli обнаружено, что изменение транскрипционной специфичности РНК-полимеразы зависит также от АДФ-рибозилирования a-субъединицы. Следовательно, функция последней также связана со специфичностью транскрипции отдельных участков генома. Таким образом, механизмы изменения специфичности РНК-полимеразы разнообразны и не сводятся к смене серии σ-субъединиц.
Скорость синтеза белков у прокариот зависит также от матричной активности ДНК, которая изменяется при химической модификации ДНК, в частности метилировании с участием ДНК-метилаз, а также от особенностей сверхспирализации ДНК, определяемой соотношением типов ДНК-топоизомераз (ДНК-гиразы и ДНК-релаксазы).
Для прокариот установлен еще один очень своеобразный механизм контроля белкового синтеза. При недостатке аминокислот в клетках накапливаются значительные количества необычного нуклеотида — гуанозинтетрафосфата (ффГфф), который прерывает инициацию синтеза рРНК и тРНК, присоединяясь, вероятнее всего, к РНК-полимеразе. ффГфф образуется при участии специфического фермента в том случае, если ненагруженная аминокислотой молекула тРНК связывается с A-участком на рибосоме. Это инициирует реакцию отщепления пирофосфатной группы от АТФ и перенос ее на фф5ГOН (ГДФ), что и приводит к синтезу необычного нуклеотида. Ряд генов может находиться и под позитивным контролем ффГфф. Таким путем контролируются системы, способные восстанавливать белковый синтез, подавленный в результате недостатка аминокислот.
Приведенные выше механизмы контроля скорости белкового синтеза на уровне транскрипции не исчерпывают все имеющиеся к настоящему времени сведения в этой быстро пополняющейся новыми фактами области исследований. В частности, известны примеры ауторегуляции оперонов, когда регуляторный ген входит в состав оперона, регулируемого его продуктом (оперон утилизации гистидина). У арабинозного оперона индукция синтеза ферментов происходит под действием активатора, связывающегося с инициатором, расположенным ближе к структурным цистронам, чем оператор. Активатор образуется из репрессора при связывании его с L-арабинозой, в то время как свободный репрессор узнает оператор.
Для ряда оперонов биосинтеза аминокислот (например, триптофана) показано существование механизма регуляции с участием специфического регуляторного участка ДНК — аттенюатора, расположенного непосредственно перед структурными цистронами, после оператора. Аттенюатор, включающий около 30 нуклеотидов, может выполнять роль терминатора синтеза мРНК. При обычных колебаниях содержания триптофана в среде большинство начавших синтезироваться мРНК терминируется в области аттенюатора, образуя небольшую по размерам лидерную РНК. Малая часть инициированных мРНК (до 10%) транскрибируется до конца. При голодании по триптофану доля терминации в аттенюаторе снижается.
Существуют и механизмы контроля скорости белкового синтеза на уровне трансляции. Фактором ограничения скорости или даже прекращения трансляции может быть недостаточное количество тРНК определенных видов или даже полное отсутствие их. Так, после заражения Е. coli каким-либо фагом одни тРНК исчезают, новые появляются. В результате некоторые белки совсем перестают синтезироваться. Предполагают, что фаг путем модифицирования (метилирование, тиолирование) ингибирует одни тРНК, а другие активирует. Недостаток тРНК какого-либо типа может быть результатом действия на них нуклеаз с расщеплением ЦЦА-конца. Скорость трансляции может регулироваться также вследствие изменения активности аминоацил-тРНК-синтетаз (это, например, могут вызывать фаги своими белками), а также числа и активности рибосом, в частности активности пептидилтрансферазы.
С. Очоа установил, что существуют протеинкиназы, ингибирующие трансляцию путем фосфорилирования факторов инициации.
Контроль синтеза белка наблюдается даже у просто устроенных фагов. Так, фаг М32, содержащий всего лишь три гена (для белка созревания, белка оболочки и репликазы), использует механизм, регулирующий экспрессию (выражение) этих генов. Белки оболочки образуются в значительно больших количествах, чем белки созревания. Вероятнее всего, связывание 30S-субчастиц рибосом и факторов инициации происходит быстрее с инициаторным нуклеотидом гена, кодирующего белки оболочки. При усиленном образовании белка оболочки он подавляет трансляцию гена репликации, связываясь с его инициаторным участком. Регуляция белкового синтеза у вирусов имеет свои сложности, обусловленные взаимодействием генетического аппарата инфицированной клетки хозяина и вируса.
Механизмы регуляции белкового синтеза у эукариот исследованы пока недостаточно. Предполагают, что основные принципы регуляции у них аналогичны таковым у прокариот, но в целом этот процесс сложнее. Для эукариот не характерна прямая субстратная регуляция, распространенная у организмов без оформленного клеточного ядра. В отличие от прокариот опероны эукариот обычно моноцистронные, с очень обширными регуляторными зонами. Наличие обширных регуляторных зон в опероне эукариот связано с их способностью воспринимать большое число различных факторов, изменяющих транскрипционную активность. У эукариот структурные гены, ответственные за разные звенья той или иной цепи биохимических реакций, как правило, разбросаны по геному, а не сосредоточены в одном опероне, как это часто наблюдается у прокариот.
В ядрах дифференцированных клеток эукариот большинство генов находится в репрессированном состоянии: одновременно транскрибируется в среднем только около 10% генов. Конкретное же число активно работающих структурных генов различно в разных тканях и органах и на разных стадиях развития. Например, в ретикулоцитах, где идет синтез глобинов, число копий глобиновых мРНК превосходит 150 000 на клетку, а в других клетках того же организма их либо крайне мало, либо совсем не удается обнаружить.
Все структурные гены эукариот предлагают условно разделять на три типа; 1) гены, функционирующие во всех клетках организма (например, гены, кодирующие ферменты энергетического обмена); 2) гены, функционирующие только в тканях одного типа (в частности, гены, определяющие синтез миозина в мышечной ткани); 3) гены, нужные для выполнения клетками узких функций (например, гены, кодирующие синтез белка хрусталика).
ДНК эукариот ассоциирована с гистонами и другими белками, которые могут выполнять регуляторную функцию, влияя на РНК-полимеразную реакцию. Сродство гистонов к ДНК зависит от степени их фосфорилирования, метилирования и ацетилирования. Усиление этих процессов ведет к уменьшению способности гистонов связываться с ДНК, что приводит к увеличению ее активности. Предполагают, что такую модификацию гистонов катализируют кислые белки, обладающие ферментативной активностью. С помощью гистонов у эукариотических организмов осуществляется в значительной мере групповая репрессия работы генов — одновременное групповое подавление активности генов во всем ядре, в целой хромосоме или в большом ее участке.
Групповая регуляция активности структурных генов у эукариот развита в гораздо большей степени, чем у прокариот и вирусов, во многом отличаются и ее формы. Такой тип групповой регуляции, очень характерный для прокариот, как управление работой структурных генов общим для них оператором и другими регуляторными компонентами данного оперона, у эукариот очень редок, так как оперон, как правило, содержит только один структурный ген. У эукариот очень распространена согласованная регуляция генов, принадлежащих к разным оперонам, пространственно разобщенных в хромосоме или даже находящихся в разных хромосомах. Яркий пример групповой регуляции активности генов — полное прекращение транскрипции всех генов при сперматогенезе у животных. Это происходит благодаря изменениям белковых компонентов хромосом.
Групповая регуляция нескольких или многих генов, принадлежащих разным оперонам, может осуществляться общим для всех этих генов регуляторным фактором, действующим на каждый ген в отдельности. У эукариот широко распространена регуляция активности групп генов особыми сигнальными веществами, вырабатываемыми другими клетками. Примерами таких сигнальных веществ являются гормоны, действующие на клетки-мишени. Некоторые из гормонов (стероидные) образуют в клетке комплексы с белками-рецепторами, индуцирующие работу одного или нескольких генов в хромосомах клеточного ядра. Большая часть гормонов рецептируется на поверхности клеток и действует на синтез белка через систему цАМФ-протеинкиназы (см. разд. 12.6.1).
Для скорости транскрипции у эукариот важен и уровень метилирования ДНК, определяющий конформацию хроматина в области соответствующих генов. В регуляции транскрипции у эукариот определенная роль отводится изменениям в структуре (характер упаковки) нуклеопротеинов. Некодирующие последовательности нуклеотидов ДНК-интроны, возможно, являются внутригенными регуляторными зонами, создающими необходимую структуру нуклеопротеина. Аналогичную функцию, очевидно, могут выполнять и спейсеры, расположенные между повторяющимися генами. От структуры нуклеопротеиновых участков в геноме эукариот зависит их способность к взаимодействию с белками-регуляторами, изменяющими транскрипционную активность генов. В управлении работой генов у эукариот, так же как и у прокариот, могут играть роль транспозиция и изменение положения регуляторных элементов в хромосоме (см. разд. 4.3.8).
Активация биосинтеза белка в хлоропластах у растений может происходить под действием света как в результате того, что некоторые репрессирующие системы хлоропласта являются фоточувствительными, так и в связи с увеличением активности РНК-полимеразы.
Пространственное разделение процессов транскрипции и трансляции у эукариот дает возможность контролировать синтез белка на этапе модификации РНК-транскрипта, проникновения мРНК из ядра в цитоплазму. Регуляция на стадии модификации транскрипта, вероятно, может осуществляться путем изменения активности ферментов кэпинга (например, метилаза гуанина) и скорости образования полиаденилата, изменения режима сплайсинга или неоднозначности сплайсинга (см. разд. 4.4.3). Скорость отделения белков от информосом перед комплексированием мРНК с рибосомой также определяет интенсивность биосинтеза белков. Если у вирусов и прокариот после трансляции на рибосомах мРНК быстро разрушаются, то у эукариот многие мРНК, образуя комплексы с белками, могут длительно сохраняться и использоваться для трансляции спустя много времени после синтеза на ДНК. Например, при эмбриогенезе стабильные мРНК, синтезированные еще во время оогенеза и запасенные в цитоплазме яйца, определяют в значительной мере течение ранних стадий развития зародыша.
В регулировании процессов трансляции у эукариот известную роль отводят изменениям в пространственной структуре тРНК, определяемой содержанием минорных нуклеотидов. От конформации тРНК зависит скорость проникновения ее в рибосому, правильность ориентации. Помимо данного пути контроля синтеза через тРНК возможна регуляция и на уровне процессинга тРНК, т. е. скорости превращения предшественника в активную тРНК. Как и у прокариот, у эукариот большую роль играют изменения числа и активности рибосом. Так, в неоплодотворенных яйцеклетках синтез белка идет медленно, хотя рибосом достаточно много. После оплодотворения синтез белка резко активируется без изменения числа рибосом. Активность рибосомы определяется многими факторами, в том числе активностью пептидилтрансферазы, ингибированием или активацией белковых факторов трансляции. Пост трансляционная модификация белков также может являться этапом, на котором контролируется синтез белков.
У эукариот существует и такой механизм, обеспечивающий детерминированное направление развития групп клеток, как отбор и избирательное размножение клеток, продуцирующих нужный белок (например, клонирование клеток, синтезирующих антитела).