Основы биохимии - А. А. Анисимов 1986
Обмен белков и аминокислот
Структура антител, механизм их образования
Появление белков-антител в сыворотке и тканях человека и позвоночных животных в ответ на введение генетически чужеродных соединений (антигены) является основой гуморальной иммунной реакции. Антигенами называются все те вещества, которые несут признаки генетической чужеродности и при введении в организм вызывают развитие специфических иммунологических реакций. Типичными антигенами являются чужеродные белки, полисахариды микроорганизмов.
Антигенные свойства могут проявлять нуклеиновые кислоты, сложные липиды, некоторые низкомолекулярные вещества (ряд гормонов, лекарств), химически синтезированные соединения, если они связаны с носителем-белком, полисахаридом и др. Такие вещества получили название гаптенов. Наименьшая молекулярная масса веществ, против которых удалось получить антитела без их присоединения к другим крупным молекулам, составляет около 1000 (например, олигопептиды, содержащие более 8 аминокислотных остатков).
Антитела — вещества гликопротеиновой природы, образующиеся в ответ на введение в организм антигена и обладающие способностью к специфической реакции с антигеном. Кроме сыворотки крови антитела обнаружены в экскреторных жидкостях (молоко, выделения слезных желез, слюна и др.), а также на поверхности некоторых типов клеток лимфатической системы. Встреча антигена с соответствующим антителом приводит к образованию комплекса. При выпадении этого комплекса в осадок происходит реакция преципитации. Если антитела, взаимодействуя с антигенами, вызывают склеивание клеток, их называют агглютининами, если же они вызывают лизис, их называют лизинами.
Антитела обнаруживают высокую специфичность в отношении чужеродных белков, вызвавших их образование. Различные белки одного и того же организма вызывают образование различных антител. Так, если иммунизировать кролика гемоглобином лошади, то образовавшиеся при этом антитела не способны реагировать с другими белками лошади. Также неодинаковы в иммунологическом отношении гомологичные белки разных организмов. Примером вновь могут служить гемоглобины. Антитела, образовавшиеся в организме кролика в ответ на введение гемоглобина лошади, реагируют наиболее активно с гемоглобином лошади и значительно слабее с гемоглобинами других млекопитающих.
Специфичность антител отражает филогенетические взаимоотношения между видами. Гомологичные белки близкородственных видов обнаруживают большее сходство по иммунологическим свойствам, чем белки далеко отстоящих друг от друга видов. Узкую избирательность взаимодействия антиген — антитело используют в практике лабораторных биохимических исследований для идентификации индивидуальных белков. Благодаря своей высокой специфичности иммунохимический метод (в сочетании с электрофорезом — иммуноэлектрофоретический) очень точен и во многих случаях незаменим.
Антитела представляют собой растворимые белки плазмы, относящиеся к иммуноглобулинам (преимущественно к у-глобулинам). По седиментационным и электрофоретическим характеристикам, а также по появлению в очень больших количествах при некоторых состояниях организма иммуноглобулины человека подразделяют на пять классов: IgG, IgM, IgA, IgD и IgE. Первые три представлены количественно более существенно, два последних называются минорными классами. Содержание IgG, IgM и IgA (относительно общего содержания иммуноглобулинов) в крови здорового человека составляет 70—80, 5—10 и 10—20% соответственно.
Будучи гликопротеинами, иммуноглобулины всегда содержат углеводы, количество которых по отношению к общей массе колеблется от 2—3% в IgG до 10—12% в IgA и IgM. Ковалентно связанные углеводы относятся главным образом к гексозо- и гексозаминосодержащим олигосахаридам с небольшим содержанием сиаловой кислоты и фукозы. Углеводные простетические группы определяют скорость деградации антител гепатоцитами. Молекулярная масса иммуноглобулинов колеблется от 150 000 до 900 000; IgM макроглобулинов ≈ 900 000, IgA ≈ 170 000—500 000, IgG ≈ 150 000, IgD и IgE ≈ 180 000.
Молекулы большинства иммуноглобулинов представляют собой димеры, состоящие из двух (L) легких (от англ. light) и двух тяжелых цепей (H, от англ. heavy). IgA и IgM содержат более четырех цепей в своем составе. H- и L-цепи существенно отличаются по первичной структуре. В составе индивидуальной молекулы обе L-цепи идентичны друг другу по структуре, обе Н-цепи также обладают одинаковой последовательностью аминокислот. Их длина у иммуноглобулинов разных классов различна. Молекулярная масса легких цепей составляет 20 000—25 000, тяжелых — 50 000—55 000. С помощью межцепочечных дисульфидных связей четыре цепи объединяются в единую ковалентно связанную структуру. После восстановления межцепочечных дисульфидных связей требуются еще дополнительные достаточно жесткие условия для разрушения прочных нековалентных контактов между L- и Н-цепями и разделения цепей, например добавление мочевины или снижение pH.
В состав иммуноглобулинов человека могут входить L-цепи одного из двух типов: н (каппа) либо λ(ламбда).
Тяжелых цепей антител существует пять типов: а, у, δ, ε, μ. Они определяют классы антител: в IgM входит μ-цепь, в ІgG — у, в ІgD — δ в ІgE — ε, в ІgA — а. Каждая тяжелая цепь может вступать в ассоциацию с любой из легких цепей. В сыворотке крови здорового человека содержится смесь множества различных иммуноглобулинов. Их исключительно большая гетерогенность не позволяет выделить из смеси и исследовать структуру какого-либо одного индивидуального иммуноглобулина. Однако известно заболевание — множественная миелома (опухоль костного мозга), при которой происходит злокачественная пролиферация (быстрое размножение, разрастание и перерождение) одного определенного типа антителообразующих клеток, синтезирующих один тип иммуноглобулинов в достаточно больших концентрациях. Было показано, что миеломные белки по целому ряду структурных и функциональных признаков очень близки к нормальным иммуноглобулинам. Миеломные Іg можно выделить в относительно больших количествах, они легко поддаются очистке до гомогенного состояния. Из мочи больных миеломой выделены белки Бенс-Джонса, которые представляют собой L-цепи Іg.
В 70-х годах были проведены исследования, позволившие кардинально решить проблему получения высокоспецифических антител в больших количествах. Путем слияния ß-лимфоцита (клетки с коротким периодом продукции антител) и опухолевой клетки удалось получить гибрид, в котором проявлялись важнейшие свойства обеих родительских клеток: способность опухолевой клетки к неограниченному размножению и способность лимфоцита к синтезу антител. Так как в качестве опухолевой клетки исследователи взяли клетку миеломы, то гибрид назвали гибридомой. Клонированные (размноженные) гибридомные клетки синтезируют в большом количестве моноклональные антитела, гомогенные по структуре и специфичности.
Определение аминокислотной последовательности иммуноглобулинов показало, что молекулу антитела можно разделить на участки, или домены. Одни из них характеризуются постоянной последовательностью аминокислот, они называются константными участками (С), у других — сильно различающиеся последовательности, это — вариабельные участки (V).
С- и V-участки есть у всех легких и тяжелых цепей. Вариабельные участки располагаются в N-концевых частях L- и Н-цепей. В L-цепях к V-участку относится около 100 аминокислотных остатков, а в тяжелых — около 120. В пределах вариабельных участков цепей иммуноглобулинов содержатся гипервариабельные области. Именно они формируют участки связывания антигенов и называются антигенсвязывающими центрами молекул антител (активные центры). Аминокислотная последовательность в них варьирует в связи с различиями в специфичности антител. Эти структурные особенности обеспечивают возможность взаимодействия с различными антигенами.
Константные участки антител функционируют при связывании комплемента, обеспечивают перенос антител через плацентарный барьер (у человека и некоторых млекопитающих иммунитет от матери к ребенку может передаваться в процессе внутриутробного развития в результате переноса антител из крови матери через плаценту).
При изучений структуры иммуноглобулинов установлено, что их расщепление на фрагменты при частичном протеолизе происходит в области шарнирного участка Н-цепей. Этот участок расположен на поверхности молекулы и обладает некоторой подвижностью. Гидролиз ІgG папаином приводит к образованию трех фрагментов: двух Lab-фрагментов (от англ. antigen — binding) антигенсвязывающих и одного Fc-(от англ. crystallizable) фрагмента с постоянным аминокислотным составом. Молекулярная масса Fab- фрагмента 50 000—52 000. Он сохраняет иммунологическую активность исходного IgG, но проявляет себя как моновалентное антитело, т. е. имеющее один антигенсвязывающий участок. В состав Fab-фрагмента входит целая L-цепь (либо н, либо λ-цепь) и N-концевая половина Н-цепи. Они соединены между собой дисульфидной связью, Lc-фрагмент обладает М=48 000 и состоит из оставшихся половин H-цепей (рис. 5.8). Основной тип вторичной структуры иммуноглобулинов — антипараллельная ß-складчатая. Она перемежается с a-спиралью и образует «клубки», возникающие при сшивании дисульфидными мостиками аминокислотных остатков внутри каждой цепи. Эти «клубки» названы доменами.

Рис. 5.8. Схема молекулы Іg человека
Всего в молекуле IgG 12 доменов: по 4 на тяжелых и по 2 на легких цепях. Молекулярная масса каждого домена примерно одинакова — около 12 500. Первые домены (VL и VH) составлены из вариабельных участков легких и тяжелых цепей, остальные — из константных участков легких или тяжелых цепей — СL и СH. Активные центры антител формируются доменами вариабельных участков. В этом участвует от 4 до 8 аминокислотных остатков с широкой вариабельностью по видам аминокислот и их сочетаниям. Эти участки называются гипервариабельными областями легких и тяжелых цепей.
Специфичность антител при связывании антигенов обусловлена как первичной, так и третичной структурой. Третичная структура иммуноглобулинов комплементарна конформации антигена, обеспечивает сближение, взаимную ориентацию специфических участков полипептидной цепи с образованием связывающего участка. Однако узкая избирательность взаимодействия антител с антигенами определяется в первую очередь различиями первичной структуры вариабельных участков.
Реакция антиген — антитело протекает аналогично взаимодействию субстрата с активным центром фермента. Этот механизм был исследован на связывании Fab-фрагмента с гаптенами. Взаимодействие антигена и Fab-фрагмента осуществляется за счет водородных связей, гидрофобных взаимодействий и электростатических сил. Вклад отдельных остатков аминокислот или моносахаридов антигена во взаимодействие с антителом может широко варьировать. Например, замена в брадикинине (нонапептид) хотя бы только одной аминокислоты приводит к почти полному прекращению его связывания антителами. Иная картина наблюдается при взаимодействии группового вещества А крови с антителами IgM. Последние комплементарно связывают только N-ацетилглюкозамин, другие моносахаридные остатки группового вещества А не влияют в данном случае на сродство антитела к антигену.
Синтез иммуноглобулинов осуществляется обычными механизмами белкового синтеза, но L- и H-цепи образуются двумя различными типами полирибосом. В процессе синтеза антител наблюдается кооперативное взаимодействие клеток трех типов, которые образуются в костном мозге: ß-лимфоцитов, T-лимфоцитов и макрофагов.
В-лимфоциты потенциально способны образовывать антитела. Они попадают из костного мозга в периферические лимфоузлы, селезенку. Другая группа клеток из костного мозга направляется либо в тимус, либо в лимфатические узлы, либо в селезенку и там под влиянием гормонов тимуса превращается в T-лимфоциты. Макрофаги играют роль в синтезе иммуноглобулинов за счет своей способности к фагоцитарному поглощению и частичному расщеплению корпускулярных чужеродных объектов (бактерии, белковые структуры). Продукты деятельности макрофагов являются дополнительными антигенными стимулами для В- и T-лимфоцитов.
В природе существует очень большое число самых разнообразных соединений, которые, попав в организм, будут выступать в роли антигенов. Возникают вопросы, наиболее интересные и в то же время сложные, плохо исследованные в проблеме иммунохимии: содержит ли ДНК в окончательно сформированном состоянии столь же огромное число генов разных антител, сколь многообразны антигены? Поскольку простые расчеты и логика подсказывают отрицательный ответ, каким же другим путем обеспечивается колоссальная вариабельность антител?
По современным представлениям, иммунная система способна отличить друг от друга около 105—107 различных антигенов. Иммуноглобулины кодируются большим числом мини-генов (субгены), разделенных некодирующими последовательностями. Исходно разобщенные мини-гены, кодирующие разные части цепей иммуноглобулинов, соединяются между собой на уровне ДНК и мРНК в процессе развития ß-лимфоцитов — продуцентов специфических антител. В эмбриональных лимфоцитах содержится много сотен субгенов, вариабельных частей легких цепей (VL) и тяжелых (VH). Кроме того, на расстоянии тысяч нуклеотидных пар перед началом генов контактных участков иммуноглобулинов расположено несколько коротких последовательностей — J (от англ. joining — соединяющие). В цепях, кроме того, имеются очень короткие последовательности D (от англ. diversity — разнообразие), также принимающих участие в создании разнообразия (рис. 5.9).
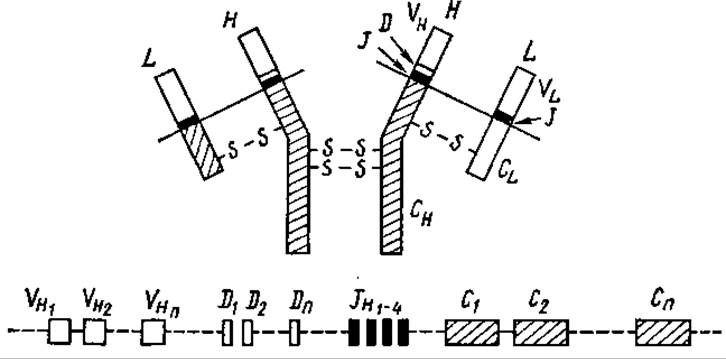
Рис. 5.9. Соответствие участков полипептидов иммуноглобулина и кодирующих их субгенов (по Р. Б. Хесину, 1984):
участий, кодирующие вариабельные районы; С1-n — участки, кодирующие константные районы поли пептидов; J1-4 короткие участки, соединяющие V- и С-районы; D1-n — «очень короткие участки»
При образовании полных генов один из VL-субгенов соединяется с одним из JL-участков, образуя единый ген. После его транскрипции и дальнейшего сплайсинга образуется единая мРНК, кодирующая единый VJC-полипептид легкой цепи иммуноглобулина. Еще сложнее происходит перестройка при образовании генов Н-цепей: сливаются VH-участки с JH, DH и, возможно, СH. Огромная вариабельность клонов лимфоцитов объясняется, таким образом, колоссальным количеством возможных комбинаций V-, V-, D-, J- и С-субгенов.
Выбор конкретных генетических элементов, которые «создают» функционирующие гены иммуноглобулинов в данной лимфоидной клетке, является, по-видимому, случайным. Поскольку в образовании активного центра принимают участие и H- и L-цепи, при равной вероятности соединения любых H-цепей с любыми L-цепями число возможных вариантов активных центров еще резко возрастает.
В целом, многообразие специфичности антител в настоящее время связывают с тем, что в процессе эволюции организмы сталкивались с огромным количеством чужеродных агентов и это способствовало накоплению большого числа генов антител. Соматические мутации в генах и сборка самих генов из сегментов (субгенов, или мини-генов) многократно увеличивают разнообразие антител. Селективными агентами являются антигены, они узнают иммуноглобулиновые рецепторы на поверхности клетки, связываются с ними и стимулируют размножение данной клетки, способствуя быстрому образованию ее многочисленного клона.
При взаимодействии антигенов с антителами происходит включение системы комплемента. Она состоит из нескольких (около 10) сывороточных белков крови. Каскадный механизм их активации запускается в результате образования комплекса антиген — антитело. В конечном счете действие комплемента приводит к лизису чужеродных веществ и к активации лейкоцитов. Таким образом, комплемент вместе с антителами и специализированными клетками участвует в защите организма хозяина от инфекций.
Явление отторжения пересаженных тканей, наблюдаемое у млекопитающих и птиц, обусловлено наличием антигенов гистосовместимости на поверхности практически всех клеток (за исключением клеток эмбрионов и эритроцитов). Наиболее подробно они изучены у человека и мышей. Это белки с большой гидрофобностью, которые кодируются рядом различных генных локусов (подобно изоферментам). Часто эти гены находятся в хромосоме вблизи друг от друга, образуя генные области. Для каждого генного локуса существует множество аллелей (альтернативные формы гена), что обусловливает высокую степень полиморфизма.
Самые активные антигены гистосовместимости кодируются генами, расположенными в ограниченной области хромосомы, — МНС (от англ. major histocompatibility complex). У человека эту область обозначают HLA, у мышей — Н-2. Функции антигенов гистосовместимости пока недостаточно изучены. Есть основание считать, что они участвуют в регуляции иммунной системы и системы комплемента, а также во взаимодействиях между клетками.
Организм на протяжении своей жизни встречается со множеством разных бактерий и антигенов, поэтому в норме плазма содержит огромное число различных антител. В частности, иммунитет к определенным бактериям или вирусам обусловлен присутствием соответствующих «своих» специфических антител. Искусственный активный иммунитет получают путем введения в организм убитых бактерий, а также токсоидов — обработанных формальдегидом (поэтому обезвреженных) токсинов дифтерийной или столбнячной палочки. В результате прививок таким путем полученными вакцинами у человека вырабатываются специфические антитела, способные реагировать с определенным видом живых бактерий или естественным токсином, т. е. возникает иммунитет.
Наиболее активными в создании прочного искусственного иммунитета являются вакцины из живых ослабленных микробов. Их получают путем выращивания патогенных микроорганизмов при воздействии неблагоприятных факторов (прогревание при субоптимальных температурах, добавление в питательную среду некоторых веществ и т. д.). Против ряда инфекций живые вакцины являются практически единственным средством специфической профилактики (сибирская язва, туляремия, чума). Широко применяют живые вакцины против оспы, бешенства, полиомиелита и многих других заболеваний. В последнее время стали использовать также химические вакцины, которые готовят путем экстрагирования антигенных фракций из культур соответствующих микроорганизмов. Успешно проводят исследования по химическому синтезу антигенов, значительно более простых по структуре, чем природные. Все более реальным становится получение синтетических вакцин.
Временный пассивный иммунитет создается в результате введения антител, выработанных другим, иммунным организмом какого-то животного. Для лечения дифтерии и столбняка, например, используют плазму иммунизированных лошадей, которая содержит антитела к соответствующим токсинам.
Антитела образуются только у позвоночных животных, однако это не означает, что беспозвоночные не обладают иммунитетом. Иммунная система развилась из распознавания клеток друг другом при помощи комплементарных поверхностных рецепторов, различения «своего» и «чужого». Так как иммунная система функционирует во взаимодействии с комплексом гистосовместимости, их эволюция должна рассматриваться совместно.
У морских звезд и кольчецов происходит отторжение пересаженной ткани, ее разрушение. У членистоногих имеются неиндуцируемые механизмы агглютинации чужеродных веществ. Тимус и селезенка, а с ними и антитела появляются только у позвоночных. Строение цепей антител изменялось в процессе эволюции позвочночных животных. Бесчелюстные (или круглоротые, куда относятся миноги и миксины) содержат иммуноглобулины с μ-подобными тяжелыми цепями.
Даже самые примитивные иммуноглобулины состоят уже из нескольких, хотя и однотипных, полипептидных цепей. Однако субъединицы у них еще не соединены дисульфидными мостиками. IgM — один из древнейших классов иммуноглобулинов, он существует у всех хрящевых и костистых рыб. У амфибий также найдены антитела класса М, но, кроме того, у некоторых бесхвостых амфибий обнаружены тяжелые цепи, напоминающие типы а или δ. Только у рептилий впервые появляются ϰ- и λ-цепи. а-Цепи существуют у птиц и млекопитающих, а у — только у млекопитающих. У них содержатся также разнообразные формы а-, у-, δ- и ε-цепей и может наблюдаться экспрессия более чем одного класса в одной клетке.