Основы биохимии - А. А. Анисимов 1986
Обмен белков и аминокислот
Диссимиляция белков
5.6.1. Расщепление белков в процессе пищеварения. Роль белков в питании. В организме человека и животных непрерывно происходит разрушение клеток, расщепление и расходование белков: распад «устаревших» молекул белка всех тканей, шелушение эпителия, рост ногтей, рогов, копыт, расход пищеварительных и других ферментов, расход гормонов, образование антител и т. д. Восполнение непрерывно расходующихся белков во всех этих процессах возможно лишь при поступлении достаточного количества их с пищей. Суточная потребность человека в белках составляет 80—100 г, а для людей физического труда — до 120—150 г, белков животного происхождения из них должно быть не менее 50—70 г. При недостатке белков быстро нарушается функционирование щитовидной железы, надпочечников, половых желез. Особенно чувствительна к белковому голоданию центральная нервная система, в первую очередь кора головного мозга. Даже при полном голодании человека мозг и сердце долго не теряют в массе, обновляют свои белки за счет их распада в мышцах, печени.
Различают белки пищи полноценные и неполноценные. Полноценные белки содержат все 10 незаменимых аминокислот, которые животные и человек в отличие от растений и микроорганизмов не способны синтезировать. В процессе эволюции утратилась способность к их синтезу, так как эти аминокислоты поступали в организм в достаточных количествах с растениями, микроорганизмами, другими животными.
К незаменимым аминокислотам относятся лизин, аргинин, гистидин, валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан. Этот перечень требует некоторых примечаний. Аргинин может синтезироваться в организме человека и других животных, но происходит это в очень небольших количествах. Поскольку тирозин образуется непосредственно из фенилаланина в одну стадию, потребность в фенилаланине является фактически потребностью в этих обеих аминокислотах, и тирозин можно отнести к незаменимым аминокислотам. По этой же причине цистеин — заменимая аминокислота только в том случае, когда в пище есть метионин. Глицин, являющийся заменимой аминокислотой для всех животных, незаменим для цыплят.
В неполноценных белках отсутствует одна или несколько незаменимых аминокислот. К полноценным белкам относят казеин молока, альбумин яйца, молочный альбумин, глутенин пшеницы, к неполноценным — многие растительные белки (зеин кукурузы, легумин бобовых), они обычно бедны лизином, метионином, триптофаном. Недостатком растительных белков является также то, что в растительных продуктах содержание белков сравнительно невелико, поэтому при вегетарианском питании (только растительными продуктами) употребить их нужно очень много, чтобы покрыть суточную потребность организма в белках. Кроме того, некоторые растительные белки плохо перевариваются.
Животные продукты содержат большие количества белков, и их нужно сравнительно немного для обеспечения организма (особенно важно, что животные белки являются обычно полноценными). Все это объясняет, почему в суточном рационе более половины белков должно быть животного происхождения.
Однако из сказанного не вытекает, что растительные белки следует игнорировать. В белках овощей достаточно много триптофана и фенилаланина, белки картофеля обладают хорошим аминокислотным составом, хотя содержание белков в клубнях невысокое — около 2%. Кроме того, в белках разных растений отсутствуют различные незаменимые аминокислоты, поэтому смеси двух-трех растительных белков могут быть достаточно полноценными. Например, смесь примерно из равного количества непросеянной муки кукурузы, сорго и семян хлопчатника с добавлением 3% дрожжей, а также витамина А и СаСО3 по питательности мало уступает коровьему молоку.
Наименьшее содержание белков в пище, при котором устанавливается белковое равновесие (расходование белков организмом компенсируется их поступлением с пищей), называется белковым минимумом. Белковое равновесие сохраняется и при избытке белков в пище. Они не могут, подобно углеводам или жирам, откладываться в запас, поэтому начинается усиленный распад белков, выделение продуктов их диссимиляции с мочой и калом, пока не установится равновесие. При этом в организме создается избыток вредных кислых продуктов распада белка, происходит подкисление тканей (ацидоз).
Одним из продуктов распада является мочевая кислота, которая при избытке откладывается в суставах (заболевание подагрой). Эти кислые вредные продукты нейтрализуются и выводятся из организма в соединении со щелочными минеральными веществами, которых много в растительной пище — овощах, фруктах. Этим в первую очередь и объясняется полезность сопровождения мясных блюд растительными гарнирами, в чем люди на жизненном опыте убедились с давних времен. Кроме того, избыточное одностороннее питание животными белками вызывает в кишечнике усиленные гнилостные процессы с образованием токсических веществ. Молочно-растительная пища благоприятно действует на кишечную микрофлору, задерживает гнилостные процессы.
Переваривание белков. Организм использует не сами поступающие с пищей белки, а продукты их расщепления — аминокислоты и простейшие пептиды. Белки пищи подвергаются гидролитическому перевариванию в «защищенных компартментахз». У простейших переваривание происходит в пищеварительных вакуолях, у человека и животных—в просвете кишечника. Таким образом, собственное содержимое животных клеток оказывается не доступным гидролитическим пищеварительным ферментам. Последние синтезируются и секретируются в виде неактивных проферментов — зимогенов.
После синтеза на рибосомах эндоплазматического ретикулума особых секреторных клеток проферменты «упаковываются» в виде зимогенных гранул, которые затем мигрируют к поверхности клеток и секретируются в окружающую среду. Достигнув места своего действия, зимогены превращаются в активные ферменты, иногда под действием молекулы другого фермента, отсекающего от предшественника фрагмент полипептидной цепи, так называемый пептид-ингибитор.
Переваривание белков начинается в желудке. У взрослого человека в желудок поступают секреты из протоков от 10 до 30 млн. желудочных желез. Секреция осуществляется железами, образованными клетками трех типов: главными, мукозными и обкладочными. Главные клетки вырабатывают и секретируют пепсиноген, мукозные — слизь, обкладочные клетки секретируют соляную кислоту и у человека внутренний фактор — мукопротеин, необходимый для нормального всасывания из кишечника поступающего с пищей витамина В12. Концентрация протонов в желудке в 106 раз больше, чем в плазме крови. Точная природа механизма образования НС1 остается неизвестной. Простейшая гипотеза предполагает, что механизм секреции сходен с механизмом транспорта протонов за счет АТФ при функционировании внутренней мембраны митохондрий. Большая роль в секреции НСl отводится карбоангидразе.
Секрецию обкладочных клеток стимулируют гистамин и гормоны гастрины. Последние вырабатываются в пилорической и привратниковой частях желудка. Образование гастринов угнетается гормоном слизистой двенадцатиперстной кишки — секретином и гормоном гипоталамуса, присутствующим в поджелудочной железе, — соматостатином.
Выдвинуто предположение о каскадном механизме регуляции секреции кислоты в желудке. В основу этого предположения положена гипотеза о медиаторнoй роли гистамина для гастрина. Гастрин индуцирует образование гистамина, который активирует аденилатциклазу. Образовавшийся цАМФ активирует протеинкиназы, одна из них фосфорилирует малоактивный изофермент карбоангидразы, что приводит к увеличению его активности, которая необходима для секреции НСl.
Основной протеолитический фермент желудочного сока — пепсин. Молекулярная масса его зимогенной формы — 40 000. Процесс активации пепсиногена является аутокаталитическим и осуществляется под влиянием самого пепсина и резко кислой среды желудочного содержимого. Молекулярная масса пепсина — 32 700, т. е. меньше, чем у пепсиногена. При активации от N-концевой части пепсиногена отщепляется 42 аминокислотных остатка в виде смеси пептидов-ингибиторов. В желудке субстратами пепсина могут быть как денатурированные белки после кулинарной обработки пищи, так и нативные белки.
Пепсин гидролизует пептидные связи, образованные аминогруппами циклических аминокислот: фен, три и тир. Пептидные связи, образованные дикарбоновыми аминокислотами, гидролизуются пепсином очень медленно. Оптимальным условием действия пепсина является pH 2—3. Если секреция НС1 не обеспечивает такой кислотности, переваривание белков резко ухудшается. При желудочной ахилии оно вообще не происходит в желудке, так как в его содержимом при этом нет ни пепсина, ни кислоты. В условиях in vitro пепсин способен гидролизовать белки до отдельных аминокислот, но этот процесс требует большой затраты времени. Пиша же в желудке находится ограниченное время, поэтому здесь процесс переваривания белков останавливается на стадии образования смеси полипептидов.
Из слизистой желудка человека выделен протеолитический фермент гастриксин. Он действует на белки примерно так же, как пепсин, отличается меньшей молекулярной массой, менее кислым оптимумом pH. У человека пепсин вызывает свертывание молока, у жвачных животных эту функцию выполняет специфический фермент, который находится в сычуге (четвертый отдел желудка) молочных телят и называется химозином или реннином. Исследования структуры всех протеолитических ферментов желудка обнаруживают значительную гомологию последовательностей, что указывает на наличие у них общего предшественника.
Дальнейшему перевариванию белки подвергаются в слабощелочной среде тонкого кишечника. Здесь их гидролиз катализируют несколько ферментов: трипсин, химотрипсин, эластазы, пептидазы. Трипсин и химотрипсин действуют эффективнее после пепсина, однако они способны расщеплять белок и без его предварительного гидролиза пепсином. Благодаря этому больные после резекции желудка сохраняют способность использовать пищевые белки.
Поджелудочная железа секретирует трипсиноген, химотрипсиноген (см. разд. 3.3), прокарбоксипептидазы А и В, проэластазу. В кишечнике секретируется фермент энтерокиназа, которая осуществляет специфично и быстро активацию трипсиногена в трипсин. Энтерокиназа была впервые открыта и исследована Н. П. Шеповальниковым в лаборатории И. П. Павлова. Активация трипсиногена может происходить и аутокаталитическим путем самим трипсином, однако этот процесс протекает медленнее в 2000 раз.
Роль энтерокиназы трудно переоценить, так как образующийся трипсин служит активатором всех остальных протеолитических зимогенов в соответствующие активные формы. Трипсиноген образован одиночной полипептидной цепью. В процессе активации при гидролизе в N-конце одной пептидной связи освобождается гексапептид; происходит частичное изменение конформации молекулы, появляется ферментативная активность и образуется трипсин.
Последовательность вал — (асп)4 — лиз отщепляемого гексапептида существует у трипсиногенов большинства позвоночных от рыб до человека. Пепсин, трипсин и химотрипсин дополняют друг друга по субстратной специфичности (см. разд. 3.3). Совместное их действие приводит к глубокому гидролизу белков до небольших пептидов.
Карбоксипептидаза А — фермент, содержащий цинк, в основном отщепляет С-концевые аминокислотные остатки с ароматическими боковыми цепями. Она выделяется в виде прокарбоксипептидазы А и активируется трипсином.
Карбоксипептидаза В также выделяется в неактивной форме. Будучи активированной, она атакует С-концевые остатки, содержащие только арг и лиз.
Проэластаза выделяется поджелудочной железой, превращается в эластазу под влиянием трипсина, действует на пептидные связи между остатками различных нейтральных аминокислот, особенно активна в отношении белка эластина.
Слизистая тонкого кишечника также содержит протеолитические ферменты. Они могут секретироваться в кишечный сок, но действуют преимущественно внутриклеточно. К этим ферментам относится группа аминопептидаз, поочередно освобождающих N-концевые аминокислоты. Лейцинаминопептидаза — экзопептидаза со слабо выраженной специфичностью; это Zn-содержащий фермент, который активируется также Мn2+. Слизистая кишечника содержит и дипептидазы, например глицилглицин-дипептидазу, активируемую Со2+ или Мn2+.
В результате комбинированного действия протеолитических ферментов, выделяемых стенкой желудка, поджелудочной железой и слизистой кишечника, белки, поступающие с пищей, подвергаются в тонком кишечнике почти полному гидролизу до аминокислот.
Непрогидролизованные небольшие пептиды составляют очень малую долю белков пищи. Они также могут всасываться из кишечника, поэтому после переваривания белков содержание пептидного азота в крови несколько увеличивается. Проникновение через слизистую кишечника в кровь нативных белков является большим исключением. Оно может наблюдаться, например, при скармливании животному белков сыворотки крови этого же вида. После съедания большого количества яичного белка он появляется в моче, при этом наблюдаются признаки интоксикации, отравления. У новорожденных большинства видов млекопитающих проницаемость слизистой кишечника повышена, поэтому в кровь могут поступать антитела молозивного молока. Эти примеры только подчеркивают исключительность явления, крайне редко наблюдаемого в природе всасывания белков из кишечника в кровь.
Всасывание аминокислот из кишечника. Всасывание аминокислот происходит в основном в тонком кишечнике. Это активный процесс, требующий энергии и зависящий от содержания Na+. Существует более пяти специфических транспортных систем, каждая из которых переносит наиболее близкие по строению аминокислоты. Аминокислоты конкурируют друг с другом за участки связывания. Всосавшиеся в кишечнике аминокислоты попадают через портальную систему в печень.
Разложение белков при гнилостных процессах в кишечнике. В ротовой полости и желудке в норме нет условий для развития гнилостных бактерий. В кишечнике часть аминокислот до всасывания используется микробами как источник питания. При избыточном потреблении животных белков и ряде патологий в кишечнике возможно развитие гнилостных и бродильных процессов. При декарбоксилировании аминокислот микробами образуются амины, иногда ядовитые (путресцин, кадаверин). При дезаминировании возникают различные продукты: насыщенные и ненасыщенные кислоты, оксикислота, кетокислота.
Одним из основных условий декарбоксилировании аминокислот бактериями является наличие кислой среды (pH 3,5—5,5). В кишечнике же при нормальном функционировании среда слабощелочная. Однако в результате инвазии некоторыми патогенными бактериями возникают диспепсии (расстройства пищеварения, не связанные с органическими изменениями желудочно-кишечного тракта), при которых реакция среды в кишечнике подкисляется (обычно локально) до pH 3—5. В подкисленных участках активно развиваются процессы брожения.
При бактериальном разрушении цистина, цистеина и метионина образуются сероводород (H2S), метилмеркаптан (CH3SH) и другие серосодержащие соединения. Из тирозина путем постепенного укорочения его боковой цепи микроорганизмы могут образовывать токсичные крезол и фенол. Эти вещества после всасывания через систему воротной вены попадают в печень. Обезвреживание их происходит при образовании парных соединений с серной или глюкуроновой кислотами. Такие парные соединения нетоксичны, выделяются с мочой.
Из аминокислоты триптофана при гниении белков образуются индол и скатол. У скатола частично разрушена боковая цепь, индол полностью ее лишен. Кольцевая структура остается без изменений.

Индол и скатол — ядовитые вещества, с которыми связан запах кала, они также обезвреживаются в печени путем соединения с серной или глюкуроновой кислотами, предварительно окисляясь в соединения, содержащие гидроксильные группы (соответственно — индоксил и скатоксил); в виде парных соединений они выводятся с мочой.
5.6.2. Тканевые протеиназы животных. Протеолиз у растений и микроорганизмов. Во всех животных тканях обнаружены активные протеолитические ферменты как типа протеиназ (эндопептидазы, пептидил-пептидгидролазы), так и пептидаз. Особенно большая их активность отмечается обычно в интенсивно растущих или делящихся клетках, а также в клетках желез и других органов, характеризующихся высоким уровнем скорости белкового синтеза. Это объясняется тем, что синтез тканевых белков в значительной мере идет за счет аминокислот, образующихся при диссимиляции устаревших белковых молекул. Наряду с доставкой пластического материала для биосинтетических реакций внутриклеточный протеолиз может играть роль в специфических процессах: внутриклеточного переваривания в ходе морфогенеза у насекомых и позвоночных, в реакциях естественного иммунитета, образовании и распаде физиологически активных веществ (ферменты, гормоны). Последнее хорошо иллюстрируется многочисленными примерами превращения проферментов в активные ферменты, наличия во многих органах и тканях протеиназ, расщепляющих избыточное количество отдельных гормонов.
Внутриклеточный протеолиз локализован в основном в лизосомах, содержащих большой набор активных гидролаз, в том числе и кислых протеиназ. Внутриклеточные протеиназы, гидролизующие белки в слабокислой области pH, называются катепсинами. В настоящее время различают пять достаточно хорошо охарактеризованных типов катепсинов, которые обозначают буквами А, В, С, D, Е. Они отличаются оптимумом pH, субстратной специфичностью и рядом других свойств. На долю катепсина D у некоторых животных приходится около 2/3 общей протеолитической активности гомогенатов селезенки, почек. В отличие от катепсинов 5 и С он не относится к сульфгидрильным протеиназам, не ингибируется реагентами на сульфгидрильные группы. Катепсин Е по субстратной специфичности и другим свойствам близок к катепсину D.
Кроме катепсинов, являющихся кислыми тканевыми протеиназами, в различных органах и тканях обнаружены нейтральные и щелочные протеиназы (в эритроцитах, легких, скелетных мышцах, мозге). Их биологические функции и каталитические свойства исследованы пока недостаточно. Особую группу внутриклеточных протеиназ, имеющих оптимум в щелочной области pH, составляют калликреины, широко распространенные в тканях и жидкостях организма. Особенно активны они в крови, слюнных железах, поджелудочной железе. Под действием калликреина плазмы образуется брадикинин, а калликреинов поджелудочной и других желез — каллидин (см. разд. 2.5.1), превращаемый в крови аминопептидазой в брадикинин.
Протеиназы высших растений в большинстве случаев относятся к сульфгидрильному типу, активируются цистеином, глутатионом и другими восстановителями. Оптимальная зона их действия находится в слабокислом, нейтральном и слабощелочном pH и во многом зависит от природы субстрата. Типичный представитель — папаин из сока плодов дынного дерева (Carica papaya). Значительно реже встречаются растительные протеиназы, не активируемые восстановителями. Протеиназы насекомоядных растений (росянка, непентес) имеют резко кислый оптимум pH 3—3,5.
Микроорганизмы образуют в основном секретируемые протеиназы (экзоцеллюлярные), которые обеспечивают их низкомолекулярными продуктами распада белков окружающей среды. Внутриклеточными являются в основном пептидазы, которые расщепляют пептиды, проникшие в клетку из внешней среды. Значительно реже обнаруживаются внутриклеточные протеиназы. Широкой субстратной специфичностью обладают протеазы актиномицетов, гидролизирующие как глобулярные, так и фибриллярные белки.
Препараты протеазы из Str. griseus в связи с универсальностью их действия и большой активностью используют в промышленности, лабораторной биохимической практике и выпускаются под названием проназа (Япония, США) или протелин (СССР).
Хорошо исследованы и широко используют в лабораторной практике и промышленности щелочные протеиназы Вас. subtilis — субтилизины, поскольку они гидролизуют белки глубже и с большей скоростью, чем многие другие протеиназы (в том числе пепсин и трипсин). Это типичные сериновые протеиназы, по строению активного центра очень близкие к химотрипсину.
5.6.3. Дезаминирование и дальнейший катаболизм аминокислот у животных, растений и бактерий. Образовавшиеся в результате протеолиза белков аминокислоты подвергаются дальнейшим превращениям. Начальной стадией катаболизма большинства аминокислот является удаление а-аминогруппы либо путем переаминирования с кетокислотой (чаще всего а-кетоглутаровой), либо путем различных типов дезаминирования: окислительного, восстановительного, гидролитического, внутримолекулярного.
При переаминировании а-аминогруппа аминокислоты переносится к а-углеродному атому а-кетоглутаровой кислоты, значительно реже пировиноградной или щавелевоуксусной. В результате реакции образуются а-кетоаналог исходной аминокислоты и новая аминокислота (см. разд. 5.2.3). Общий итог переаминирования различных аминокислот (кроме лизина и треонина) состоит в том, что все их аминогруппы «собираются» в виде глутаминовой кислоты, а у некоторых организмов — аспартата или аланина. Однако в конечном итоге эти две аминокислоты тоже вступают в реакцию с а-кетоглутаровой кислотой и образуют глутамат, который передает аминогруппы в заключительную серию реакций, ведущих к образованию конечных продуктов азотистого обмена. В дальнейшем аминогруппы, собранные из разных аминокислот в L-глутаминовой кислоте, освобождаются в виде ионов NH+4.
Реакцию окислительного дезаминирования осуществляет специфическая и активная L-глутаматдегидрогеназа:

Таким образом, как в реакциях аминирования кетокислот, переаминирования, так и при дезаминировании ведущую роль играет система глутаминовая кислота⇄а-кетоглутаровая.
L-Глутаматдегидрогеназа особенно активна в цитозоле печени, а также в митохондриях; является аллостерическим ферментом. Ее активность повышается в присутствии АДФ, ГДФ и некоторых аминокислот, подавляется такими эффекторами, как АТФ, ГТФ и НАДН. У многих организмов окислительное дезаминирование может осуществляться за счет флавиновых дегидрогеназ: оксидазы L-аминокислот и оксидазы D-аминокислот. Однако существенного вклада в обмен аминогрупп они не вносят, локализованы в эндоплазматической сети и микротельцах клеток печени и почек. У высших растений основным путем дезаминирования аминокислот также является окислительное дезаминирование, происходящее по той же схеме, что и в печени животных. Оно свойственно грибам, дрожжам, бактериям.
В растениях дезаминирование аминокислот может, кроме того, осуществляться при участии полифенолоксидазы и полифенолов по следующей схеме:
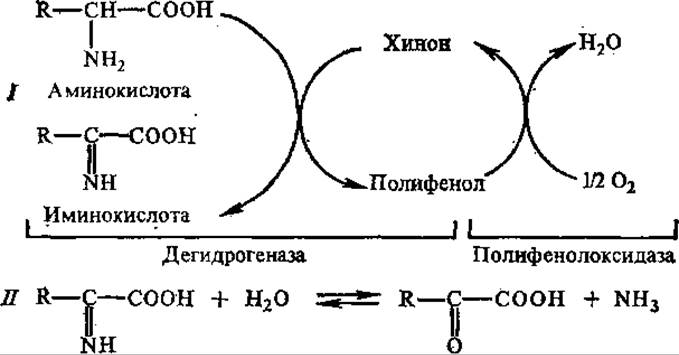
У бактерий, иногда у растений, встречаются другие три типа дезаминирования:
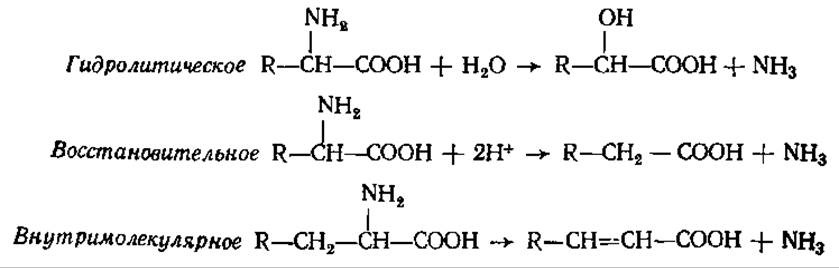
В анаэробных условиях под действием микроорганизмов — аммонификаторов аминокислоты разлагаются таким образом, что одна окисляется, а другая восстанавливается и при этом выделяется аммиак:

Кетокислота вновь взаимодействует с одной исходной аминокислотой. Образующиеся в результате катаболизма аминокислот кетокислоти и другие органические соединения подвергаются дальнейшей деградации, что приводит к образованию веществ, которые или включаются в цикл трикарбоновых кислот и служат энергетическим материалом, или используются в качестве предшественников для синтеза метаболитов, в том числе биологически важных соединений. Насколько разнообразны по своей природе образующиеся из аминокислот продукты можно видеть из рис. 5.10.

Рис. 5.10. Основные пути метаболизма аминокислот
Путей включения аминокислот в цикл Кребса несколько, и они зависят от природы бокового радикала аминокислоты. Иногда одна часть углеродного скелета аминокислоты включается в цикл Кребса через одни «ворота», а другая часть — через другие. Например, углеродные каркасы фенилаланина и тирозина поступают в цикл в виде фумаровой и ацетоуксусной кислот.
Таким образом, процесс дезаминирования аминокислот является основным способом превращения азотистых веществ в безазотистые соединения, которые могут быть затем использованы для дальнейшей переработки в углеводы, жиры и другие соединения.
5.6.4. Конечные продукты азотного обмена, эволюционные и экологические аспекты. В результате диссимиляции аминокислот у всех живых организмов образуется аммиак. Однако, будучи токсичным даже в самых малых концентрациях, он не накапливается в клетке, а быстро удаляется либо путем выведения во внешнюю среду, либо путем превращения в нетоксичные соединения. У многих организмов первичное связывание аммиака в клетках происходит путем образования амидов — глутамина и аспарагина. Как показал выдающийся советский агрохимик Н. Д. Прянишников, этот путь особенно характерен для растительных тканей, у которых в форме указанных амидов запасается постоянно дефицитный для растений азот. Однако и у животных образование глутамина (в несколько меньшей мере аспарагина) широко представлено, обнаружено в мышцах, мозге, печени, почках млекопитающих, жировом теле и гемолимфе насекомых.
У животных и человека образующийся в разных тканях и органах глутамин поступает в кровь, а затем в печень и почки, т. е. является своеобразной транспортной формой аммиака и временным его хранилищем. В последние годы обнаружено, что аспарагиновая и глутаминовая кислоты могут амидироваться, находясь в составе белковой молекулы, т. е. возможно амидирование белков.
Освобождающийся в тканях NH3 может сразу же использоваться и на синтез новых аминокислот, чаще всего путем восстановительного аминирования (см. разд. 5.2.3).
У человека, а также всех млекопитающих, амфибий и ряда других животных основным конечным продуктом азотного обмена, выводимым из организма, является мочевина.
Еще в конце прошлого столетия И. П. Павлов, М. В. Ненцкий, И. Залесский, С. С. Салазкин установили, что синтез мочевины осуществляется в печени. Первая теория синтеза мочевины была разработана М. В. Ненцким, в ней правильно утверждалось, что исходными соединениями для образования мочевины являются NH3 и СО2. В 30-х годах Г. Кребс, подробно исследуя цепь реакций образования мочевины, нашел, что эта цепь имеет циклический характер и существенную роль в процессе играет орнитин. В связи с последним весь процесс биосинтеза мочевины получил название орнитинового цикла.
В первой реакции цикла взаимодействуют NH3, СО2, две молекулы АТФ с образованием карбомоилфосфата (см. разд. 5.2.2), Фермент карбамоилфосфат-синтаза локализован в митохондриях печени, донором азота для этого фермента может служить только NH3. Карбамоилфосфат отдает свою карбамоильную группу орнитину, в результате образуется цитруллин. Эта реакция катализируется орнитин-карбамоилтрансферазой:

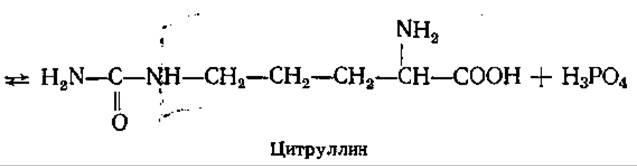
Вторая NH2-группа будущей молекулы мочевины включается в цикл с помощью аспарагиновой кислоты, образующейся за счет переаминирования между глутаминовой кислотой и оксалоацетатом. Превращение глутаминовой кислоты в аспарагиновую катализируется ферментом аспартатаминотрансферазой. Аминогруппа аспарагиновой кислоты конденсируется с карбамильной группой цитруллина. Реакция протекает в присутствии АТФ, катализируется аргининосукцинат-синтетазой. В результате образуется аргининосукцинат, который затем обратимо расщепляется до аргинина и фумарата.
Аргинин расщепляется аргиназой до мочевины и орнитина, который снова входит в цикл (рис. 5.11). Следовательно, для синтеза одной молекулы мочевины нужны две молекулы NH3, одна молекула СO2 и три молекулы АТФ. Количество выделяемой из организма мочевины находится в зависимости от количества белков в пище и у взрослого человека в норме составляет 25—35 г/сут.
Далеко не у всех систематических групп животных основным конечным продуктом белкового обмена является мочевина. В процессе эволюции у разных видов животных в зависимости от условий жизнеобитания сформировались разные биохимические пути образования экскретируемых конечных продуктов азотного обмена (табл. 5.2). Таким образом, конкретные формы конечных продуктов азотного обмена определяются и уровнем эволюционного развития, и условиями внешней среды (среди последних главную роль играет обеспеченность водой).
Таблица 5.2. Основные конечные продукты азотного обмена у разных групп животных
Животные |
Главный конечный продукт белкового обмена |
Животные |
Главный конечный продукт белкового обмена |
Водные беспозвоночные |
Аммиак |
Черепахи |
Мочевина и мочевая кислота |
Костистые рыбы |
Аммиак, некоторое количество мочевины |
Насекомые |
Мочевая кислота |
Пластинчатожаберные |
Мочевина |
Наземные брюхоногие моллюски |
» » |
Крокодилы |
Аммиак, некоторое количество мочевой кислоты |
Ящерицы |
|
Эмбрионы амфибий |
Аммиак |
Змеи |
» » |
Взрослые амфибии Млекопитающие |
Мочевина |
Птицы |
» » |
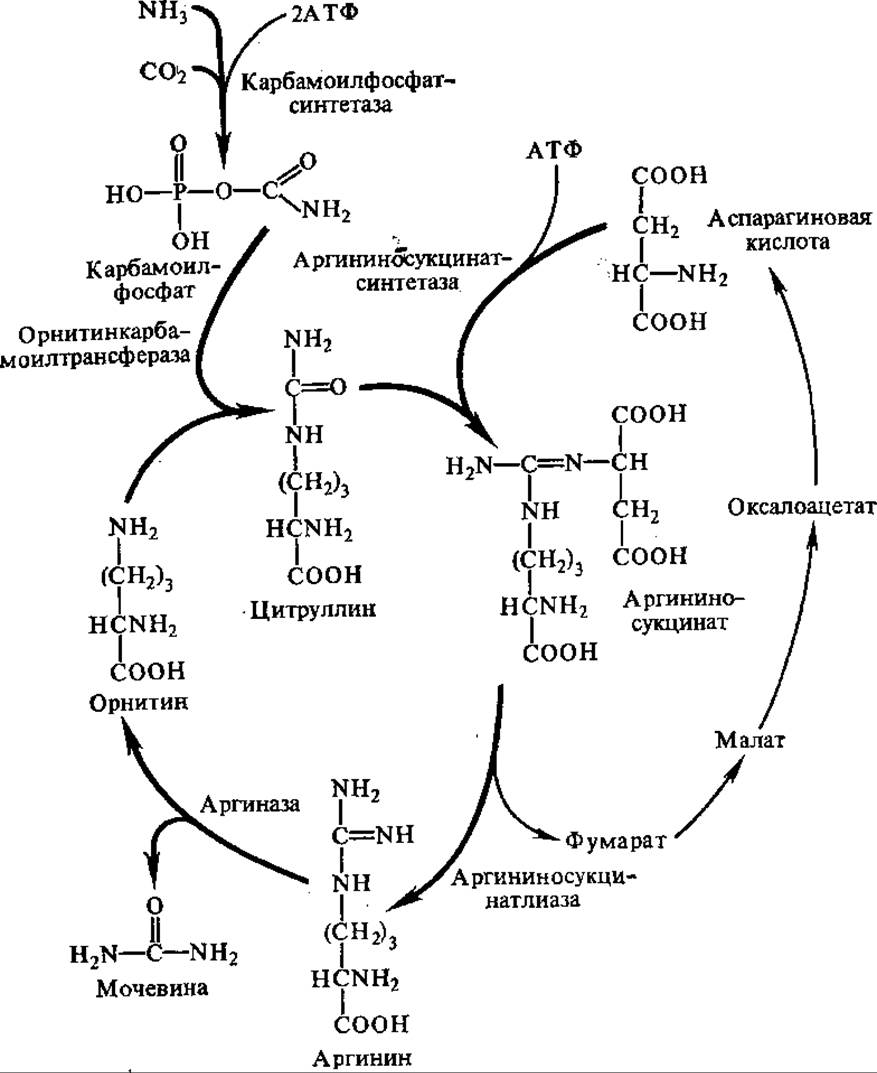
Рис. 5.11. Орнитиновый цикл
Способность к обезвреживанию аммиака путем синтеза органических соединений появилась у животных на определенной ступени их эволюционного развития. У многих беспозвоночных, особенно обитателей водоемов, аммиак и аммонийные соли составляют до 80% азотистых веществ, выделяющихся с мочой. Эта группа животных получила название аммониотелических. В условиях больших объемов воды выделяющийся аммиак разводится до столь малых концентраций, что они становятся нетоксичными. Аммиак образуется у этих животных непосредственно в почечных канальцах в результате расщепления глутамина и сразу же поступает в мочу; Глутамин + Н2О→Глутаминовая кислота + NH3. Для беспозвоночных характерно также выделение с мочой некоторого количества аминокислот (до 25% от белков пищи). Видимо, азотный обмен беспозвоночных недостаточно совершенен, они не способны полноценно использовать белки пищи.
В значительной мере аммониотелическими животными являются также пресноводные костистые рыбы, система химического связывания аммиака у них развита еще слабо. У костистых морских рыб на долю аммонийных солей приходится 40—60% суммарного азота мочи. Кроме того, у них довольно много выделяется триметиламиноксида О = N ≡ (СН3)3. Его образование связано, видимо, с окислительным расщеплением холина.
Небольшое количество аммонийных солей (3—6% общего азота мочи) обнаруживается и в моче человека, позвоночных животных. Однако для них это нетипичный конечный продукт азотного обмена. При некоторых заболеваниях (например, при диабете) в организме накапливаются кислые продукты метаболизма, наступает ацидоз. В таких случаях количество аммонийных солей в моче резко возрастает, NH3 используется для нейтрализации кислот. При этом организм экономит расходование других, полезных для него катионов (К, Mg и др.), поддерживает нормальное солевое равновесие.
Большинство наземных позвоночных животных — млекопитающие, амфибии (во взрослом состоянии), хрящевые рыбы—образуют группу уреотелических животных, основным конечным продуктом азотного обмена у них является хорошо растворимая в воде мочевина. Птицы и наземные пресмыкающиеся потребляют ограниченное количество воды, у летающих птиц она создает перегрузку массы, наземные рептилии обитают часто в засушливых местах. У них моча представляет собой полужидкую массу, содержащую кристаллы плохо растворимой в воде мочевой кислоты. Такие организмы называют урикотелическими. Кроме птиц и наземных рептилий к ним относятся насекомые.
Образование мочевой кислоты, происходящее в печени и отчасти в слизистой кишечника, представляет собой сложный процесс, поскольку ему предшествует образование пуриновых циклов. При этом два атома азота пурина дают амидные группы глутамина, один атом азота — аспартат и один — глицин (см. разд. 4.5.2).
У человека и приматов мочевая кислота присутствует в моче, но в очень небольших количествах как конечный продукт обмена пуринов (у человека в норме за сутки с мочой выделяется 0,6—0,7 г мочевой кислоты). При заболевании подагрой резко увеличивается содержание мочевой кислоты в крови, ее малорастворимая натриевая соль откладывается в хрящах, сухожилиях, суставных сумках. Отложение мочевой кислоты и ее солей (ураты) в виде камней происходит также в почках. Возникновению подагры способствует избыток мясной пищи, содержащей много пуриновых оснований.
Интересный пример зависимости азотного обмена от условий жизни представляют собой двоякодышащие рыбы из тропических водоемов. Во время жаркого периода года они зарываются в ил, моча содержит много мочевины; в сезон тропических дождей, когда реки заполняются водой, двоякодышащие рыбы освобождаются от избытка мочевины, накопившейся во время засухи, и начинают, подобно многим другим рыбам, выделять аммонийные соли. У водных черепах, живущих в сырых местах, выделяется мочевина, а у черепах засушливых районов — мочевая кислота. У лягушек, живущих в воде, головастик выделяет с мочой в основном аммонийные соли, т. е. может быть отнесен к аммониотелическим животным. Взрослые лягушки, с выходом на сушу, выделяют мочевину и являются уреотелическими.
На образование конечных продуктов азотного обмена у птиц и рептилий большое влияние оказывают условия их эмбрионального развития — замкнутое пространство яйца, окруженного оболочками, непроницаемыми для воды. Количество воды в яйце очень небольшое, образование токсичных аммонийных солей быстро привело бы к гибели эмбриона. Синтез мочевины имел бы последствием резкое повышение осмотической концентрации, что тоже отрицательно сказалось бы на развитии эмбриона. И только образование малорастворимой в воде мочевой кислоты не влияет на развитие эмбриона, она образует осадок, выключается из обмена. Интересно, что в самый первый период развития эмбрион птиц выделяет в среду аммонийные соли, затем мочевину и, наконец, далее — мочевую кислоту, что сохраняется в течение всего постэмбрионального пути. Таким образом, здесь наблюдается своеобразное биохимическое выражение известного биогенетического закона Мюллера — Геккеля повторения филогенеза в онтогенезе.
У человека и млекопитающих уреотелический тип азотного обмена устанавливается уже во время эмбриогенеза. Образующаяся у них мочевина поступает через плаценту в кровь матери и затем почками удаляется из организма.
У большинства млекопитающих мочевая кислота, образующаяся в небольших количествах как конечный продукт обмена пуриновых оснований, в дальнейшем окисляется с участием фермента печени уратоксидазы до аллонтоина: У собак, например, почти весь пуриновый азот выделяется с мочой в форме аллантоина. У человека, приматов и птиц нет уратоксидазы, поэтому мочевая кислота у них сама является конечным продуктом пуринового обмена. Свиньи кроме аллантоина выделяют с мочой гуанин, так как у них мала активность гуаниндезаминазы. В связи с этим у свиней описаны случаи гуаниновой подагры, при которой кристаллы гуанина откладываются в суставах. Гуанин является конечным продуктом метаболизма у пауков.

У многих животных (кроме млекопитающих) аллантоин может подвергаться дальнейшему расщеплению с образованием аллантоиновой кислоты (у некоторых рыб), а из нее — мочевины и глиоксиловой кислоты (амфибии, большинство рыб, пресноводные пластинчатожаберные моллюски), аммиака (ракообразные, некоторые морские беспозвоночные). С эволюционной точки зрения интересно отметить, что по мере усложнения форм животных у них исчезают отдельные ферменты расщепления мочевой кислоты; у человека и приматов эти ферменты вообще отсутствуют.
Постоянным азотсодержащим компонентом мочи человека и многих позвоночных является креатинин — ангидрид креатина (метилгуанидинуксусная кислота). Человек выделяет его 1,5—2,5 г/сут. Креатина особенно много в мышцах, где его макроэргический фосфорный эфир (креатинфосфат) является основной формой запасания энергии. А. В. Палладии впервые предположил, что в синтезе креатина принимает участие аргинин. В наше время опыты с использованием меченых атомов подтвердили это: синтез креатина (он происходит в почках и печени) начинается с переноса гуанидинового фрагмента аргинина на глицин, образовавшаяся гуанидинуксусная кислота затем метилируется. Креатинин образуется или непосредственно из креатина при отщеплении воды (1), или из креатинфосфата при отщеплении Н3РО4(2):

Сам креатин в моче взрослого человека обычно отсутствует или содержится в очень небольших количествах. Однако существует прямая зависимость между содержанием креатина (и креатинфосфата) в мышцах и креатинина в моче. Особенно устойчиво коррелирует содержание креатинина в моче с мышечной массой данного человека.
Выделение самого креатина с мочой достаточно часто наблюдается в детском возрасте. Появление его в моче взрослых (креатинурия) является следствием той или иной патологии: различные формы мышечной дистрофии, миозит (воспаление скелетных мышц), диабет, гипертиреоз, авитаминоз Е. У женщин креатинурия бывает при беременности и в раннем послеродовом периоде.
У беспозвоночных животных вместо креатинина в моче присутствует аргинин, креатинин же обнаруживается крайне редко. Метаболическую и энергетическую роль креатинфосфата у беспозвоночных животных выполняют различные другие фосфорилированные гуанидинсодержащие вещества, наиболее часто — аргининфосфат.
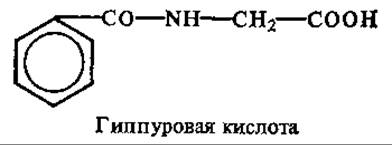
В моче человека также всегда содержится некоторое количество (0,1—2 г в суточном объеме) гиппуровой кислоты. Очень много ее в моче травоядных животных, так как она образуется из бензойной кислоты, продукта расщепления ароматических соединений растительных тканей.
Сравнение путей и механизмов катаболизма белков у разных представителей живого мира позволяет заключить, что основные черты этого процесса имеют много общего и исходного. Следовательно, эти биохимические процессы сформировались на достаточно ранних этапах эволюции до разделения единого потока живой материи по отдельным руслам. В дальнейшем ходе эволюции разные таксономические группы, занимая определенные экологические ниши, формировали специфические особенности белкового метаболизма, которые способствовали их выживанию в конкретных сочетаниях условий жизнеобитания, помогали полнее использовать эти условия.
Высшие растения с их неподвижным образом жизни достаточно быстро используют соли азота в зоне корневой системы, поэтому эволюция их азотного обмена шла в направлении экономного использования азота в условиях строго ограниченного его поступления в организм. В связи с этим растения не экскретируют продукты обезвреживания аммиака во внешнюю среду. Аспарагин и глутамин являются у них запасными формами азота. Кроме детоксикации аммиака и запасания азота аспарагин и глутамин важны так же, как резервные формы дикарбоновых аминокислот, необходимых для многих метаболических процессов. Не удивительно поэтому, что содержание амидов в белках растений достигает очень больших величин: в белках семян кукурузы и пшеницы количество дикарбоновых кислот составляет 35—45%, причем большая часть — в форме амидов.
У растений, отличающихся высоким содержанием органических кислот в тканях (щавель, ревень), обезвреживание аммиака происходит путем образования аммиачных солей органических кислот. В тканях некоторых высших растений обнаружена и мочевина, синтезирующаяся в орнитиновом цикле. Большие количества мочевины накапливают некоторые грибы (шампиньоны — до 13%). Исследованиями известного биохимика и физиолога растений из ГДР К. Мотеса (1962) показано относительно широкое распространение у растений аллантоина. В некоторых растениях (ольха, береза, орешник и др.) накапливаются значительные количества цитруллина, в форме которого обезвреживается, видимо, аммиак. Однако образование мочевины, аллантоина, цитруллина для растений в делом нетипично (все они не выделяются во внешнюю среду).
Много своеобразного и пока еще плохо исследованного существует в соотношениях процессов катаболизма и биосинтеза белков у бактерий. Долгое время ставили под сомнение возможность применения для них термина «обновление белков», предполагали стабильность некоторых белков (в границах жизни клетки). Только в 60-х годах было достоверно показано, что в живых, но не размножающихся клетках Е. coli и дрожжей происходит обновление белков. Установлено, что в клетках Е. coli в логарифмической фазе роста деградация белка происходит со скоростью около 3% в расчете на одну генерацию. При этом скорость деградации часто не зависит от физиологического состояния клетки. Видимо, концентрация белков в бактериальных клетках есть функция прежде всего процессов их биосинтеза.
При дезаминировании аминокислот у бактерий наряду с общими для всех живых организмов путями дезаминирования функционируют специфичные для бактерий: восстановительный, гидролитический, внутримолекулярный. Характерно для ряда бактерий и присутствие высокоактивных малоспецифичных оксидаз L- и D-аминокислот. Многие микроорганизмы (прежде всего — анаэробные) сбраживают аминокислоты, используют их не только как строительный материал, но и как источник энергии. Известны бактерии, специализирующиеся на сбраживании пуриновых и пиримидиновых оснований, мочевой кислоты.
Принципиальное различие между бактериями и животными наблюдается в отношении регуляции метаболизма аминокислот. У бактерий, когда они попадают в среду, богатую всеми аминокислотами, происходит репрессия синтеза тех ферментов, которые участвуют в синтезе аминокислот. Когда же богатую аминокислотами пищу получают животные, у них активируются процессы деградации аминокислот.