Основы биохимии - А. А. Анисимов 1986
Биологическое окисление и биоэнергетика
Окислительное фосфорилирование
7.3.1. Дыхательная цепь. В цикле трикарбоновых кислот от субстратов отщепляются протоны и электроны. Они поступают на коферменты НАД+ и ФАД+, которые передают их в дыхательную цепь, образованную окислительно-восстановительными ферментами, находящимися во внутренней мембране митохондрий. Передвигаясь от одного переносчика электронов к другому, электроны опускаются на все более низкие энергетические уровни, отдавая порциями свою энергию. В последнем звене цепи они восстанавливают молекулярный кислород. Освобожденная при переносе электронов по дыхательной цепи энергия запасается в фосфатных связях АТФ.
Синтез АТФ из АДФ и фосфорной кислоты, который происходит с использованием энергии, освобождающейся при окислении веществ в живых клетках, и сопряжен с переносом электронов по дыхательной цепи, называется окислительным фосфорилированием. Оно было открыто в начале 30-х годов XX столетия В. А. Энгельгардтом.
Дыхательную цепь нередко называют редокс-цепью, что в переводе означает окислительно-восстановительная цепь, поскольку в ней многократно протекают процессы окисления — восстановления. Ее называют также цепью переноса электронов, электронтранспортной или электронпереносящей цепью. Эти понятия более широкие, чем «дыхательная цепь», так как подобные системы функционируют в мембранах хлоропластов, ядер, микросом.
Компоненты дыхательной цепи, осуществляющие перенос электронов и окислительное фосфорилирование, слиты в единое целое с внутренней мембраной митохондрий и функционируют в форме полиферментативных комплексов или ансамблей. Одну полную цепь переноса электронов составляет большое число молекул. Так, в митохондриях, полученных из сердца быка, цепь переноса электронов состоит примерно из 80 белковых молекул. Только 1/3 из них — непосредственные переносчики электронов, остальные 2/3 — белки, выполняющие вспомогательные функции.
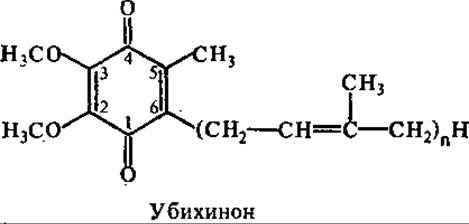
В состав дыхательной цепи входит небелковый переносчик электронов — убихинон, который иногда называют коферментом Q (сокращенно KoQ). Он представляет собой производное бензохинона с изопреноидной боковой цепью, которая у разных видов организмов содержит от 6 до 10 пятиуглеродных изопреновых остатков. В большинстве тканей млекопитающих функционирует убихинон Q10 (10 — число изопреновых остатков в боковой цепи), у дрожжевых грибов — Q6. Убихинон может участвовать в одно - или двухэлектронном переносе. При частичном восстановлении (одноэлектронный перенос) он образует относительно стойкий семихинон, при полном (двухэлектронном) восстановлении — гидрохинон (убихинол).
Таким образом, убихинон и его гидрохинон образуют окислительно-восстановительную пару. Они переносят водородные атомы, т. е. электроны и протоны, от одной группы переносчиков к другой. Убихинон может мигрировать в липидной фазе мембраны, представляя собой мобильный субстрат для ферментов, встроенных в мембрану.
Электроны и протоны отщепляются от субстратов в реакциях цикла Кребса преимущественно пиридинзависимыми дегидрогеназами с образованием НАДН. Последний окисляется флавинзави- симым ферментом — НАДН-дегидрогеназой. Она отдает электроны и протоны убихинону, который передает их системе цитохромов.
Флавинзависимых дегидрогеназ известно много. Они содержат в качестве простетических групп флавинадениндинуклеотид (ФАД) или флавинмононуклеотид (ФМН), которые прочно связаны с белком, во многих случаях ковалентно. В окислительно-восстановительных реакциях участвует изоаллоксазиновое кольцо рибофлавина: происходит перенос двух атомов водорода на ФАД или ФНМ с образованием восстановленных форм ФАДН2 и ФМН∙Н2. Нередко флавиновые ферменты и образуемые ими комплексы содержат в своем составе атомы металлов, чаще всего в форме белков с железосерными центрами (FeS-белки). В этих белках железо находится не в форме гема, а присоединено координационными связями к атомам серы в цистеиновых остатках белка. Некоторые белки содержат лабильно связанные атомы серы.
От некоторых субстратов (янтарная кислота, глицеролфосфат, КоА-производные жирных кислот) флавиновые ферменты сами отнимают водород, минуя пиридинзависимые дегидрогеназы и НАДН. Флавиновые дегидрогеназы передают электроны и протоны в дыхательную цепь на убихинон. Примером могут служить сукцинатдегидрогеназа, глицерол-3-фосфат-дегидрогеназа. Они содержат в своем составе железосерные центры. При окислении КоА-производных жирных кислот флавопротеин отщепляет атомы водорода от алифатической цепи и передает их второму флавопротеину, от которого они поступают к третьему флавопротеину, содержащему железосерные центры и передающему атомы водорода на убихинон (рис. 7.2).

Рис. 7.2. Расположение основных компонентов дыхательной цепи во внутренней мембране митохондрий:
a, a3, b, с, c1 — компоненты цитохромной системы; остальные пояснения см. в тексте
Важнейшей флавинзависимой дегидрогеназой дыхательной цепи является НАДН-дегидрогеназа, осуществляющая окисление НАДН. Структура НАДН-дегидрогеназного комплекса еще не выяснена полностью. В нем содержится не менее 10 отдельных полипептидных цепей, ФМН и белки с железосерными центрами. В нативном препарате на одну молекулу ФМН приходится 16 Fe и 16 S-2. Исследования спектра ЭПР позволили выявить четыре железосерных центра. Белки, содержащие железосерные центры, обнаружены в составе второй важнейшей дегидрогеназы, входящей в состав дыхательной цепи, — сукцинатдегидрогеназы — и в ферментативном комплексе, окисляющем восстановленный убихинон окисленным цитохромом с.
Сукцинатдегидрогеназа — фермент внутренней мембраны митохондрий; выделена из сердечной мышцы быка, М = 97 000 (состоит из двух субъединиц с М = 70 000 и 27 000). Более крупный компонент содержит субстратсвязывающий центр и ФАД. В обеих субъединицах обнаружены железосерные центры. Электроны от сукцината поступают на ФАД, затем на железосерные центры большой субъединицы, а от нее — на железосерные центры малой субъединицы.
От восстановленного убихинона электроны поступают на цитохромную систему. Цитохромы — группа железосодержащих белков. Они присутствуют во всех аэробных клетках. В состав цитохромов входят железопорфириновые простетические группы, подобные находящимся в гемоглобине и миоглобине. В ходе переноса электронов обратимо изменяется валентность содержащегося в дитохромах железа:
![]()
Роль цитохромов в дыхании клеток была впервые исследована Д. Кейлиным (1925). В настоящее время из различных видов живых организмов выделено большое число цитохромов. Их делят на группы, основываясь на различиях структуры гемовой простетической части. Выделяют четыре типа гемов, их обозначают буквами ß, b, с и d. Они отличаются боковыми цепями порфириновых структур. При обозначении цитохромов с хорошо установленной структурой при букве ставят числовой индекс, который указывает на принадлежность цитохрома к определенной подгруппе. Например, в митохондриях высших животных и растений идентифицировано пять различных цитохромов: а, а3 b, с, с1.
Цитохромы отличаются друг от друга по своим белкам, по природе боковых цепей порфиринов и по способу присоединения гема к белкам. В спектре поглощения цитохромов в восстановленной форме наблюдаются три основные полосы поглощения в видимой области. В порядке уменьшения длин волн их обозначают как а-, ß- и у-полосы; из них а-полоса обычно имеет вид острого пика. В связи с этим при обозначении цитохромов с недостаточно исследованной структурой указывают длину волны (в нанометрах) а-полосы поглощения в спектре восстановленной формы. Так, в дыхательную цепь входят два цитохрома b-группы: b562 и b566. В то же время нередко используют названия цитохромов, данные им по случайным признакам. Например, в эндоплазматической сети локализуется цитохром Р-450, названный так потому, что его комплекс с СО имеет максимум поглощения при длине волны 450 нм.
С кислородом реагирует лишь последний цитохром дыхательной цепи — цитохром с-оксидаза (цитохром аа3). Это единственный цитохром, обладающий каталитическими, т. е. ферментативными, свойствами, другие цитохромы не являются ферментами. Молекула этой оксидазы содержит два атома Сu и две группы гема типа а: а и а3. Цитохром с-оксидаза, находящаяся во внутренней мембране митохондрий сердечной мышцы быка, состоит из шести разных белковых субъединиц. Цитохромоксидаза из дрожжей и Neurospora содержит семь субъединиц. Цитохромоксидаза осуществляет быстрое окисление цитохрома молекулярным O2. Она является терминальной, т. е. конечной, оксидазой дыхательной цепи митохондрий. Цитохромоксидаза локализована во внутренней мембране митохондрий, с которой относительно прочно связана, образуя асимметричный мостик между двумя сторонами мембраны. Предполагают, что гем а3 находится на внутренней стороне, а гем а, который первым взаимодействует с цитохромом с, — на наружной стороне внутренней мембраны митохондрий. Кислород подходит к цитохромоксидазе, по-видимому, со стороны матрикса, происходит четырехэлектронное восстановление молекулы O2 до воды.
Универсальным донором атомов Н для дыхательной цепи служит НАДН. Если при окислении субстрата возникает НАДФН, то он обычно используется как восстановитель в процессах биосинтеза. Однако может протекать трансгидрогеназная реакция, посредством которой атомы водорода передаются от НАДФН на НАД+, после чего поступают в дыхательную цепь:
![]()
Решающее значение в установлении последовательности переноса электронов между компонентами дыхательной цепи имело применение ряда специфических ингибиторов (рис. 7.3). Так, ротенон (инсектицид) ингибирует НАДН-дегидрогеназу, и при его воздействии все компоненты дыхательной цепи переходят в окисленное состояние. Амитал (барбитурат натрия) препятствует восстановлению убихинона. Антибиотик антимицин А блокирует окисление цитохромов b, а цианиды, азид и H2S связываются с цитохромоксидазой. На основании этих определений, а также термодинамических расчетов переносчики электронов можно расположить так, как показано на рис. 7.3.
Каждый компонент дыхательной цепи во внутренней мембране митохондрий встроен между своим восстановителем и окислителем. В результате этого создаются условия для потока электронов от субстрата через последовательно расположенные переносчики электронов к O2. Все белки погружены в толщу мембраны, входят в ее состав, лишь цитохром с лабильно присоединен к наружной поверхности мембраны. Активный центр НАДН-дегидрогеназы располагается на внутренней стороне мембраны, где и реагирует с НАДН. Центр связывания O2 цитохрома а3 также находится на стороне мембраны, обращенной в матрикс (см. рис. 7.2).

Рис. 7.3. Дыхательная цепь митохондрий.
Стрелками показаны места вхождения электронов от различных субстратов в электронпереносящую цепь и их дальнейший транспорт; пунктиром — точки приложения ингибиторов
Когда электроны идут по дыхательной цепи, на определенных участках они теряют свою энергию в сравнительно большом количестве, вполне достаточном для образования АТФ. Это участки сопряжения окисления и фосфорилирования, на которых функционируют белки, называемые сопрягающими факторами. Последние образуют сопрягающее устройство или Н+-АТФазный комплекс, синтезирующий АТФ из АДФ и Фн. Он пронизывает внутреннюю мембрану митохондрий, которая поэтому и называется сопрягающей мембраной. Кроме белков, участвующих в переносе электронов и преобразовании энергии, внутренняя мембрана митохондрий содержит структурные белки и липиды.
7.3.2. Энергетика переноса электронов. Реакции, при которых происходит перенос электронов от донора электронов (восстановитель) к акцептору электронов (окислитель), называются окислительно-восстановительными. В некоторых из них перенос электронов осуществляется путем передачи атомов водорода.
Восстановители и окислители образуют окислительно-восстановительные пары:
![]()
Способность восстановителя отдавать электроны окислителю обычно выражается величиной стандартного восстановительного потенциала (TE'0). Он измеряется при pH 7,0 и температуре 25°С. Стандартный восстановительный потенциал численно равен электродвижущей силе (в вольтах), возникающей в полуэлементе, в котором окислитель и восстановитель, присутствующие в концентрациях 1,0 моль при стандартных условиях, находятся в равновесии с электродом, способным обратимо принимать электроны от восстановителя.
В качестве стандарта принят восстановительный потенциал реакции: Н2 ⇄ 2Н+ + 2е-. При давлении газообразного Н2 в 1,0 атм, концентрации ионов Н+, равной 1,0 моль (что соответствует pH 0), и 25°С его условно считают равным 0. При pH 7,0 стандартный восстановительный потенциал системы Н2 ⇄ 2Н+ равен — 0,42 В.
Знание стандартных восстановительных потенциалов различных биологических систем позволяет определять направление потока электронов. Согласно законам термодинамики, если существуют два компонента, способные к окислению — восстановлению, но обладающие разным восстановительным потенциалом, вещество с более высоким потенциалом будет служить в такой системе окислителем, а вещество с более низким потенциалом — восстановителем. В дыхательной цепи все реакции направлены по термодинамической лестнице от компонента с максимально отрицательный потенциалом — НАДН (—0,32 В) к кислороду, имеющему большую положительную величину потенциала (+0,82 В). По этому
принципу можно расположить все переносчики электронов дыхательной цепи в определенном порядке: НАД→ФАД→цитохром b→цитохром с→цитохром а→O2.
Если реагируют друг с другом две окислительно-восстановительных пары, то можно рассчитать стандартное изменение свободной энергии AG0' по формуле
∆G0' = — nF∆E'0, (1)
где ∆G0' — стандартное изменение свободной энергии в килоджоулях, n — число переносимых электронов, F — число Фарадея (96,5 кДж), ∆Е'0 — разность стандартных восстановительных потенциалов акцептора и донора электронов. Например: пара электронных эквивалентов переносится от НАДН (E'0 = —0,32 В) к молекулярному кислороду (Е'0 = +0,82 В), т. е. проходит всю дыхательную цепь, изменение свободной энергии составляет: ∆G0'= -2∙96,5∙[0,82—(—0,32)]= —220 кДж.
Таким образом, перенос электронов через всю дыхательную цепь от НАДН к молекулярному кислороду приводит к большому изменению свободной энергии. В физиологических условиях для образования АТФ из АДФ и неорганического фосфата требуется —34,5 кДж. Используя уравнение (1), можно рассчитать, что для синтеза АТФ достаточна разность потенциалов 0,2 В. Следовательно, при переносе одной пары электронов через всю дыхательную цепь выделяется энергия, достаточная для синтеза нескольких молекул АТФ.
7.3.3. Участки сопряжения в дыхательной цепи. В дыхательной цепи содержится три участка, в которых перенос электронов сопровождается большим изменением разности потенциалов (свободной энергии). Уменьшение свободной энергии в каждом из этих участков достаточно велико для того, чтобы обеспечить образование АТФ из АДФ и Фн. Именно в этих участках дыхательной цепи осуществляется запасание энергии в фосфатных связях АТФ (рис. 7.4).
Более точно участки сопряжения были определены путем измерения коэффициента окислительного фосфорилирования — Р/О. Он был предложен в 1939 г. советским ученым В. А. Белицером как мера эффективности окислительного фосфорилирования. В этих опытах, ставших классическими, было показано, что в электронпереносящей цепи осуществляется одно или несколько фосфорилирований, сопряженных с окислением. Коэффициент Р/О — это число молей АТФ, образующихся из АДФ и Фн на один грамм-атом поглощенного кислорода.
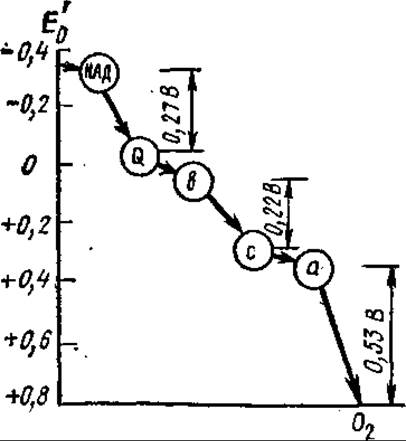
Рис. 7.4. Уменьшение свободной энергии, обусловленное перемещением пары электронов по дыхательной цепи от НАДН до кислорода
К настоящему времени коэффициенты P/О определены для окисления митохондриями ряда субстратов. Так, для НАДН и субстратов, окисляющихся НАДН-дегидрогеназами (яблочная, пировиноградная, изолимонная кислоты), Р/O = 3, а при окислении янтарной кислоты в фумаровую Р/О = 2. Следовательно, электроны и протоны, отщепляемые от НАДН, проходят через три, а от янтарной кислоты только через два участка сопряжения (второй и третий) дыхательной цепи (см. рис. 7.3).
Большое значение для выяснения локализации участков сопряжения в дыхательной цепи имели работы Б. Чанса. Им развито представление о пяти состояниях дыхательной цепи. Состояние 1 наблюдается в отсутствие субстратов окисления и фосфорилирования, при этом скорость дыхания чрезвычайно низка. При состоянии 2 дыхание ограничено, так как отсутствует субстрат окисления, хотя субстрат фосфорилирования (АДФ) добавлен в достаточном количестве. Состояние 3 — это самое активное состояние, характеризующееся высокой скоростью дыхания. В среду инкубации добавлены в избытке и субстраты окисления, и субстрат фосфорилирования (АДФ). Скорость дыхания ограничивается только скоростью проникновения субстратов в митохондрии и активностью ферментов окислительного фосфорилирования.
После того как весь добавленный АДФ превратится в АТФ, дыхание вновь затормозится. Это состояние 4, или состояние дыхательного контроля. На сопрягающей мембране накапливается электрохимический потенциал ионов Н+, мембрана не может разряжаться из-за отсутствия АДФ. Мембранный потенциал препятствует движению электронов по дыхательной цепи, и тогда окисление субстрата тоже прекращается. Остановка дыхания никогда не бывает полной, так как рано или поздно наступает «утечка» мембранного потенциала, что обеспечивает низкую скорость дыхания, т. е. дыхательный контроль1. Митохондрии обладают очень высоким сродством к АДФ. Новая добавка АДФ возвращает высокую скорость дыхания (состояние 3), которое продолжается до исчерпания АДФ или кислорода. В последнем случае наступает анаэробиоз, или состояние 5.
1 В. П. Скулачевым введено понятие «протонный контроль», под которым понимается торможение активности Н+-АТФазы, а также дыхательных и фотосинтетических цепей переноса электронов посредством градиента электрохимического потенциала протонов или одной из его составляющих. Это понятие несколько шире, чем дыхательный контроль, так как относится не только к дыхательным, но и к фотосинтетическим редокс-цепям.
Б. Чанс и сотрудники, используя спектрофотометрический метод, сравнили степень окисленности переносчиков электронов при всех пяти состояниях дыхательной цепи и определили положение участков сопряжения в ней. Если дыхательная цепь заторможена из-за отсутствия АДФ (состояние 4), то она заторможена в участках сопряжения. Тогда переносчик, расположенный до точки сопряжения, должен находиться в восстановленной форме, на нем накоплены электроны, так как его окисление затруднено. Второй переносчик, расположенный после точки сопряжения, находится в наиболее окисленной форме, так как затруднено его восстановление. После этого к митохондриям добавляется АДФ, т. е. дыхательная цепь переходит в состояние 3 — наиболее активное. Интенсивность дыхания увеличивается примерно в 50 раз. Перенос электронов в участках сопряжения при этом ускоряется. Первый переносчик, расположенный до точки сопряжения, окисляется, второй, расположенный после точки сопряжения, восстанавливается.
В результате Б. Чанс установил участки сопряжения в дыхательной цепи: они соответствуют участкам, где перенос электронов сопровождается большим изменением разности потенциалов: первый — между НАДН и ФП1, второй — между цитохромом b и цитохромом с1, третий — на участке цитохромоксидазы. Таким образом, дыхательная цепь разделяет энергию, выделяющуюся при переносе электронов, на отдельные «порции». В трех случаях они превышают 34,5 кДж∙моль-1, необходимые для генерирования АТФ из АДФ и фосфата.
7.3.4. Механизм энергетического сопряжения в митохондриях. Вопрос о механизме энергетического сопряжения — это выяснение того, как энергия электронов дыхательной цепи трансформируется в энергию фосфатных связей АТФ. Для объяснения этого явления было предложено много схем, однако все они могут быть разделены на три группы.
Первая (хронологически) — химическая концепция, или промежуточных факторов сопряжения. Она рассматривает окислительное фосфорилирование по аналогии с фосфорилированием при гликолизе. Предполагают, что на продукте окисления образуется высокоэнергетическая связь, и эта энергия переносится на АТФ. Таким образом, предусматривается прямое использование химической энергии, освобождающейся при окислении переносчиков электронов, в энергию предшественника АТФ. Сопряжение между этими двумя реакциями — окисления и синтеза АТФ — осуществляется через общие промежуточные продукты. Так как неорганический фосфат не участвует непосредственно в цепи переноса электронов, предполагают, что в переносе энергии функционируют промежуточные факторы сопряжения, к которым присоединяется фосфат. Ниже на представленной схеме символами А и В обозначены переносчики электронов дыхательной цепи в окисленной или восстановленной форме, X и Y — гипотетические промежуточные факторы сопряжения, Фн — неорганический фосфат.
Восстановленный переносчик АН2 окисляется следующим переносчиком В, образуется высокоэнергетическое соединение А~Х. Затем А вытесняется другим фактором сопряжения — Y. В образовавшемся комплексе X~Y один из промежуточных факторов замещается на Фн, образуется соединение Х~Ф, которое служит непосредственным донором фосфорила для АДФ:
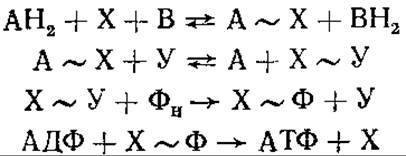
Гипотеза химического сопряжения не смогла объяснить двух фактов. Во-первых, несмотря на длительные поиски, не удалось доказать реальность существования высокоэнергетических промежуточных соединений типа А~Х. Во-вторых, оставалось неясным, почему для осуществления окислительного фосфорилирования необходима неповрежденная мембрана митохондрий.
Эти противоречия легко разрешает хемиосмотическая (или протондвижущая) концепция. Она была сформулирована английским биохимиком П. Митчеллом (1961); многое для ее доказательства сделано В. П. Скулачевым. Хемиосмотическая теория предусматривает переход химической энергии, освобождающейся в процессе переноса электронов, в электрическую энергию мембранного потенциала, а затем преобразование последней в химическую энергию связей АТФ. Согласно этой теории внутренняя мембрана митохондрий (сопрягающая мембрана) обладает высоким электрическим сопротивлением и очень низкой проницаемостью для заряженных частиц, прежде всего для протонов и гидроксид-ионов. Окислительно-восстановительные ферменты, составляющие дыхательную цепь, располагаются поперек внутренней мембраны митохондрий.
Предполагают, что в ней содержится также система ферментов — протонных насосов, приводимых в действие потоком электронов в дыхательной цепи. Используя энергию, выделяющуюся при переносе электронов, «насосы» выкачивают протоны (без сопровождающих их анионов) из матрикса в межмембранное пространство. В результате происходит закисление последнего, наружная сторона сопрягающей мембраны получает положительный заряд. В матриксе митохондрии при этом образуется избыток ОН-, внутренняя сторона мембраны заряжается отрицательно. Таким образом, на сопрягающей мембране одновременно с градиентом концентрации протонов (∆рН) возникает градиент электрического потенциала (∆ψ).
Химическая энергия окисления трансформируется в электрическую и накапливается в форме мембранного потенциала. Внутренняя мембрана митохондрий уподобляется конденсатору, ее поверхность — обкладкам конденсатора, которые разделены слоем изолятора — липидов. Образующийся электрохимический потенциал ионов водорода (∆μН+) состоит, следовательно, из химической компоненты (∆рН) и электрической (∆ψ). Обратный поток протонов по градиенту их концентрации к матриксной стороне мембраны осуществляется через АТФ-синтетазный комплекс. Именно этот поток протонов и служит движущей силой для синтеза АТФ. Согласно теории Митчелла на каждые два протона, прошедшие через мембрану, синтезируется одна молекула АТФ. Следовательно, цепь переноса электронов должна содержать три протонных насоса, соответствующих трем участкам фосфорилирования.
Дыхательная цепь трижды «перешнуровывает» внутреннюю мембрану митохондрий. Каждая пара электронов дыхательных субстратов, транспортируемая от НАДН к кислороду, как бы извлекает три пары ионов Н+ из внутреннего матрикса, которые переносятся затем наружу, в межмембранное пространство. В результате при переносе двух электронов образуется три молекулы АТФ (рис. 7.5).
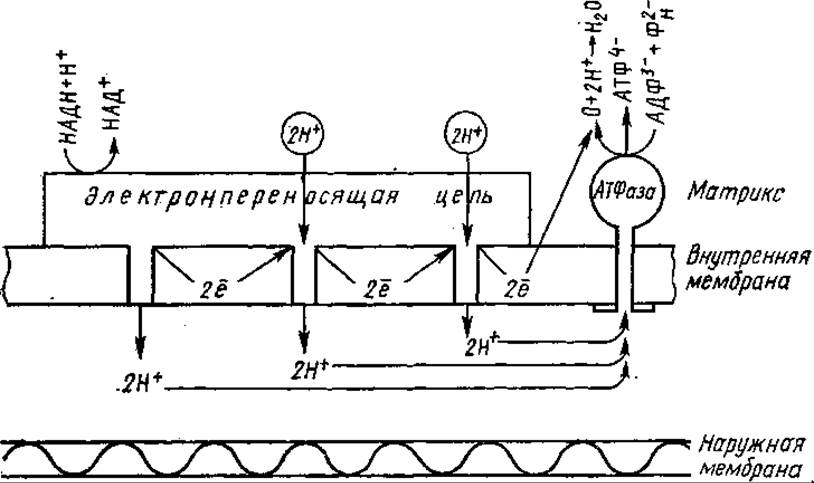
Рис, 7.5. Схема окислительного фосфорилирования, протекающего во внутренней мембране митохондрии посредством протондвижущего механизма
Таким образом, АТФ-синтетаза — это протонный насос. Она использует движение протонов вниз по градиенту для того, чтобы синтезировать АТФ.
В настоящее время хемиосмотическая теория подтверждена большим количеством экспериментов. Так, Э. Рэкер использовал с этой целью бактериородопсин — хромопротеин, содержащий в своем составе ретиналь. Бактериородопсин, поглощая световую энергию, образует на сопрягающей мембране электрохимический потенциал ионов водорода. Из митохондрий сердца быка была получена Н+-АТФаза, из солелюбивых бактерий — бактериородопсин, после чего оба белка соединили с растительным фосфолипидом. Это была химерная протеолипосома — комплекс из веществ, принадлежащих существам из трех разных биологических царств — животных, растений и бактерий. Она оказалась способной к фотосинтезу: поглощая свет, синтезировала АТФ из АДФ и фосфата. Бактериородопсин генерировал протонный ток за счет энергии света, а Н+- АТФаза использовала его при биосинтезе АТФ.
В последние годы Ю. А. Овчинникову, В. П. Скулачеву и сотрудникам удалось непосредственно измерить величину электродвижущей силы, возникающей при освещении бактериородопсина. Его встраивали в фосфолипидную пленку, разделяющую два отсека кюветы, заполненных раствором электролита. В отсеки были погружены электроды. При освещении бактериородопсина (вспышка лазера 15 нс) на мембране возникала разность потенциалов около 0,25 В, т. е. достаточная для синтеза АТФ.
Третья концепция механизма сопряжения окисления и фосфорилирования — конформационная. Она рассматривает работу митохондрий по аналогии с работой мышцы. Прямые эксперименты показывают, что митохондрии могут сокращаться и расслабляться (это обнаруживается по изменению их светорассеяния). Согласно конформационной концепции химическая энергия окисления сначала используется для совершения механической работы (изменения конформации митохондрии) и лишь затем превращается в химическую энергию АТФ. Энергия, освобождающаяся при переносе электронов в дыхательной цепи, используется непосредственно для перевода внутренней мембраны митохондрий в новое, богатое энергией конформационное состояние. Этот этап можно сравнить со сжатием пружины. Затем происходит перенос энергии на АТФ. Мембрана принимает исходную конформацию, «пружина» расслабляется. Эти положения конформационной схемы не получили экспериментального подтверждения. В 1974 г. П. Бойер, модифицируя конформационную гипотезу, предположил, что конформацию изменяет митохондриальная АТФаза (АТФ-синтетаза).
Большинство исследователей в настоящее время считают, что проблема окислительного фосфорилирования может быть решена в рамках хемиосмотической теории Митчелла. Она раскрывает основные принципы, дает общий подход к решению конкретных вопросов и механизмов энергетического сопряжения. Однако, видимо, не следует сбрасывать со счетов химическую и конформационную гипотезы, польза которых при расшифровке и конкретизации отдельных положений теории Митчелла несомненна.
Наиболее сложным в проблеме окислительного фосфорилирования является раскрытие механизма, с помощью которого электрохимический потенциал ионов Н+ используется в реакции синтеза АТФ. П. Митчелл, объясняя процесс утилизации энергии электрохимического потенциала, постулировал прямое взаимодействие протонного потока с активным участком АТФазной системы.
АТФазный комплекс митохондрий (Н+-АТФаза, или АТФ-синтетаза) состоит из растворимой АТФазы (фактор F1) и мембранных компонентов (комплекс F0). Фактор F1 — белок с М = 360 000— 380000. Он обладает сложной четвертичной структурой: состоит из пяти типов субъединиц: а (М = 54 000); ß(M = 50 000); у (М = 33 000); δ (М = 17000); ε (М = 11 000).
Наиболее вероятный субъединичный состав фактора F1соответствует формуле а3β3уδ3. Основные каталитические свойства фактора F1обеспечиваются а- и ß-субъединицами. Активный центр локализуется вблизи их контакта, находится на ß-субъединице. На a-субъединице фермента располагается нуклеотидсвязывающий центр, обладающий высоким сродством к субстратам — АДФ и Фн (рис. 7.6). Роль у- и δ-субъединиц состоит в осуществлении связи между фактором F1 и остальными компонентами АТФазного комплекса. ε-Субъединица играет роль природного ингибитора АТФазной активности.
В состав комплекса F0 входят четыре типа полипептидов: белок, сообщающий АТФазному комплексу чувствительность к олигомицину, — OSCP (M = 19 000), фактор F2 (M = 30 000), фактор F6 (M = 8000), ДЦКД1-связывающий протеолипид (М = 6500). Комплекс F0 обеспечивает связывание фактора F1 с мембраной и участвует в образовании протонпроводящего пути в Н+-АТФазном комплексе. Этот путь обладает высокой специфичностью, так как проницаем только для протонов.
Согласно хемиосмотической теории энергетического сопряжения АТФазный комплекс осуществляет сопряжение электрохимического градиента протонов, генерируемого дыхательной цепью, с реакциями синтеза АТФ. Конкретная роль АТФазы заключается в следующем. 1. Перенос протонов через липидный бислой с внешней стороны митохондриальной мембраны к фактору F1 — транслокационная ступень. 2. Образование АТФ из АДФ и Фн — каталитическая ступень. 3. Обеспечение направленности тока протонов на использование энергии электрохимического потенциала для получения высоких концентраций АТФ — сопрягающая ступень. Первые два процесса осуществляются соответственно факторами F0 и F1, третий требует согласованности в функционировании указанных факторов.
Основную роль в переносе протона играет ДЦКД-связывающий протеолипид фактора F0. В нем обнаружены два гидрофобных участка и один гидрофильный, расположенный в середине молекулы. Предполагают, что протеолипид располагается поперек мембраны, образуя шпильку, так что полярный участок оказывается на внешней стороне мембраны и служит входом Н+-иона в канал.
1 ДЦКД — N,N'-Дициклогексилкарбодиимид — ингибитор протонной проводимости. Протеолипид — гидрофобный белок, содержащий ковалентно связанные жирные кислоты.

Рис. 7.6. Гипотетическая схема молекулярной организации АТФ-синтетазного комплекса:
a, ß, y, δ, ε — субъединицы сопрягающего фактора F1, F0— мембранный компонент АТФ- синтетазного комплекса, пунктиром показан путь протонов
В переносе протона, по-видимому, принимают участие остатки глу, арг и тир, входящие в состав протеолипида. Наиболее вероятным механизмом переноса протона представляется эстафетная передача по протoн-донорным и акцепторным группам указанных аминокислот. Передвижение протонов осуществляется электрофоретически по градиенту их концентрации.
Каталитическая стадия, или синтез АТФ из АДФ и Н3РО4, формально может рассматриваться как реакция дегидратации: АДФ + Н3РO4 ⇄ АТФ + Н2O.
Согласно первоначальным предположениям П. Митчелла, сопряжение окисления и фосфорилирования происходит в результате использования энергии ∆μH+ при нагнетании протонов в активный центр АТФазы, который располагается вблизи от протонпроводящего пути. Электрофоретическое движение протонов по этому пути приводит к их концентрированию в активном центре. Два протона воздействуют на кислород фосфата и, соединяясь с ним, образуют молекулу воды. Это делает фосфатную группу весьма реактивной, способной связываться непосредственно с АДФ. Протонирование фосфата является энергозависимым. П. Митчелл предполагал, что именно на этом этапе используется энергия ∆μН+.
Однако исследования, проведенные в последние годы, позволили П. Бойеру (США) сделать вывод, что быстрый и обратимый синтез АТФ может происходить в активном центре АТФазы без затрат энергии ∆μН+. Стадией, лимитирующей данную реакцию, является высвобождение синтезированного АТФ из активного центра фермента в матрикс, т. е. из гидрофобной фазы в водную. Именно этот процесс многократно (в 1000 раз) ускоряется при энергизации мембраны.
Энергозависимое протонирование определенных групп в АТФазном комплексе, происходящее за счет энергии ∆μН+, может вызывать конформационные изменения в факторе F1. Эти изменения приводят к быстрому высвобождению синтезированного АТФ из активного центра. Следует признать, что многие конкретные вопросы работы АТФ-синтетазы остаются пока нерешенными.
Согласно данным И. А. Козлова и В. П. Скулачева (1977, 1984), в процессе выхода АТФ из активного центра АТФазы большую роль играют изменения свойств тех центров фермента, где происходит связывание АТФ, АДФ и Н3РO4, а также характер взаимодействия этих центров. В целом АТФ-синтетазная реакция протекает по тому же пути, что и АТФазная, путем обращения всех стадий гидролиза.
По мнению А. Д. Виноградова (1984), сопрягающий фактор F1 катализирует синтез или гидролиз АТФ, будучи в двух альтернативных, взаимопревращающихся состояниях, равновесие между которыми контролируется соотношением количеств АТФ и АДФ в митохондриях.
Протонные АТФазы, выделенные из митохондрий животных, высших растений и грибов, а также из хлоропластов и бактериальных клеток, обладают общим типом строения и, по-видимому, одним и тем же механизмом функционирования. Важным моментом является обратимость реакции, катализируемой АТФазным комплексом. При соответствующих условиях комплекс F1—F0 может расщеплять молекулу АТФ и использовать полученную при этом энергию для выкачивания протонов, т. е. для образования на мембране электрохимического потенциала ионов водорода.