Основы биохимии - А. А. Анисимов 1986
Биологическое окисление и биоэнергетика
Пути использования энергии в клетке
7.4.1. Энергетика биосинтетических реакций. Любое проявление жизнедеятельности — движение, дыхание, воспроизведение, рост, реакции на возбуждение — связаны с преобразованием энергии. Прямым источником энергии для большинства эндергонических процессов служит АТФ. Потенциальная химическая энергия АТФ используется для синтеза белков, жирных кислот, нуклеиновых кислот, стероидов и ряда других соединений. Биосинтетические реакции сопряжены с реакцией расщепления АТФ. Активирование обычно происходит за счет энергии, высвобождаемой при отщеплении фосфорильной группы от АТФ. Однако для того чтобы потенциал последней мог быть использован для протекания эндергонического метаболического процесса, должен существовать механизм сопряжения, иначе гидролиз АТФ в клетке будет приводить просто к выделению тепла.
Часть механизма сопряжения — это нуклеофильное замещение у атома фосфора с последующим замещением у атома углерода. Этот процесс начинается с переноса части молекулы АТФ на нуклеофильное соединение. Нуклеофильная атака может протекать у концевого атома фосфора (у) с замещением АДФ, при этом переносится фосфоэфирная группа и АДФ освобождается; или у среднего атома фосфора (ß), что приводит к переносу аденилатной группы и высвобождению неорганического пирофосфата; в редких случаях переносится пирофосфатная группа и высвобождается АМФ. В очень редких случаях замещение происходит у внутреннего (а) атома фосфора, при этом образуется аденозин и триполифосфат или продукты его гидролиза. Если в роли нуклеофила в реакциях замещения выступает вода, то гидролиз доходит до полного завершения, и высвобождаются все группы АТФ (фосфатная, аденилатная или пирофосфатная). Это сопровождается значительным уменьшением свободной энергии, что делает указанные стадии практически необратимыми.
Разнообразные биосинтетические процессы в живом организме начинаются, как правило, с взаимодействия АТФ и исходного для биосинтеза соединения. Получив энергию одной из высокоэнергетических связей АТФ, это соединение активируется и становится способным вступать в биосинтез. Таким путем, например, активируются аминокислоты при биосинтезе белков, образуя предварительно аминоациладенилаты. Биосинтез полисахаридов также начинается с образования нуклеозиддифосфатсахаров при участии АТФ или УТФ. Кроме УТФ в некоторых биосинтезах вместо АТФ функционируют другие эквивалентные ей нуклеозидтрифосфаты — ГТФ, ЦТФ.
7.4.2. Работа мышц и других сократительных структур. В живом организме непрерывно осуществляется движение органов, тканей, отдельных клеток, их органелл, протоплазмы, жгутиков, ресничек и т. п. Еще в 1939 г. В. А. Энгельгардт и М. Н. Любимова обнаружили, что сократительный белок мышц — миозин — обладает АТФазной активностью. При гидролизе АТФ за счет освобождающейся энергии происходит его сокращение, изменение конформации — мышца совершает работу. Таким образом, сократительный белок мышц сам извлекает себе энергию для работы из молекул АТФ. Позднее этими же авторами было показано, что повышенная АТФазная активность обнаруживается и в ряде других случаев, когда в живом организме осуществляется движение (например, при движении листьев стыдливой мимозы).
В настоящее время не вызывает сомнения, что разнообразные движения в живых организмах (сокращение мышц, движение жгутиков, ресничек у простейших, перемещение сперматозоидов, движение листьев у некоторых растений, цитоплазмы в клетке) происходит за счет энергии АТФ, которая извлекается самими сократительными (контрактильными) белками, осуществляющими движение. Это явление хорошо иллюстрирует известное положение диалектического материализма о жизни как форме движения материи качественно более высокой, чем физическая и химическая, но включающей их в «снятом» виде.
Сокращение мышц — явление биологическое, но оно включает в себя и химические процессы (гидролиз АТФ), и физические (использование энергии для движения). Участвующие в процессах движения молекулы обычно объединены в сократительные структуры. В некоторых случаях кроме движения они обеспечивают прочность и форму клеток, образуя так называемый цитоскелет.
В эукариотических клетках сократительные структуры подразделяют на микротрубочки и микрофиламенты (от лат. philamentum — нить). Первые состоят в основном из белка тубулина, вторые — в большом количестве содержат белок актин. Характерной особенностью мышечных клеток является наличие в них сократительных миофибрилл, представляющих собой пучки белковых молекул, организованные особым образом.
Под электронным микроскопом в миофибриллах обнаруживаются два вида нитей — толстые и тонкие. Основой тонких нитей является белок актин, который может быть в двух формах — мономерной, глобулярной (G-актин) и полимерной, в виде филаментов (F-актин). G-актин состоит из 375 аминокислотных остатков, его полимеризация в F-актин обязательно сопровождается расходованием АТФ с образованием двухнитчатой спирали. В цитоплазме других клеток актин представлен равновесной смесью F- и G-форм. В процессе эволюции актин претерпел незначительные изменения. Второй основной белок мышц — миозин. Пучки его молекул образуют толстые нити миофибрилл. Миозин — очень крупный белок (длиной до 160 нм), состоящий из двух тяжелых цепей в форме а-спиралей (М = 212 000) и 2—4 легких цепей (М = 20 000). К С-концу молекула миозина приобретает форму фибриллярного «хвоста», а на N-конце содержит «головку», где расположены короткие цепи.
С нитями актина связаны регуляторные белки мышцы — тропомиозин и тропонин. Тропомиозин имеет форму длинной а-спирали, которая как бы обвивает нить актина. Тропонин, соединяясь с тропомиозином, образует комплекс, названный нативным тропомиозином.
Многие стороны молекулярного механизма мышечного сокращения пока еще недостаточно ясны, однако в общих чертах этот процесс представляется следующим образом. Актин и миозин образуют в мышце актомиозиновый комплекс — актомиозин, в котором нити актина связываются с головками миозина. АТФазная активность миозина в таком комплексе существенно возрастает. Сигналом для сокращения мышцы служит электрический импульс двигательного нерва, вызывающий высвобождение катионов Са2+, их выход из особых мембранных пузырьков — «цистерн» в саркоплазму — внутриклеточную жидкость мышц. Кальций активирует гидролиз АТФ миозином. Свободная энергия гидролиза АТФ запасается в виде конформационных изменений головок миозина, вызывающих смещение нити актина примерно на 10 нм по отношению к миозиновой нити. При этом сшивки между головками миозина и актиновыми нитями расходятся, они стабильны только в отсутствие АТФ. Тем временем другие поперечные мостики миозиновых головок присоединяются к актиновым нитям, препятствуя их возвращению в первоначальное положение. После рефосфорилирования АДФ в АТФ процесс повторяется. По мере образования и разрушения поперечных сшивок происходит продолжение скольжения нитей актина, они втягиваются межу нитями миозина и могут даже надвигаться одна на другую (рис. 7.7), что приводит в итоге к укорочению мышцы, ее сокращению. Этот механизм, пока еще в некоторых пунктах гипотетический, получил название «гребной модели», поскольку повторяющееся кратковременное действие поперечных сшивок в актомиозине напоминает гребки многовесельной лодки, ее движение. Расслабление мышцы происходит после прекращения импульса от двигательного нерва. При этом ионы Са вновь изолируются в цистернах, перемещаемые туда Са2+-зависимой АТФазой (см. разд. 9.2.).
Хотя непосредственным источником энергии работающей мышцы служит АТФ, ее содержание в мышце невелико. Запасными высокоэнергетическими соединениями в мышцах млекопитающих является креатинфосфат, а у беспозвоночных — аргининфосфат. За счет высокоэнергетических связей этих соединений может образовываться АТФ в мышцах из АДФ.
Кроме процесса сокращения мышц актин как главный компонент микрофиламентов участвует в стабилизации и изменении формы клеток, в митозе, движении клеток (в частности, амебоидном), токах цитоплазмы, движении органелл, фагоцитозе, секреторной активности, распределении белков в мембране и др. У растений хлоропласты не обособлены друг от друга, а как бы нанизаны на актиновые филаменты, которые осуществляют их движение.
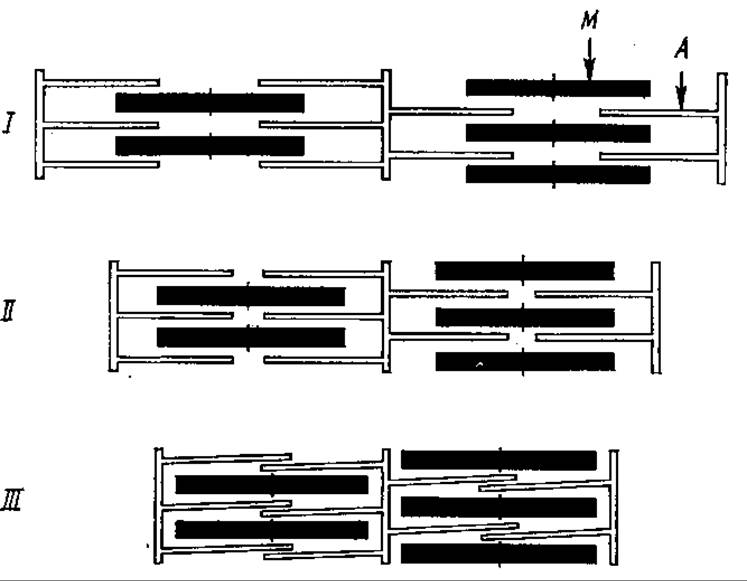
Рис. 7.7. Модель сокращения мышцы:
1 — состояние покоя, II— умеренное сокращение, III — максимальное сокращение; А — тонкие нити (актин), М — толстые нити (миозин)
Актомиозиновые структуры, обусловливающие пульсирующее движение протоплазмы, обнаружены у миксомицетов. Актиноподобные филаменты обнаружены в ситовидных трубках растений; высказывают предположения об их участии в передвижении ассимилятов. Микрофиламенты эукариот представляют собой длинные нитевидные структуры толщиной 5—7 нм. Они обычно образуют пучки, группы или сетчатые структуры. Если в мышечных волокнах и ворсинках кишечника пучки актиновых филаментов образуют стабильную структуру, то в большинстве других случаев их форма и локализация в клетке меняются в зависимости от фазы развития и других факторов. Актин содержится практически во всех эукариотических клетках, но особенно много его (до 20—30% от общего белка) в активно передвигающихся клетках (амебы, макрофаги, тромбоциты), у которых он преобладает среди белков клеточного экстракта. У большинства немышечных клеток, как и в мышечных волокнах, преобразователем энергии, обладающим АТФазной активностью, является миозин, близкий по структуре к мышечному.
Наряду с актинсодержащими микрофиламентами во всех эукариотических клетках найдены тубулинсодержащие микротрубочки. Они участвуют в следующих процессах: 1) движение жгутиков и ресничек; 2) движение хромосом во время митоза и мейоза; 3) транспорт гранул и пузырьков в клетке; 4) движение гранул меланина в меланоцитах; 5) транспорт веществ вдоль аксона и дендритов нейрона; 6) сообщение между содержимым клетки и наружной средой.
У растений микротрубочки обнаружены, например, у плесневых грибов, в хлоропластах толстянковых. Из прокариотических организмов микротубулярные структуры есть у спирохет. Морфология микротрубочек достаточно стандартна: они представляют собой длинные полые цилиндры с наружным диаметром около 24 нм и внутренним — 15 нм. Их основной белок — тубулин — очень похож по первичной структуре и конформации у представителей самых отдаленных систематических групп, что говорит о его небольших изменениях в процессе эволюции. Димерные глобулярные субъединицы тубулина (М = 115 000), полимеризуясь, образуют длинные протофибриллы, из которых построены микротрубочки. Если тубулин по функции соответствует актину, то роль преобразователя энергии АТФ (т. е. функцию миозина) в микротрубочках выполняет белок дитин,
У бактерий в отличие от эукариот нет большого разнообразия типов подвижности, они перемещаются с помощью однотипной структуры — жгутика. Тело жгутика — филамент — представляет собой полый цилиндр, образованный двумя рядами идентичных субъединиц, состоящих из единственного белка — флагеллина. Источником энергии для движения бактериальных жгутиков является не АТФ (редкое исключение), а электрохимический потенциал ионов водорода — ∆μН+.
7.4.3. Роль трансмембранного электрохимического потенциала в биоэнергетике. Согласно концепции, развиваемой В. П. Скулачевым, трансмембранный электрохимический потенциал ионов водорода (∆μН+) занимает важнейшее место в системе энергетических превращений (рис. 7.8). Энергия внешних источников (света или дыхательных субстратов) превращается в ∆μН+, который может использоваться на разнообразные процессы, протекающие в сопрягающих мембранах. Таким образом, по В. П. Скулачеву, ∆μН+ — это вторая (наряду с АТФ) конвертируемая форма энергии в клетке. Она обеспечивает химическую работу, прежде всего синтез высокоэнергетических фосфатов — АТФ и неорганического пирофосфата.
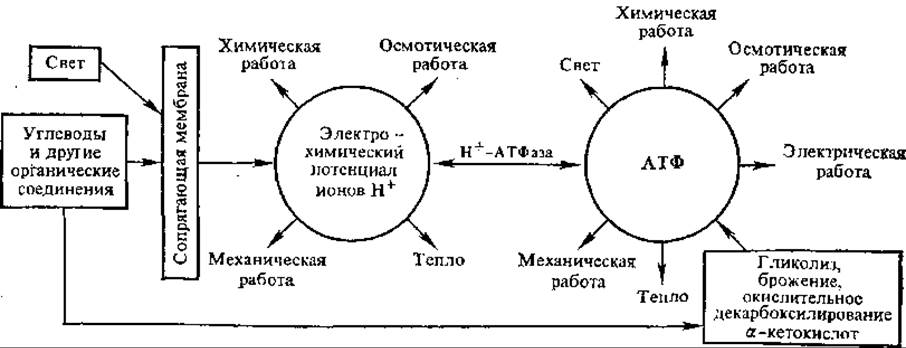
Рис. 7.8. Значение АТФ и электрохимического потенциала ионов водорода в энергетике клетки
Трансмембранный потенциал расходуется клеткой и на ряд других эндергонических процессов. Как уже указывалось, бактериальные клетки в некоторых случаях непосредственно используют его для совершения механической работы (движение жгутиков). Осмотическая работа — накопление катионов и анионов в митохондриях против градиента концентрации также совершается за счет электрохимического потенциала. Электрохимический потенциал ионов водорода, наряду с АТФ, расходуется на теплообразование.