Основы биохимии - А. А. Анисимов 1986
Биологическое окисление и биоэнергетика
Регуляторное теплообразование и свободное окисление. Оксигеназы и оксидазы
В организме среднего взрослого человека, весящего около 70 кг, каждые 24 ч генерируется и высвобождается 8000 кДж энергии. За это время не изменяются существенно ни масса тела, ни его структура и состав. Поэтому вся эта энергия, за исключением количества, которое потребовалось для выполнения физической работы, выделяется в виде тепла. Она необратимо рассеивается в окружающей среде. Весь процесс обеспечивает организм теплом, необходимым для поддержания температуры тела на уровне около 37°С.
При помещении теплокровных животных в холодные условия усиливается теплообразование в мышцах. Это явление включает в себя несколько механизмов. Первый механизм — сократительный термогенез. Актомиозин гидролизует АТФ, скелетные мышцы сокращаются, начинается мышечная дрожь. Таким образом, в определенных условиях скелетные мышцы наряду с основной функцией — сократительной — могут играть роль «отопительной системы» организма.
В других случаях термогенез осуществляется за счет рассеяния энергии дыхания без участия АТФ, т. е. за счет свободного окисления. Оно будет играть в этом случае, как показано С. Е. Севериным и В. П. Скулачевым (1960), роль биологического приспособления к низким температурам. При свободном окислении дыхание протекает с максимальной скоростью, но АТФ не образуется, т. е. имеет место разобщение переноса электронов и фосфорилирования. Свободное окисление происходит на мембранах эндоплазматической сети, в пероксисомах, а также и в самих митохондриях. Согласно гипотезе В. П. Скулачева при свободном окислении в наружной мембране митохондрий действует укороченная цепь переноса электронов, не содержащая участков сопряжения: НАДН → цитохром b5 → цитохром с.
Цитохром b5 всегда есть в наружной мембране митохондрий. Цитохром с содержится только во внутренней мембране, но он может частично десорбироваться в межмембранное пространство митохондрий. В этом случае поток электронов направляется прямо на конечный пункт сопряженного фосфорилирования с образованием одной молекулы АТФ. В энергетическом плане этот процесс менее эффективен, но при этом не прекращается образование АТФ. Это происходит, например, при появлении и накоплении в клетках ингибиторов двух первых участков сопряжения окисления и фосфорилирования.
Свободное окисление может протекать также и во внутренней мембране митохондрий, например, в случае воздействия особых веществ — разобщителей окисления и фосфорилирования. При добавлении их в среду инкубации митохондрий окисление (т. е. поглощение субстратов, кислорода, выделение СO2) продолжается с повышенной скоростью, а синтез АТФ прекращается. Следовательно, энергия окисления рассеивается.
В биохимической практике давно используют одно из таких веществ — 2,4-динитрофенол (ДНФ). В настоящее время известно около 40 соединений — разобщителей, что позволило раскрыть механизм их действия на окислительное фосфорилирование. Все эти вещества обладают гидрофобностью, т. е. хорошей растворимостью в липидах мембраны, и содержат подвижные протоны. Работами В. П. Скулачева и его сотрудников доказано, что разобщители повышают проницаемость сопрягающей мембраны для протонов, в результате чего снижается электрохимический потенциал ионов водорода, генерируемый дыхательной цепью. В связи с этим разобщители называют протонофорами, т. е. переносчиками протонов.
На рис. 7.9 представлена сопрягающая мембрана митохондрий, на которой образуется в результате работы дыхательной цепи электрохимический потенциал ионов водорода. ДНФ диссоциирует, образуя протон и анион. Анион растворяется в липидах и движется электрофоретически к наружной поверхности мембраны. Здесь он захватывает протон из внешней среды и тогда направляется по градиенту своей концентрации к внутренней стороне мембраны. Так повышается протонная проводимость мембраны, рассеивается в виде тепла энергия электрохимического потенциала ионов водорода.
В живой клетке к числу эндогенных разобщителей окислительного фосфорилирования относятся тироксин, фенолы, ненасыщенные жирные кислоты и их пероксиды, некоторые специфические белки. Разобщение окисления и фосфорилирования наблюдается при действии экстремальных температур, радиации, у растений — при недостаточном снабжении водой, элементами минерального питания.
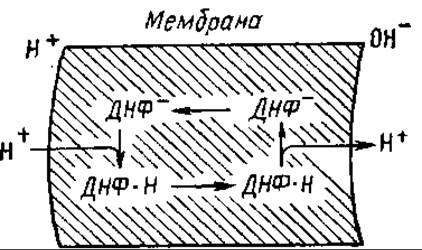
Рис. 7.9. Транспорт протонов разобщителем — 2,4-динитрофенолом
Свободное окисление обнаружено также в микросомах. Под ними подразумевают фракцию морфологически замкнутых везикул, в которые превращается эндоплазматическая cеть при гомогенизации тканей. Часть микросомальных пузырьков может существовать и в интактной клетке в виде отдельных цистерн и вакуолей. Препаративно микросомы выделяют путем ультрацентрифугирования при g < 50 000 (предварительно при g = 24 000 удаляют митохондрии). А. И. Арчаков (1983) предложил для обозначения окислительных процессов в микросомах особый термин—микросомальное окисление. Оно особенно характерно для микросомных фракций таких органов, как печень и надпочечники.
В микросомах содержатся активные оксигеназы — ферменты, непосредственно присоединяющие кислород к различным субстратам. Различают две группы этих ферментов. Диоксигеназы катализируют присоединение обоих атомов молекулярного кислорода к окисляемому субстрату. В качестве простетической группы содержат гем или негемовое железо. Монооксигеназы (гидроксилазы) присоединяют только один атом О с образованием ОН-группы субстрата, другой атом восстанавливается при этом до воды с участием НАДН или НАДФН.
Микросомальные окислительные цепи содержат флавопротеины и цитохромы, отличающиеся от митохондриальных. Важную роль в окислительных цепях играют цитохромы Р-450. Наиболее вероятные пути переноса электронов в мембране микросом описываются следующей схемой:

На этой схеме ФП1 — флавопротеин цитохром P-450-редуктаза, специфичная к НАДФН, окисляет НАДФН и восстанавливает цитохромы Р-450; ФП2 — НАДН-специфический флавопротеин; ЦЧФ — цианидчувствительный фактор; RH — окисляемый субстрат. В реакциях гидроксилирования цитохромы Р-450 выполняют несколько функций. Одна из них—активация кислорода — характерна для всех цитохромов Р-450. Кислород активируется, один его атом непосредственно внедряется в окисляемое вещество, образуя ОН-группу, второй атом расходуется на образование воды. Вторая функция — связывание субстратов — весьма специфична.
Разные цитохромы Р-450 связывают различные субстраты — соединения определенного класса. Благодаря этому микросомальная фракция окисляет сотни веществ различной химической природы. Среди них следует назвать эндогенные субстраты — насыщенные и ненасыщенные жирные кислоты, стероидные гормоны, холестерин, желчные кислоты, простагландины. Наряду с ними разрушается огромное количество чужеродных веществ, попадающих в организм человека и животных из внешней среды, — ксенобиотиков (от греч. ксенос — чуждый): ядохимикаты, лекарственные вещества, косметические препараты. Атом кислорода, внедряясь в окисляемый субстрат, образует ОН-группу, и тогда гидрофобное соединение превращается в полярное. Полярные продукты менее токсичны, так как легко удаляются из мембран в водную фазу клетки.
Таким образом, микросомальное окисление — основная детоксицирующая система в организме животных и человека. Цитохромы P-450, играющие главную роль в этой системе, обнаружены в мембранах эндоплазматической сети клеток печени, в митохондриях коры надпочечников, в плазматических мембранах различных бактерий. В клетках печени они относятся к числу индуцируемых ферментов: количество их может увеличиваться в 2—5 раз при введении одного из чужеродных соединений, например фенобарбитала или ДДТ. В связи с этим можно облегчить лечение острой интоксикации путем введения какого-либо безвредного индуктора цитохрома Р-450.
Кроме детоксицирующей функции оксигеназы у человека и животных играют определенную роль в некоторых реакциях биосинтеза (стероидных гормонов, желчных кислот, простагландинов) и других метаболических процессах (например, превращение циклических аминокислот).
В бактериальных и дрожжевых клетках оксигеназы способствуют поступлению и усвоению пластического материала, окисляя углеродсодержащие вещества и облегчая их поступление в клетки. У растений окисление органических соединений в монооксигеназных реакциях используется главным образом для синтеза биорегуляторов.
Биологическое окисление, осуществляемое без участия пиридин-нуклеотидов и цитохромов, может катализироваться оксидазами, т. е. теми оксидоредуктазами, которые переносят электроны или водород непосредственно на кислород. К ним относятся оксидазы L- и D-аминокислот, ксантиноксидаза, аскорбатоксидаза, фенолоксидазы, каталаза, пероксидазы, а также цитохромоксидаза, функционирующая в цепи переноса электронов. При действии оксидаз энергия рассеивается, исключением служит только окисление, проводимое цитохромоксидазой.
Многие оксидазы представляют собой флавопротеины, состоящие из белка и флавиннуклеотида. В процессе катализа флавиновый остаток принимает пару водородных атомов, восстановленная форма спонтанно восстанавливает О2 до Н2O2. Однако иногда субстрат (МН2) отдает флавину только один электрон, и тогда флавин осциллирует между окисленной и восстановленной семихинонной формами:
![]()
Реакции такого типа — главный источник пероксида водорода в метаболических системах.
Молекулярный кислород парамагнитен и обладает двумя неспаренными электронами. Они находятся на разных орбиталях, поскольку два электрона не могут занимать одну и ту же орбиталь (если только их спины не противоположны — антипараллельны). Восстановление О2 путем прямого введения пары электронов в его частично заполненные орбитали невозможно без «обращения» спина одного из них, следовательно, существует «спиновый запрет» восстановления O2. Таким образом, взаимодействие О2 с веществами, все электроны которых спарены, затруднено. Спиновый запрет восстановления O2 может быть преодолен последовательным добавлением одиночных электронов. Поэтому O2 легко вступает в реакции с веществами, содержащими одиночные неспаренные электроны. В одноэлектронных реакциях восстановления кислорода участвуют свободнорадикальные промежуточные продукты. Полное восстановление O2 до Н2O требует четырех электронов. При одноэлектронном восстановлении в качестве промежуточных продуктов возникают надпероксидный (супероксидный) анион О-2-, пероксид водорода Н2O2 и гидроксидный радикал ОН-. Эти продукты очень реакционноспособны, ядовиты для живых организмов, обладают мутагенным действием. Реакции протекают по следующей схеме:
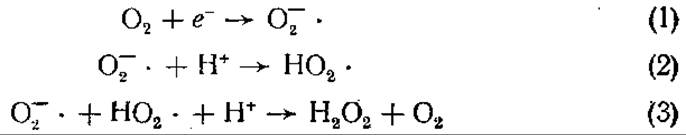
Надпероксидный анион, возникший в результате одноэлектронного восстановления кислорода (1), может протонироваться в гидропероксидный радикал в последующей реакции (2). Радикал НO2- спонтанно вступает в реакцию, приводящую к образованию пероксида водорода (3). Таким образом, любая система, продуцирующая надпероксидный анион, будет вскоре содержать Н2O2.
Железосодержащие соединения могут катализировать реакцию между O2- и Н2O2, образуя ОН-:
![]()
Гидроксидный радикал ОН- представляет собой очень мощный окислитель, который может атаковать все органические соединения. Он образуется в клетках при воздействии на них ионизирующей радиации.
При самопроизвольном окислении гемоглобина, ферредоксинов, гидрохинонов появляются O2- и Н2O2. Эти соединения образуются также при других окислительных процессах в митохондриях и хлоропластах и устраняются благодаря действию соответствующих ферментов. Для защиты клетки от аниона О-2 служит фермент супероксид-дисмутаза, который преобразует надпероксидный радикал в пероксид водорода:
O-2 + O-2 + 2Н+ → H2O2 + O2
Супероксид-дисмутазы найдены во всех дышащих клетках, а также в факультативно анаэробных бактериях. Это металлоферменты, у которых в каталитическом цикле происходит восстановление и окисление иона металла, например Сu2+, Мn3+ или Fe3+. Супероксид-дисмутаза клеток эукариот содержит Zn2+ и Сu2+ в активном центре вблизи друг от друга. Сu2+ функционирует также в каталитическом цикле. В бактериях и митохондриях эукариот найдена супероксид-дисмутаза, содержащая Мu3+. В бактериях и синезеленых водорослях найдены дисмутазы, содержащие Fe3+.
Пероксид водорода, образующийся из надпероксидного аниона, а также выделяющийся при аэробном восстановлении флавопротеинов, обезвреживают ферменты каталазы и пероксидазы. Они представляют собой гемопротеины. Каталаза действует согласно реакции
Н2O2 + Н2O2 → O2 + 2Н2O
Активность этого фермента высока почти во всех клетках и органах животных. Она обнаруживается во всех растительных объектах и в большинстве микроорганизмов (кроме облигатных анаэробов).
Пероксидазы специфичны только в отношении акцептора водорода, т. е. пероксида водорода. В качестве доноров водорода они могут использовать различные соединения. Например, полифенолы и некоторые ароматические соединения они окисляют по следующей схеме с образованием соответствующего хинона и воды:

Особенно активные пероксидазы содержатся в тканях высших растений. В животных тканях (кровь, печень, почки) также обнаружены пероксидазы. Гемовое железо, присутствующее в молекулах каталазы и пероксидазы, участвует в образовании промежуточных перекисных соединений. Ферменты, катализирующие метаболизм Н2O2, в большом количестве находятся в особых органеллах растительных и животных клеток — пероксисомах. Около 40% общего количества белка пероксисом из печени крысы составляет каталаза.
Фенолоксидазы представляют собой медьпротеины, встречающиеся чаще всего в цитоплазме растительных клеток. Эти ферменты окисляют монофенолы в дифенолы, а последние — до хинонов. Действием фенолоксидаз объясняется самопроизвольное потемнение срезов растительных тканей (картофель, фрукты, грибы), оно вызывается образованием хинонов с последующей спонтанной реакцией между хинонами.
Широко распространена в растениях аскорбатоксидаза — медь-протеин, также сосредоточенный главным образом в цитоплазме клеток. В растениях содержатся дыхательные цепи, в которых фенолоксидазы и аскорбатоксидаза функционируют как терминальные оксидазы. Эти окислительные системы локализуются вне митохондрий.
Автономными окислительными системами той или иной степени сложности и эффективности наделены практически все структурные компоненты клетки. Так, ядра обладают не только ферментами гликолиза, но и рядом ферментов, связанных с окислительным фосфорилированием. Достаточно полноценной системой окислительно-восстановительных ферментов обладают пластиды растений, прежде всего хлоропласты.