Основы биохимии - А. А. Анисимов 1986
Биомембраны
Функции мембран
Мембраны выполняют большое число различных функций. Они ограничивают клетку от наружной среды и тем самым служат клетке защитой, обусловливают постоянство внутриклеточной среды. Через мембрану осуществляется контакт клетки с внешней средой, она передает в клетку информацию извне. Мембраны прямо или косвенно участвуют в биохимических процессах, поскольку большинство ферментов связано с ними.
Мембраны играют большую роль во взаимодействиях клеток друг с другом, имеют прямое отношение к процессам их роста и деления, определяют антигенные свойства. Строение и характер распределения антигенов на поверхности всегда специфичны для данной клетки, органа, стадии развития. На мембране расположены клеточные рецепторы, распознающие и связывающие специфические лиганды, проводящие внутрь клетки сигнал. К рецепторным молекулам относятся антитела, рецепторы гормонов, нейромедиаторов, опиатов, токсинов, лектинов, вирусов. Большинство рецепторов представляет собой гликопротеины или ганглиозиды (рецепторы холерного, столбнячного, дифтерийного токсинов и токсина ботулизма). Специфичность рецепторов по отношению к лигандам обеспечивается углеводной частью молекул. Связывание лиганда рецептором приводит в одних случаях к изменению активности аденилатциклазы и количества цАМФ, в других — к усиленному поступлению в клетку ионов (рецептор действует как ионофор), что приводит к генерации электрических сигналов.
Способность клеток проводить сигналы наиболее ярко выражена в нервных волокнах; обнаруживается она и у других клеток. Проведение электрических сигналов по возбудимой мембране возможно благодаря тому, что в клетках поддерживается разность концентрации ионов по обе стороны мембраны. В состоянии покоя ионы Na «выкачиваются» из клетки против градиента концентрации с помощью К+, Nа+-АТФазы, функционирующей как своеобразный насос, для работы которого необходима энергия АТФ. Ионы К при этом поступают внутрь клетки. Обмен К+ и Na+происходит в неэквивалентных количествах (К+ поступает внутрь клетки меньше), и это приводит к тому, что внутренняя сторона клеточной мембраны заряжена электроотрицательно по отношению к наружной поверхности. Разность потенциалов между внешней и внутренней сторонами мембраны называется потенциалом покоя. При возбуждении избирательно увеличивается проницаемость клеток для ионов Na, в результате чего они поступают внутрь клетки и клеточная мембрана при этом деполяризуется. Деполяризация сопровождается распространением по поверхности мембраны затухающего электрического сигнала.
Такая локальная деполяризация мембраны происходит в коротких отростках нервных клеток — дендритах — и в мембранах ряда других клеток. В длинных отростках нервных клеток — аксонах — проведение импульса обусловлено развитием потенциала действия, связанного с перезарядкой мембраны (внутренняя поверхность приобретает положительный заряд по отношению к наружной). Длительность потенциала действия 1 мс, после чего происходит его падение вследствие нарастания компенсирующего потока ионов К наружу из клетки. После проведения импульса в клетке восстанавливается состояние покоя. Химическая природа процессов, изменяющих проницаемость мембран для ионов, пока неясна. При передаче возбуждения определенную роль могут играть и другие ионы, например Са2+.
Важнейшей функцией мембран является регуляция транспорта веществ в клетку и из нее. Небольшие нейтральные молекулы могут проникать через мембраны за счет диффузии. Скорость диффузии вещества определяется его растворимостью в мембране, коэффициентом диффузии и разностью концентрации вещества снаружи и внутри клетки. При наличии разности (градиент) концентраций вещества в двух точках случайное движение молекул переходит в направленный перенос данного вещества из области повышенной в область пониженной его концентрации.
Таким образом, поток веществ по градиенту концентрации — пассивный транспорт — осуществляется путем диффузии и не требует для своего осуществления затрат энергии. Для веществ, растворимых в липидах (основные компоненты биомембран), этот процесс хорошо описывается обычными законами диффузии. Менее исследован пассивный транспорт водорастворимых веществ. Предполагают, что гидрофобные углеводородные цепи липидов постоянно извиваются в мембране, образуя в ней временные пустоты, через которые проникают вода и растворенные в ней незаряженные молекулы. Однако теория временных дырок не может объяснить проницаемости мембран для крупных гидрофильных молекул. В этом случае очень плодотворны представления о наличии в плазматических мембранах достаточно большого количества постоянных пор. Из клеточной мембраны грамотрицательных бактерий выделены особые белки, делающие мембраны проницаемыми для сахаров и других водорастворимых метаболитов. Такие белки, имеющие пока различные названия (порины, матричные белки, колицины), пронизывают мембрану и образуют поры, каналы, пропускающие молекулы с массой до 600—900, но задерживающие макромолекулы.
Если растворенное вещество заряжено, то в этом случае при переносе следует учитывать два градиента — градиент концентрации и градиент электрического заряда. Их сумму называют электрохимическим потенциалом. Пассивное движение ионов происходит по градиенту электрохимического потенциала.
Когда диффузионный процесс сочетается с химической реакцией, может существенно изменяться скорость переноса, которая при этом обычно увеличивается. Это так называемая облеченная диффузия. При ней перенос веществ совпадает с направлением свободной диффузии, т. е. осуществляется по градиенту концентрации, и следовательно, как и при свободной диффузии для своего осуществления не требует затрат энергии.
При облегченной диффузии функционируют специальные вещества — переносчики молекул и ионов. Соединяясь с транспортируемыми молекулами, которые сами в мембране не растворяются, они как бы «протаскивают» их через мембрану.
Облегченная диффузия обычно характерна для водорастворимых веществ. Большинство (если не все) мембранных переносчиков являются белками. Конкретный механизм функционирования переносчиков при облегченной диффузии исследован недостаточно. Они могут, например, обеспечивать перенос путем вращательного движения в мембране. В последнее время появились сведения, что белки-переносчики при контакте с транспортируемым веществом изменяют свою конформацию, в результате в мембране открываются своеобразные «ворота», или каналы. Эти изменения происходят за счет энергии, высвобождающейся при связывании транспортируемого вещества с белком. Возможен также перенос эстафетного типа. В этом случае сам переносчик остается неподвижным, а ионы мигрируют вдоль него от одной гидрофильной связи к другой.
Моделью переносчика такого типа может служить антибиотик грамицидин. В липидном слое мембраны его длинная линейная молекула принимает форму спирали и образует гидрофильный канал, по которому может мигрировать по градиенту ион К.
Получены экспериментальные доказательства существования природных ионных каналов в биологических мембранах. Транспортные белки отличаются высокой специфичностью по отношению к переносимому через мембраны веществу, по многим свойствам напоминая ферменты. Они обнаруживают большую чувствительность к pH, конкурентно ингибируются соединениями, близкими по структуре к переносимому веществу, и неконкурентно — агентами, изменяющими специфически функциональные группы белков.
Облегченная диффузия отличается от обычной не только большей скоростью, но и способностью к насыщению. Увеличение скорости переноса веществ происходит пропорционально росту градиента концентрации только до определенных пределов. Последний определяется «мощностью» переносчика.
Иногда транспорт какого-либо вещества с участием переносчика сопровождается параллельной транслокацией другого соединения в том же самом направлении. Это явление получило название симпорта. Если транспорт какого-либо вещества сопряжен с переносом другого вещества в противоположном направлении, такое явление обозначают термином антипорт.
Биомембраны обладают не только пассивной проницаемостью (транспорт по градиенту), но, действуя подобно насосу, могут перекачивать вещество в сторону большей его концентрации, т. е. из более разбавленного раствора в менее разбавленный. Транспорт веществ против градиента концентрации (незаряженные частицы) или электрохимического градиента (для заряженных частиц), требующий затрат энергии, называется активным транспортом. Бескислородная среда, ингибиторы дыхания, наркотики и другие воздействия, вызывающие нарушение снабжения клеток энергией, приводят к приостановке активного транспорта.
В зависимости от способа использования энергии для транспорта (прямой или косвенный) различают первичный активный транспорт и вторичный. При первичном активном транспорте перенос растворенного вещества через мембрану осуществляется непосредственно в ходе реакции энергетического преобразования в АТФазных системах или окислительно-восстановительных цепях.
Движущей силой при вторичном активном транспорте служит градиент ионов (Н+, К+, Na+и др.), созданный на мембране за счет функционирования систем первичного активного транспорта. Этот градиент используется для переноса других веществ с помощью белков-переносчиков. Например, транспорт сахарозы может осуществляться за счет работы Н+-АТФазы (т. е. создаваемого ею протонного градиента — ∆μН+). Накопление ионов водорода приводит к формированию на наружной стороне мембраны комплекса: белок — сахароза — протон. Комплекс движется по градиенту ∆μН+ внутрь клетки. Предполагают, что так же осуществляется транспорт в клетку аминокислот, анионов.
Типичным примером первичного активного транспорта является транспорт ионов К и Na против их электрохимического градиента, осуществляемый Na+, К+-АТФазой, перенос Н+ с помощью протонных насосов.
Общепринятое представление о работе Na+, К+-АТФазы, (Na+, К+-ионный насос) сводится к следующему. Ионы Na и АТФ присоединяются к молекуле АТФазы в присутствии Mg2+. Связывание ионов Na запускает реакцию гидролиза АТФ, в результате которой образуются АДФ и фосфорилированная форма фермента. Фосфорилирование индуцирует переход ферментативного белка в новое конформационное состояние и участок или участки, несущие Na+, оказываются обращенными к внешней среде. Здесь Na+обменивается на К+, так как для фосфорилированной формы фермента характерно высокое сродство к ионам К. Обратный переход фермента в исходную конформацию инициируется гидролитическим отщеплением фосфорильной группы в виде неорганического фосфата и сопровождается освобождением К+ во внутреннее пространство клетки. Дефосфорилированный активный центр фермента способен присоединить новую молекулу АТФ, и цикл повторяется (рис. 9.3).
Количества поступивших в клетку в результате работы насоса ионов К и Na не равны между собой. На три выведенных иона Na приходится два введенных иона К при одновременном гидролизе одной молекулы АТФ. Открывание и закрывание канала на противоположных сторонах мембраны и чередующееся изменение эффективности связывания Na+ и К+ обеспечиваются энергией гидролиза АТФ. Транспортируемые ионы — Na+ и К+ — кофакторы данной ферментативной реакции. Теоретически можно представить самые различные насосы, действующие по этому принципу, хотя в настоящее время известны лишь немногие из них.
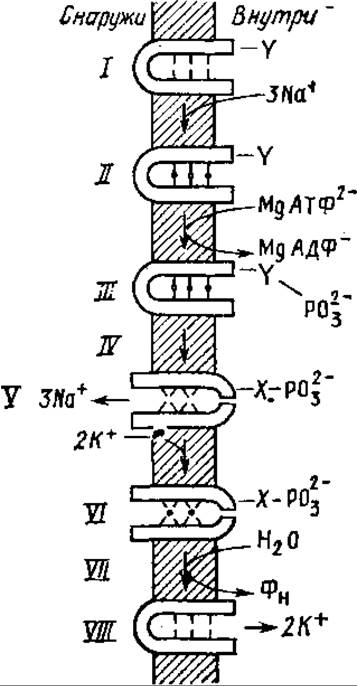
Рис. 9.3. Гипотетическая модель Na+, K+-Hacoca (по Д. Мецлеру, 1980).
Открывание и закрывание канала на противоположных сторонах мембраны и чередующееся изменение эффективности связывания Na+ и К+ обеспечиваются энергией гидролиза АТФ. І — конформация, при которой связывается Na+; выступающие группы образуют в центральной полости связывающие участки размером 0,1 нм. II — связано три иона Na. III — группа Y фосфорилирована; возможно, за счет отрицательного заряда ионы Na связываются более прочно. IV — происходит конформационный переход; фосфорильная группа переходит на другой акцептор — X, V — конформация, при которой связывается К+; образуются К+-связывающие участки размером 0,13 нм; ионы Na диффундируют наружу. VI — связаны два иона К. VII — за счет гидролиза связи между X и фосфорилом происходит переход в исходную конформацию. VIII — ионы К диффундируют внутрь клетки
Ионы Са, подобно ионам Na, активно выводятся из клеток Са2+-АТФазой. Особенно большое количество белка кальциевого насоса содержат мембраны эндоплазматического ретикулума. Цепь химических реакций, ведущих к гидролизу АТФ и перебросу Са2+, может быть записана в виде следующих уравнений:

где Сан — Са2+, находящийся снаружи; Савн — Са2+, находящийся внутри; E1и Е2 — различные конформации фермента переносчика Са2+); переход которых из одной в другую связан с использованием энергии АТФ.
Система активного вывода Н+ из цитоплазмы поддерживается двумя типами реакций: деятельностью электрон-транспортной цепи (редокс-цепи) и гидролизом АТФ. Оба — и редокс- и гидролитический Н+-насосы— находятся в мембранах, способных превращать световую или химическую энергию в энергию ∆μН+ (т. е. плазматических мембранах прокариот, сопрягающих мембранах хлоропластов и митохондрий; см. разд. 7.4.3). В результате работы Н+ АТФазы и (или) редокс-цепи транслоцируются протоны, и на мембране возникает протондвижущая сила (∆μ+). Электрохимический градиент ионов водорода, как показывают исследования, может быть использован для сопряженного транспорта (вторичный активный транспорт) большого числа метаболитов — анионов, сахаров, аминокислот и т. д.
С активностью плазматической мембраны связаны процессы, обеспечивающие, поглощение клеткой твердых и жидких веществ с большой молекулярной массой, — фагоцитоз и пиноцитоз (от грец. фагос — есть, пинос — пить, цитос — клетка). Клеточная мембрана образует карманы, или впячивания, которые втягивают вещества извне. Затем такие впячивания отшнуровываются и окружают мембраной капельку внешней среды (пиноцитоз) или твердые частицы (фагоцитоз). Пиноцитоз наблюдается в самых разнообразных клетках, особенно в тех органах, где происходят процессы всасывания.