Биохимия и молекулярная биология - Белясова Н.А. 2002
Молекулярные основы и механизмы наследственности
Организация генетического аппарата клетки
Репликация нуклеиновых кислот
Основной функцией ДНК является ее способность к самоудвоению (репликации). Репликация — очень точный механизм, практически не допускающий ошибок. В самой ДНК (у некоторых вирусов — в РНК) закодирована информация о структуре ферментов, осуществляющих удвоение нуклеиновых кислот, синтез новых нуклеотидов — строительную базу репликации, исправление ошибок репликации, а также репарацию повреждений ДНК, вызванных разными факторами. Наконец, сама структура ДНК, а именно наличие двух цепей в ее составе, является условием, облегчающим процесс копирования, поскольку в таком случае каждая из цепочек может выполнять роль матрицы при синтезе новых молекул ДНК. Подобное предположение высказали Джеймс Уотсон и Фрэнсис Крик еще в 1953 г., и оно получило экспериментальное подтверждение. Такой механизм копирования ДНК, когда каждая из цепей выполняет функцию шаблона, а вновь синтезированные молекулы являются гибридными (состоят из одной старой и одной новой цепей), называется полуконсервативным.
Кроме полуконсервативной, были предложены еще две модели репликации: консервативная и дисперсивная. Особенности этих моделей репликации ДНК состоят в следующем. Согласно дисперсивной модели, родительская спираль ДНК при удвоении разрывается на каждом полуобороте путем множественной фрагментации, а синтез новых цепей происходит на фрагментах (рис. 1.9). По консервативной модели раскручивания спирали ДНК не происходит вовсе, и она служит матрицей для двух новых цепей, в результате чего родительская спираль целиком состоит из старого, а дочерняя — из нового материала. Доказательство реальности полуконсервативного механизма репликации ДНК предоставили Месельсон и Сталь в 1958 г. в экспериментах с ультрацентрифугированием меченой бактериальной ДНК.
Суть этих экспериментов состояла в следующем: ДНК E.coli метили радиоактивным изотопом 15N, а затем давали осуществиться одному раунду репликации ДНК, выращивая клетки в течение ~ 50 мин на питательной среде, содержащей нормальный изотоп азота — 14N. Выделенную из клеток ДНК подвергали ультрацентрифугированию в градиенте плотности хлористого цезия. При таком центрифугировании молекулы CsCl создают в пробирке градиент плотности, и молекулы других веществ распределяются в этом градиенте в соответствии со своей плотностью. ДНК E.coli, выращенных на среде, содержащей 15N, имеет плотность 1,724 г/см3, тогда как ДНК клеток, выращенных на обычной среде с изотопом 14N, характеризуется плотностью 1,710 г/см3. Таким образом, смесь этих двух типов ДНК легко разделяется при центрифугировании по плотности. Локализацию ДНК в пробирке с градиентом CsCl можно определить по поглощению ультрафиолетовых лучей (ДНК поглощает излучение с длиной волны 260 нм). Таким образом, ДНК в пробирке выявляется в виде «полос» — «легкая» у верхнего края пробирки, «тяжелая» — ближе ко дну. В данном эксперименте в пробирке с градиентом хлористого цезия образовалась всего одна, средняя по «тяжести» полоса, положение которой соответствовало гибридной ДНК, включающей оба изотопа азота — 15N и 14N. Это обстоятельство исключало возможность реализации только одной модели репликации ДНК — консервативной. Для выбора между оставшимися двумя моделями репликации Месельсон и Сталь позволили бактериям, ДНК которых содержала оба изотопа, совершить еще одно деление на среде с 14N. Затем их ДНК снова подвергли ультрацентрифугированию. На этот раз в пробирке сформировалось две полосы ДНК — «легкая» и средняя по «тяжести», что подтверждает справедливость полуконсервативного механизма репликации ДНК.
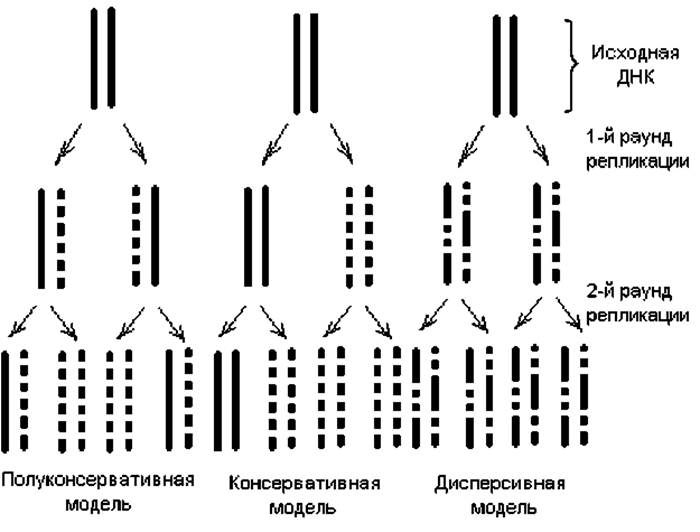
Рис. 1.9. Предполагаемые модели репликации дуплексной ДНК. Сплошными линиями изображены исходные («тяжелые», содержащие 15N) цепи ДНК, а прерывистыми линиями показаны полученные в результате репликации новые («легкие», содержащие 14N) цепочки ДНК
Итак, все изученные к настоящему времени способы репликации нуклеиновых кислот сводятся к полуконсервативному механизму, согласно которому после каждого раунда репликации одна нить в каждой из двух дочерних молекул является родительской, т. е. консервативной, а другая — синтезированной заново. Репликация одно- и двухцепочечных нуклеиновых кислот, представляющих геномы разных организмов, осуществляется с соблюдением определенных закономерностей при реализации разных механизмов, которые рассмотрены ниже. Общим для всех этих процессов является: 1) участие сложного комплекса ферментов, которые осуществляют репликацию; 2) наличие трех основных стадий процесса — инициации, элонгации и терминации; 3) соблюдение принципа комплементарности при построении новых цепей, при котором шаблоном (матрицей) служит родительская цепочка; 4) высокая точность процесса; 5) возможность исправления ошибок репликации в ходе корректорской правки.
Репликация двухцепочечных ДНК. Двухцепочечные ДНК формируют геномы всех клеточных организмов — и прокариот и эукариот. Наилучшим образом механизм репликации ДНК изучен по отношению к прокариотическим клеткам, в частности бактерий E.coli. В экспериментах с прокариотами показано, что в условиях, ограничивающих синтез белка, репликация ДНК не происходит, из чего можно сделать вывод, что этот процесс нуждается в участии белков. В настоящее время показано, что в процессе репликации ДНК участвуют продукты более чем 10 генов. Это, в первую очередь, ДНК-полимеразы, а также топоизомеразы, геликазы и лигазы. Появляется все больше данных в пользу участия в процессе репликации ДНК высокоорганизованного мультиферментного комплекса — реплисомы, включающей праймосомо-праймазный комплекс, геликазы, Pol III-холофермент и гиразы.
ДНК-полимеразы — это ключевые ферменты репликативного процесса, которые собственно и осуществляют наращивание полинуклеотидных цепей, используя принцип комплементарности. Наиболее полно изучены ДНК-полимеразы кишечной палочки. В клетках этих бактерий обнаружено три различных типа ДНК-полимераз (Pol-I, Pol-II и Pol-III), которые различаются в первую очередь скоростью катализа и нуклеазной активностью. ДНК-полимераза I (Pol-I) представляет собой одиночный полипептид, содержащий порядка 1000 аминокислотных остатков. В клетке E.coli насчитывается около 400 молекул этого фермента. Pol-I обладает следующими активностями: полимеразной — присоединение комплементарных матричной цепи дезоксинуклеотидов к свободной 3'-ОН-группе праймера в направлении от 5'- к 3'-концу (5'→3') строящейся молекулы ДНК; экзонуклеазной — гидролиз фосфодиэфирных связей (отщепление нуклеотидов) в одной цепи ДНК или на неспаренном конце дуплексной ДНК, начиная с 3'-конца цепи (3'→5') и 5'-конца цепи (5'→3'). Экзонуклеазные активности играют очень большую роль в репликации и репарации хромосомной ДНК E.coli. 3'→5'-экзонуклеазная активность обеспечивает контроль за присоединением каждого нуклеотида и удаление ошибочных нуклеотидов с растущего конца цепи (корректорская правка), а 5' → 3'-экзонуклеазная активность используется для удаления димеров пиримидинов и рибонуклеотидов фрагментов Оказаки.
ДНК-полимераза II (Pol-II) присутствует в клетках кишечной палочки в значительно меньшем числе копий и осуществляет полимеразную активность гораздо медленнее, чем Pol-I (составляет только 5% активности ДНК-полимеразы I). В отличие от Pol-I этот фермент не обладает 5' → 3'- экзонуклеазной активностью. Роль этой полимеразы в репликации до конца не выяснена. Считается, что этот фермент не обязателен для репликации ДНК, но может заменять отдельные функции Pol-I при ее повреждении.
ДНК-полимераза III (Pol-III) — основной фермент, ответственный за репликацию хромосомальной ДНК E.coli. В каждой клетке содержится только 10—20 молекул этого фермента, но работает он примерно в 60 раз быстрее ДНК-полимеразы I. Кроме того, Pol-III обладает повышенным сродством к матрице и обеспечивает более высокую эффективность копирования. Для данного фермента, так же как и для Pol-II, не присуща 5' → 3'-экзонуклеазная активность. Поэтому для репликации отстающей цепи необходимо участие Pol-I, чтобы произошло удаление РНК-праймеров на 5'-конце фрагментов Оказаки.
В эукариотических клетках выявлено большее количество ДНК- полимераз, но их функции изучены хуже.
Функция топоизомераз сводится к разрешению механических и топологических проблем в процессе раскручивания двойной спирали в репликативной вилке. Эти ферменты изменяют степень сверхспирализации и приводят к образованию «шарнира», который создает условия для непрерывного движения репликативной вилки. В различных организмах идентифицированы топоизомеразы двух основных типов: топоизомеразы типа I надрезают одну из двух цепей, в результате чего концевой участок двойной спирали может повернуться вокруг интактной цепи, и затем воссоединяют концы разрезанной цепи. Топоизомеразы типа II вносят временные разрывы в обе комплементарные цепи, изменяют степень сверхспирализации, а затем соединяют разорванные концы.
Геликазы осуществляют образование и продвижение вдоль спирали ДНК репликативной вилки — участка молекулы с расплетенными цепями. Эти ферменты используют для расплетения цепей энергию, высвобождающуюся при гидролизе АТР. Для обеспечения более высокой скорости раскручивания несколько геликаз действуют в комплексе с белками второго типа, которые связываются с одноцепочечными участками молекулы и тем самым стабилизируют расплетенный дуплекс.
Наконец, ДНК-лигазы катализируют процессы воссоединения фрагментов цепей ДНК, участвуя в образовании ковалентных связей (фосфодиэфирных мостиков) между 5'-P- и 3'-ОН-группами соседних дезоксирибонуклеотидов. Эти ферменты также используют энергию макроэргических связей, образующуюся при гидролизе АТР или GTP.
Механизм репликации двухцепочечной ДНК лучше всего исследован для бактерий E.coli и будет рассмотрен на данном примере.
Инициация репликации ДНК. Процесс репликации ДНК кишечной палочки начинается в строго определенной точке, которая называется origin (ori), или точкой начала репликации, и расположена на 85 мин. генетической карты хромосомы этих бактерий. В ori репликации на ДНК действуют ферменты (топоизомеразы, геликазы), обусловливающие формирование репликативной вилки, в которой собственно и происходит копирование цепей. Для репликации необходимо наличие: ДНК-матрицы в виде одноцепочечного участка ДНК, смеси дезоксирибонуклеозидтрифосфатов, реплисомы (ансамбля ферментов, принимающих участие в репликации) и 3'-ОН-группы нуклеиновой кислоты — затравки, к которой ДНК-полимераза должна присоединять следующий нуклеотид. Дело в том, что ни одна из ДНК-полимераз не может начинать процесс полимеризации нуклеотидов de novo. Эту функцию выполняют РНК-полимеразы, которые узнают ori репликации в репликативной вилке и синтезируют коротенькие (10—60 рибонуклеотидов) последовательности — РНК-затравки (праймеры). При этом синтез затравок осуществляется в направлении от 5'- к 3'-концу, и в результате образуется свободный 3'-ОН-конец, который может использовать ДНК-полимераза для продолжения процесса полимеризации цепей на стадии элонгации репликации (рис. 1.10).
Элонгация репликации ДНК. Синтез новых цепей ДНК осуществляется с соблюдением принципа комплементарности: каждый подбираемый в растущую цепь нуклеотид должен быть комплементарен соответствующему (расположенному напротив) нуклеотиду в исходной (матричной) цепи.
Поскольку все ДНК-полимеразы осуществляют процесс полимеризации нуклеотидов только в одном направлении (5'→3'), а репликативная вилка движется вдоль ДНК в обоих направлениях, непрерывно синтезироваться в каждом из направлений может лишь одна нить, которую называют лидирующей. Вторая (противоположная) нить синтезируется короткими фрагментами (фрагменты Оказаки) и называется отстающей (рис. 1.10). Фрагменты Оказаки у прокариот содержат порядка 1000 нуклеотидов, а у эукариот — 100—200 нуклеотидов.
Кроме полимеризации цепей, которую осуществляет в основном ДНК-полимераза III, в процессе репликации ДНК происходят следующие события:
— вырезание РНК-затравок из лидирующей цепи и из каждого фрагмента Оказаки. Эту функцию выполняет Pol-I с помощью своей 5'→3'- экзонуклеазной активности;
— заполнение «брешей», оставшихся после вырезания РНК-затравок. Эту работу также осуществляет ДНК-полимераза I, используя свободную 3'-ОН-группу соседнего фрагмента Оказаки;
— соединение фрагментов ДНК в отстающей цепи с помощью фермента ДНК-лигазы: когда растущий 3'-гидроксильный конец каждого фрагмента Оказаки доходит до 5'-дезоксинуклеотидного конца соседнего фрагмента, вступает в действие ДНК-лигаза и образуется непрерывная отстающая цепь;
— исправление ошибок репликации — корректорская правка. Этот механизм характерен как для Pol-I, так и для Pol-III и основывается на их 3'→5'- экзонуклеазной активности. Известно, что ДНК-полимераза проверяет комплементарность подбираемого нуклеотида, контролируя размер новой предполагаемой пары нуклеотидов в своем активном центре, и ее полимеразная активность включается лишь тогда, когда эта комплементарность установлена. С другой стороны, каждый вновь встроенный нуклеотид также проверяется на соответствие своей паре в активном центре фермента. Если размер образовавшейся пары нуклеотидов не соответствует истинному (когда основания противоположных нуклеотидов не комплементарны друг другу), с помощью своей 3'→5'-экзонуклеазной активности фермент вырезает некомплементарный нуклеотид и ищет ему замену. Дополнительным механизмом, уменьшающим ошибки репликации, служит репарация ДНК. В результате частота ошибочного включения нуклеотидов в образующуюся при репликации цепь ДНК крайне низка (10-8—10-10).
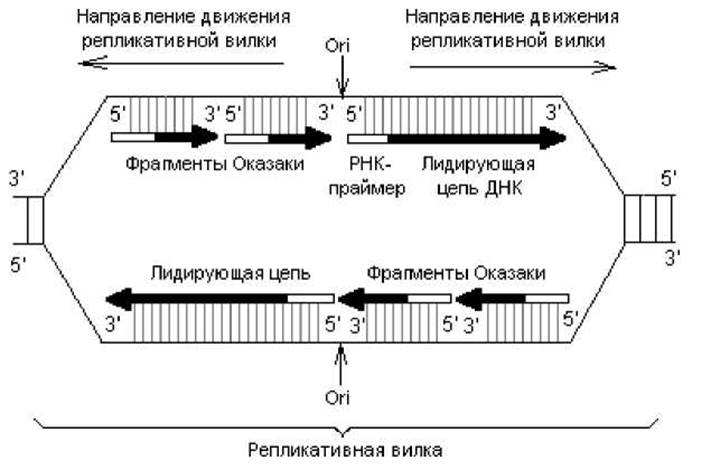
Рис. 1.10. Репликация у E.coli. Стрелками показано направление синтеза новых цепей ДНК. Незаштрихованные толстые линии — РНК-праймеры, начинающие синтез; сплошные жирные линии — фрагменты удлиняющихся цепей ДНК. Вертикальными линиями показаны водородные связи между комплементарными нуклеотидами
Терминация репликации. При двунаправленной репликации кольцевого генома (как у кишечной палочки) репликативные вилки встречаются на расстоянии 180° от точки репликации, и в этом месте репликация завершается. Кольцевые ДНК в месте встречи соединяются лигазой, при этом они оказываются попарно сцепленными, и в дальнейшем происходит их разделение на отдельные геномы с помощью топоизомеразы типа II.
Скорость репликации ДНК у бактерий E.coli составляет примерно 1500 пар нуклеотидов в секунду. Таким образом, полный геном кишечной палочки (4∙106 п. н.) реплицируется примерно за 40 мин. Однако клетки E.coli делятся быстрее — каждые 20 мин, и это означает, что при прежней скорости копирования увеличивается частота актов инициации в той же самой точке начала репликации. Т. е. еще до завершения первого раунда репликации генома в сайте ori инициируется второй раунд репликации. Скорость движения репликативной вилки в эукариотических клетках значительно меньше (10—100 п. н. в секунду), но завершение репликации в разумное время обеспечивается одновременной инициацией во множестве точек. В результате хромосома дрозофилы, например, содержащая 6,5∙107 п. н., реплицируется за несколько минут.
В целом закономерности репликации, выявленные для прокариот, характерны и для большинства эукариотических геномов. Отличия состоят, в первую очередь, в наличии у эукариот множества сайтов инициации репликации на каждой хромосоме, иных, чем у прокариот, механизмах исправления ошибок репликации, а также в ферментативном оснащении процесса репликации. Схематическое изображение процессов репликации циклических, формирующих геномы прокариот и плазмид, и линейных (эукариотических) геномов представлены на рис. 1.11.
В линейной ДНК раскручивание цепей осуществляется путем вращения одной цепи вокруг другой. В кольцевой ДНК раскручивание и репликация ведут к образованию структуры, напоминающей кольцо с внутренней петлей. Ее называют тэта-петлей, поскольку по форме она похожа на греческую букву Θ. Такие петли можно наблюдать на радиоавтографах реплицирующихся бактериальных ДНК, что впервые осуществил Кэрнс для ДНК E.coli.
Приведенный механизм двунаправленной репликации ДНК является наиболее распространенным, но не единственным. ДНК фагов Р22, 186, Р2, а также фагов Т4 и 1 на поздних стадиях литического цикла реплицируется по однонаправленному механизму (тип катящегося кольца). В этом случае двухцепочечная кольцевая ДНК надрезается специфическим ферментом в уникальном сайте одной цепи (точке начала катящегося кольца). Образовавшийся в результате надреза 5'-конец цепи связывается с ферментом, осуществившим надрез. Синтез ДНК начинается с вытеснения 5'-конца, связанного с ферментом, в раствор, что позволяет ДНК-полимеразе присоединять нуклеотиды к 3'-ОН-концу. Происходит полуконсервативная репликация, в ходе которой 5'-конец разорванной цепи вытесняется в виде свободного хвоста и его длина все увеличивается, а матрицей служит интактная замкнутая цепь. Эту реплицирующуюся структуру (рис. 1.12) называют катящимся кольцом, так как разматывание свободной одиночной цепи сопровождается вращением двухцепочечной матрицы вокруг своей оси.
Если этот механизм используется для репликации двухцепочечной ДНК, то 5'-концевые хвосты служат матрицами для синтеза небольших фрагментов ДНК, которые сразу же сшиваются вместе под действием ДНК-лигазы. В результате растущие хвосты вскоре после своего образования приобретают двухцепочечную структуру. Элонгация хвостов приводит иногда к тому, что их длина многократно превышает общую длину исходной кольцевой молекулы. Такой способ репликации использует, например, фаг λ. При упаковке ДНК в капсиды в специальных участках, называемых cos-сайтами и отстоящих друг от друга на длину вирусного генома, образуются надрезы, в результате чего длинные дуплексы многократно повторенной фаговой ДНК расчленяются на фрагменты, соответствующие по размерам зрелой ДНК, обнаруживаемой в вирионах бактериофага λ.
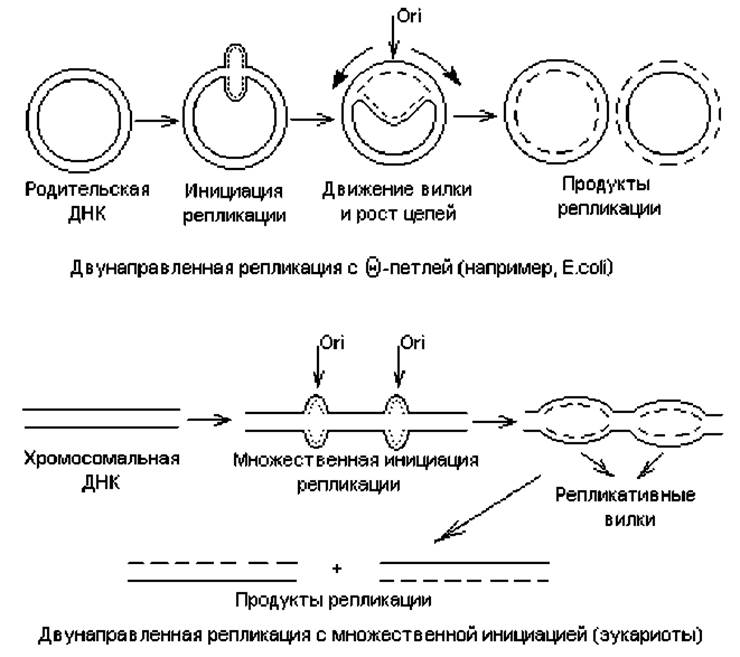
Рис. 1.11. Типы двунаправленной репликации двухцепочечной ДНК. Сплошными линиями обозначены исходные цепи ДНК; пунктиром — вновь синтезирующиеся цепи
Репликация по типу катящегося кольца характерна также для процесса образования копии бактериальной хромосомы E. coli Hfr и фактора F+, передающихся при конъюгации в реципиентную клетку.
Репликация одноцепочечных ДНК. У фагов М13 или φХ174, чьи зрелые геномы представлены одиночными кольцевыми ДНК, репликация осуществляется по механизму катящегося кольца (рис. 1.12). Это происходит на поздних стадиях инфекционного процесса, после того, как инфицирующая ДНК превращается в двухцепочечную кольцевую форму. В данном случае не осуществляется репликация 5'-концевых участков, в отличие от репликации геномов фага 1 (рис. 1.12, поз. 5), поэтому продуктом репликации являются длинные одиночные цепи ДНК, постоянно отделяющиеся от «катящегося рулона» Эти цепи надрезаются в каждой точке начала репликации и замыкаются с образованием зрелых кольцевых форм, упаковываемых в капсиды.

Рис. 1.12. Репликация двухцепочечной ДНК по типу катящегося кольца. Сплошной линией обозначены цепи исходной ДНК; пунктиром — вновь синтезированные в ходе репликации цепочки. Позиция 1 — исходная кольцевая ДНК; 2 — формирование надреза в одной из цепей с обнажением 3'- и 5'-концов; 3, 4 — репликация кольцевой цепи в репликативной вилке; 5 — начало репликации 5'-хвоста; 6, 7 — продукты репликации
Репликация РНК. Образование РНК-содержащих вирусов происходит путем репликации их РНК, тогда как все клеточные РНК образуются в результате транскрипции ДНК. За исключением ретровирусов репликация РНК в основном повторяет процесс репликации ДНК. Как и при репликации ДНК, порядок расположения нуклеотидов определяется комплементарным копированием матрицы, в данном случае обязательно цепи РНК. Ферменты, осуществляющие этот процесс, называются РНК-зависимыми репликазами. РНК бактериальных вирусов R17 и MS2, а также полиовирусов и вируса Синдбис, инфицирующих животных, всегда обозначается знаком (+), поскольку последовательность их РНК-геномов идентична последовательности мРНК. Таким образом, геном инфицирующего вируса может служить в качестве мРНК и содержит информацию о синтезе некоторых, если не всех, вирусных белков. Специфическая репликаза, кодируемая геномом вируса и образующаяся вскоре после инфекции, связывается с одним или несколькими белками клетки-хозяина и инициирует процесс копирования (+)-цепи с ее 3'-конца с образованием полной (-)-цепи, ассоциированной с (+)-цепью-матрицей. Затем та же репликаза синтезирует множество копий (+)-цепи РНК, используя новосинтезированную (-)-цепь в качестве матрицы. Геномы некоторых вирусов (вирус везикулярного стоматита, гриппа) представлены одной или несколькими (-)-цепями. В этом случае они служат матрицами для синтеза (+)-цепей, которые играют роль мРНК и используются при синтезе дочерних (-)-цепей.
Отличительной особенностью репликации геномов ретровирусов является то, что после проникновения их РНК в клетку хозяина вирусный геном подвергается обратной транскрипции. При этом сначала образуется дуплекс РНК-ДНК, а затем — двухцепочечная ДНК. Фермент, катализирующий комплементарное копирование РНК с образованием ДНК, называется обратной траскриптазой (ревертазой). Он содержится в ретровирусных частицах (вирионах) и активируется после попадания в клетку. Появляется все больше данных о том, что обратная транскрипция происходит в самых разных эукариотических клетках, а обратная транскриптаза играет важную роль в процессах перестройки генома. Репликация двухцепочечной формы ретровирусной ДНК не начинается до тех пор, пока она не встроится в клеточную ДНК. Механизм рекомбинационного встраивания пока полностью не установлен. После интеграции ретровирусная ДНК реплицируется как часть клеточной ДНК. РНК дочерних вирионов образуется в результате транскрипции интегрированных копий вирусной ДНК.