Биохимия и молекулярная биология - Белясова Н.А. 2002
Метаболизм. Процессы, требующие притока энергии
Интеграция метаболизма
Регуляция метаболизма
Химические реакции, протекающие в клетках, катализируются ферментами. Неудивительно поэтому, что большинство способов регуляции обмена веществ основано на двух ведущих процессах: изменении концентрации ферментов и их активности. Эти способы регуляции метаболизма характерны для всех клеток и осуществляются с помощью разнообразных механизмов в ответ на сигналы разного рода. Кроме этого, клетки владеют дополнительными способами регуляции метаболизма, многообразие которых удобно рассмотреть в соответствии с несколькими уровнями организации.
Регуляция на уровне транскрипции. Этот тип регуляции рассмотрен в главе 3 на нескольких примерах положительного и отрицательного контроля транскрипции прокариотических генов. Данный механизм характерен, в первую очередь, для регуляции количества мРНК, определяющих структуру ферментов, а кроме этого — белков-гистонов, рибосомальных, транспортных белков. Группа последних, не обладая каталитической активностью, также принимает большое участие в изменении скорости соответствующих процессов (формирование хромосом и рибосом, транспорт веществ через мембраны), а значит, и метаболизма в целом.
В регуляции транскрипции генов участвуют регуляторные белки, структура которых определяется специфическими генами (регуляторами), их комплексы с лигандами (например, лактозой при индукции транскрипции или триптофаном при репрессии), комплексы сАМР-САР, гуанозинтетрафосфат, а в некоторых случаях таким действием обладают белки — продукты экспрессии собственных генов. Особое значение в данных процессах имеют такие важные сигнальные молекулы, как сАМР и гуанозинтетрафосфат. Можно сказать, что сАМР сигнализирует клетке об энергетическом голоде — отсутствии глюкозы. В ответ на это увеличивается частота транскрипции структурных генов, отвечающих за катаболизм других источников углерода и энергии (активация катаболитных оперонов, катаболитная репрессия, глава 3). Гуанозинтетрафосфат (гуанозин-5'-дифосфат-3'-дифосфат) является сигналом аминокислотного голодания. Этот нуклеотид связывается с РНК-полимеразой и изменяет ее сродство к промоторам различных генов. В результате экспрессия генов, ответственных за биосинтез углеводов, липидов, нуклеотидов и др. уменьшается, а экспрессия других генов, в частности детерминирующих процессы протеолиза белков, наоборот, повышается.
Процесс транскрипции чаще регулируется с помощью изменения частоты событий инициации транскрипции, но, кроме этого, могут регулироваться скорость элонгации транскрипции и частота ее преждевременной терминации. На события элонгации и терминации первостепенное влияние оказывает конформационное состояние ДНК или самой мРНК (наличие «стопсигналов», шпилечных структур).
Аллостерическая регуляция активности ферментов. Этот тип регуляции является одним из самых быстрых и гибких, он осуществляется с помощью молекул-эффекторов, взаимодействующих с аллостерическим центром фермента (глава 6). Аллостерической регуляции, как и оперонной, подвержены ключевые ферменты тех или иных метаболических путей. Таким образом, скорость всего биосинтетического или катаболического процесса зависит от одной, реже нескольких реакций, катализируемых ключевыми ферментами.
Особое значение регуляция имеет для процессов биосинтеза протеиногенных аминокислот. Поскольку их 20, и каждая в суммарном клеточном белке у разных организмов представлена в определенном отношении, требуется очень четкая регуляция, координирующая процессы синтеза отдельных аминокислот. Такой контроль исключает перепроизводство аминокислот, и выделение их из клетки возможно лишь у микроорганизмов с нарушенной регуляцией.
Пример регуляции биосинтеза аминокислот семейства аспартата у энтеробактерий представлен на рис. 19.3. Четыре аминокислоты имеют общий предшественник — аспарагиновую кислоту. Ее превращение в аспартилфосфат у бактерий E. coli катализируют три изоферментные формы аспартокиназы, каждая из которых испытывает репрессию и/или ингибирование со стороны разных конечных продуктов данного разветвленного метаболического пути. Аналогичным способом регулируется синтез гомосериндегидрогеназы.
Обращает на себя внимание существование механизма обратной связи, который заключается в том, что конечные продукты метаболических процессов регулируют уровень синтеза и/или активность ферментов, катализирующих первые этапы образования этих метаболитов.
Аллостерическими эффекторами могут выступать самые различные вещества: субстраты и конечные продукты метаболических путей, иногда — промежуточные метаболиты; в катаболических процессах — нуклеозиддифосфаты и нуклеозидтрифосфаты, а также переносчики восстановительных эквивалентов; в каскадных реакциях — сАМР и сGMP, которые регулируют активность ферментов (например, протеинкиназ), участвующих в ковалентной модификации белков; ионы металлов и множество иных соединений. Примеры аллостерической регуляции ферментов приведены в главе 6 и др. разделах.
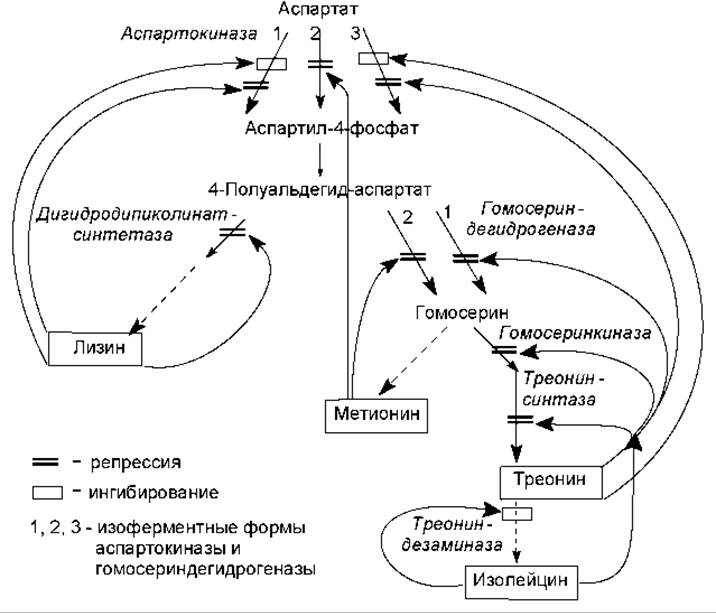
Рис. 19.3. Схема регуляции синтеза и активности ферментов, участвующих в пути биосинтеза аминокислот семейства аспартата у бактерий E.coli. Гены, кодирующие аспартокиназу 1, гомосеринкиназу и треонинсинтетазу, составляют треониновый оперон, поливалентно репрессируемый треонином и изолейцином
Ковалентная модификация ферментов. Этот тип регуляции активности ферментов иначе называют взаимопревращениями ферментов, поскольку суть данного процесса состоит в превращении активных форм ферментов в неактивные и наоборот. Особенности и примеры ковалентной модификации описаны в главе 6. Эти процессы находятся под разнообразным контролем, в том числе и гормональным. Классическим примером взаимопревращений ферментов является регуляция метаболизма гликогена в печени.
Скорость синтеза этого резервного полисахарида находится под контролем гликоген-синтазы, а расщепление катализируется гликоген- фосфорилазой. Оба фермента могут пребывать в активной и неактивной формах. При голодании или в стрессовых ситуациях в кровь выделяются гормоны — адреналин и глюкагон, которые связываются с рецепторами на плазматических мембранах клеток и активируют при посредничестве G-белков фермент аденилатциклазу (катализирует синтез сАМР). сАМР связывается с протеинкиназой А и активирует ее, что приводит к фосфорилированию гликоген-синтазы и переводу ее в неактивную форму. Гликоген перестает синтезироваться. Кроме этого, протеинкиназа А в ходе каскадных реакций вызывает фосфорилирование гликоген-фосфорилазы, которая в результате активируется и начинает расщеплять гликоген. На процессы синтеза и распада гликогена действует также другой гормон — инсулин. В этом примере сигнальными молекулами служат гормоны, а посредниками — G-белок и сАМР. Взаимопревращения ферментов осуществляются в ходе фосфорилирования — дефосфорилирования.
Гормональная регуляция. Этот тип регуляции метаболизма предусматривает участие гормонов — сигнальных веществ, образующихся в клетках эндокринных желез, поэтому гормональная регуляция свойственна только высшим организмам. Выше описано действие гормонов на процесс обмена гликогена, в котором регулируется активность ферментов на уровне ковалентной модификации. Кроме этого, гормоны способны оказывать воздействие на скорость транскрипции (оперонная регуляция).
Из специализированных клеток, где происходит синтез гормонов, последние поступают в кровь и переносятся к клеткам-мишеням, имеющим рецепторы, способным связывать гормоны и тем самым воспринимать гормональный сигнал. Связывание гормона рецептором запускает каскад реакций с участием молекул-посредников, которые завершаются клеточным ответом. Липофильные гормоны связываются с внутриклеточным рецептором (белок) и регулируют транскрипцию определенных генов. Гидрофильные гормоны действуют на клетки-мишени за счет связывания с рецепторами на плазматической мембране.
Кроме гормонов, аналогичным действием обладают другие сигнальные вещества: медиаторы, нейромедиаторы, ростовые факторы. Четкой границы, позволяющей отличать гормоны от перечисленных веществ, нет. Медиаторами называют сигнальные вещества, которые продуцируются не железами внутренней секреции, а различными типами клеток. К медиаторам относят гистамин, простагландины, которые обладают гормоноподобным действием.
Нейромедиаторами считают сигнальные вещества, продуцируемые клетками центральной нервной системы.
Изменение концентрации метаболитов. Важным условием, обеспечивающим высокую скорость того или иного метаболического пути, является концентрация субстратов. Она может зависеть от интенсивности протекания других процессов, в которых также расходуются эти субстраты (конкуренция), или от скорости транспорта данных веществ через мембраны (плазматическую или органелл). В частности, у эукариотических клеток появляется возможность регулировать метаболизм, перераспределяя метаболиты по отдельным компартментам.
Кроме этого, скорость метаболических процессов определяется концентрацией кофакторов. Например, гликолиз и ЦТК регулируются доступностью ADP (глава 10, 11) на уровне изменения активности ключевых аллостерических ферментов.
Посттранскрипционная и посттрансляционная модификация макромолекул. Эти процессы также описаны в соответствующих разделах (глава 3). Модификация и/или процессинг первичных РНК-транскриптов осуществляются с разной скоростью, от чего зависит концентрация зрелых молекул РНК, способных транслироваться, а значит, и интенсивность белкового синтеза. В свою очередь, пептиды, прежде чем превратиться в зрелый белок, также должны модифицироваться, и если это касается ферментов, то речь идет об их ковалентной модификации.