Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Печень
Роль печени в углеводном обмене
Основная роль печени в углеводном обмене заключается в обеспечении постоянства концентрации глюкозы в крови. Это достигается регуляцией между синтезом и распадом гликогена, депонируемого в печени.
В печени синтез гликогена и его регуляция в основном аналогичны тем процессам, которые протекают в других органах и тканях, в частности в мышечной ткани. Синтез гликогена из глюкозы обеспечивает в норме временный резерв углеводов, необходимый для поддержания концентрации глюкозы в крови в тех случаях, если ее содержание значительно уменьшается (например, у человека это происходит при недостаточном поступлении углеводов с пищей или в период ночного «голодания»).
Необходимо подчеркнуть важную роль фермента глюкокиназы в процессе утилизации глюкозы печенью. Глюкокиназа, подобно гексокиназе, катализирует фосфорилирование глюкозы с образованием глюкозо-6-фосфата, при этом активность глюкокиназы в печени почти в 10 раз превышает активность гексокиназы. Важное различие между этими двумя ферментами заключается в том, что глюкокиназа в противоположность гексокиназе имеет высокое значение КМ для глюкозы и не ингибируется глюкозо-6-фосфатом.
После приема пищи содержание глюкозы в воротной вене резко возрастает: в тех же пределах увеличивается и ее внутрипеченочная концентрация*. Повышение концентрации глюкозы в печени вызывает существенное увеличение активности глюкокиназы и автоматически увеличивает поглощение глюкозы печенью (образовавшийся глюкозо-6-фосфат либо затрачивается на синтез гликогена, либо расщепляется).
* При всасывании углеводов из кишечника уровень глюкозы в крови воротной вены повышается до 20 ммоль/л, а в периферической крови ее содержится не более 5 ммоль/л.
Считают, что основная роль печени—расщепление глюкозы—сводится прежде всего к запасанию метаболитов-предшественников, необходимых для биосинтеза жирных кислот и глицерина, и в меньшей степени к окислению ее до СО2 и Н2О. Синтезированные в печени триглицериды в норме выделяются в кровь в составе липопротеинов и транспортируются в жировую ткань для более «постоянного» хранения.
В реакциях пентозофосфатного пути в печени образуется НАДФН, используемый для восстановительных реакций в процессах синтеза жирных кислот, холестерина и других стероидов. Кроме того, при этом образуются пентозофосфаты, необходимые для синтеза нуклеиновых кислот.
Наряду с утилизацией глюкозы в печени происходит и ее образование. Непосредственным источником глюкозы в печени служит гликоген. Распад гликогена в печени происходит в основном фосфоролитическим путем. В регуляции скорости гликогенолиза в печени большое значение имеет система циклических нуклеотидов. Кроме того, глюкоза в печени образуется также в процессе глюконеогенеза.
Основными субстратами глюконеогенеза служат лактат, глицерин и аминокислоты. Принято считать, что почти все аминокислоты, за исключением лейцина, могут пополнять пул предшественников глюконеогенеза.
При оценке углеводной функции печени необходимо иметь в виду, что соотношение между процессами утилизации и образования глюкозы регулируется прежде всего нейрогуморальным путем при участии желез внутренней секреции.
Центральную роль в превращениях глюкозы и саморегуляции углеводного обмена в печени играет глюкозо-6-фосфат. Он резко тормозит фосфоролитическое расщепление гликогена, активирует ферментативный перенос глюкозы с уридиндифосфоглюкозы на молекулу синтезирующегося гликогена, является субстратом для дальнейших гликолитических превращений, а также окисления глюкозы, в том числе по пентозофосфатному пути. Наконец, расщепление глюкозо-6-фосфата фосфатазой обеспечивает поступление в кровь свободной глюкозы, доставляемой током крови во все органы и ткани (рис. 16.1).
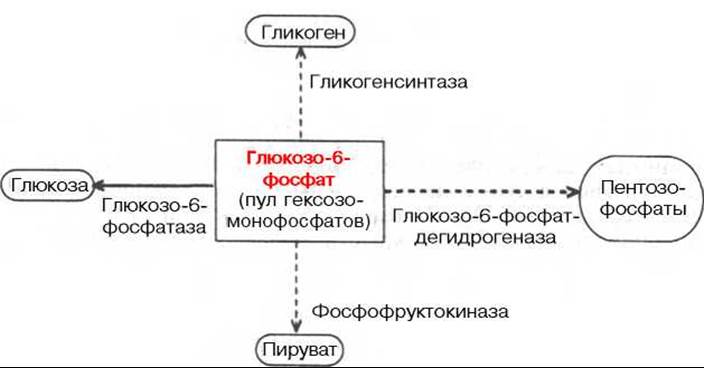
Рис. 16.1. Участие глюкозо-6-фосфата в метаболизме углеводов.
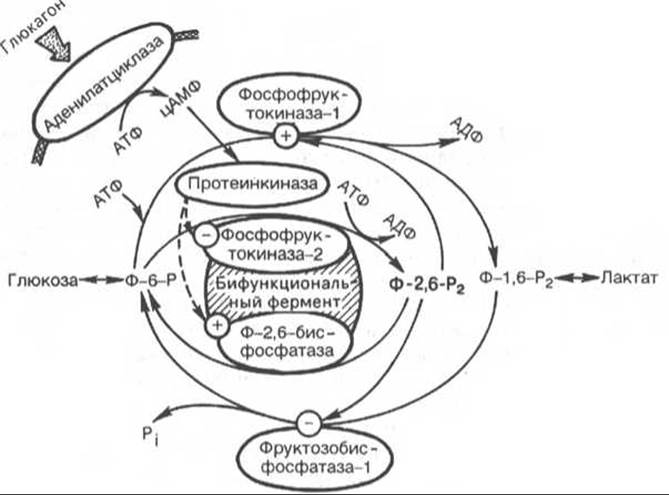
Рис. 16.2. Гормональная регуляция системы фруктозо-2,6-бисфосфата (Ф-2,6-Р2) в печени при участии цАМФ-зависимых протеинкиназ.
Как отмечалось, наиболее мощным аллостерическим активатором фосфофруктокиназы-1 и ингибитором фруктозо- 1,6-бисфосфатазы печени является фруктозо-2,6-бисфосфат (Ф-2,6-Р2). Повышение в гепатоцитах уровня Ф-2,6-Р2 способствует усилению гликолиза и уменьшению скорости глюконеогенеза. Ф-2,6-Р2 снижает ингибирующее действие АТФ на фосфофруктокиназу-1 и увеличивает сродство этого фермента к фруктозо-6-фосфату. При ингибировании фруктозо-1,6-бисфосфатазы Ф-2,6-Р2 возрастает значение КМ для фруктозо-1,6-бисфосфата. Содержание Ф-2,6-Р2 в печени, сердце, скелетной мускулатуре и других тканях контролируется бифункциональным ферментом, который осуществляет синтез Ф-2,6-Р2 из фруктозо-6-фосфата и АТФ и гидролиз его до фруктозо-6-фосфата и Pi, т.е. фермент одновременно обладает и киназной, и бисфосфатазной активностью. Бифункциональный фермент (фосфофруктокиназа-2/фруктозо-2,6-бисфосфатаза), выделенный из печени крысы, состоит из двух идентичных субъединиц с мол. массой 55000, каждая из которых имеет два различных каталитических центра. Киназный домен при этом расположен на N-конце, а бисфосфатазный — на С-конце каждой из полипептидных цепей. Известно также, что бифункциональный фермент печени является прекрасным субстратом для цАМФ-зависимой протеинкиназы А. Под действием протеинкиназы А происходит фосфорилирование остатков серина в каждой из субъединиц бифункционального фермента, что приводит к снижению его киназной и повышению бисфосфатазной активности. Заметим, что в регуляции активности бифункционального фермента существенная роль принадлежит гормонам, в частности глюкагону (рис. 16.2).
При многих патологических состояниях, в частности при сахарном диабете, отмечаются существенные изменения в функционировании и регуляции системы Ф-2,6-Р2. Установлено, что при экспериментальном (стептозотоциновом) диабете у крыс на фоне резкого увеличения уровня глюкозы в крови и моче в гепатоцитах содержание Ф-2,6-Р2 снижено. Следовательно, снижается скорость гликолиза и усиливается глюконеогенез. Данный факт имеет свое объяснение. Возникающие у крыс при диабете нарушения гормонального фона: увеличение концентрации глюкагона и уменьшение содержания инсулина — обусловливают повышение концентрации цАМФ в ткани печени, усиление цАМФ-зависимого фосфорилирования бифункционального фермента, что в свою очередь приводит к снижению его киназной и повышению бисфосфатазной активности. Таков может быть механизм снижения уровня Ф-2,6-Р2 в гепатоцитах при экспериментальном диабете. По-видимому, существуют и другие механизмы, ведущие к снижению уровня Ф-2,6-Р2 в гепатоцитах при стрептозотоциновом диабете. Показано, что при экспериментальном диабете в ткани печени имеет место снижение активности глюкокиназы (возможно, и снижение количества данного фермента). Это приводит к падению скорости фосфорилирования глюкозы, а затем к снижению содержания фруктозо-6-фосфата — субстрата бифункционального фермента. Наконец, в последние годы было показано, что при стрептозотоциновом диабете уменьшается количество мРНК бифункционального фермента в гепатоцитах и как следствие — снижается уровень Ф-2,6-Р2 в ткани печени, усиливается глюконеогенез. Все это еще раз подтверждает положение, что Ф-2,6-Р2, являясь важным компонентом в цепи передачи гормонального сигнала, выступает в роли третичного посредника при действии гормонов, прежде всего на процессы гликолиза и глюконеогенеза.
Рассматривая промежуточный обмен углеводов в печени, необходимо также остановиться на превращениях фруктозы и галактозы. Поступающая в печень фруктоза может фосфорилироваться в положении 6 до фруктозо-6-фосфата под действием гексокиназы, обладающей относительной специфичностью и катализирующей фосфорилирование, кроме глюкозы и фруктозы, еще и маннозы. Однако в печени существует и другой путь: фруктоза способна фосфорилироваться при участии более специфического фермента — фруктокиназы. В результате образуется фруктозо-1-фосфат. Эта реакция не блокируется глюкозой. Далее фруктозо-1-фосфат под действием альдолазы расщепляется на две триозы: диоксиацетонфосфат и глицеральдегид. Под влиянием соответствующей киназы (триокиназы) и при участии АТФ глицеральдегид подвергается фосфорилированию до глицеральдегид-3-фосфата. Последний (в него легко переходит и диоксиацетонфосфат) подвергается обычным превращениям, в том числе с образованием в качестве промежуточного продукта пировиноградной кислоты.
Следует отметить, что при генетически обусловленной нетолерантности к фруктозе или недостаточной активности фруктозо-1,6-бисфосфатазы наблюдается индуцируемая фруктозой гипогликемия, возникающая вопреки наличию больших запасов гликогена. Вероятно, фруктозо-1-фосфат и фруктозо-1,6-бисфосфат ингибируют фосфорилазу печени по аллостерическому механизму.
Известно также, что метаболизм фруктозы по гликолитическому пути в печени происходит гораздо быстрее, чем метаболизм глюкозы. Для метаболизма глюкозы характерна стадия, катализируемая фосфофруктокиназой-1. Как известно, на этой стадии осуществляется метаболический контроль скорости катаболизма глюкозы. Фруктоза минует эту стадию, что позволяет ей интенсифицировать в печени процессы метаболизма, ведущие к синтезу жирных кислот, их эстерификацию и секрецию липопротеинов очень низкой плотности; в результате может увеличиваться концентрация триглицеридов в плазме крови.
Галактоза в печени сначала фосфорилируется при участии АТФ и фермента галактокиназы с образованием галактозо-1-фосфата. Для галактокиназы печени плода и ребенка характерны значения КМ и Vмакс, примерно в 5 раз превосходящие таковые у ферментов взрослого человека. Большая часть галактозо-1-фосфата в печени превращается в ходе реакции, катализируемой гексозо-1-фосфат-уридилилтрансферазой:
УДФ-глюкоза + Галактозо-1-фосфат —> УДФ-галактоза + Глюкозо-1-фосфат.
Это уникальная трансферазная реакция возвращения галактозы в основное русло углеводного метаболизма. Наследственная утрата гексозо-1- фосфат-уридилилтрансферазы приводит к галактоземии — заболеванию, для которого характерны умственная отсталость и катаракта хрусталика. В этом случае печень новорожденных теряет способность метаболизировать D-галактозу, входящую в состав лактозы молока.