Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Кровь
Химический состав крови
Белки плазмы крови
Из 9—10% сухого остатка плазмы крови на долю белков приходится 6,5—8,5%. Используя метод высаливания нейтральными солями, белки плазмы крови можно разделить на три группы: альбумины, глобулины и фибриноген. Нормальное содержание альбуминов в плазме крови составляет 40—50 г/л, глобулинов — 20—30 г/л, фибриногена—2,4 г/л. Плазма крови, лишенная фибриногена, называется сывороткой.
Синтез белков плазмы крови осуществляется преимущественно в клетках печени и ретикулоэндотелиальной системы. Физиологическая роль белков плазмы крови многогранна.
1. Белки поддерживают коллоидно-осмотическое (онкотическое) давление и тем самым постоянный объем крови. Содержание белков в плазме значительно выше, чем в тканевой жидкости. Белки, являясь коллоидами, связывают воду и задерживают ее, не позволяя выходить из кровяного русла. Несмотря на то что онкотическое давление составляет лишь небольшую часть (около 0,5%) от общего осмотического давления, именно оно обусловливает преобладание осмотического давления крови над осмотическим давлением тканевой жидкости. Известно, что в артериальной части капилляров в результате гидростатического давления безбелковая жидкость крови проникает в тканевое пространство. Это происходит до определенного момента — «поворотного», когда падающее гидростатическое давление становится равным коллоидно-осмотическому. После «поворотного» момента в венозной части капилляров происходит обратный ток жидкости из ткани, так как гидростатическое давление стало меньше, чем коллоидноосмотическое. При иных условиях в результате гидростатического давления в кровеносной системе вода просачивалась бы в ткани, что вызвало бы отек различных органов и подкожной клетчатки.
2. Белки плазмы принимают активное участие в свертывании крови. Ряд белков, в том числе фибриноген, являются основными компонентами системы свертывания крови.
3. Белки плазмы в известной мере определяют вязкость крови, которая, как отмечалось, в 4—5 раз выше вязкости воды и играет важную роль в поддержании гемодинамических отношений в кровеносной системе.
4. Белки плазмы принимают участие в поддержании постоянного рН крови, так как составляют одну из важнейших буферных систем крови.
5. Важна также транспортная функция белков плазмы крови: соединяясь с рядом веществ (холестерин, билирубин и др.), а также с лекарственными средствами (пенициллин, салицилаты и др.), они переносят их к тканям.
6. Белки плазмы играют важную роль в процессах иммунитета (особенно это касается иммуноглобулинов).
7. В результате образования с белками плазмы недиализируемых комплексов поддерживается уровень катионов в крови. Например, 40—50% кальция сыворотки связано с белками, значительная часть железа, магния, меди и других элементов также связана с белками сыворотки.
8. Наконец, белки плазмы крови могут служить резервом аминокислот.
Современные физико-химические методы позволили открыть и описать около 100 различных белковых компонентов плазмы крови. Особое значение приобрело электрофоретическое разделение белков плазмы (сыворотки) крови.
В сыворотке крови здорового человека при электрофорезе на бумаге можно обнаружить 5 фракций: альбумины, а1-, а2-, ß-, у-глобулины. Методом электрофореза в агаровом геле в сыворотке крови выделяют 7—8 фракций, а при электрофорезе в крахмальном или полиакриламидном геле — до 16—17 фракций. Следует помнить, что терминология белковых фракций, получаемых при различных видах электрофореза, еще окончательно не установилась. При изменении условий электрофореза, а также при электрофорезе в различных средах (например, в крахмальном или полиакриламидном геле) скорость миграции и, следовательно, порядок белковых зон могут меняться.
Еще большее число белковых фракций (свыше 30) можно получить методом иммуноэлектрофореза (рис. 17.1). Этот метод представляет собой своеобразную комбинацию электрофоретического и иммунологического методов анализа белков. Иными словами, термин «иммуноэлектрофорез» подразумевает проведение электрофореза и реакции преципитации в одной среде, т.е. непосредственно на гелевом блоке. При данном методе с помощью серологической реакции преципитации достигается значительное повышение аналитической чувстительности электрофоретического метода.
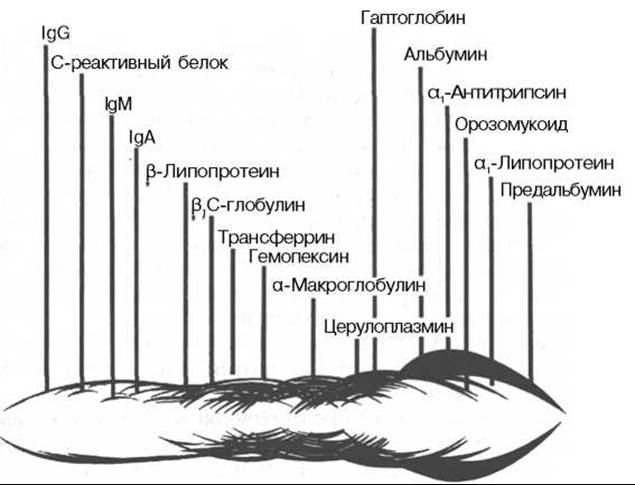
Рис. 17.1. Иммуноэлектрофореграмма белков сыворотки крови человека (по Генри).
Характеристика основных белковых фракций
Альбумины. На долю альбуминов приходится более половины (55—60%) белков плазмы крови человека. Мол. масса альбумина около 70000. Сывороточные альбумины сравнительно быстро обновляются (период полураспада альбуминов человека 7 дней).
Благодаря высокой гидрофильности, особенно в связи с относительно небольшим размером молекул и значительной концентрацией в сыворотке, альбумины играют важную роль в поддержании онкотического давления крови. Известно, что концентрация альбуминов в сыворотке ниже 30 г/л вызывает значительные изменения онкотического давления крови, что приводит к возникновению отеков. Альбумины выполняют важную функцию транспорта многих биологически активных веществ (в частности, гормонов). Они способны связываться с холестерином, желчными пигментами. Значительная часть кальция в сыворотке крови также связана с альбуминами.
При электрофорезе в крахмальном геле фракция альбуминов у некоторых людей иногда делится на две (альбумин А и альбумин В), т.е. у таких людей имеется два независимых генетических локуса, контролирующих синтез альбуминов. Добавочная фракция (альбумин В) отличается от обычного сывороточного альбумина тем, что молекулы этого белка содержат два остатка дикарбоновых аминокислот или более, замещающих в полипептидной цепи обычного альбумина остатки тирозина или цистеина. Существуют и другие редкие варианты альбумина (альбумин Ридинг, альбумин Джент, альбумин Маки). Наследование полиморфизма альбуминов происходит по аутосомному кодоминантному типу и наблюдается в нескольких поколениях.
Помимо наследственного полиморфизма альбуминов, встречается преходящая бисальбуминемия, которую иногда принимают за врожденную. Описано появление быстрого компонента альбумина у больных, получавших большие дозы пенициллина. После отмены пенициллина этот компонент вскоре исчезал из крови. Существует предположение, что повышение электрофоретической подвижности фракции альбумин — антибиотиксвязано с увеличением отрицательного заряда за счет СООН- групп пенициллина.

Рис. 17.2. Строение молекулы иммуноглобулинов (схема). Объяснения в тексте.
Глобулины. Сывороточные глобулины при высаливании нейтральными солями можно разделить на 2 фракции — эуглобулины и псевдоглобулины. Фракция эуглобулинов в основном состоит из y-глобулинов, а фракция псевдоглобулинов включает a-, ß- и у-глобулины, которые при электрофорезе, особенно в крахмальном или полиакриламидном геле, способны разделяться на ряд подфракций. а- и ß-Глобулиновые фракции содержат липопротеины, а также белки, связанные с металлами. Большая часть антител, содержащихся в сыворотке, находится во фракции у-глобулинов. При снижении уровня белков этой фракции резко понижаются защитные силы организма.
Иммуноглобулины, или антитела*, синтезируются В-лимфоцитами или образующимися из них плазматическими клетками. Известно 5 классов иммуноглобулинов: IgG, IgA, IgM, IgD и IgE, при этом IgG, IgA и IgM — основные классы; IgD и IgE — минорные классы иммуноглобулинов плазмы человека. Молекула иммуноглобулина состоит из двух идентичных пар полипептидных цепей. Каждая пара в свою очередь состоит из двух разных цепей: легкой (L) и тяжелой (Н). Иными словами, молекула иммуноглобулинов состоит из двух легких (L) цепей (мол. масса 23000) и двух тяжелых (Н) цепей (мол. масса 53000—75000), образующих тетрамер (L2H2) при помощи дисульфидных связей (рис. 17.2). Каждая цепь разделена (может быть, несколько условно) на специфические домены, или участки, имеющие определенное структурное и функциональное значение. Половину легкой цепи, включающую карбоксильный конец, называют константной областью (CL), a N-концевую половину легкой цепи — вариабельной областью (VL).
* Существует мнение, что не все иммуноглобулины являются антителами [Уайт А. и др., 1981], т.е. термин «иммуноглобулины» относится не только к нормальным классам антител, но и, в частности, к большому числу «патологических» белков, обычно называемых миеломными белками.
Примерно четвертую часть тяжелой цепи, включающую N-конец, относят к вариабельной области Н-цепи (VH), остальная часть ее — это константные области (СН1, СН2, СН3). Участок иммуноглобулина, связывающийся со специфическим антигеном, формируется N-концевыми вариабельными областями легких и тяжелых цепей, т.е. VH- и VL-доменами. У высших позвоночных имеются все 5 классов антител (IgA, IgD, IgE, IgG и IgM), каждый со своим классом Н -цепей: а, δ, ε, у и μ соответственно. Молекулы IgA содержат а-цепи, молекулы IgG — у-цепи и т.д. Кроме того, имеется ряд подклассов иммуноглобулинов IgG и IgA. Например, у человека существует 4 подкласса IgG: IgG1, IgG2, IgG3 и IgG4, содержащих тяжелые цепи у1, у2, y3 и у4, соответственно. Разные Н-цепи придают шарнирным участкам и «хвостовым» областям антител различную конформацию и определяют характерные свойства каждого класса и подкласса (подробнее см. руководства по иммунологии).
В клинической практике встречаются состояния, характеризующиеся изменением как общего количества белков плазмы крови, так и процентного соотношения отдельных белковых фракций.
Гиперпротеинемия — увеличение общего содержания белков плазмы. Диарея у детей, рвота при непроходимости верхнего отдела тонкой кишки, обширные ожоги могут способствовать повышению концентрации белков в плазме крови. Иными словами, потеря воды организмом, а следовательно, и плазмой приводит к повышению концентрации белка в крови (относительная гиперпротеинемия).
При ряде патологических состояний может наблюдаться абсолютная гиперпротеинемия, обусловленная увеличением уровня у-глобулинов: например, гиперпротеинемия в результате инфекционного или токсического раздражения системы макрофагов; гиперпротеинемия при миеломной болезни. В сыворотке крови больных миеломной болезнью обнаруживаются специфические «миеломные» белки. Появление в плазме крови белков, не существующих в нормальных условиях, принято называть парапротеинемией. Нередко при этом заболевании содержание белков в плазме достигает 100-160 г/л.
Иногда при миеломной болезни аномальные белки плазмы преодолевают почечный барьер и появляются в моче. Эти белки, представляющие собой легкие цепи иммуноглобулинов, получили название белков Бенс-Джонса. Явления парапротеинемии можно наблюдать и при макроглобулинемии Вальденстрема. Для болезни Вальденстрема характерно появление в плазме крови белков с большой молекулярной массой (1000000— 1600000); содержание макроглобулинов может достигать 80% от общего количества белка, составляющего в этом случае 150—160 г/л.
Гипопротеинемия, или уменьшение общего количества белка в плазме крови, наблюдается главным образом при снижении уровня альбуминов. Выраженная гипопротеинемия — постоянный и патогенетически важный симптом нефротического синдрома. Содержание общего белка снижается до 30—40 г/л. Гипопротеинемия наблюдается также при поражении печеночных клеток (острая атрофия печени, токсический гепатит и др.). Кроме того, гипопротеинемия может возникнуть при резко увеличенной проницаемости стенок капилляров, при белковой недостаточности (поражение пищеварительного тракта, карцинома и др.). Следовательно, можно считать, что гиперпротеинемия, как правило, связана с гиперглобулинемией, а гипопротеинемия — с гипоальбуминемией.
При многих заболеваниях очень часто изменяется процентное соотношение отдельных белковых фракций, хотя общее содержание белка в сыворотке крови остается в пределах нормы. Такое состояние носит название «диспротеинемия». На рис. 17.3 схематично представлен характер изменения белковых фракций сыворотки крови при ряде заболеваний без учета формы и стадии болезни.

Рис. 17.3. Изменения электрофореграммы белков сыворотки крови при некоторых заболеваниях (по Эммриху).
В течении многих болезней, связанных с общим воспалением (инфекционные заболевания, ревматизм и т.д.), отмечается несколько стадий, что, несомненно, сказывается и на белковом спектре крови.
Как отмечалось, a- и ß-глобулиновые фракции белков сыворотки крови содержат липопротеины и гликопротеины. В состав углеводной части гликопротеинов крови входят в основном следующие моносахариды и их производные: галактоза, манноза, рамноза, глюкозамин, галактозамин, нейраминовая кислота и ее производные (сиаловые кислоты). Соотношение этих углеводных компонентов в отдельных гликопротеинах сыворотки крови различно. Чаще всего в осуществлении связи между белковой и углеводной частями молекулы гликопротеинов принимают участие аспарагиновая кислота (ее карбоксил) и глюкозамин. Несколько реже встречается связь между гидроксилом треонина или серина и гексозаминами или гексозами.
Нейраминовая кислота и ее производные (сиаловые кислоты) — наиболее лабильные и активные компоненты гликопротеинов. Они занимают конечное положение в углеводной цепочке молекулы гликопротеинов и во многом определяют свойства данного гликопротеина.
Гликопротеины имеются почти во всех белковых фракциях сыворотки крови. При электрофорезе на бумаге гликопротеины в большом количестве выявляются в a1- и а2-фракциях глобулинов. Гликопротеины, связанные с a-глобулиновыми фракциями, содержат небольшое количество фруктозы, а гликопротеины, выявляемые в составе ß- и особенно у-глобулиновых фракций, содержат фруктозу в значительном количестве.
Повышенное содержание гликопротеинов в плазме или сыворотке крови наблюдается при туберкулезе, плевритах, пневмониях, остром ревматизме, гломерулонефритах, нефротическом синдроме, диабете, инфаркте миокарда, подагре, а также при остром и хроническом лейкозах, миеломе, лимфосаркоме и некоторых других болезнях. У больного ревматизмом увеличение содержания гликопротеинов в сыворотке соответствует тяжести заболевания. Это объясняется, по мнению ряда исследователей, деполимеризацией основного вещества соединительной ткани, что приводит к поступлению гликопротеинов в кровь.
Липопротеины плазмы крови
Липопротеины — это высокомолекулярные водорастворимые частицы, представляющие собой комплекс белков и липидов. В этом комплексе белки вместе с полярными липидами формируют поверхностный гидрофильный слой, окружающий и защищающий внутреннюю гидрофобную липидную сферу от водной среды и обеспечивающий транспорт липидов в кровяном русле и их доставку в органы и ткани.
Плазменные липопротеины (ЛП) — это сложные комплексные соединения, имеющие характерное строение: внутри липопротеиновой частицы находится жировая капля (ядро), содержащая неполярные липиды (триглицериды, эстерифицированный холестерин); жировая капля окружена оболочкой, в состав которой входят фосфолипиды, белок и свободный холестерин. Толщина наружной оболочки липопротеиновой частицы (ЛП- частица) составляет 2,1—2,2 нм, что соответствует половине толщины липидного бислоя клеточных мембран. Это позволило сделать заключение, что в плазменных липопротеинах наружная оболочка в отличие от клеточных мембран содержит липидный монослой. Фосфолипиды, а также неэстерифицированный холестерин (НЭХС) расположены в наружной оболочке таким образом, что полярные группы фиксированы наружу, а гидрофобные жирно-кислотные «хвосты» — внутрь частицы, причем какая-то часть этих «хвостов» даже погружена в липидное ядро. По всей вероятности, наружная оболочка липопротеинов представляет собой не гомогенный слой, а мозаичную поверхность с выступающими участками белка. Существует много различных схем строения ЛП-частицы. Предполагают, что входящие в ее состав белки занимают только часть наружной оболочки. Допускается, что часть белковой молекулы погружена в ЛП-частицу глубже, чем толщина ее наружной оболочки (рис. 17.4). Итак, плазменные ЛП представляют собой сложные надмолекулярные комплексы, в которых химические связи между компонентами комплекса носят нековалентный характер. Поэтому применительно к ним вместо слова «молекула» употребляют выражение «частица».
Классификация липопротеинов. Существует несколько классификаций ЛП, основанных на различиях в их свойствах: гидратированной плотности, скорости флотации, электрофоретической подвижности, а также на различиях в апопротеиновом составе частиц.
Наибольшее распространение получила классификация, основанная на поведении отдельных ЛП в гравитационном поле в процессе ультрацентрифугирования. Применяя набор солевых плотностей, можно изолировать отдельные фракции ЛП: хиломикроны (ХМ) — самые легкие частицы, затем липопротеины очень низкой плотности (ЛПОНП), липопротеины низкой плотности (ЛПНП) и липопротеины высокой плотности (ЛПВП).
Различная электрофоретическая подвижность по отношению к глобулинам плазмы крови положена в основу другой классификации ЛП, согласно которой различают ХМ (остаются на старте подобно у-глобулинам), ß-ЛП, пре-β-ЛП и а-ЛП, занимающие положение ß-, a1- и а2-глобулинов соответственно. Электрофоретическая подвижность фракций ЛП, выделенных путем ультрацентрифугирования, соответствует подвижности отдельных глобулинов, поэтому иногда используют двойное их обозначение: ЛПОНП и пре-Р-ЛП, ЛПНП и ß-ЛП, ЛПВП и а-ЛП (рис. 17.5). Следует помнить, что изолированные различными методами ЛП не являются полностью идентичными, поэтому рекомендуется использовать терминологию, соответствующую методу выделения.

Рис. 17.4. Строение ЛП-частицы (схема). Имеется сходство со структурой плазматической мембраны. Некоторое количество эстерифицированного холестерина и триглицеридов (не показано) содержится в поверхностном слое, а в ядре частицы - небольшое количество неэстерифицированного холестерина (по А.Н. Климову и Н.Г. Никульчевой). Объяснение в тексте.
Аполипопротеины (апобелки, апо) входят в состав липопротеинов. Это один белок либо несколько белков, или полипептидов, которые называют апобелками (сокращенно апо). Эти белки обозначают буквами латинского алфавита (А, В, С). Так, два главных апобелка ЛПВП обозначаются A-I и А-II. Основным апобелком ЛПНП является апобелок В, он входит также в состав ЛПОНП и хиломикронов. Апобелки C-I, С-II и C-III представляют собой небольшие полипептиды, которые могут свободно переходить от одного липопротеина к другому. Помимо апобелков А, В и С, в липопротеинах плазмы крови идентифицировано еще несколько апобелков. Одним из них является выделенный из ЛПОНП апобелок Е, на его долю приходится 5—10% от общего количества апобелков ЛПОНП.

Рис. 17.5. Шлирен-профиль липопротеинов плазмы крови человека при аналитическом ультрацентрифУгировании (по А.Н. Климову и Н.Г. Никульчевой, 1995).
Апобелки выполняют не только структурную функцию, но и обеспечивают активное участие комплексов ЛП в транспорте липидов в токе крови от мест их синтеза к клеткам периферических тканей, а также обратный транспорт холестерина в печень для дальнейших метаболических превращений. Апобелки выполняют функцию лигандов во взаимодействии ЛП со специфическими рецепторами на клеточных мембранах, регулируя тем самым гомеостаз холестерина в клетках и в организме в целом. Не меньшее значение имеет также регуляция апобелками активности ряда основных ферментов липидного обмена: лецитин-холестеролацилтрансферазы, липопротеинлипазы, печеночной триглицеридлипазы. Структура и концентрация в плазме крови каждого апобелка находится под генетическим контролем, в то время как содержание липидов в большей степени подвержено влиянию диетических и других факторов.
Дислипопротеинемией (ДЛП) называют изменения в содержании липопротеинов в плазме (сыворотке) крови: повышение, снижение или практически полное отсутствие. Сюда же относят случаи появления в крови необычных или патологических ЛП. Таким образом, понятие «дислипопротеинемия» охватывает все разновидности изменения уровня ЛП в крови. Более узким является термин «гиперлипопротеинемия» (ГЛП), отражающий увеличение какого-то класса или классов ЛП в крови. Первой и весьма успешной попыткой систематизации отклонений от нормы в липопротеидном спектре крови явилась классификация типов ГЛП, разработанная D. Fredrickson и соавт. и одобренная экспертами ВОЗ. Согласно варианту ВОЗ, различают следующие типы ГЛП.
Тип I — гиперхиломикронемия. Основные изменения в липопротеинограмме следующие: высокое содержание ХМ, нормальное или слегка повышенное содержание ЛПОНП; резко повышенный уровень триглицеридов в сыворотке крови. Клинически это состояние проявляется ксантоматозом.
Тип II делят на два подтипа: тип IIа — гипер-β-липопротеинемия с характерным высоким содержанием в крови ЛПНП и тип IIб — гипер-β-липопротеинемия с высоким содержанием одновременно двух классов липопротеинов (ЛПНП, ЛПОНП). При типе II отмечается высокое, а в некоторых случаях очень высокое содержание холестерина в плазме крови. Уровень триглицеридов в крови может быть либо нормальным (типа IIа), либо повышенным (тип IIб). Клинически проявляется атеросклеротическими нарушениями, нередко развивается ишемическая болезнь сердца (ИБС).
Тип III — дис-ß-липопротеинемия. В сыворотке крови появляются липопротеины с необычно высоким содержанием холестерина и высокой электрофоретической подвижностью («флотирующие» ß-липопротеины). Они накапливаются в крови вследствие нарушения превращения ЛПОНП в ЛПНП. Этот тип ГЛП часто сочетается с различными проявлениями атеросклероза, в том числе с ИБС и поражением сосудов ног.
Тип IV — гиперпре-β-липопротеинемия. Характерны повышение уровня ЛПОНП, нормальное содержание ЛПНП, отсутствие ХМ; увеличение уровня триглицеридов при нормальном или слегка повышенном уровне холестерина. Клинически этот тип сочетается с диабетом, ожирением, ИБС.
Тип V — гиперпре-β-липопротеинемия и гиперхиломикронемия. Наблюдаются повышение уровня ЛПОНП, наличие ХМ. Клинически проявляется ксантоматозом, иногда сочетается со скрытым диабетом. Ишемической болезни сердца при данном типе ГЛП не наблюдается.
Несомненным достоинством данной классификации является то, что она выделила связь нарушений обмена ЛП с развитием атеросклероза, благодаря чему не утратила своего значения и в настоящее время. Однако эта классификация не охватывает все возможные варианты отклонений от нормы в содержании липидов и ЛП в плазме крови. В частности, она не учитывает изменения концентрации ЛПВП, пониженное содержание которых является независимым фактором риска развития атеросклероза и ИБС а повышенное, наоборот, выполняет роль антириск-фактора.
Исследования, проведенные во многих странах мира, показали, что у больных ИБС содержание а-липопротеинового холестерина ниже, чем у лиц без признаков ИБС. Холестерин ЛПВП как «предсказатель» ИБС оказался в 8 раз чувствительнее, чем холестерин ЛПНП. Предложено в качестве «предсказателя» рассчитывать так называемый холестериновый коэффициент атерогенности (К), представляющий собой отношение уровня холестерина ЛПНП и ЛПОНП к содержанию холестерина ЛПВП:
![]()
В клинике очень удобно рассчитывать этот коэффициент на основании определения уровня общего холестерина и холестерина ЛПВП:
![]()
Чем выше этот коэффициент (у здоровых лиц он не превышает 3), тем выше опасность развития (и наличия) ИБС.
Отдельные наиболее изученные и интересные в клиническом отношении белки плазмы
Гаптоглобин входит в состав глобулиновой фракции. Этот белок обладает способностью соединяться с гемоглобином. Образовавшийся гаптоглобин — гемоглобиновый комплекс может поглощаться системой макрофагов, при этом предупреждается потеря железа, входящего в состав гемоглобина как при физиологическом, так и при патологическом его освобождении из эритроцитов. Методом электрофореза выявлены 3 группы гаптоглобинов: Нр 1—1, Нр 2—1 и Нр 2—2. Установлено, что имеется связь между наследованием типов гаптоглобинов и резус-антителами.
Ингибиторы трипсина обнаруживаются при электрофорезе белков плазмы крови в зоне a1- и а2-глобулинов; они способны ингибировать трипсин и другие протеолитические ферменты. В норме содержание этих белков составляет 2,0—2,5 г/л, но при воспалительных процессах в организме, беременности и ряде других состояний содержание белков-ингибиторов протеолитических ферментов увеличивается.
Трансферрин относится к ß-глобулинам и обладает способностью соединяться с железом. Комплекс трансферрина с железом окрашен в оранжевый цвет. В этом комплексе железо находится в трехвалентной форме. Концентрация трансферрина в сыворотке крови составляет около 200—400 мг% (23—45 мкмоль/л). В норме только 1/3 трансферрина насыщена железом. Следовательно, имеется определенный резерв трансферрина, способного связывать железо. Трансферрин у различных людей может принадлежать к разным типам. Выявлено 19 типов трансферринов, различающихся по величине заряда белковой молекулы, ее аминокислотному составу и числу
молекул сиаловых кислот, связанных с белком. Обнаружение разных типов трансферринов связывают с наследственными особенностями.
Церулоплазмин имеет голубоватый цвет, обусловленный наличием в его составе 0,32% меди; обладает слабой каталитической активностью, окисляя аскорбиновую кислоту, адреналин, диоксифенилаланин и некоторые другие соединения. Концентрация церулоплазмина в сыворотке крови в норме 25—43 мг% (1,7—2,9 мкмоль/л). При гепатоцеребральной дистрофии (болезнь Вильсона—Коновалова) содержание церулоплазмина в сыворотке крови значительно снижено, а концентрация меди в моче высокая. Снижение уровня церулоплазмина отмечается также при мальабсорбции, нефрозе, дефиците меди, возникающем при парентеральном питании.
Содержание церулоплазмина повышено при беременности, гипертиреозе, инфекции, апластической анемии, остром лейкозе, лимфогранулематозе, циррозе печени.
Электрофоретическими методами установлено наличие 4 изоферментов церулоплазмина. В норме в сыворотке крови взрослых людей обнаруживается 2 изофермента, которые заметно различаются по своей подвижности при электрофорезе в ацетатном буфере при рН 5,5. В сыворотке новорожденных также были выявлены 2 фракции, имеющие большую электрофоретическую подвижность, чем изоферменты церулоплазмина взрослого человека. Следует отметить, что по своей электрофоретической подвижности изоферментный спектр церулоплазмина в сыворотке крови при болезни Вильсона-Коновалова сходен с изоферментным спектром новорожденных.
С-реактивный белок получил свое название в результате способности вступать в реакцию преципитации с С-полисахаридом пневмококков. В сыворотке крови здорового организма С-реактивный белок отсутствует, но обнаруживается при многих патологических состояниях, сопровождающихся воспалением и некрозом тканей.
Появляется С-реактивный белок в острый период болезни, поэтому его иногда называют белком «острой фазы». С переходом в хроническую фазу заболевания С-реактивный белок исчезает из крови и снова появляется при обострении процесса. При электрофорезе белок перемещается вместе с а2-глобулинами.
Криоглобулин в сыворотке крови здоровых людей также отсутствует и появляется в ней при патологических состояниях. Отличительное свойство этого белка — способность выпадать в осадок или желатинизироваться при температуре ниже 37°С. При электрофорезе Криоглобулин чаще всего передвигается вместе с у-глобулинами. Криоглобулин можно обнаружить в сыворотке крови при миеломе, нефрозе, циррозе печени, ревматизме, лимфосаркоме, лейкозах и других заболеваниях.
В настоящее время установлено, что один из криоглобулинов идентичен белку фибронектину, связанному с поверхностью фибробластов. Последний был выделен как в мономерной (мол. масса 220000), так и в димерной формах. Данный белок широко распространен в соединительной ткани.
Интерферон — специфический белок, синтезируемый в клетках организма в ответ на воздействие вирусов. Этот белок обладает способностью угнетать размножение вирусов в клетках, но не разрушает уже имеющиеся вирусные частицы. Образовавшийся в клетках интерферон легко выходит в кровяное русло и оттуда проникает в ткани и клетки. Интерферон обладает специфичностью, хотя и не абсолютной. Например, интерферон обезьян угнетает размножение вируса в культуре клеток человека. Защитное действие интерферона в значительной степени зависит от соотношения между скоростями распространения вируса и интерферона в крови и тканях.
Ферменты плазмы (сыворотки) крови
Ферменты, которые обнаруживаются в норме в плазме или сыворотке крови, условно можно разделить на 3 группы: секреторные, индикаторные и экскреторные. Секреторные ферменты, синтезируясь в печени, в норме выделяются в плазму крови, где играют определенную физиологическую роль. Типичными представителями данной группы являются ферменты, участвующие в процессе свертывания крови, и сывороточная холинэстераза. Индикаторные (клеточные) ферменты попадают в кровь из тканей, где они выполняют определенные внутриклеточные функции. Один из них находится главным образом в цитозоле клетки (ЛДГ, альдолаза), другие — в митохондриях (глутаматдегидрогеназа), третьи — в лизосомах (ß-глюкуронидаза, кислая фосфатаза) и т.д. Большая часть индикаторных ферментов в сыворотке крови определяется в норме лишь в следовых количествах. При поражении тех или иных тканей ферменты из клеток «вымываются» в кровь; их активность в сыворотке резко возрастает, являясь индикатором степени и глубины повреждения этих тканей.
Экскреторные ферменты синтезируются главным образом в печени (лейцинаминопептидаза, щелочная фосфатаза и др.). В физиологических условиях эти ферменты в основном выделяются с желчью. Еще не полностью выяснены механизмы, регулирующие поступление данных ферментов в желчные капилляры. При многих патологических процессах выделение экскреторных ферментов с желчью нарушается, а активность в плазме крови повышается.
Особый интерес для клиники представляет исследование активности индикаторных ферментов в сыворотке крови, так как по появлению в плазме или сыворотке крови ряда тканевых ферментов в повышенных количествах можно судить о функциональном состоянии и поражении различных органов (например, печени, сердечной и скелетной мускулатуры). При остром инфаркте миокарда особенно важно исследовать активность креатинкиназы, АсАТ, ЛДГ и оксибутиратдегидрогеназы.
При заболеваниях печени, в частности при вирусном гепатите (болезнь Боткина), в сыворотке крови значительно увеличивается активность АлАТ и АсАТ, сорбитолдегидрогеназы, глутаматдегидрогеназы и некоторых других ферментов. Большинство ферментов, содержащихся в печени, присутствуют и в других органах тканей. Однако известны ферменты, которые более или менее специфичны для печеночной ткани. К таким ферментам, в частности, относится у-глутамилтранспептидаза, или у-глутамилтрансфераза (ГГТ). Данный фермент — высокочувствительный индикатор при заболеваниях печени. Повышение активности ГГТ отмечается при остром инфекционном или токсическом гепатите, циррозе печени, внутрипеченочной или внепеченочной закупорке желчных путей, первичном или метастатическом опухолевом поражении печени, алкогольном поражении печени. Иногда повышение активности ГГТ наблюдается при застойной сердечной недостаточности, редко — после инфаркта миокарда, при панкреатитах, опухолях поджелудочной железы.
Органоспецифическими ферментами для печени считаются также гистидаза, сорбитолдегидрогеназа, аргиназа и орнитинкарбамоилтрансфераза. Изменение активности этих ферментов в сыворотке крови свидетельствует о поражении печеночной ткани.
В настоящее время особо важным лабораторным тестом стало исследование активности изоферментов в сыворотке крови, в частности изоферментов ЛДГ. Известно, что в сердечной мышце наибольшей активностью обладают изоферменты ЛДГ1 и ЛДГ2, а в ткани печени — ЛДГ4 и ЛДГ5 (см. главу 10). Установлено, что у больных с острым инфарктом миокарда в сыворотке крови резко повышается активность изоферментов ЛДГ1 и отчасти ЛДГ2. Изоферментный спектр ЛДГ в сыворотке крови при инфаркте миокарда напоминает изоферментный спектр сердечной мышцы. Напротив, при паренхиматозном гепатите в сыворотке крови значительно возрастает активность изоферментов ЛДГ4 и ЛДГ5 и уменьшается активность ЛДГ1 и ЛДГ2.
Диагностическое значение имеет также исследование активности изоферментов креатинкиназы в сыворотке крови. Существуют по крайней мере 3 изофермента креатинкиназы: ВВ, ММ и MB. В мозговой ткани в основном присутствует изофермент ВВ (от англ. brain — мозг), в скелетной мускулатуре — ММ-форма (от англ. muscle — мышца). Сердце содержит гибридную МВ-форму, а также ММ-форму. Изоферменты креатинкиназы особенно важно исследовать при остром инфаркте миокарда, так как МВ-форма в значительном количестве содержится практически только в сердечной мышце. Повышение активности МВ-формы в сыворотке крови свидетельствует о поражении именно сердечной мышцы.
Возрастание активности ферментов сыворотки крови при многих патологических процессах объясняется прежде всего двумя причинами: 1) выходом в кровяное русло ферментов из поврежденных участков органов или тканей на фоне продолжающегося их биосинтеза в поврежденных тканях; 2) одновременным повышением каталитической активности некоторых ферментов, переходящих в кровь. Возможно, что повышение активности ферментов при «поломке» механизмов внутриклеточной регуляции обмена веществ связано с прекращением действия соответствующих регуляторов и ингибиторов ферментов, изменением под влиянием различных факторов строения и структуры макромолекул ферментов.