Биологическая химия - Березов Т. Т., Коровкин Б. Ф. 1998
Соединительная ткань
Межклеточный органический матрикс соединительной ткани
Коллаген
Характерным компонентом структуры соединительной ткани являются коллагеновые волокна. Они построены в основном из своеобразного белкаи — коллагена. Коллаген составляет 25—33% от общего количества белка организма взрослого человека, или 6% от массы тела.
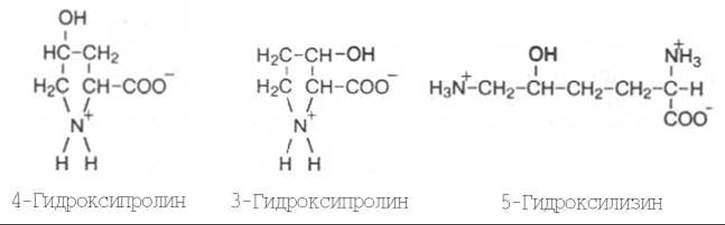
Видимые в оптическом микроскопе коллагеновые волокна состоят из различимых в электронном микроскопе фибрилл — вытянутых в длину белковых молекул, названных тропоколлагеном. Тропоколлаген — основная структурная единица коллагена (рис. 21.2). Необходимо четко разграничивать понятия «коллагеновые волокна» и «коллаген». Первое понятие по существу является морфологическим и не может быть сведено к биохимическим представлениям о коллагене как о белке. Коллагеновое волокно представляет собой гетерогенное образование и содержит, кроме белка коллагена, другие химические компоненты. Молекула тропоколлагена — это белок коллаген. Одной из отличительных черт данного белка является то, что 1/3 всех его аминокислотных остатков составляет глицин, 1/3 — пролин и 4-гидроксипролин, около 1% — гидроксилизин; некоторые молекулярные формы коллагена содержат также 3-гидроксипролин, хотя и в весьма ограниченном количестве:
Молекулярная масса тропоколлагена около 285000. Тропоколлаген состоит из трех полипептидных цепей одинакового размера, которые сливаются в спиралевидный триплет. Тройная спираль стабилизируется многочисленными межцепочечными поперечными сшивками между лизиновыми и гидроксилизиновыми остатками. Каждая полипептидная цепь тропоколлагена содержит около 1000 аминокислотных остатков. Таким образом, основная структурная единица коллагена имеет очень большие размеры, например в 10 раз больше, чем химотрипсин.
Изучение аминокислотного состава и последовательности чередования аминокислот в полипептидных цепях тропоколлагена показало, что существует два типа цепей — цепи а1 и а2, а также четыре разновидности цепи a1: a1 (I), a1 (II), a1 (III) и a1 (IV). В табл. 21.1 представлены данные о структуре коллагенов различных тканей.
Таблица 21.1. Типы коллагенов и некоторые их структурные свойства (по Уайту и др., 1981)
Тип |
Ткань |
Полипептидные цепи |
Дополнительная характеристика |
I |
Кожа, кости, сухожилия, роговица глаза |
[a1 (I)]2 a2 |
< 10 остатков оксилизина в цепи |
II |
Хрящ, стекловидное тело |
[a1 (II)]3 |
>10 остатков оксилизина в цепи |
III |
Кровеносные сосуды, кожа плода |
[a1 (III)]3 |
Слишком высокое содержание оксипролина и глицина |
IV |
Базальная мембрана |
[a1(IV)]3 |
Высокое содержание 3-оксипролина; > 20 остатков оксилизина в цепи; низкое содержание аланина |
Как и все белки, коллаген синтезируется клетками из свободных аминокислотных остатков. Аминокислотные остатки, специфичные для молекулы коллагена, гидроксипролин и гидроксилизин не образуются из соответствующих свободных аминокислот. Эти аминокислотные остатки появляются после включения пролина и лизина в полипептидную цепь с участием ферментов пролилгидроксилазы или лизилгидроксилазы и кофактора — аскорбиновой кислоты.
Учитывая наличие разных молекулярных форм в пределах одного типа (например, коллаген типа 1 имеет состав [a1 (I)]2a2 либо [a1 (I)]3, есть основание считать, что существует по крайней мере не менее 10 молекулярных форм коллагена (Е.С. Северин).
Напомним, что коллаген — внеклеточный белок, но он синтезируется в виде внутриклеточной молекулы-предшественника, которая перед образованием фибрилл зрелого коллагена подвергается посттрансляционной модификации. Предшественник коллагена (сначала препроколлаген, а затем проколлаген) претерпевает процессинг в ходе прохождения через эндоплазматический ретикулум и комплекс Гольджи до появления во внеклеточном пространстве. Внеклеточные амино- и карбоксипротеаза проколла гена удаляют соответственно аминоконцевой и карбоксиконцевой пропептиды. Вновь образованные молекулы коллагена спонтанно собираются в коллагеновые фибриллы. В результате перекрестного связывания цепей и спиральных молекул фибрилл через основания Шиффа и альдольную конденсацию (т.е. перекрестное связывание их рядом ковалентных связей) образовавшиеся фибриллы приобретают силу напряжения зрелых коллагеновых фибрилл.