БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 15. БИОХИМИЯ МЕЖКЛЕТОЧНОГО МАТРИКСА
IV. Специализированные белки межклеточного матрикса
Белки межклеточного матрикса выполняют различные функции, но их можно разделить на две большие группы по одному весьма важному признаку: 1) белки, обладающие адгезивными свойствами; 2) белки, подавляющие адгезию клеток.
А. Адгезивные белки
К первой группе белков с выраженными адгезивными свойствами относят фибронектин, ламинин, нидоген, фибриллярные коллагены и коллаген IV типа; их относят к белкам «зрелой» соединительной ткани.
Фибронектин
Фибронектин — один из ключевых белков межклеточного матрикса, неколлагеновый структурный гликопротеин, синтезируемый и выделяемый в межклеточное пространство многими клетками. Он построен из двух идентичных полипептидных цепей, соединённых дисульфидными мостиками у своих С-концов (рис. 15-19).
Рис. 15-19. Строение фибронектина.

Полипептидная цепь фибронектина содержит 7-8 доменов, на каждом из которых расположены специфические центры для связывания разных веществ. Фибронектин может связывать коллаген, протеогликаны, гиалуроновую кислоту, углеводы плазматических мембран, гепарин, фермент трансглутаминазу. Благодаря своей структуре фибронектин может выполнять интегрирующую роль в организации межклеточного вещества, а также способствовать адгезии клеток.
Существует несколько форм фибронектина, которые синтезируются разными клетками. Растворимый, или плазменный, фибронектин синтезируется гепатоцитами. Нерастворимый, или тканевый фибронектин синтезируется в основном фибробластами или эндотелиоцитами, глиоцитами и эпителиальными клетками.
Обе формы фибронектина вовлекаются в разнообразные процессы: способствуют адгезии и распространению эпителиальных и мезенхимальных клеток, стимулируют пролиферацию и миграцию эмбриональных и опухолевых клеток, контролируют дифференцировку и поддержание цитоскелета клеток, активно участвуют в воспалительных и репаративных процессах. Это связано с тем, что каждая субъединица фибронектина содержит последовательность Арг-Гли-Асп (RGD), с помощью которой он может присоединяться к клеточным рецепторам (интегринам). Эти рецепторы опосредованно взаимодействуют с актиновыми микрофиламентами, которые находятся в цитозоле. В этом процессе участвуют так называемые белки прикрепления (от англ. attach — прикреплять proteins): талин, винкулин, α-актинин (рис. 15-20).
С помощью таких белок-белковых взаимодействий информация может передаваться из межклеточного матрикса внутрь клетки, а также в обратном направлении — из клетки наружу, таким образом влияя на протекающие в клетке процессы.
Рис. 15-20. Схема взаимодействия фибронектина с интегрином.
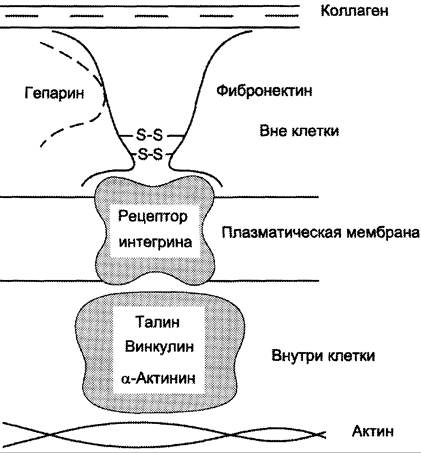
Известно также, что фибронектин участвует в миграции клеток, которые могут присоединяться к его RGD-участкам, и, таким образом, фибронектин как бы помогает им перемещаться в межклеточном матриксе.
В межклеточном матриксе, окружающем трансформированные (или опухолевые) клетки, количество фибронектина заметно снижено, что может быть одной из причин появления метастазов.
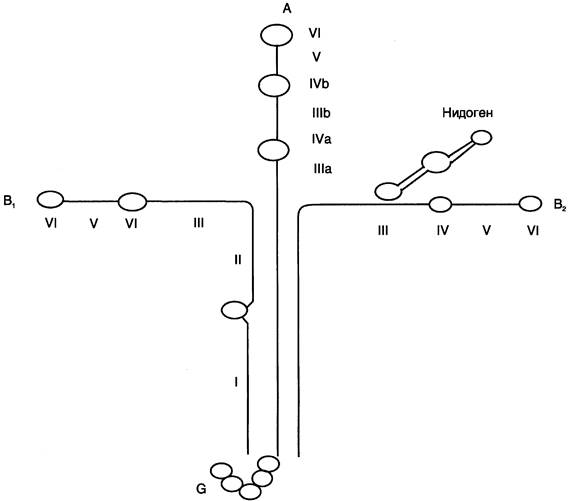
Ламинин — наиболее распространённый неколлагеновый гликопротеин базальных мембран. Он состоит из трёх полипептидных цепей: А, В1 и В2. Молекула ламинина имеет крестообразную форму с тремя одноцепочечными ветвями и одной трёхцепочечной ветвью (рис. 15-21). Каждая цепь ламинина содержит несколько глобулярных и стержневидных доменов, на которых имеются специфические центры связывания для различных веществ. Ламинин взаимодействует со всеми структурными компонентами базальных мембран, включая коллаген IV типа, нидоген, фибронектин, ГСПГ. Кроме того, молекула ламинина имеет несколько центров связывания с клетками. Главные функции ламинина определяются его способностью связывать клетки и модулировать клеточное поведение. Он может влиять на рост, морфологию, дифференцировку и подвижность клеток.
Рис. 15-21. Строение комплекса ламинин-нидоген.
Ламинин выполняет роль адгезивного белка для различных эпителиальных и мезенхимальных клеток.
Нидоген — сульфатированный гликопротеин базальных мембран, образует с ламинином плотный, нековалентно связанный комплекс; сила связывания нидогена с коллагеном IV типа гораздо меньше, чем с ламинином. Этот белок представлен одной полипептидной цепью, содержащей три глобулярных домена (рис. 15-21). Один из доменов нидогена имеет центр связывания ламинина, в области другого домена находится центр связывания коллагена IV типа. Таким образом, нидоген может выступать в качестве одного из связывающих мостов между различными компонентами межклеточного матрикса и участвовать в образовании тройных комплексов ламинин-нидоген-коллаген. Кроме этого, нидоген содержит RGD-последовательность и поэтому может присоединяться к клеточной поверхности.
Б. Антиадгезивные белки
Ко второй группе белков, обладающих антиад- гезивными свойствами, относят такие гликопротеины, как остеонектин, тенасцин и тромбоспондин. Эти белки появляются и играют заметную роль в эмбриогенезе и морфогенезе, развитии клеточного ответа на повреждение. Их концентрация в матриксе повышается при некоторых опухолевых заболеваниях.
Остеонектин (синонимы: ВМ-40, SPARC, от англ. secreted protein acidic and rich in cysteine) состоит из 4 доменов, к 2 из которых могут присоединяться ионы Са2+. Остеонектин — кислый белок, богатый цистеином. Показано, что он может ингибировать G1-S'-фазу роста эндотелиальных клеток.
Тенасцин (антиген мышечных сухожилий) — олигомерный гликопротеин, состоящий, подобно фибронектину, из 2 субъединиц, соединённых дисульфидной связью. Эту большую молекулу, похожую на осьминога, называют ещё «гексабрахион», так как она имеет 6 «рук», отходящих радиально от одного участка. Благодаря такому строению, тенасцин может взаимодействовать с большим количеством лигандов, к которым относят различные молекулы межклеточного матрикса.
Тенасцин обладает как адгезивными, так и антиадгезивными свойствами, синтезируется в различных тканях эмбриона (наиболее интенсивно — в зонах эпителиально-мезинхимальных контактов и в развивающейся нервной ткани). В зрелых тканях небольшие количества тенасцина находятся в сухожилиях и хрящах, его синтез увеличивается в заживающих ранах.
Тромбоспондин, как и другие белки межклеточного матрикса, может взаимодействовать со многими лигандами: коллагеном, фибронектином, ламинином, протеогликанами, ионами Са2+ и др. В клетках роговицы глаза и тромбоцитах тромбоспондин проявляет адгезивные свойства, а в клетках эндотелия и фибробластах он функционирует как антиадгезивный белок.
Таким образом, функции этих белков определяются их локализацией и окружением.