БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 15. БИОХИМИЯ МЕЖКЛЕТОЧНОГО МАТРИКСА
III. Гликозаминогликаны и протеогликаны
Гликозаминогликаны — линейные отрицательно заряженные гетерополисахариды. Раньше их называли мукополисахаридами, так как они обнаруживались в слизистых секретах (мукоза) и придавали этим секретам вязкие, смазочные свойства. Эти свойства обусловлены тем, что гликозаминогликаны могут связывать большие количества воды, в результате чего межклеточное вещество приобретает желеобразный характер.
Протеогликаны — высокомолекулярные соединения, состоящие из белка (5 — 10%) и гликоза- миногликанов (90 — 95%). Они образуют основное вещество межклеточного матрикса соединительной ткани и могут составлять до 30% сухой массы ткани.
Белки в протеогликанах представлены одной полипептидной цепью разной молекулярной массы. Полисахаридные компоненты у разных протеогликанов разные. Протеогликаны отличаются от большой группы белков, которые называют гликопротеинами. Эти белки тоже содержат олигосахаридные цепи разной длины, ковалентно
присоединённые к полипептидной основе. Углеводный компонент гликопротеинов гораздо меньше по массе, чем у протеогликанов, и составляет не более 40% от общей массы. Гликопротеины выполняют в организме человека разные функции и присутствуют во всех классах белков — ферментах, гормонах, транспортных, структурных белках и др. Представители гликопротеинов — коллаген и эластин, иммуноглобулины, ангиотен- зиноген, трансферрин, церулоплазмин, внутренний фактор Касла, тиреотропный гормон.
Гликозаминогликаны и протеогликаны, являясь обязательными компонентами межклеточного матрикса, играют важную роль в межклеточных взаимодействиях, формировании и поддержании формы клеток и органов, образовании каркаса при формировании тканей.
Благодаря особенностям своей структуры и физико-химическим свойствам, протеогликаны и гликозаминогликаны могут выполнять в организме человека следующие функции:
✵ они являются структурными компонентами межклеточного матрикса;
✵ протеогликаны и гликозаминогликаны специфически взаимодействуют с коллагеном, эластином, фибронектином, ламинином и другими белками межклеточного матрикса;
✵ все протеогликаны и гликозаминогликаны, являясь полианионами, могут присоединять, кроме воды, большие количества катионов (Nа+, К+, Са2+) и таким образом участвовать в формировании тургора различных тканей;
✵ протеогликаны и гликозаминогликаны играют роль молекулярного сита в межклеточном матриксе, они препятствуют распространению патогенных микроорганизмов;
✵ гиалуроновая кислота и протеогликаны выполняют рессорную функцию в суставных хрящах;
✵ гепарансульфатсодержащие протеогликаны способствуют созданию фильтрационного барьера в почках;
✵ кератансульфаты и дерматансульфаты обеспечивают прозрачность роговицы;
✵ гепарин — антикоагулянт;
✵ гепарансульфаты — компоненты плазматических мембран клеток, где они могут функционировать как рецепторы и участвовать в клеточной адгезии и межклеточных взаимодействиях. Они также выступают компонентами синаптических и других пузырьков.
А. Строение и классы гликозаминогликанов
Гликозаминогликаны представляют собой длинные неразветвлённые цепи гетерополисахаридов. Они построены из повторяющихся дисахаридных единиц. Одним мономером этого дисахарида является гексуроновая кислота (D-глюкуроновая кислота или L-идуроновая), вторым мономером — производное аминосахара (глюкоз- или галактозамина). NН2-группа аминосахаров обычно ацетилирована, что приводит к исчезновению присущего им положительного заряда. Кроме гиалуроновой кислоты, все гликозаминогликаны содержат сульфатные группы в виде О-эфиров или N-сульфата.
В настоящее время известна структура шести основных классов гликозаминогликанов, которые представлены в табл. 15-4.
Таблица 15-4. Структура различных классов гликозаминогликанов
Класс гликозаминогликанов |
Компоненты, входящие в состав дисахаридных единиц |
Структура гликозаминогликанов |
Гиалуроновая кислота |
1. D-глюкуроновая кислота 2. N-ацетил-D-глюкозамин |
D-глюкуроновая кислота (β1—> 3) N-aцeтил-глюкoзaмин (β1 —> 4) D-глюкуроновая кислота (β1 —> 3) N-ацетилглюкозамин (β1 —> 4) |
Хондроитин-4-сульфат (хондроитинсульфат А) |
1. D-глюкуроновая кислота 2. N-ацетил-D-галактозамин-4- сульфат |
D-глюкуроновая кислота (β1 —> 3) N-ацетил-галактозамин-4- сульфат (β1 —> 4) D-глюкуроновая кислота (β1 —> 3) N-ацетилгалактозамин-4- сульфат (β1 —> 4) |
Хондроитин-6-сульфат (хондроитинсульфат С) |
1. D-глюкуроновая кислота 2. N-ацетил-D-галактозамин-6- сульфат |
D-глюкуроновая кислота (β1—> 3) N-ацетилгалактозамин-6- сульфат (β1 —> 4) D-глюкуроновая кислота (β1 —> 3) N-ацетилгалактозамин-6- сульфат (β1 —> 4) |
Дерматансульфат1 |
1. L-идуроновая кислота 2. N-ацетил-D-галактозамин-4- сульфат |
L-идуроновая кислота (β1 —> 3) N-ацетилгалактозамин-4- сульфат (β1 —> 4) L-идуроновая кислота (β1 —> 3) N-ацетилгалактозамин-4- сульфат (β1 —> 4) |
Кератансульфат |
1. D-галактоза 2. N-ацетил-D-галактозамин-6- сульфат |
D-галактоза (β1 —> 4) N-ацетилглюкозамин (β1 —> 3) D-галактоза (β1 —> 4) N-ацетилглюкозамин-6- сульфат (β1 —> 3) |
Гепарансульфат2 |
1. D-глюкуронат-2-сульфат 2. N-ацетил-D-галактозамин-6- сульфат |
D-глюкуронат-2-сульфат (α1 —> 4) N-ацетилглюкозамин-6- сульфат (α1 —> 4) D-глюкуронат-2 -сульфат (β1 —> 4) N-ацетилглюкозамин-6- сульфат (α1 —> 4) |
1 В состав дисахаридной единицы может входить D-глюкуроновая кислота.
2 Может содержать N-сульфопроизводное глюкозамина вместо N-ацетилглюкозамина и различное количество идуроновой и глюкуроновой кислот.
Гиалуроновая кислота находится во многих органах и тканях. В хряще она связана с белком и участвует в образовании протеогликановых агрегатов, в некоторых органах (стекловидное тело глаза, пупочный канатик, суставная жидкость) встречается и в свободном виде. Предполагается, что в суставной жидкости гиалуроновая кислота выполняет роль смазочного вещества, уменьшая трение между суставными поверхностями.
Повторяющаяся дисахаридная единица в гиалуроновой кислоте имеет следующую структуру:

Гиалуроновая кислота содержит несколько тысяч дисахаридных единиц, молекулярная масса её достигает 105 — 107 Д.
Хондроитинсульфаты — самые распространённые гликозаминогликаны в организме человека; они содержатся в хряще, коже, сухожилиях, связках, артериях, роговице глаза. Хондроитинсульфаты являются важным составным компонентом агрекана — основного протеогликана хрящевого матрикса. В организме человека встречаются 2 вида хондроитинсульфатов: хондроитин-4-сульфат и хондроитин-6-сульфат. Они построены одинаковым образом, отличие касается только положения сульфатной группы в молекуле N-ацетилгалакгозамина (см. схему А).

Одна полисахаридная цепь хондроитинсульфата содержит около 40 повторяющихся дисахаридных единиц и имеет молекулярную массу 104 — 106 Д.
Кератансульфаты — наиболее гетерогенные гликозаминогликаны; отличаются друг от друга по суммарному содержанию углеводов и распределению в разных тканях. Кератансульфат I находится в роговице глаза и содержит кроме повторяющейся дисахаридной единицы L-фукозу, D-маннозу и сиаловую кислоту. Кератансульфат II был обнаружен в хрящевой ткани, костях, межпозвоночных дисках. В его состав помимо сахаров дисахаридной единицы входят N-ацетилгалактозамин, L-фукоза, D-манноза и сиаловая кислота. Кератансульфат II входит в состав агрекана и некоторых малых протеогликанов хрящевого матрикса. В отличие от других гликозаминогликанов, кератансульфаты вместо гексуроновой кислоты содержат остаток галактозы (см. схему Б).
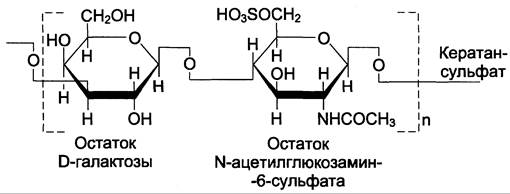
Молекулярная масса одной цепи кератансульфата колеблется от 4 х 103 до 20 х 103 Д.
Дерматансульфат широко распространён в тканях животных, особенно он характерен для кожи, кровеносных сосудов, сердечных клапанов.
В составе малых протеогликанов (бигликана и декорина) дерматансульфат содержится в межклеточном веществе хрящей, межпозвоночных дисков, менисков. Повторяющаяся дисахаридная единица дерматансульфата имеет следующую структуру (см. схему А).
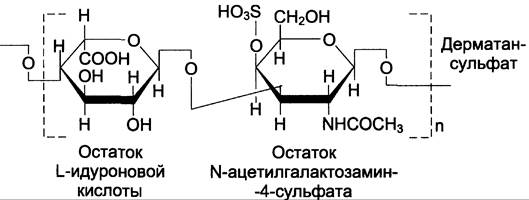
Молекулярная масса одной цепи дерматансульфата колеблется от 15 х 103 до 40 х 103 Д.
Гепарин — важный компонент противосвёртывающей системы крови (его применяют как антикоагулянт при лечении тромбозов). Он синтезируется тучными клетками и находится в гранулах внутри этих клеток. Наибольшие количества гепарина обнаруживаются в лёгких, печени и коже. Дисахаридная единица гепарина похожа на дисахаридную единицу гепаран- сульфата. Отличие этих гликозаминогликанов заключается в том, что в гепарине больше N-сульфатных групп, а в гепарансульфате больше N-ацетильных групп. Молекулярная масса гепарина колеблется от 6 х 103 до 25 х 103 Д (см. схему Б).

Гепарансульфат находится во многих органах и тканях. Он входит в состав протеогликанов базальных мембран. Гепарансульфат является постоянным компонентом клеточной поверхности. Структура дисахаридной единицы гепарансульфата такая же, как у гепарина. Молекулярная масса цепи гепарансульфата колеблется от 5 x 103 до 12 х 103 Д.
Б. Синтез и разрушение гликозаминогликанов
Метаболизм гликозаминогликанов зависит от соотношения скорости их синтеза и распада.
Синтез гликозаминогликанов
Полисахаридные цепи гликозаминогликанов практически всегда связаны с белком, который называется коровым, или сердцевинным. Присоединение полисахарида к белку осуществляется через связующую область, в состав которой чаще всего входит трисахарид галактоза-галактоза-ксилоза (рис. 15-14).
Рис. 15-14. Связующая область гликозаминогликанов.

Олигосахариды связующей области присоединяются к коровому белку ковалентными связями 3 типов:
1. О-гликозидной связью между серином и ксилозой;
2. О-гликозидной связью между серином или треонином и N-ацетилгалактозамином;
3. N-гликозиламиновой связью между амидным азотом аспарагина и N-ацетилглюкозамином.
Полисахаридные цепи гликозаминогликанов синтезируются путём последовательного присоединения моносахаридов. Донорами моносахаридов обычно являются соответствующие нуклеотид-сахара. Реакции синтеза гликозаминогликанов катализируют ферменты семейства трансфераз, обладающие абсолютной субстратной специфичностью. Эти трансферазы локализованы на мембранах аппарата Гольджи. Сюда по каналам ЭР поступает коровый белок, синтезированный на полирибосомах, к которому присоединяются моносахариды связующей области и затем наращивается вся полисахаридная цепь. Сульфатирование углеводной части происходит здесь с помощью сульфотрансферазы, донором сульфатной группы выступает ФАФС (см. раздел 12).
Аминосахара синтезируются из глюкозы; в соединительной ткани ~20% глюкозы используется таким образом. Непосредственным предшественником N-ацетилглкжозамина, N-ацетилгалактозамина и сиаловой кислоты является фруктозо- 6-фосфат. Источником NН2-группы в этих сахарах служит глутамин. Аминосахар далее ацетилируется с помощью ацетил-КоА. Активированными формами этих аминосахаров служат их УДФ-производные (схема, рис. 15-15).
Схема
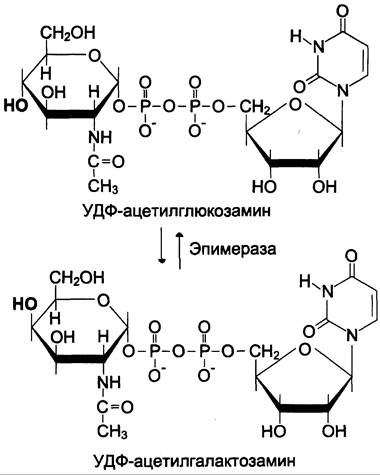
Рис. 15-15. Схема синтеза аминосахаров.

Источниками глюкуроновой кислоты в организме человека могут быть пища, внутриклеточное лизосомальное разрушение гликозаминогликанов и синтез глюкуроновой кислоты. Активированная форма глюкуроновой кислоты (УДФ-глюкуронат) образуется при окислении УДФ-глюкозы (см. схему).

L-идуроновая кислота образуется после включения D-глюкуроновой кислоты в углеводную цепь в результате реакции эпимеризации.
На синтез гликозаминогликанов влияют глюкокортикоиды: они тормозят синтез гиалуроновой кислоты и сульфатированных гликозаминогликанов. Показано также тормозящее действие половых гормонов на синтез сульфатированных гликозаминогликанов в органах-мишенях.
Разрушение гликозаминогликанов
Гликозаминогликаны отличаются высокой скоростью обмена: полупериод жизни (Т1/2) многих из них составляет от 3 до 10 дней (только для кератансульфата Т1/2 -120 дней). Разрушение полисахаридных цепей осуществляется экзо- и эндогликозидазами, и сульфатазами, к которым относят гиалуронидазу, глюкуронидазу, галактозидазу, идуронидазу и др. Из внеклеточного пространства гликозаминогликаны поступают в клетку по механизму эндоцитоза и заключаются в эндоцитозные пузырьки, которые затем сливаются с лизосомами. Лизосомальные гидролазы обеспечивают постепенное полное расщепление гликозаминогликанов до мономеров.
Мукополисахаридозы — наследственные тяжёлые заболевания, проявляющиеся значительными нарушениями в умственном развитии детей, поражениями сосудов, помутнением роговицы, деформациями скелета, уменьшением продолжительности жизни. В основе мукополисахаридозов лежат наследственные дефекты каких-либо гидролаз, участвующих в катаболизме гликозаминогликанов. Эти заболевания характеризуются избыточным накоплением гликозаминогликанов в тканях, приводящим к деформации скелета и увеличению органов, содержащих большие количества внеклеточного матрикса. Обычно поражаются ткани, в которых в норме синтезируются наибольшие количества гликозаминогликанов. В лизосомах при этом накапливаются не полностью разрушенные гликозаминогликаны, а с мочой выделяются их олигосахаридные фрагменты. Известно несколько типов мукополисахаридозов, вызванных дефектами разных ферментов гидролиза гликозаминогликанов. Основные типы мукополисахаридозов приведены в табл. 15-5.
Таблица 15-5. Типы мукополисахаридозов
Название болезни |
Продукты накопления |
Дефектный фермент |
Болезнь Хюрлер |
Дерматансульфат Гепарансульфат |
α-L-идуронидаза |
Болезнь Гюнтера |
Дерматансульфат |
Идуронатсульфатаза |
Болезнь Санфилиппо |
Гепарансульфат |
Гепарансульфатаза, N-ацетил-α-D- глюкозаминидаза или ацетилтрансфераза |
Болезнь Моркио |
Кератансульфат Хондроитин-6-сульфат |
Хондроитинсульфат — N-ацетил- галактозамин-6-сульфатсульфатаза |
Болезнь Марото-Лами |
Дерматансульфат |
Хондроитинсульфат — N-ацетил- галактозамин-4-сульфатсульфатаза |
Болезнь Слая |
Хондроитинсульфаты |
β-глюкуронидаза |
Для постановки диагноза конкретного заболевания обычно определяют активность лизосомальных гидролаз. Так как эти болезни в настоящее время не поддаются лечению, необходимо проводить пренатальную диагностику при подозрении на носительство дефектных генов.
В. Строение и виды протеогликанов
В межклеточном матриксе присутствуют разные протеогликаны. Среди них есть очень крупные — например агрекан и версикан. Кроме них, в межклеточном матриксе имеется целый набор так называемых малых протеогликанов, которые широко распространены в разных видах соединительной ткани и выполняют там самые разнообразные функции.
Основной протеогликан хрящевого матрикса называется агрекан, он составляет 10% по весу исходной ткани и 25% сухого веса хрящевого матрикса. Это очень большая молекула, в которой к одной полипептидной цепи присоединены до 100 цепей хондроитинсульфатов и около 30 цепей кератансульфатов. По форме молекула агрекана напоминает бутылочный «ёршик» (рис. 15-16).
Рис. 15-16. Строение агрекана. ГК — гиалуроновая кислота; 1 — хондроитинсульфат; 2 — кератансульфат; 3 — сердцевинный белок. В центре молекулы находится сердцевинный белок (молекулярная масса -220 кД), имеющий три глобулярных домена: G1, G2, G3, выполняющих разные функции. N-концевой домен в1 обеспечивает связывание агрекана с гиалуроновой кислотой и низкомолекулярным связывающим белком; функция домена G2 пока неизвестна; С-концевой домен G3 обеспечивает присоединение агрекана к другим молекулам межклеточного матрикса и, возможно, участвует в межклеточных взаимодействиях. Между доменами G2 и G3 находятся области, в которых к белку присоединяются кератансульфаты и хондроитинсульфаты. В этих областях в коровом белке имеются пептидные участки, состоящие из 6 и 19 аминокислотных остатков, которые повторяются от 10 до 20 раз.

В хрящевой ткани молекулы агрекана собираются в агрегаты с гиалуроновой кислотой и небольшим связывающим белком. Оба компонента присоединяются к агрекану нековалентными связями в области домена G1. Домен G1 взаимодействует примерно с пятью дисахаридными единицами гиалуроновой кислоты, далее этот комплекс стабилизируется связывающим белком; домен G1 и связывающий белок вместе занимают 25 дисахаридных единиц гиалуроновой кислоты. Конечный агрегат с молекулярной массой более 200 х 106 Д состоит из одной молекулы гиалуроновой кислоты и ~100 молекул агрекана (и такого же количества связывающего белка). Координация сборки этих агрегатов является центральной функцией хондроцитов. Агрекан и связывающий белок продуцируются этими клетками в необходимых количествах. Эти компоненты могут взаимодействовать друг с другом внутри клетки, но процесс агрегации полностью завершается в межклеточном матриксе. Показано, что гиалуроновая кислота образуется на поверхности хондроцитов специфической синтетазой и «выталкивается» в межклеточное пространство, чтобы связаться с агреканом и связывающим белком. Созревание функционально активного тройного комплекса составляет около 24 ч.
Катаболизм агрекана изучен в настоящее время недостаточно. Имеются данные о наличии в хрящевом межклеточном матриксе фермента агреканазы. Местом действия этого фермента является интерглобулярная область между доменами G1 и G2. Кроме того, в зоне присоединения цепей хондроитинсульфата в коровом белке имеются ещё 3 места протеолитического расщепления агрекана. Конечный продукт расщепления агрекана представляет собой комплекс домена G1, связывающего белка и гиалуроновой кислоты. Он поступает в хондроцит по механизму эндоцитоза и подвергается расщеплению лизосомальными гидроксилазами.
Малые протеогликаны
Малые протеогликаны — протеогликаны с низкой молекулярной массой. Они содержатся в хрящах, сухожилиях, связках, менисках, коже и других видах соединительной ткани.
Эти протеогликаны имеют небольшой кодовый белок, к которому присоединены одна или две цепи гликозаминогликанов. Наиболее изучены декорин, бигликан, фибромодулин, люмикан, перлекан.
Коровые белки бигликана и декорина похожи по размерам и структуре (молекулярная масса 36 000 и 38 000 Д, соответственно). Они имеют несколько тандемных повторов, богатых лейцином, которые образуют α-спирали или β-структуры. На N- и С-концах этих белков имеются домены, содержащие S-S-связи. Коровые белки значительно различаются по первичной структуре в N-концевых областях, что определяет различия в присоединении гликозаминогликанов. Бигликан содержит серин в положениях 5 и 11, что обеспечивает присоединение двух полисахаридных цепей. Декорин содержит один серин в положении 4, поэтому к нему присоединяется одна полисахаридная цепь. У этих протеогликанов полисахаридные цепи представлены дерматансульфатом с молекулярной массой ~30 000 Д (рис. 15-17).
Рис. 15-17. Малые протеогликаны хряща. 1 — области повторяющихся аминокислотных последовательностей, богатых лейцином, образуют α-спирали или β-структуры; 2 — домены в N- и С-концевых областях, сердцевинных белков, содержащие S-S-связи; 3 — цепи дерматансульфатов, которые присоединяются к ОН-группе серина (S) в N-концевой области; 4 — короткие цепи, которые присоединяются к белку в области повторов, богатых лейцином; это присоединение опосредовано олигосахаридами ∇, которыесвязываются с белком по NН2-группе аспарагина.

Ко'ровый белок фибромодулина (молекулярная масса ~40 000 Д) тоже имеет области тандемных повторов, богатые лейцином, но его N- концевая область отличается тем, что не содержит серина, а имеет несколько сульфатированных остатков тирозина, поэтому одна или две цепи кератансульфата присоединяются к ко'ровому белку фибромодулина не в N-концевой, а в области, богатой лейцином, через NH2-гpyппy аспарагина.
Малые протеогликаны являются мультифункциональными макромолекулами. Они могут связываться с другими компонентами соединительной ткани и оказывать влияние на их строение и функции. Например, декорин и фибромодулин присоединяются к фибриллам коллагена II типа и ограничивают их диаметр (т. е. препятствуют образованию толстых фибрилл). Декорин и бигликан, присоединяясь к фибронектину, подавляют клеточную адгезию, а присоединяясь к фактору роста опухолей β, снижают его митогенную активность. Кроме этого, имеется большое количество данных о том, что малые протеогликаны играют важную регуляторную роль в процессах развития и восстановления соединительной ткани.
Протеогликаны базальных мембран
Протеогликаны базальных мембран отличаются значительной гетерогенностью. Это преимущественно гепарансульфатсодержащие протеогликаны (ГСПГ), представленные двумя разновидностями: высокой и низкой плотности (рис. 15-18).
Рис. 15-18. Гепарансульфатсодержащие протеогликаны низкой (А) и высокой (Б) плотности. Гепарансульфатсодержащие протеогликаны высокой плотности имеют звездообразную форму и состоят из четырёх коротких гепарансульфатных цепей, связанных с небольшим белковым ядром. Гепарансульфатсодержащие протеогликаны низкой плотности имеют большое многодоменное белковое ядро, представленное одной полипептидной цепью. К одному из полюсов ядра прикреплены три длинные гепарансульфатные цепи.
