БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 4. БИОСИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ И БЕЛКОВ (МАТРИЧНЫЕ БИОСИНТЕЗЫ). ОСНОВЫ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
III. Репарация
Процесс, позволяющий живым организмам восстанавливать повреждения, возникающие в ДНК, называют репарацией. Все репарационные механизмы основаны на том, что ДНК — двухцепочечная молекула, т. е. в клетке есть 2 копии генетической информации. Если нуклеотидная последовательность одной из двух цепей оказывается повреждённой (изменённой), информацию можно восстановить, так как вторая (комплементарная) цепь сохранена.
Процесс репарации происходит в несколько этапов. На первом этапе выявляется нарушение комплементарности цепей ДНК. В ходе второго этапа некомплементарный нуклеотид или только основание устраняется, на третьем и четвёртом этапах идёт восстановление целостности цепи по принципу комплементарности. Однако в зависимости от типа повреждения количество этапов и ферментов, участвующих в его устранении, может быть разным.
Очень редко происходят повреждения, затрагивающие обе цепи ДНК, т. е. нарушения структуры нуклеотидов комплементарной пары. Такие повреждения в половых клетках не репарируются, так как для осуществления сложной репарации с участием гомологичной рекомбинации требуется наличие диплоидного набора хромосом.
А. Спонтанные повреждения
Нарушения комплементарности цепей ДНК могут происходить спонтанно, т. е. без участия каких-либо повреждающих факторов, например, в результате ошибок репликации, дезаминирования нуклеотидов, депуринизации.
Ошибки репликации
Точность репликации ДНК очень велика, но примерно один раз на 105 — 106 нуклеотидных остатков происходят ошибки спаривания, и тогда вместо пары нуклеотидов A — T, G— С в дочернюю цепь ДНК оказываются включёнными нуклеотиды, некомплементарные нуклеотидам матричной цепи. Однако ДНК-полимеразы δ, ε способны после присоединения очередного нуклеотида в растущую цепь ДНК делать шаг назад (в направлении от 3'- к 5'- концу) и вырезать последний нуклеотид, если он некомплементарен нуклеотиду в матричной цепи ДНК. Этот процесс исправления ошибок спаривания (или коррекция) иногда не срабатывает, и тогда в ДНК по окончании репликации остаются некомплементарные пары, тем более, что ДНК-полимераза α лишена корректирующего механизма и «ошибается» чаще, чем другие полимеразы.
При неправильном спаривании в первичной структуре дочерней цепи ДНК необычные основания не появляются, нарушена только комплементарность. Система репарации некомплементарных пар должна происходить только на дочерней цепи и производить замену некомплементарных оснований только в ней. Ферменты, участвующие в удалении неправильной пары нуклеотидов, распознают матричную цепь по наличию метилированных остатков аденина в последовательностях -GATC-. Пока основания нуклеотидных остатков в дочерней цепи неметилированы, ферменты должны успеть выявить ошибку репликации и устранить её.
Распознавание и удаление (первый этап) некомплементарного нуклеотида происходят при участии специальных белков mut S, mut L, mut H. Каждый из белков выполняет свою специфическую функцию. Mut S находит неправильную пару и связывается с этим фрагментом. Mut Н присоединяется к метилированному (по аденину) участку -GATC-, расположенному вблизи некомплементарной пары. Связующим между mut S и mut Н служит белок mut L, его присоединение завершает образование активного фермента. Формирование комплекса mut S, mut L, mut H на участке, содержащем ошибку, способствует проявлению у белка mut Н эндонуклеаз- ной активности. Ферментативный комплекс гидролизует фосфоэфирную связь в неметилированной цепи (рис. 4-21).
Рис. 4-21. Система репарации ошибок репликации. 1 — белок mut S «узнаёт» некомплементарную пару и присоединяется в этом участке ДНК; 2 — белки mut Н взаимодействуют с метилированной по аденину последовательностью материнской цепи -GATC- ; завершается формирование ферментативного комплекса после присоединения mut L; 3 — комплекс определяет вновь синтезированную цепь по отсутствию метилированного остатка аденина в последовательности -GATC- и разрывает её; 4 — экзонуклеаза удаляет фрагмент дочерней цепи ДНК, содержащий ошибку; 5 — ДНК-полимераза р по принципу комплементарности застраивает брешь; 6 — ДНК-лигаза 3’-конец вновь синтезированного фрагмента соединяет с основной цепью и завершает репарацию ошибки.

К свободным концам цепи присоединяется экзонуклеаза (второй этап). Отщепляя по одному нуклеотиду в направлении от 3'- к 5'- концу дочерней цепи, она устраняет участок, содержащий некомплементарную пару. Брешь застраивает ДНК-полимераза β (третий этап), соединение основного и вновь синтезированного участков цепи катализирует фермент ДНК-лигаза (четвёртый этап). Для успешного функционирования экзонуклеазы, ДНК-полимеразы β и ДНК-лигазы необходимо участие в репарации хеликазы и SSB-белков.
Депуринизация (апуринизация)
ДНК каждой клетки человека теряет за сутки около 5000 пуриновых остатков вследствие разрыва N-гликозидной связи между пурином и дезоксирибозой (рис. 4-22).
Рис. 4-22. Депуринизация — спонтанное удаление аденина или гуанина.

Тогда в молекуле ДНК на месте этих оснований образуется участок, лишённый азотистых оснований, названный АП-сайтом (AP-site, или апуриновый сайт). Термин «АП-сайт» используют также в тех случаях, когда из ДНК выпадают пиримидиновые основания и образуются апиримидиновые сайты (от англ. apurinic-apyrimidinic site).
Этот тип повреждений устраняет фермент ДНК-инсертаза (от англ. insert — вставлять), который может присоединять к дезоксирибозе основание в соответствии с правилом комплементарности. В этом случае нет необходимости разрезать цепь ДНК, вырезать неправильный нуклеотид и репарировать разрыв.
Дезаминирование
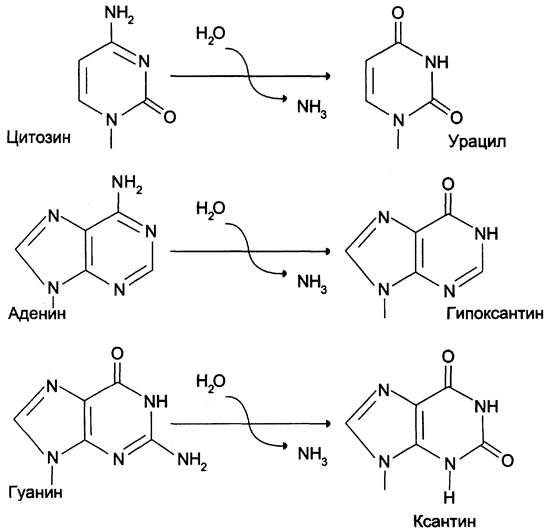
Реакции дезаминирования цитозина и превращение его в урацил (рис. 4-23), аденина в гипоксантин, гуанина в ксантин происходят значительно реже, чем депуринизация, и составляют 10 реакций на один геном в сутки.
Рис. 4-23. Продукты спонтанного дезаминирования различных оснований ДНК. Все продукты дезаминирования (урацил, гипоксантин, ксантин) нехарактерны для состава ДНК и поэтому довольно легко распознаются ферментами репарации.
Исправление этого вида спонтанного повреждения происходит в 5 этапов (рис. 4-24). В репарации принимает участие ДНК-N-гликозилаза, гидролизующая связи между аномальным основанием и дезоксирибозой (первый этап), в результате образуется АП-сайт, который распознаёт фермент АП-эндонуклеаза (второй этап). Как только в цепи ДНК возникает разрыв, в работу вступает ещё один фермент — АП-экзонуклеаза, который отщепляет от цепи дезоксирибозу, лишённую основания (третий этап). В цепи ДНК появляется брешь размером в один нуклеотид. Следующий фермент ДНК-полимераза р к 3'-концу разорванной цепи присоединяет нуклеотид по принципу комплементарности (четвёртый этап). Чтобы соединить два свободных конца (3'-конец встроенного нуклеотида и 5'-конец основной цепи), требуется ещё один фермент — ДНК- лигаза (пятый этап).
Рис. 4-24. Репарация АП-сайтов с участием ДНК-N-гликозилазы и АП-экзонуклеазы.

Нерепарируемо и поэтому опасно дезаминирование метилированного цитозина. Продукт его спонтанного дезаминирования — тимин, нормальное для ДНК основание, которое не распознаётся ДНК-N-гликозилазой.
Б. Индуцируемые повреждения
Индуцируемые повреждения возникают в ДНК в результате воздействия разнообразных мутагенных факторов как радиационной, так и химической природы.
Образование димеров пиримидиновых оснований
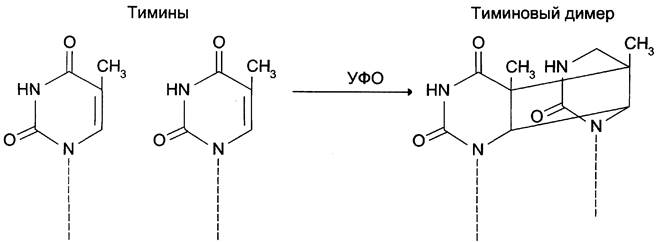
Под действием УФО двойная связь между С5 и С6 атомами углерода в составе пиримидиновых оснований (тимине и цитозине) может разрываться. Атомы углерода остаются связанными одной связью. Расстояние между параллельными плоскостями оснований полинуклеотидной цепи, в которых произошёл разрыв, равно примерно 3,4 А. Это расстояние позволяет освободившимся валентностям между С-С атомами пиримидиновых оснований, расположенных последовательно в цепи ДНК, сформировать циклобутановое кольцо (рис. 4-25). В зависимости от того, какие основания соединены в димер, их называют димерами тимина, цитозина или тимин-цитозиновыми димерами.
Рис. 4-25. Димер тимина (циклобутановое кольцо).
Удаление пиримидиновых димеров происходит под действием фотолиазы. Фермент расщепляет вновь образовавшиеся связи между соседними пиримидиновыми основаниями и восстанавливает нативную структуру. В фотолиазе есть участок, либо сам поглощающий фотоны (в синей части спектра), либо связывающийся с кофакторами, адсорбирующими свет. Таким образом, свет активирует фотолиазу, которая распознаёт димеры в облучённой ДНК, присоединяется к ним и разрывает возникшие между пиримидиновыми кольцами связи. После этого фермент отделяется от ДНК.
Повреждения оснований ДНК химическими мутагенами
Азотистые основания в ДНК могут подвергаться разнообразным повреждениям: алкилированию, окислению, восстановлению или связыванию основания с формамидными группировками. Репарация начинается с присоединения ДНК-N- гликозилазы к повреждённому основанию. Существует множество ДНК-N-гликозилаз, специфичных к разным модифицированным основаниям. Ферменты гидролитически расщепляют N-гликозидную связь между изменённым основанием и дезоксирибозой, это приводит к образованию АП-сайта в цепи ДНК (первый этап). Репарация АП-сайта может происходить или только при участии ДНК-инсертазы, которая присоединяет к дезоксирибозе основание в соответствии с правилом комплементарности, или при участии всего комплекса ферментов, участвующих в репарации: АП-эндонуклеазы, АП-экзонуклеазы, ДНК-полимеразы β и ДНК-лигазы.
В. Дефекты репарационных систем и наследственные болезни
Репарация необходима для сохранения нативной структуры генетического материала на протяжении всей жизни организма. Снижение активности ферментов репарационных систем приводит к накоплению повреждений (мутаций) в ДНК.
Причиной многих наследственных болезней человека выступает нарушение отдельных этапов процесса репарации.
Пигментная ксеродерма
У больных в системе репарации снижена активность ферментов, ответственных за удаление неправильных оснований, «застройку» бреши и другие функции. Дефект репарационной системы проявляется в сверхчувствительности к УФ-свету, что приводит к появлению красных пятен на коже, переходящих в незаживающие коросты и нередко в рак кожи.
Трихотиодистрофия
Заболевание связано с повышенной фоточувствительностью ДНК, вызванной снижением активности фермента, участвующего в удалении димеров тимина. Симптомы заболевания: ломкость волос вследствие нехватки серы в белках волос и их луковиц; часто умственная и физическая отсталость; аномалии кожи и зубов.