БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 4. БИОСИНТЕЗ НУКЛЕИНОВЫХ КИСЛОТ И БЕЛКОВ (МАТРИЧНЫЕ БИОСИНТЕЗЫ). ОСНОВЫ МОЛЕКУЛЯРНОЙ ГЕНЕТИКИ
IV. Транскрипция
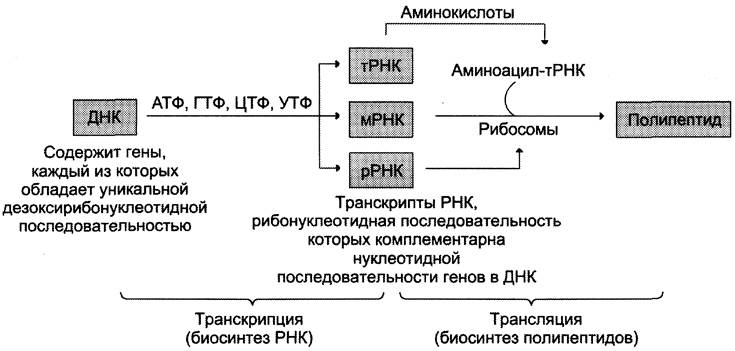
Транскрипция — первая стадия реализации генетической информации в клетке. В ходе процесса образуются молекулы мРНК, служащие матрицей для синтеза белков, а также транспортные, рибосомальные и другие виды молекул РНК, выполняющие структурные, адаптерные и каталитические функции (рис. 4-26).
Рис. 4-26. Схема реализации генетической информации в фенотипические признаки. Реализацию потока информации в клетке можно представить схемой ДНК —> РНК —> белок. ДНК —> РНК обозначает биосинтез молекул РНК (транскрипцию); РНК —> белок означает биосинтез полипептидных цепей (трансляцию).
Транскрипция у эукариотов происходит в ядре. В основе механизма транскрипции лежит тот же структурный принцип комплементарного спаривания оснований в молекуле РНК (G = С, А = U и Т = А). ДНК служит только матрицей и в ходе транскрипции не изменяется. Рибонуклеозидтрифосфаты (ЦТФ, ГТФ, АТФ, УТФ) — субстраты и источники энергии, необходимые для протекания полимеразной реакции, образования 3',5'-фосфодиэфирной связи между рибонуклеозидмонофосфатами.
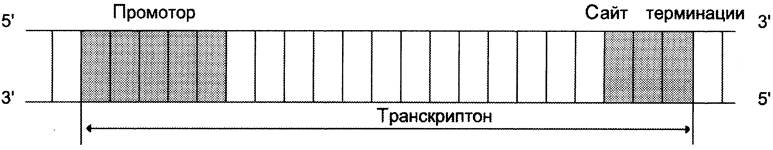
Синтез молекул РНК начинается в определённых последовательностях (сайтах) ДНК, которые называют промоторы, и завершается в терминирующих участках (сайты терминации). Участок ДНК, ограниченный промотором и сайтом терминации, представляет собой единицу транскрипции — транскриптон. У эукариотов в состав транскриптона, как правило, входит один ген (рис. 4-27), у прокариотов несколько. В каждом транскриптоне присутствует неинформативная зона; она содержит специфические последовательности нуклеотидов, с которыми взаимодействуют регуляторные транскрипционные факторы.
Рис. 4-27. Строение транскриптона.
Транскрипционые факторы — белки, взаимодействующие с определёнными регуляторными сайтами и ускоряющие или замедляющие процесс транскрипции. Соотношение информативной и неинформативной частей в транскрип- тонах эукариотов составляет в среднем 1 : 9 (у прокариотов 9 : 1).
Соседние транскриптоны могут быть отделены друг от друга нетранскрибируемыми участками ДНК. Разделение ДНК на множество транскриптонов позволяет осуществлять с разной активностью индивидуальное считывание (транскрипцию) разных генов.
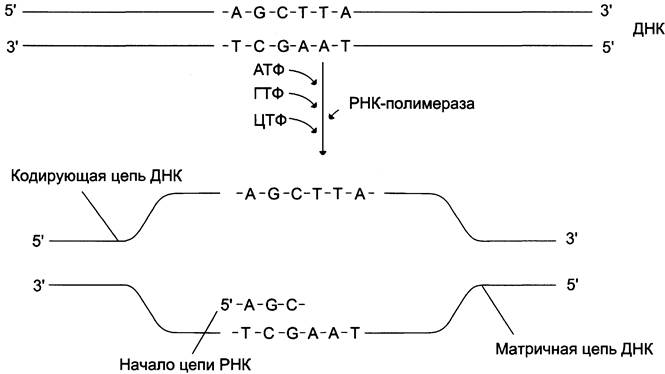
В каждом транскриптоне транскрибируется только одна из двух цепей ДНК, которая называется матричной, вторая, комплементарная ей цепь, называется кодирующей. Синтез цепи РНК идёт от 5'- к 3'-концу, при этом матричная цепь ДНК всегда антипараллельна синтезируемой нуклеиновой кислоте (рис. 4-28).
Рис. 4-28. Транскрипция РНК на матричной цепи ДНК. Синтез РНК всегда происходит в направлении 5' —> 3'.
Транскрипция не связана с фазами клеточного цикла; она может ускоряться и замедляться в зависимости от потребности клетки или организма в определённом белке.
РНК-полимеразы
Биосинтез РНК осуществляется ДНК-зависимыми PHК- полимеразами. В ядрах эукариотов обнаружены 3 специализированные РНК- полимеразы: РНК-полимераза I,синтезирующая пре-рРНК; РНК-полимераза II, ответственная за синтез пре-мРНК; РНК-полимераза III, синтезирующая пре-тРНК. РНК-полимеразы — олигомерные ферменты, состоящие из нескольких субъединиц — 2α, β, β', σ. Субъединица σ (сигма) выполняет регуляторную функцию, это один из факторов инициации транскрипции. РНК-полимеразы I, II, III, узнающие разные промоторы, содержат разные по строению субъединицы σ.
А. Стадии транскрипции
В процессе транскрипции различают 3 стадии: инициацию, элонгацию и терминацию.
Инициация
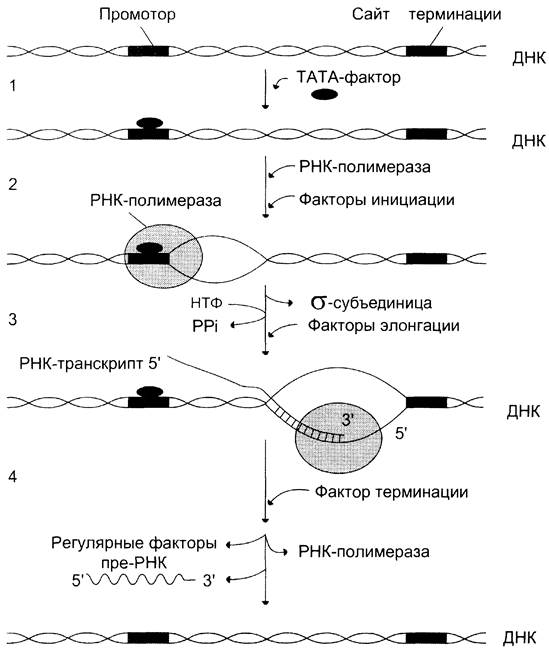
Активация промотора происходит с помощью большого белка — ТАТА-фактора, называемого так потому, что он взаимодействует со специфической последовательностью нуклеотидов промотора — ТАТААА- (ТАТА-бокс) (рис. 4-29).
Рис. 4-29. Строение промотора эукариотов. Промоторные элементы — специфические последовательности нуклеотидов, характерные для любого промотора, связывающего РНК-полимеразу. Первый промоторный элемент — последовательность АТАТАА- (ТАТА-бокс) отделён от сайта начала транскрипции приблизительно на 25 пар нуклеотидов (п.н.). На расстоянии примерно 40 (иногда до 120) п.н. от него располагается последовательность GGССААТС- (СААТ-бокс).

Присоединение ТАТА-фактора облегчает взаимодействие промотора с РНК-полимеразой. Факторы инициации вызывают изменение конформации РНК-полимеразы и обеспечивают раскручивание примерно одного витка спирали ДНК, т. е. образуется транскрипционная вилка, в которой матрица доступна для инициации синтеза цепи РНК (рис. 4-30).
Рис. 4-30. Стадии транскрипции. 1 — присоединение ТАТА-фактора к промотору. Чтобы промотор был узнан РНК-полимеразой, необходимо образование транскрипционного комплекса ТАТА-фактор/ТАТА-бокс (промотор). ТАТА-фактор остаётся связанным с ТАТА-боксом во время транскрипции, это облегчает использование промотора многими молекулами РНК-полимеразы; 2 — образование транскрипционной вилки; 3 — элонгация; 4 — терминация.
После того как синтезирован олигонуклеотид из 8-10 нуклеотидных остатков, σ-субъединица отделяется от РНК-полимеразы, а вместо неё к молекуле фермента присоединяются несколько факторов элонгации.
Элонгация
Факторы элонгации повышают активность РНК-полимеразы и облегчают расхождение цепей ДНК. Синтез молекулы РНК идёт от 5'- к 3'-концу комплементарно матричной цепи ДНК. На стадии элонгации, в области транскрипционной вилки, одновременно разделены примерно 18 нуклеотидных пар ДНК. Растущий конец цепи РНК образует временную гибридную спираль, около 12 пар нуклеотидных остатков, с матричной цепью ДНК. По мере продвижения РНК-полимеразы по матрице в направлении от 3'- к 5'-концу впереди неё происходит расхождение, а позади — восстановление двойной спирали ДНК.
Терминация
Раскручивание двойной спирали ДНК в области сайта терминации делает его доступным для фактора терминации. Завершается синтез РНК в строго определённых участках матрицы — терминаторах (сайты терминации). Фактор терминации облегчает отделение первичного транскрипта (пре-мРНК), комплементарного матрице, и РНК-полимеразы от матрицы. PHК-полимераза может вступить в следующий цикл транскрипции после присоединения субъединицы σ.
Б. Ковалентная модификация (процессинг) матричной РНК
Первичные транскрипты мРНК, прежде чем будут использованы в ходе синтеза белка, подвергаются ряду ковалентных модификаций. Эти модификации необходимы для функционирования мРНК в качестве матрицы.
Модификация 5'-конца
Модификации пре-мРНК начинаются на стадии элонгации. Когда длина первичного транскрипта достигает примерно 30 нуклеотидных остатков, происходит кэпирование его 5'-конца. Осуществляет кэпирование гуанилилтрансфераза. Фермент гидролизует макроэргическую связь в молекуле ГТФ и присоединяет нуклеотиддифосфатный остаток 5'- фосфатной группой к 5'-концу синтезированного фрагмента РНК с образованием 5',5'- фосфодиэфирной связи. Последующее метилирование остатка гуанина в составе ГТФ с образованием N7-метилгуанозина завершает формирование кэпа (рис. 4-31).
Рис. 4-31. Ковалентная модификация концевых нуклеотидных остатков первичного транскрипта мРНК.
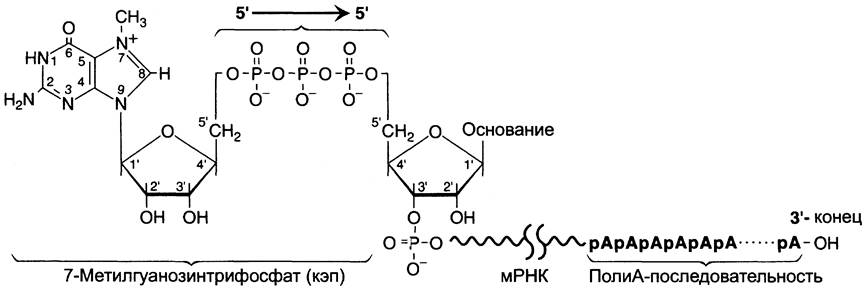
Модифицированный 5'-конец обеспечивает инициацию трансляции, удлиняет время жизни мРНК, защищая её от действия 5'-экзонук- леаз в цитоплазме. Кэпирование необходимо для инициации синтеза белка, так как инициирующие триплеты AUG, GUG распознаются рибосомой только если присутствует кэп. Наличие кэпа также необходимо для работы сложной ферментной системы, обеспечивающей удаление интронов.
Модификация 3'-конца
3'-Конец большинства транскриптов, синтезированных РНК-полимеразой II, также подвергается модификации, при которой специальным ферментом полиА-полимеразой формируется полиА-последовательность (полиА- «хвост»), состоящая из 100 — 200 остатков адениловой кислоты.
Сигналом к началу полиаденилирования является последовательность -AAUAAA- на растущей цепи РНК. Фермент полиА-полимераза, проявляя экзонуклеазную активность, разрывает 3'-фосфоэфирную связь после появления в цепи РНК специфической последовательности -AAUAAA-. К 3'-концу в точке разрыва полиА-полимераза наращивает полиА-«хвост». Наличие полиА-последовательности на 3'-конце облегчает выход мРНК из ядра и замедляет её гидролиз в цитоплазме.
Ферменты, осуществляющие кэпирование и полиаденилирование, избирательно связываются с РНК-полимеразой II, и в отсутствие полимеразы неактивны.
Сплайсинг первичных транскриптов мРНК
С появлением методов, позволяющих изучать первичную структуру молекул мРНК в цитоплазме и последовательность нуклеотидов кодирующей её геномной ДНК, было установлено, что они не комплементарны, а длина гена в несколько раз больше «зрелой» мРНК. Последовательности нуклеотидов, присутствующие в ДНК, но не входящие в состав зрелой мРНК, были названы некодирующими, или интроны, а последовательности, присутствующие в мРНК, — кодирующими, или экзоны. Таким образом, первичный транскрипт — строго комплементарная матрице нуклеиновая кислота (пре-мРНК), содержащая как экзоны, так и интроны. Длина интронов варьирует от 80 до 1000 нуклеотидов. Последовательности интронов «вырезаются» из первичного транскрипта, концы экзонов соединяются друг с другом. Такую модификацию РНК называют «сплайсинг» (от англ. tosplice — сращивать). Сплайсинг происходит в ядре, в цитоплазму поступает уже «зрелая» мРНК.
Гены эукариотов содержат больше интронов, чем экзонов, поэтому очень длинные молекулы пре-мРНК (около 5000 нуклеотидов) после сплайсинга превращаются в более короткие молекулы цитоплазматической мРНК (от 500 до 3000 нуклеотидов).
Процесс «вырезания» интронов протекает при участии малых ядерных рибонуклеопротеинов (мяРНП). В состав мяРНП входит малая ядерная РНК (мяРНК), нуклеотидная цепь которой связана с белковым остовом, состоящим из нескольких протомеров. В сплайсинге принимают участие различные мяРНП (рис. 4-32).
Нуклеотидные последовательности интронов функционально неактивны. Но на 5'- и 3'-концах они имеют высокоспецифические последовательности — AGGU- и GAGG- соответственно (сайты сплайсинга), которые обеспечивают их удаление из молекулы пре-мРНК. Изменение структуры этих последовательностей влияет на процесс сплайсинга.
Рис. 4-32. Сплайсинг РНК. В процессе сплайсинга принимают участие различные мяРНП, которые формируют сплайсосому. мяРНП, взаимодействуя с РНК и друг с другом, фиксируют и ориентируют реакционные группы первичного транскрипта. Каталитическая функция сплайсосом обусловлена РНК-составляющими; такие РНК называют рибозимами.
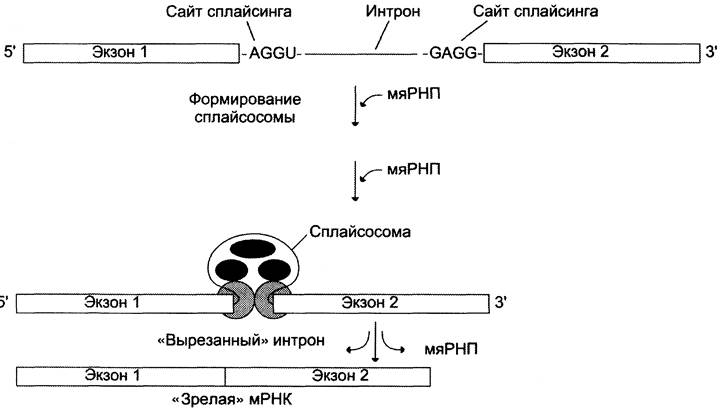
На первой стадии процесса мяРНП связываются со специфическими последовательностями первичного транскрипта (сайты сплайсинга), далее к ним присоединяются другие мяРНП. При формировании структуры сплайсосомы 3'-конец одного экзона сближается с 5'-концом следующего экзона. Сплайсосома катализирует реакцию расщепления 3',5'-фосфодиэфирной связи на границе экзона с нитроном. Последовательность интрона удаляется, а два экзона соединяются. Образование 3',5'-фосфодиэфирной связи между двумя экзонами катализируют мяРНК (малые ядерные РНК), входящие в структуру сплайсосомы. В результате сплайсинга из первичных транскриптов мРНК образуются молекулы «зрелой» мРНК.
Альтернативный сплайсинг первичных транскриптов мРНК
Для некоторых генов описаны альтернативные пути сплайсинга и полиаденилирования одного и того же транскрипта. Экзон одного варианта сплайсинга может оказаться интроном в альтернативном пути, поэтому молекулы мРНК, образованные в результате альтернативного сплайсинга, различаются набором экзонов. Это приводит к образованию разных мРНК и, соответственно, разных белков с одного первичного транскрипта. Так, в парафолликулярных клетках щитовидной железы (рис. 4-33) в ходе транскрипции гена гормона кальцитонина (см. раздел 11) образуется первичный транскрипт мРНК, который состоит из шести экзонов. Матричная РНК кальцитонина образуется путём сплайсинга первых четырёх экзонов (1-4). Последний (четвёртый) экзон содержит сигнал полиаденилирования (последовательность -ААUААА-), узнаваемый полиА-полиме- разой в парафолликулярных клетках щитовидной железы. Этот же первичный транскрипт в клетках головного мозга в ходе другого (альтернативного) пути сплайсинга превращается в мРНК кальцитонинподобного белка, отвечающего за вкусовое восприятие. Матричная РНК этого белка состоит из первых трёх экзонов, общих с кальцитониновой мРНК, но включает дополнительно пятый и шестой экзоны, не свойственные мРНК кальцитонина. Шестой экзон тоже имеет сигнал полиаденилирования -ААUААА-, узнаваемый ферментом полиА-полимеразой в клетках нервной ткани. Выбор одного из путей (альтернативный сплайсинг) и одного из возможных сайтов полиаденилирования играет важную роль в тканеспецифической экспрессии генов.
Рис. 4-33. Альтернативный сплайсинг гена кальцитонина. В клетках щитовидной железы сплайсинг первичного транскрипта приводит к образованию кальцитониновой мРНК, включающей 4 экзона и полиА-последовательность, которая образуется после расщепления транскрипта в первом участке сигнала полиаденилирования. В клетках мозга образуется мРНК, содержащая: экзоны 1, 2, 3, 5, 6 и полиА-последовательность, образованную после второго сигнала полиаденилирования.

Разные варианты сплайсинга могут приводить к образованию разных изоформ одного и того же белка. Например, ген тропонина состоит из 18 экзонов и кодирует многочисленные изоформы этого мышечного белка. Разные изоформы тропонина образуются в разных тканях на определённых стадиях их развития.
В. Процессинг первичных транскриптов рибосомальной РНК и транспортной РНК
Гены, кодирующие большую часть структурных РНК, транскрибируются РНК-полимеразами I и III. Нуклеиновые кислоты — предшественники рРНК и тРНК — подвергаются в ядре расщеплению и химической модификации (процессингу).
Посттранскрипционные модификации первичного транскрипта тРНК (процессинг тРНК)
Первичный транскрипт тРНК содержит около 100 нуклеотидов, а после процессинга —
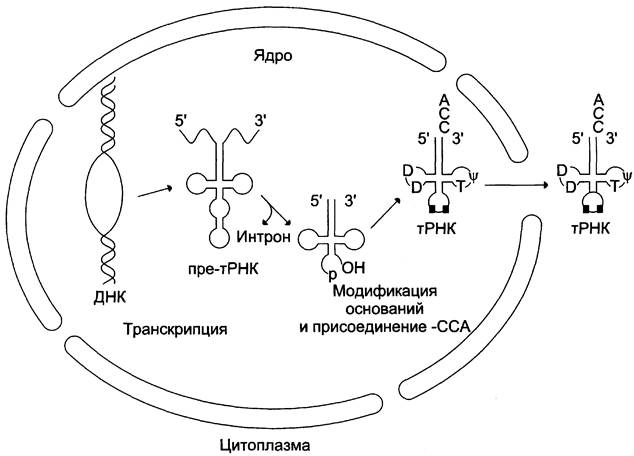
70 — 90 нуклеотидных остатков. Посттранскрипционные модификации первичных транскриптов тРНК происходят при участии РНК-аз (рибонуклеаз). Так, формирование 3'-конца тРНК катализирует РНК-аза, представляющая собой 3'-экзонуклеазу, «отрезающую» по одному нуклеотиду, пока не достигнет последовательности -ССА, одинаковой для всех тРНК. Для некоторых тРНК формирование последовательности - ССА на 3'-конце (акцепторный конец) происходит в результате последовательного присоединения этих трёх нуклеотидов. Пре-тРНК содержит всего один интрон, состоящий из 14 — 16 нуклеотидов. Удаление интрона и сплайсинг приводят к формированию структуры, называемой «антикодон», — триплета нуклеотидов, обеспечивающего взаимодействие тРНК с комплементарным кодоном мРНК в ходе синтеза белков (рис. 4-34).
Рис. 4-34. Процессинг пре-тРНК. Определённые азотистые основания нуклеотидов тРНК в ходе процессинга метилируются под действием РНК-метилазы и превращаются, например, в 7-метилгуанозин и 2-метилгуанозин (минорные основания). В молекуле тРНК содержатся и другие необычные основания — псевдоуридин, дигидроуридин, которые также модифицируются во время процессинга.
Посттранскрипционные модификации (процессинг) первичного транскрипта рРНК. Формирование рибосом
В клетках человека содержится около сотни копий гена рРНК, локализованных группами на пяти хромосомах. Гены рРНК транскрибируются РНК-полимеразой I с образованием идентичных транскриптов. Первичные транскрипты имеют длину около 13 000 нуклеотидных остатков (45S рРНК). Прежде чем покинуть ядро в составе рибосомной частицы, молекула 45S рРНК подвергается процессингу, в результате образуется 28S рРНК (около 5000 нуклеотидов), 18S рРНК (около 2000 нуклеотидов) и 5,8S рРНК (около 160 нуклеотидов), которые являются компонентами рибосом (рис. 4-35). Остальная часть транскрипта разрушается в ядре.
Рис. 4-35. Образование и выход из ядра субъединиц рибосом. В результате процессинга из молекулы предшественника 45S рРНК образуются три типа рРНК: 18S, входящая в состав малой субъединицы рибосом, а также 28S и 5,8S, локализующиеся в большой субъединице. Все три рРНК образуются в равных количествах, так как они происходят из одного и того же первичного транскрипта. 5S рРНК большой субъединицы рибосом транскрибируется отдельно от первичного транскрипта 45S рРНК. Рибосомальные РНК, образованные в ходе посттранскрипционных модификаций, связываются со специфическими белками, и образуется рибосома.

Рибосома — органелла клетки, участвующая в биосинтезе белка. Рибосома эукариотов (80S) состоит из двух, большой и малой, субъединиц: 60S и 40S. Белки рибосом выполняют структурную, регуляторную и каталитическую функции.