БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 5. БИОЛОГИЧЕСКИЕ МЕМБРАНЫ
II. Белки мембран
Если основная роль липидов в составе мембран заключается в стабилизации бислоя, то белки отвечают за функциональную активность мембран. Одни из них обеспечивают транспорт определённых молекул и ионов, другие являются ферментами, третьи участвуют в связывании цитоскелета с внеклеточным матриксом или служат рецепторами для гормонов, медиаторов, эйкозаноидов, липопротеинов, оксида азота(NО). На долю белков приходится от 30 до 70% массы мембран. Белки определяют особенности функционирования каждой мембраны.
Особенности строения и локализации белков в мембранах
Мембранные белки, контактирующие с гидрофобной частью липидного бислоя, должны быть амфифильными. Те участки белка, которые взаимодействуют с углеводородными цепями жирных кислот, содержат преимущественно неполярные аминокислоты. Участки белка, находящиеся в области полярных «головок», обогащены гидрофильными аминокислотными остатками.
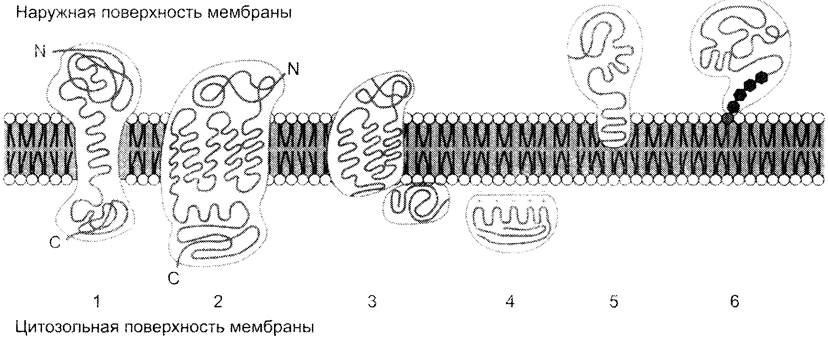
Белки мембран различаются по своему положению в мембране (рис. 5-10). Они могут глубоко проникать в липидный бислой или даже пронизывать его — интегральные белки,либо разными способами прикрепляться к мембране — поверхностные белки.
Рис. 5-10. Расположение (локализация) белков в мембранах. Трансмембранные белки, например, 1 — гликофорин А; 2 — рецептор адреналина. Поверхностные белки: 3 — белки, связанные с интегральными белками, например, фермент сукцинатдегидрогеназа; 4 — белки, присоединённые к полярным «головкам» липидного слоя, например, протеинкиназа С; 5 — белки, «заякоренные» в мембране с помощью короткого гидрофобного концевого домена, например, цитохром b5; 6 — «заякоренные» белки, ковалентно соединённые с липидом мембраны (например, фермент щелочная фосфатаза).
Поверхностные белки
Поверхностные белки часто прикрепляются к мембране, взаимодействуя с интегральными белками или поверхностными участками липидного слоя.
Белки, образующие комплексы с интегральными белками мембраны
Ряд пищеварительных ферментов, участвующих в гидролизе крахмала и белков, прикрепляется к интегральным белкам мембран микроворсинок кишечника.
Примерами таких комплексов могут быть сахараза-изомальтаза и мальтаза-гликоамилаза (см. раздел 7). Возможно, связь этих пищеварительных ферментов с мембраной позволяет с высокой скоростью гидролизовать субстраты и усваивать продукты гидролиза клеткой.
Белки, связанные с полярными «головками» липидов мембран
Полярные или заряженные домены белковой молекулы могут взаимодействовать с полярными «головками» липидов, образуя ионные и водородные связи. Кроме того, множество растворимых в цитозоле белков при определённых условиях могут связываться с поверхностью мембраны на непродолжительное время. Иногда связывание белка — необходимое условие проявления ферментативной активности. К таким белкам, например, относят протеинкиназу С, факторы свёртывания крови.
Закрепление с помощью мембранного «якоря»
«Якорем» может быть неполярный домен белка, построенный из аминокислот с гидрофобными радикалами. Примером такого белка может служить цитохром b5 мембраны ЭР. Этот белок участвует в окислительно-восстановительных реакциях, как переносчик электронов (см. раздел 12).
Роль мембранного «якоря» может выполнять также ковалентно связанный с белком остаток жирной кислоты (миристиновой — С14 или пальмитиновой — С16). Белки, связанные с жирными кислотами, локализованы в основном на внутренней поверхности плазматической мембраны. Миристиновая кислота присоединяется к N-концевому глицину с образованием амидной связи. Пальмитиновая кислота образует тиоэфирную связь с цистеином или сложноэфирную с остатками серина и треонина.
Небольшая группа белков может взаимодействовать с наружной поверхностью клетки с помощью ковалентно присоединённого к С- концу белка фосфатидилинозитолгликана. Этот «якорь» — часто единственное связующее звено между белком и мембраной, поэтому при действии фосфолипазы С этот белок отделяется от мембраны.
Трансмембранные (интегральные) белки
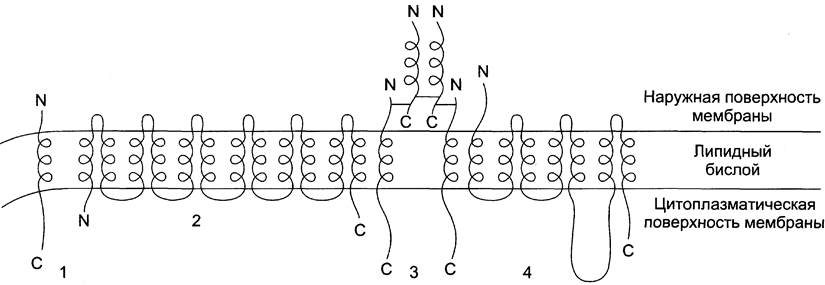
Некоторые из трансмембранных белков пронизывают мембрану один раз (гликофорин), другие имеют несколько участков (доменов), последовательно пересекающих бислой (рис. 5-11).
Рис. 5-11. Интегральные белки мембран, содержащие от 1 до 12 трансмембранных доменов. 1 - рецептор ЛПНП; 2 - ГЛЮТ-1 — транспортёр глюкозы; 3 - рецептор инсулина; 4 - адренорецептор.
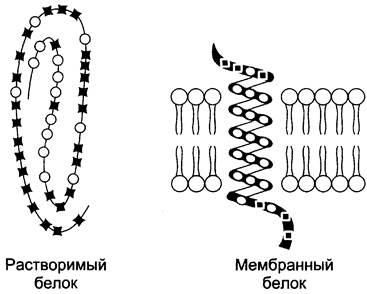
Транс мембранные домены, пронизывающие бислой, имеют конформацию α-спирали. Полярные остатки аминокислот обращены внутрь глобулы, а неполярные контактируют с мембранными липидами. Такие белки называют «вывернутыми» по сравнению с растворимыми в воде белками, в которых большинство гидрофобных остатков аминокислот спрятано внутрь, а гидрофильные располагаются на поверхности (рис. 5-12).
Рис. 5-12. Локализация неполярных (незакрашенные кружки) и полярных (закрашенные квадраты) аминокислот в растворимых и мембранных белках.
Радикалы заряженных аминокислот в составе этих доменов лишены заряда и протонированы (-СООН) или депротонированы (-NН2).
Гликозилированные белки
Поверхностные белки или домены интегральных белков, расположенные на наружной поверхности всех мембран, почти всегда гликозилированы. Олигосахаридные остатки могут быть присоединены через амидную группу аспарагина или гидроксильные группы серина и треонина (рис. 5-13).
Рис. 5-13. Строение рецептора липопротеина низкой плотности (ЛПНП). 1 — внутриклеточный домен; 2 — трансмембранный домен; 3 — олигосахаридные остатки, присоединённые к ОН-группам серина или треонина; 4 — олигосахаридные остатки, присоединённые через амидную группу аспарагина; 5 — ЛПНП-связывающий домен.

Олигосахаридные остатки защищают белок от протеолиза, участвуют в узнавании лигандов или адгезии.
Латеральная диффузия белков
Некоторые мембранные белки перемещаются вдоль бислоя (латеральная диффузия) или поворачиваются вокруг оси, перпендикулярно его поверхности.
Например, фермент фосфолипаза А2, связываясь с цитоплазматической поверхностью мембраны, может латерально перемещаться по поверхности бислоя и гидролизовать несколько тысяч фосфолипидов в минуту до тех пор, пока не отделится от мембраны.
Латеральная диффузия интегральных белков в мембране ограничена, это связано с их большими размерами, взаимодействием с другими мембранными белками, элементами цитоскелета или внеклеточного матрикса.
Белки мембран не совершают перемещений с одной стороны мембраны на другую («флип- флоп» перескоки), подобно фосфолипидам.