БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 1. СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ БЕЛКОВ
IV. Функционирование белков
Каждый индивидуальный белок, имеющий уникальную первичную структуру и конформацию, обладает и уникальной функцией, отличающей его от всех остальных белков. Набор индивидуальных белков выполняет в клетке множество разнообразных и сложных функций.
Необходимое условие для функционирования белков — присоединение к нему другого вещества, которое называют «лиганд». Лигандами могут быть как низкомолекулярные вещества, так и макромолекулы. Взаимодействие белка с лигандом высокоспецифично, что определяется строением участка белка, называемого центром связывания белка с лигандом или активным центром.
А. Активный центр белков и избирательность связывания его с лигандом
Активный центр белков — определённый участок белковой молекулы, как правило, находящийся в её углублении («кармане»), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда (рис. 1-25).
Рис. 1-25. Взаимодействие белка с лигандом. А и Б - некомплементарное взаимодействие и разрушение связей между белком и лигандом; В - комплементарное взаимодействие белка с лигандом.

Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и «подгоняется» под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
1. Характеристика активного центра
Активный центр белка — относительно изолированный от окружающей белок среды участок, сформированный аминокислотными остатками. В этом участке каждый остаток благодаря своему индивидуальному размеру и функциональным группам формирует «рельеф» активного центра.
Объединение таких аминокислот в единый функциональный комплекс изменяет реакционную способность их радикалов, подобно тому, как меняется звучание музыкального инструмента в ансамбле. Поэтому аминокислотные остатки, входящие в состав активного центра, часто называют «ансамблем» аминокислот.
Уникальные свойства активного центра зависят не только от химических свойств формирующих его аминокислот, но и от их точной взаимной ориентации в пространстве. Поэтому даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию. При денатурации активный центр белков разрушается, и происходит утрата их биологической активности.
Часто активный центр формируется таким образом, что доступ воды к функциональным группам его радикалов ограничен, т. е. создаются условия для связывания лиганда с радикалами аминокислот.
В некоторых случаях лиганд присоединяется только к одному из атомов, обладающему определённой реакционной способностью, например, присоединение O2 к железу миоглобина или гемоглобина. Однако свойства данного атома избирательно взаимодействовать с O2 определяются свойствами радикалов, окружающих атом железа в составе гема. Гем содержится и в других белках, таких как цитохромы. Однако функция атома железа в цитохромах иная, он служит посредником для передачи электронов от одного вещества другому, при этом железо становится то двух-, то трёхвалентным.
Центр связывания белка с лигандом часто располагается между доменами. Например, протеолитический фермент трипсин, участвующий в гидролизе пептидных связей пищевых белков в кишечнике, имеет 2 домена, разделённых бороздкой. Внутренняя поверхность бороздки формируется аминокислотными радикалами этих
доменов, стоящими в полипептидной цепи далеко друг от друга (Сер177, Гис40, Aсп85).
Разные домены в белке могут перемещаться друг относительно друга при взаимодействии с лигандом, что облегчает дальнейшее функционирование белка. В качестве примера можно рассмотреть работу гексокиназы, фермента, катализирующего перенос фосфорного остатка с АТФ на молекулу глюкозы (при её фосфорилировании). Активный центр гексокиназы располагается в расщелине между двумя доменами (рис. 1-26) При связывании гексокиназы с глюкозой окружающие её домены сближаются, и субстрат оказывается в «ловушке», что облегчает его дальнейшее фосфорилирование.
Рис. 1-26. Связывание гексокиназы с глюкозой.

Основное свойство белков, лежащее в основе их функций, — избирательность присоединения к определённым участкам белковой молекулы специфических лигандов.
2. Многообразие лигандов
✵ Лигандами могут быть неорганические (часто ионы металлов) и органические вещества, низкомолекулярные и высокомолекулярные вещества;
✵ существуют лиганды, которые изменяют свою химическую структуру при присоединении к активному центру белка (изменения субстрата в активном центре фермента);
✵ существуют лиганды, присоединяющиеся к белку только в момент функционирования (например, О2, транспортируемый гемоглобином), и лиганды, постоянно связанные с белком, выполняющие вспомогательную роль при функционировании белков (например, железо, входящее в состав гемоглобина).
В тех случаях, когда аминокислотные остатки, формирующие активный центр, не могут обеспечить функционирование данного белка, к определённым участкам активного центра могут присоединяться небелковые молекулы. Так, в активном центре многих ферментов присутствует ион металла (кофактор) или органическая небелковая молекула (кофермент). Небелковую часть, прочно связанную с активным центром белка и необходимую для его функционирования, называют «простетическая группа». Миоглобин, гемоглобин и цитохромы имеют в активном центре простетическую группу — гем, содержащий железо (более подробно гемсодержащие белки описаны в разделе 4, а кофакторы и коферменты — в разделе 2).
Соединение протомеров в олигомерном белке — пример взаимодействия высокомолекулярных лигандов. Каждый протомер, соединённый с другими протомерами, служит для них лигандом, так же как они для него.
Иногда присоединение какого-либо лиганда изменяет конформацию белка, в результате чего формируется центр связывания с другими лигандами. Например, белок кальмодулин после связывания с четырьмя ионами Са2+ в специфических участках приобретает способность взаимодействовать с некоторыми ферментами, меняя их активность.
3. Сродство активного центра лиганду
Скорость взаимодействия белка с лигандом определяется концентрациями белка и лиганда в растворе, а также степенью комплементарности белка и лиганда.
Константа диссоциации — характеристика сродства активного центра лиганду.
Так как взаимодействие белка с лигандом — обратимый процесс, то его можно описать следующим уравнением:
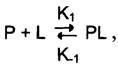
где Р — белок, L — лиганд, РL — комплекс белка с лигандом, К1 — константа скорости связывания белка с лигандом, К-1 — константа скорости распада комплекса РL.
Когда скорости образования и распада комплекса равны, говорят о том, что система находится в состоянии равновесия:
[Р] [L] К1 = [РL] К-1.
Отсюда:
![]()
Соотношение констант распада [РL] комплекса и его образования называется константой диссоциации (Кдисс) комплекса [РL]. Чем меньше Кдисс, тем больше молекул лиганда связано с белком, тем больше комплементарность между Р и L и тем больше сродство лиганда к белку. То есть между Кдисс и сродством лиганда к белку имеется обратно пропорциональная связь.
Иногда при описании процесса связывания белка с лигандом используют величину, обратную Кдисс, называемую константой связывания (Ксв) или ассоциации.
![]()
Между Ксв. и сродством лиганда к белку существует прямо пропорциональная зависимость.
Зависимость насыщения белка лигандом от концентрации лиганда при постоянной концентрации белка
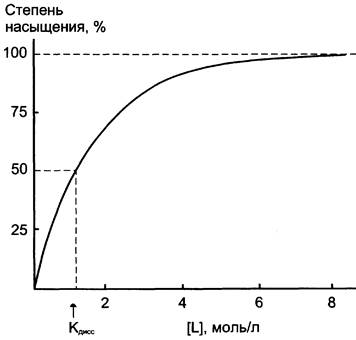
При постоянной концентрации белка увеличение концентрации лиганда приводит к росту концентрации комплекса [РL]. Эта зависимость носит характер гиперболической кривой (рис. 1-27). Кривая стремится к максимуму, когда при некоторой концентрации лиганда все молекулы белка находятся в связанном с лигандом состоянии (происходит насыщение белка лигандом). Степень насыщения белка лигандом можно выразить следующим уравнением: степень насыщения = [РL]/[Р0] х 100 (где Р0 — концентрация белка до добавления лиганда). При полунасыщении белка лигандом концентрации [РL] и [Р] равны, и из уравнения Кдисс, приведённого выше, следует, что Кдисс = [L], т. е. Кдиссчисленно равна концентрации лиганда, при которой 50% белка находится в комплексе с лигандом. Поэтому, по кривой насыщения, можно найти Кдисс и оценить сродство данного белка лиганду.
Рис. 1-27. График насыщения белка лигандом.
Зависимость между образованием комплекса [РL] и концентрацией белка при избытке лиганда
Как было сказано выше, при возрастающей концентрации лиганда насыщение белка ограничено его концентрацией. При избытке лиганда все молекулы белка находятся в составе комплекса [РL]. Однако, если увеличивать концентрацию белка, то количество [РL] начнёт увеличиваться пропорционально концентрации белка. Концентрацию комплекса [РL] можно регистрировать, например, с помощью измерения поглощения света. Учитывая, что его количество пропорционально концентрации белка, можно на основании построенного графика определять концентрацию белка в растворе (рис. 1-28).
Рис. 1-28. График зависимости изменения поглощения света, отражающего концентрацию комплекса [РL] от концентрации белка Р.

Б. Вещества, влияющие на функционирование белков
Хотя взаимодействие лиганда с активным центром белка высокоспецифично, всегда можно подобрать другое вещество, которое так же будет взаимодействовать с белком. Лиганд, взаимодействующий с белком и нарушающий его функцию, называют «ингибитор белка». Если это вещество по структуре похоже на лиганд, его называют структурным аналогом лиганда; оно также взаимодействует с активным центром белка. Аналог, замещающий естественный лиганд в активном центре белка и снижающий его функцию, называют «конкурентный ингибитор белка».
1. Лекарственные препараты как модуляторы белковых функций
Аналоги естественных лигандов белков используют в медицине в качестве лекарственных средств. Широкое применение такие лекарства нашли в регуляции передачи возбуждения через синапсы.
Передача сигнала от нерва к нерву или от нерва к эффекторному органу осуществляется через синапсы с помощью химических молекул, называемых нейромедиаторами. Нейромедиатор, выделяемый при прохождении импульса нервными окончаниями, должен высокоспецифично взаимодействовать с белками-рецепторами на постсинаптической мембране. Однако, модифицируя химическую структуру нейромедиатора, можно получить вещества, которые также связывались бы с рецептором, но при этом менялся физиологический эффект: уменьшался или усиливался. В фармакологии такие вещества называют «антагонисты» и «агонисты» соответственно.
Ингибиторы белков-рецепторов в холинэргических синапсах
В качестве примера можно рассмотреть лекарства, нарушающие проведение нервного импульса через холинергические синапсы, где в качестве нейромедиатора используется ацетилхолин. Холинергические белки-рецепторы неоднородны по своей структуре и способны связываться с другими, кроме ацетилхолина, лигандами. Их делят на 2 большие группы:
✵ М-холинорецепторы, названные так из-за их способности избирательно взаимодействовать с мускарином (токсин мухомора);
✵ Н-холинорецепторы, избирательно связывающие никотин.
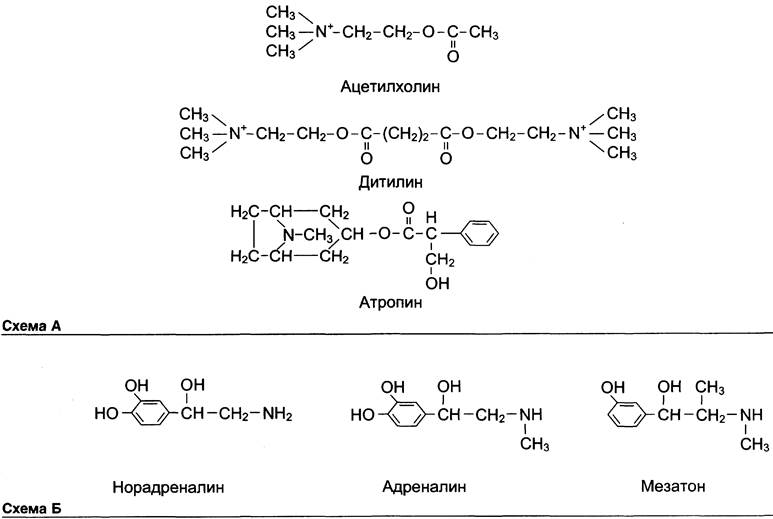
В нервно-мышечных синапсах присутствуют Н-холинорецепторы, взаимодействие которых с ацетилхолином вызывает сокращение мышц. Для расслабления мышц в эндоскопических исследованиях, а также при разнообразных хирургических операциях используют структурные аналоги ацетилхолина, служащие ингибиторами данных рецепторов. Пример такого вещества — дитилин, относящийся к группе лекарственных веществ, называемых миорелаксантами (вызывающими мышечное расслабление). Первоначально эти свойства были обнаружены у яда кураре, в связи с чем данные препараты называют также курареподобными (см. схему А на с. 44).
Наиболее известный специфический ингибитор М-холинорецепторов — атропин. Атропин — алкалоид, содержащийся в некоторых растениях: красавке, белене, дурмане. Он присоединяется к М-холинорецепторам, находящимся на мембране эффекторных клеток, в области окончаний парасимпатических нервов. Атропин препятствует их взаимодействию с ацетилхолином (антагонист природного лиганда), тем самым устраняя эффекты раздражения парасимпатических нервов.
Так как ацетилхолин, связываясь с М-холинорецепторами, вызывает сокращение многих гладких мышц, атропин (как лекарственный препарат) снимает мышечные спазмы (спазмолитик). Кроме того, он снижает стимулируемую ацетилхолином секрецию желёз (бронхиальных, пищеварительных, потовых).
М-холинорецепторы присутствуют в разных отделах ЦНС. Передозировка атропина может вызвать двигательное и речевое возбуждение.
Лекарственные вещества — стимуляторы белковых функций
Однако некоторые структурные аналоги лигандов рецепторных белков не являются ингибиторами, а вызывают такие же или более сильные физиологические эффекты, чем природные лиганды. Их более сильный и длительный эффект часто связан с тем, что модифицированные лиганды медленнее инактивируются и разрушаются в организме. Например, мезатон по структуре похож на нейромедиаторы симпатической нервной системы (норадреналин и адреналин). Мезатон повышает тонус сосудов и АД, поэтому его используют при гипотонии и коллапсе. Он менее подвержен действию инактивирующих его ферментов, поэтому оказывает более длительный и сильный эффект, чем его природные аналоги (см. схему Б).
2. Яды — специфические лиганды определённых белков
Некоторые яды, попадая в организм человека, прочно связываются с определёнными белками, ингибируют их и тем самым вызывают нарушения биологических функций.
Например, α-нейротоксины кобры и крайта специфически взаимодействуют с холинергическими рецепторами постсинаптических мембран, блокируя их работу, и оказывают курареподобное действие. α-Нейротоксины — небольшие белки с молекулярной массой около 7000 Д (65 — 70 аминокислотных остатков). Их третичную структуру стабилизируют 4 или 5 специфических дисульфидных связей (в зависимости от вида токсина). Сродство нейротоксинов к холинергическим рецепторам очень высоко (Кдисс = 10-11). Очевидно, между токсином и рецептором образуется множество связей, что и приводит к их практически необратимому соединению.
Необходимо помнить, что между лекарствами и ядами часто существует прозрачная граница, и эффект их действия зависит от дозы вводимого вещества. Так, лекарства, назначаемые в дозах, больших чем терапевтические, могут действовать как яды, т. е. вызывать серьёзные нарушения обмена веществ и функций организма, а яды в микродозах часто используют как лекарственные препараты. Например, атропин, широко применяемый для снятия спазмов гладких мышц, в больших дозах вызывает возбуждение ЦНС, а в ещё больших дозах — сон, переходящий в кому. Известное гипотензивное средство клофелин при передозировке вызывает коллапс.