БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 1. СТРОЕНИЕ, СВОЙСТВА И ФУНКЦИИ БЕЛКОВ
V. Особенности функционирования олигомерных белков на примете гемоглобина
Олигомерные белки проявляют свойства, отсутствующие у мономерных белков. Влияние четвертичной структуры на функциональные свойства белка можно рассмотреть, сравнивая строение и функции двух родственных гемсодержащих белков: миоглобина и гемоглобина. Оба белка имеют общее эволюционное происхождение, сходную конформацию отдельных полипептидных цепей и сходную функцию (участвуют в транспорте кислорода), но миоглобин — мономерный белок, а гемоглобин — тетрамер. Наличие четвертичной структуры у гемоглобина придаёт этому белку свойства, отсутствующие у миоглобина.
А. Структура и функции миоглобина
Миоглобин относят к классу гемсодержащих белков, т. е. он содержит простетическую группу — гем, довольно прочно связанную с белковой частью. Миоглобин относят к глобулярным белкам; он имеет только одну полипептидную цепь.
1. Клеточная локализация и функция
Миоглобин содержится в красных мышцах и участвует в запасании кислорода. В условиях интенсивной мышечной работы, когда парциальное давление кислорода в ткани падает, O2 освобождается из комплекса с миоглобином и используется в митохондриях клеток для получения необходимой для работы мышц энергии.
2. Строение миоглобина
Миоглобин содержит небелковую часть (гем) и белковую часть (апомиоглобин).
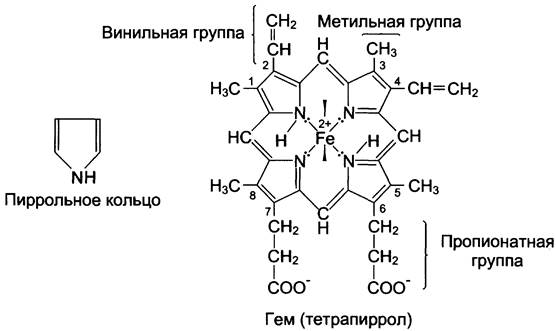
Гем — молекула, имеющая структуру циклического тетрапиррола, где 4 пиррольных кольца соединены метиленовыми мостиками и содержат 4 метальные, 2 винильные и 2 пропионатные боковые цепи. Эта органическая часть гема называется протопорфирином. Возможны 15 вариантов расположения боковых цепей, но в составе гемопротеинов присутствует только один изомер, называемый протопорфирин IX. В геме 4 атома азота пиррольных колец протопорфирина IX связаны четырьмя координационными связями с Fе2+, находящимся в центре молекулы (рис. 1-29).
Рис. 1-29. Строение гема, входящего в состав миоглобина и гемоглобина.
Апомиоглобин — белковая часть миоглобина; первичная структура представлена последовательностью из 153 аминокислот, которые во вторичной структуре уложены в 8 α-спиралей. α-Спирали обозначают латинскими буквами от А до Н, начиная с N-конца полипептидной цепи, и содержат от 7 до 23 аминокислот. Для обозначения индивидуальных аминокислот в первичной структуре апомиоглобина используют либо написание их порядкового номера от N-конца (например, Гис64, Фен138), либо букву α-спирали и порядковый номер данной аминокислоты в этой спирали, начиная с N-конца (например, Гис F8).
Третичная структура имеет вид компактной глобулы (внутри практически нет свободного места), образованной за счёт петель и поворотов в области неспирализованных участков белка. Внутренняя часть молекулы почти целиком состоит из гидрофобных радикалов, за исключением двух остатков Гис, располагающихся в активном центре.
3. Связывание гема с апомиоглобином
Гем — специфический лиганд апомиоглобина, присоединяющийся к белковой части в углублении между двумя α-спиралями F и Е. Центр связывания с гемом образован преимущественно гидрофобными остатками аминокислот, окружающими гидрофобные пиррольные кольца гема. Две боковые группы пропионовых кислот, ионизированные при физиологических значениях pH, выступают на поверхности молекулы.
В активный центр апомиоглобина кроме гидрофобных аминокислот входят также 2 остатка Гис (Гис64 и Гис93 или Гис Е7 и Гис F8), играющие важную роль в функционировании белка. Они расположены по разные стороны от плоскости гема и входят в состав спиралей F и Е, между которыми располагается гем. Атом железа в геме может образовывать 6 координационных связей, 4 из которых удерживают Fе2+ в центре протопорфирина IX (соединяя его с атомами азота пиррольных колец), а 5-я связь возникает между Fе2+ и атомом азота имидазольного кольца Гис F8 (рис. 1-30).
Рис. 1-30. Расположение гема в активном центре апомиоглобина и протомеров апогемоглобина.

Гис Е7 хотя и не связан с гемом, но необходим для правильной ориентации и присоединения другого лиганда — O2 к миоглобину.
Аминокислотное окружение гема создаёт условия для довольно прочного, но обратимого связывания O2 с Fе2+ миоглобина. Гидрофобные остатки аминокислот, окружающие гем, препятствуют проникновению в центр связывания миоглобина воды и окислению Fе2+ в Fе3+. Трёхвалентное железо в составе гема не способно присоединять O2.
Б. Структура и функции гемоглобина
Гемоглобины — родственные белки, находящиеся в эритроцитах человека и позвоночных животных. Эти белки выполняют 2 важные функции:
✵ перенос O2 из лёгких к периферическим тканям;
✵ участие в переносе СO2 и протонов из периферических тканей в лёгкие для последующего выведения из организма.
Кровь ежедневно должна переносить из лёгких в ткани около 600 л O2. Так как O2 плохо растворим в воде, то практически весь кислород в крови связан с гемоглобином эритроцитов.
От способности гемоглобина насыщаться O2 в лёгких и относительно легко отдавать его в капиллярах тканей зависят количество получаемого тканями O2 и интенсивность метаболизма. С другой стороны, O2 — сильный окислитель, избыток поступления O2 в ткани может привести к повреждению молекул и нарушению структуры и функций клеток. Поэтому важнейшая характеристика гемоглобина — его способность регулировать сродство к O2 в зависимости от тканевых условий.
Гемоглобины, так же как миоглобин, относят к гемопротеинам, но они имеют четвертичную структуру (состоят из 4 полипептидных цепей), благодаря которой возникает возможность регуляции их функций.
1. Гемоглобины человека
Гемоглобины взрослого человека
В эритроцитах взрослого человека гемоглобин составляет 90% от всех белков данной клетки.
Гемоглобин А — основной гемоглобин взрослого организма, составляет около 98% от общего количества гемоглобина, тетрамер, состоит из 2 полипептидных цепей α и 2 β(2α2β).
Гемоглобин А2 находится в организме взрослого человека в меньшей концентрации, на его долю приходится около 2% общего гемоглобина. Он состоит из 2 α- и 2 δ-цепей.
Гемоглобин А1с — гемоглобин А, модифицированный ковалентным присоединением к нему глюкозы (так называемый гликозилированный гемоглобин).
Гемоглобины, синтезирующиеся в период внутриутробного развития плода:
Эмбриональный гемоглобин синтезируется в эмбриональном желточном мешке через несколько недель после оплодотворения. Представляет собой тетрамер 2![]() 2ε. Через 2 нед после формирования печени плода в ней начинает синтезироваться гемоглобин F, который к 6 мес замещает эмбриональный гемоглобин.
2ε. Через 2 нед после формирования печени плода в ней начинает синтезироваться гемоглобин F, который к 6 мес замещает эмбриональный гемоглобин.
Гемоглобин F — фетальный гемоглобин, синтезируется в печени и костном мозге плода до периода его рождения. Имеет тетрамерную структуру, состоящую из 2 α- и 2 y-цепей. После рождения ребёнка постепенно замещается на гемоглобин А, который начинает синтезироваться в клетках костного мозга уже на 8-м месяце развития плода.
2. Строение гемоглобина А
Строение протомеров гемоглобина
Конформация отдельных протомеров гемоглобина удивительно напоминает конформацию миоглобина, несмотря на то, что в первичной структуре их полипептидных цепей идентичны только 24 аминокислотных остатка. Протомеры гемоглобина, так же, как и апомиоглобин, состоят из 8 спиралей, свёрнутых в плотную глобулярную структуру, содержащую внутреннее гидрофобное ядро и «карман» для связывания гема. Соединение гема с глобином (белковой частью) аналогично таковому у миоглобина — гидрофобное окружение гема, за исключением 2 остатков Гис Е7 и Гис F8 (рис. 1-31). Однако тетрамерная структура гемоглобина представляет собой более сложный структурно-функциональный комплекс, чем миоглобин.
Роль гистидина Е7 в функционировании миоглобина и гемоглобина
Гем имеет высокое сродство к оксиду углерода (СО). В водной среде свободный от белковой части гем связывается с СО в 25 000 раз сильнее, чем O2. Высокая степень сродства гема к СО по сравнению с O2 объясняется разным пространственным расположением комплексов Ге2+ гема с СО и O2 (рис. 1-31, А).
Рис. 1-31. Пространственное расположение СО и O2, связанных со свободным гемом (А) и гемом в составе гемоглобина или миоглобина (Б).

В комплексе Fе2+ гема с СО атомы Fе2+, углерода и кислорода расположены на одной прямой, а в комплексе Fе2+ гема с O2 атомы железа и кислорода расположены под углом, что отражает их оптимальное пространственное расположение.
В миоглобине и гемоглобине над Fе2+ в области присоединения O2 расположен Гис E7, нарушающий оптимальное расположение СО в центре связывания белков и ослабляющий его взаимодействие с гемом. Напротив, тот же Гис E7 создаёт оптимальные условия для связывания O2 (рис. 1-31, Б). В результате сродство гема к СО в белках всего в 200 раз превышает его сродство к O2.
Снижение сродства гемсодержащих белков к СО имеет важное биологическое значение. СО образуется в небольших количествах при катаболизме некоторых веществ, в частности гема. Этот эндогенно образующийся СО блокирует около 1% гемсодержащих белков. Если бы сродство гема к СО не уменьшалось под влиянием белкового окружения, эндогенный оксид углерода мог бы вызывать серьёзные отравления.
Четвертичная структура гемоглобина
Четыре полипептидные цепи, соединённые вместе, образуют почти правильную форму шара, где каждая α-цепь контактирует с двумя β-пепями (рис. 1-32).
Рис. 1-32. Строение гемоглобина.
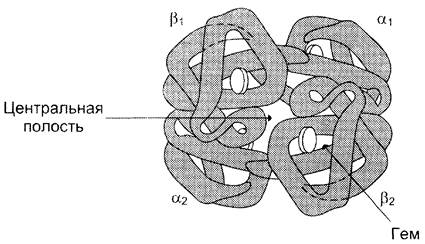
Так как в области контакта между α1- и β1-, а также между α2- и β2-цепями находится много гидрофобных радикалов, то между этими полипептидными цепями формируется сильное соединение за счёт возникновения в первую очередь гидрофобных, а также ионных и водородных связей. В результате образуются димеры α1β1 и α2β2. Между этими димерами в тетрамерной молекуле гемоглобина возникают в основном полярные (ионные и водородные) связи, поэтому при изменении pH среды в кислую или щелочную сторону в первую очередь разрушаются связи между димерами. Кроме того, димеры способны легко перемещаться относительно друг друга.
Так как поверхность протомеров неровная, полипептидные цепи в центральной области не могут плотно прилегать друг к другу, в результате в центре формируется «центральная полость», проходящая сквозь всю молекулу гемоглобина.
3. Связывание гемоглобина с О2 в лёгких и его диссоциация из комплекса в тканях
Основная функция гемоглобина — доставка О2 от лёгких к тканям. Олигомерная структура гемоглобина обеспечивает быстрое насыщение его кислородом в лёгких (образование оксигемоглобина — Нb(O2)4), возможность отщепления кислорода от гемоглобина в капиллярах тканей при относительно высоком парциальном давлении O2, а также возможность регуляции сродства гемоглобина к О2 в зависимости от потребностей тканей в кислороде.
Кооперативные изменения конформации протомеров
О2 связывается с протомерами гемоглобина через Fе2+, который соединён с четырьмя атомами азота пиррольных колец гема и атомом азота Гис F8 белковой части протомера. Связывание O2 с оставшейся свободной координационной связью Fе2+ происходит по другую сторону от плоскости гема в области Гис Е7 (аналогично тому, как это происходит у миоглобина). Гис Е7 не взаимодействует с O2, но обеспечивает оптимальные условия для его связывания (рис. 1-33).
Рис. 1-33. Изменение положения Fе2+ и белковой части гемоглобина при присоединении O2.
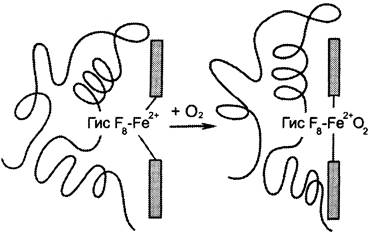
В дезоксигемоглобине благодаря ковалентной связи с белковой частью атом Fе2+ выступает из плоскости гема в направлении Гис F8. Присоединение O2 к атому Fе2+ одного протомера вызывает его перемещение в плоскость гема, за ним перемещаются остаток Гис F8 и полипептидная цепь, в состав которой он входит. Так как протомер связан с остальными протомерами, а белки обладают конформационной лабильностью, происходит изменение конформации всего белка. Конформационные изменения, произошедшие в других протомерах, облегчают присоединение следующей молекулы O2, что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы O2. Четвёртая молекула O2 присоединяется к гемоглобину в 300 раз легче, чем первая молекула (рис. 1-34).
Рис. 1-34. Кооперативные изменения конформации протомеров гемоглобина при присоединении O2.

Изменение конформации (а, следовательно, и функциональных свойств) всех протомеров олигомерного белка при присоединении лиганда только к одному из них носит название кооперативных изменений конформации протомеров.
Аналогичным образом в тканях диссоциация каждой молекулы O2 изменяет конформацию всех протомеров и облегчает отщепление последующих молекул O2.
Кривые диссоциации O2 для миоглобина и гемоглобина
Кооперативность в работе протомеров гемоглобина можно наблюдать и на кривых диссоциации O2 для миоглобина и гемоглобина (рис. 1-35).
Рис. 1-35. Кривые диссоциации кислорода для миоглобина и гемоглобина в зависимости от парциального давления кислорода.

Отношение занятых O2 участков связывания белка к общему числу таких участков, способных к связыванию, называется степенью насыщения этих белков кислородом. Кривые диссоциации показывают, насколько насыщены данные белки O2 при различных значениях парциального давления кислорода.
Кривая диссоциации O2 для миоглобина имеет вид простой гиперболы. Это указывает на то, что миоглобин обратимо связывается с лигандом, и на это не оказывают влияние никакие посторонние факторы (схема ниже).
Процессы образования и распада оксимиоглобина находятся в равновесии, и это равновесие смещается влево или вправо в зависимости от того, добавляется или удаляется кислород из системы. Миоглобин связывает кислород, который в капиллярах тканей высвобождает гемоглобин, и сам миоглобин может освобождать O2 в ответ на возрастание потребностей в нём мышечной ткани и при интенсивном использовании O2 в результате физической нагрузки.
Миоглобин имеет очень высокое сродство к
O2. Даже при парциальном давлении O2, равном 1 — 2 мм рт. ст., миоглобин остаётся связанным с O2 на 50%.
Кривая диссоциации O2 для гемоглобина. Из графика на рис. 1-35 видно, что гемоглобин имеет значительно более низкое сродство к O2; полунасыщение гемоглобина O2наступает при более высоком давлении O2 (около 26 мм рт. ст.).
Кривая диссоциации для гемоглобина имеет сигмоидную форму (S-образную). Это указывает на то, что протомеры гемоглобина работают кооперативно: чем больше O2 отдают протомеры, тем легче идёт отщепление последующих молекул O2.
В капиллярах покоящихся мышц, где давление O2 составляет около 40 мм рт. ст., большая часть кислорода возвращается в составе оксигемоглобина обратно в лёгкие. При физической работе давление O2 в капиллярах мышц падает до 10 — 20 мм рт. ст. Именно в этой области (от 10 до 40 мм рт. ст.) располагается «крутая часть» 8-образной кривой, где в наибольшей степени проявляется свойство кооперативной работы протомеров.
Следовательно, благодаря уникальной структуре каждый из рассмотренных белков приспособлен выполнять свою функцию: миоглобин — присоединять O2, высвобождаемый гемоглобином, накапливать в клетке и отдавать в случае крайней необходимости; гемоглобин — присоединять O2 в лёгких, где его насыщение доходит до 100%, и отдавать O2 в капиллярах тканей в зависимости от изменения в них давления O2.
4. Перенос Н+ и СO2 из тканей в лёгкие с помощью гемоглобина. Эффект Бора
Окисление органических веществ с целью получения энергии происходит в митохондриях клеток с использованием O2, доставляемого гемоглобином из лёгких. В результате окисления веществ образуются конечные продукты распада — СO2 и Н2O, количество которых пропорционально интенсивности процессов окисления.
СO2, образовавшийся в тканях, транспортируется в эритроциты. Там под действием фермента карбангидразы происходит увеличение скорости образования Н2СO3. Слабая угольная кислота может диссоциировать на Н+ и НСO3-
СO2 + Н2O <-> Н2СO3 <-> Н+ + HCO3-.
Равновесие реакции в эритроцитах, находящихся в капиллярах тканей, смещается вправо, так как образующиеся в результате диссоциации угольной кислоты протоны могут присоединяться к специфическим участкам молекулы гемоглобина: к радикалам Гис146 двух β-цепей, радикалам Гис122 и концевым α-аминогруппам двух α-цепей. Все эти 6 участков при переходе гемоглобина от окси- к дезоксиформе приобретают большее сродство к Н+ в результате локального изменения аминокислотного окружения вокруг этих участков (приближения к ним отрицательно заряженных карбоксильных групп аминокислот).
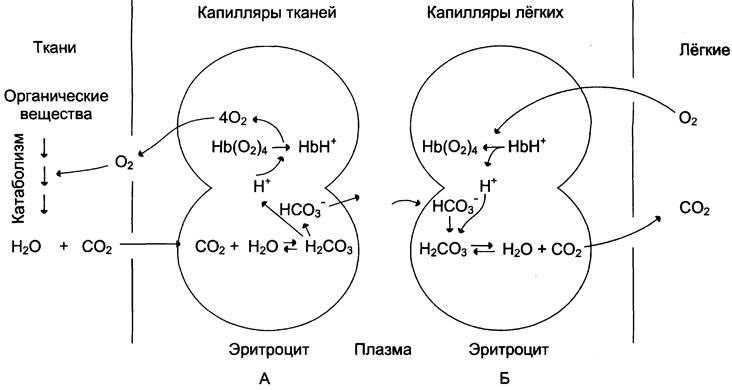
Присоединение 3 пар протонов к гемоглобину уменьшает его сродство к O2 и усиливает транспорт O2 в ткани, нуждающиеся в нём (рис. 1-36, А). Увеличение освобождения O2гемоглобином в зависимости от концентрации Н+ называют эффектом Бора (по имени датского физиолога Христиана Бора, впервые открывшего этот эффект).
В капиллярах лёгких высокое парциальное давление O2 приводит к оксигенированию гемоглобина и удалению 6 протонов. Реакция СO2+ + Н2O <-> Н2СO3 <-> Н+ + НСO3-сдвигается влево и образующийся СO2 выделяется в альвеолярное пространство и удаляется с выдыхаемым воздухом (рис. 1-36, Б).
Рис. 1-36. Перенос Н+ и СO2 с кровью. Эффект Бора. А - влияние концентрации СO2 и Н+ на высвобождение O2 из комплекса с гемоглобином в тканях (эффект Бора); Б - оксигенирование дезоксигемоглобина в лёгких, образование и выделение СO2.
Следовательно, молекула гемоглобина в ходе эволюции приобрела способность воспринимать и реагировать на информацию, получаемую из окружающей среды. Увеличение концентрации протонов в среде снижает сродство O2 к гемоглобину и усиливает его транспорт в ткани (рис. 1-37).
Рис. 1-37. Влияние pH на кривую диссоциации O2 для гемоглобина.

Большая часть СO2 транспортируется кровью в виде бикарбоната НСO3-. Небольшое количество СO2 (около 15 — 20%) может переноситься в лёгкие, обратимо присоединяясь к неионизированным концевым α-аминогруппам. R-NН2+ + СO2 = R-NН-СОО- + Н+, в результате образуется карбогемоглобин, где R — полипептидная цепь гемоглобина. Присоединение СO2 к гемоглобину также снижает его сродство к O2.
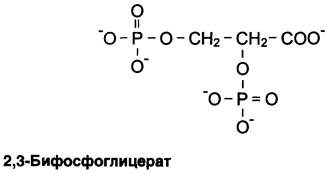
5. 2,3-Бифосфоглицерат — аллостерический регулятор сродства гемоглобина к O2
2,3-Бифосфоглицерат (БФГ) — вещество, синтезируемое в эритроцитах из промежуточного продукта окисления глюкозы 1,3-бифосфоглицерата.
Регуляция с помощью 2,3-бифосфоглицерата сродства гемоглобина к O2
В нормальных условиях 2,3-бифосфоглицерат присутствует в эритроцитах примерно в той же концентрации, что и гемоглобин. БФГ, присоединяясь к гемоглобину, также может менять его сродство к O2.
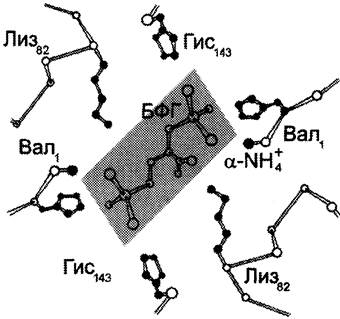
В центре тетрамерной молекулы гемоглобина есть полость, образованная аминокислотными остатками всех четырёх протомеров. Центральная полость — место присоединения БФГ.
Размеры центральной полости могут меняться: отщепление O2 от оксигемоглобина вызывает его конформационные изменения, которые способствуют образованию дополнительных ионных связей между димерами α1β1 и α2β2. В результате пространственная структура дезоксигемоглобина становится более жёсткой, напряжённой, а центральная полость расширяется.
Поверхность полости ограничена остатками аминокислот, в числе которых имеются положительно заряженные радикалы Лиз82, Гис143 β-цепей и положительно заряженные α-аминогруппы N-концевого валина β-цепей. В расширенную полость дезоксигемоглобина БФГ, имеющий сильный отрицательный заряд, присоединяется с помощью ионных связей, образующихся с положительно заряженными функциональными группами двух β-цепей гемоглобина. Присоединение БФГ ещё сильнее стабилизирует жёсткую структуру дезоксигемоглобина и снижает сродство белка к O2 (рис. 1-38).
Рис. 1-38. Взаимодействие 2,3-бифосфоглицерата с аминокислотными остатками центральной полости дезоксигемоглобина.
Присоединение БФГ к дезоксигемоглобину происходит в участке, ином по сравнению с гемом, где происходит связывание O2. Такой лиганд называется «аллостерический», а центр, где связывается аллостерический лиганд, — «аллостерический центр» (от греч. «аллос» — другой, иной, «стерос» — пространственный).
В лёгких высокое парциальное давление O2 приводит к оксигенированию гемоглобина. Разрыв ионных связей между димерами α1β1 и α2β2 приводит к «расслаблению» белковой молекулы, уменьшению центральной полости и вытеснению БФГ.

Изменение концентрации БФГ как механизм адаптации организма к гипоксии. Концентрация БФГ в эритроцитах людей, живущих в определённых климатических условиях, — величина постоянная. Однако в период адаптации к высокогорью, когда человек поднимается на высоту более 4000 м над уровнем моря, концентрация БФГ уже через 2 дня возрастает почти в 2 раза (от 4,5 до 7,0 мМ). Это снижает сродство гемоглобина к O2 и увеличивает количество O2, транспортируемого в ткани (рис. 1-39).
Рис. 1-39. Влияние различных концентраций 2,3-бифосфоглицерата на сродство гемоглобина к O2.
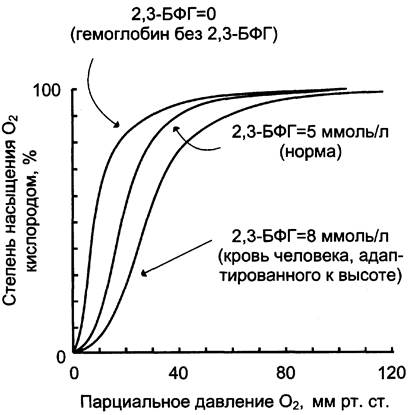
Такую же адаптацию наблюдают у больных с заболеваниями лёгких, при которых развивается общая гипоксия тканей. Так, у больных с тяжёлой обструктивной эмфиземой лёгких парциальное давление в них снижается от 100 до 50 мм рт. ст. Но при этом в эритроцитах усиливается выработка БФГ, и его концентрация повышается с 4,5 до 7,0 мМ, что существенно увеличивает доставку O2 в ткани.
Клиническое значение концентрации БФГ в консервированной крови
В крови, консервированной в некоторых средах, например, цитрат-декстрозной, за 10 дней концентрация БФГ снижается с 4,5 до 0,5 мМ. Гемоглобин такой крови имеет очень высокое сродство к O2. Если кровь со сниженной концентрацией БФГ переливать тяжелобольным, возникает опасность развития гипоксии тканей. Введённые с кровью эритроциты за 24 ч могут восстановить лишь половину нормальной концентрации БФГ. Добавлением в кровь БФГ нельзя восстановить нормальную концентрацию его в эритроцитах, так как, имея высокий отрицательный заряд, БФГ не может проникать через мембраны эритроцитов. Поэтому в настоящее время в кровь добавляют вещества, способные проникать через мембрану эритроцитов и поддерживать в них нормальную концентрацию БФГ.
6. Регуляторные свойства олигомерного белка гемоглобина
Таким образом, олигомерный белок гемоглобин, в отличие от мономерного родственного белка миоглобина, способен присоединять к специфическим участкам 4 различных лиганда: O2, Н+, СO2 и БФГ. Все эти лиганды присоединяются к пространственно разобщённым участкам, но конформационные изменения белка в месте присоединения одного лиганда передаются на весь олигомерный белок и изменяют сродство к нему других лигандов. Так, количество поступающего в ткани O2 зависит не только от парциального давления O2, но и концентрации аллостерических лигандов, что увеличивает возможность регуляции функций гемоглобина.
Как мы уже рассматривали выше, в капиллярах работающей мышцы увеличение концентрации СO2 и Н+ уменьшает сродство гемоглобина к O2 и увеличивает отдачу его в ткани. При длительной гипоксии усиливается синтез 2,3- БФГ в эритроцитах, что также снижает сродство гемоглобина к O2 и при том же парциальном давлении O2 увеличивает его транспорт в ткани.
Следовательно, благодаря воздействию регуляторных лигандов олигомерные белки способны приспосабливать свою конформацию и функцию к изменениям, происходящим в окружающей среде.
7. Особенности строения и функционирования гемоглобина плода
Фетальный гемоглобин (НbF) заменяет эмбриональный гемоглобин, начиная синтезироваться в печени через 2 нед после её формирования у плода. С 6 мес развития плода до его рождения, это основной гемоглобин эритроцитов. После рождения ребёнка он интенсивно начинает замещаться на гемоглобин А.
В физиологических условиях НbF имеет более высокое сродство к O2, чем НbА, что создаёт оптимальные условия для транспорта O2 из крови матери в кровь плода. Это свойство НbF обусловлено тем, что он слабее, чем НbА связывается с 2,3-БФГ. Физиологические особенности НbF связаны с особенностями его строения: вместо β-глобиновых цепей в НbА, он содержит две y-цепи (β-подобные). Связывание 2,3-БФГ с НbА происходит при участии положительно заряженных радикалов аминокислот двух β-цепей, некоторые из которых отсутствуют в первичной структуре y-цепей. В среде, лишённой 2,3-БФГ, НbА и НbF проявляют одинаковое высокое сродство к O2.
В. Наследственные нарушения первичной структуры и функций гемоглобина А — наследственные гемоглобинопатии
Важность первичной структуры белков для формирования их конформации и функции можно проследить на примерах наследственных заболеваний, связанных с изменением первичной структуры гемоглобина. В настоящее время известно около 300 вариантов НbА, имеющих в первичной структуре α- или β-цепей лишь небольшие изменения. Некоторые из них почти не влияют на функцию белка и здоровье человека, другие снижают функцию белка и особенно в экстремальных ситуациях снижают возможность адаптации человека, третьи — вызывают значительные нарушения функций НbА и развитие анемии, что приводит к тяжёлым клиническим последствиям.
В аномальных гемоглобинах изменения могут затрагивать аминокислоты:
✵ находящиеся на поверхности белка;
✵ участвующие в формировании активного центра;
✵ замена которых нарушает общую трёхмерную конформацию молекулы;
✵ изменяющие четвертичную структуру белка и его регуляторные свойства.
1. Замена аминокислоты на поверхности гемоглобина А
Ещё в 1904 г. чикагский врач Джеймс Херрик описал у студента тяжёлую анемию с обнаружением в его крови множества удлинённых, похожих на полумесяц, эритроцитов. Заболевание получило название «серповидно-клеточной анемии», и только в 1949 г. Лайнус Полинг и его сотрудники доказали, что оно вызвано изменением первичной структуры НbА.
В молекуле гемоглобина S (так назван аномальный гемоглобин) мутантными оказались 2 β-цепи, в которых глутамат, высокополярная отрицательно заряженная аминокислота в положении 6 была заменена валином, содержащим гидрофобный радикал.

В дезоксигемоглобине S имеется участок, комплементарный другому участку таких же молекул, содержащему изменённую аминокислоту. В результате молекулы дезоксигемоглобина начинают «слипаться», образуя удлинённые фибриллярные агрегаты, деформирующие эритроцит и приводящие к образованию аномальных эритроцитов в виде серпа (рис. 1-40).
Рис. 1-40. Ассоциация молекул дезоксигемоглобина S.
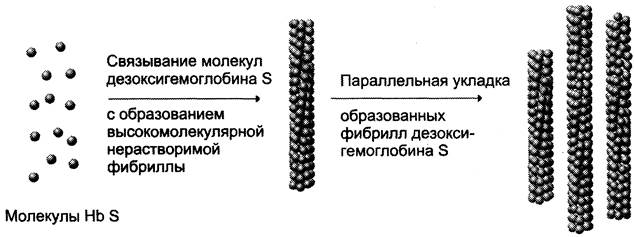
В оксигемоглобине S комплементарный участок «замаскирован» в результате изменения конформации белка. Недоступность участка препятствует соединению молекул оксигемоглобина S друг с другом. Следовательно, образованию агрегатов НbS способствуют условия, повышающие концентрацию дезоксигемоглобина в клетках (физическая работа, гипоксия, уменьшение pH, условия высокогорья, полёт на самолёте).
Так как «серповидные» эритроциты плохо проходят через капилляры тканей, они часто закупоривают сосуды и создают тем самым локальную гипоксию. Это повышает концентрацию дезоксигемоглобина S в эритроцитах, скорость образования агрегатов гемоглобина S и ещё большую деформацию эритроцитов. Нарушение доставки O2 в ткани вызывает боли и даже некроз клеток в данной области.
Серповидно-клеточная анемия — гомозиготное рецессивное заболевание; проявляется только в том случае, когда от обоих родителей наследуются 2 мутантных гена β-цепей глобина. После рождения ребёнка болезнь не проявляется до тех пор, пока значительные количества НbF не заместятся на НbS. У больных выявляют клинические симптомы, характерные для анемии: головокружение и головные боли, одышка, учащённое сердцебиение, боли в конечностях, повышенную восприимчивость к инфекционным заболеваниям.
Гетерозиготные индивидуумы, имеющие один нормальный ген НbА, а другой ген НbS, в крови имеют лишь следовые количества серповидных клеток и нормальную продолжительность жизни; клинические симптомы болезни у них обычно не проявляются.
Для диагностики наличия HbS в эритроцитах человека используют метод электрофореза, основанного на движении заряженных белков в электрическом поле. Так как в HbSотрицательно заряженные группы глутамата в β-цепях заменены незаряженным валином, HbS в щелочной среде будет двигаться медленнее, чем НbА.
Высокая частота гена HbS среди жителей Африки (до 40% населения в некоторых районах) обусловлена тем, что гетерозиготы менее чувствительны к малярии, чем люди с нормальным гемоглобином A. Plasmodium falciparum — возбудитель малярии, облигатную часть своего жизненного цикла он проводит в эритроцитах. Так как эритроциты гетерозиготных по HbS людей имеют более короткий срок жизни, чем нормальные эритроциты, возбудитель малярии не успевает закончить необходимую стадию развития. Это создаёт избирательное преимущество для гетерозиготных по HbS людей в тех областях, где малярия вызывает гибель многих людей.
Серповидно-клеточная анемия — первый описанный пример молекулярной болезни.
Почти все встречающиеся замены аминокислот на поверхности молекулы гемоглобина безвредны. Гемоглобин S — редкое исключение.
2. Изменения аминокислотного состава в области активного центра гемоглобина
Между гемом и белковой частью гемоглобина существует около 60 межатомных контактов. Большинство мутаций, нарушающих в той или иной мере эти контакты, приводят к развитию гемоглобинопатии и анемии.
Гемоглобин М — вариант гемоглобина А, где в результате мутации в гене α- или β-цепи происходит замена Гис Е7 или Гис F8 тирозином. В результате Fe2+ окисляется в Fe3+и стабилизируется в этой форме. Гемоглобин, содержащий в геме Fe3+, называют метгемоглобином (отсюда и название — гемоглобин М). Вместо O2 к Fe3+ присоединяется Н2O. Обычно изменения затрагивают либо, а-, либо β-цепи, в результате гемоглобин может переносить не более двух молекул O2. У гетерозиготных людей отмечают цианоз, связанный с нарушением транспорта O2, а гомозиготность по этому гену приводит к летальному исходу.
Гемоглобин Хаммерсмита — вариант гемоглобина А, где в положении D1 вместо фенилаланина (гидрофобной аминокислоты) находится серин (гидрофильная аминокислота). Фен D1 входит в неполярное окружение гема. Замена его на гидрофильную аминокислоту приводит к нарушению прочности связывания гема с глобином; в «гидрофобный карман», где размещается гем, способна проникать вода, окисляющая Fе2+ до Fе3+, в результате чего развивается анемия.
3. Изменения аминокислотного состава, деформирующие третичную структуру гемоглобина
Во всех нормальных гемоглобинах и в миоглобине в месте пересечения двух α-спиралей В и Е находится аминокислота глицин. Так как глицин вместо радикала содержит атом водорода, в этом месте две спирали плотно прилегают друг к другу.
В гемоглобине Ривердейла — Бронкса (вариант гемоглобина А) вместо глицина в положении В6 находится аминокислота аргинин, имеющая объёмный радикал. В результате он не умещается в столь узком пространстве, молекула меняет конформацию и становится нестабильной.
4. Замены аминокислот в области контактов димеров α1β1, α2β2, нарушающие аллостерические регуляторные функции гемоглобина
Почти все варианты гемоглобина А, где происходит замена аминокислот в области контакта димеров α1, β1, α2, β2, проявляют пониженную кооперативность и нарушенное сродство гемоглобина к O2.
Так, гемоглобин Кемпси — вариант гемоглобина А, где в положении G1 β-цепи аспарагиновая кислота заменена на аспарагин. В норме аспарагиновая кислота участвует в образовании водородной связи, стабилизирующей дезоксигемоглобин. В результате замены эта связь не образуется, что нарушает стабильность конформации дезоксигемоглобина, и сродство гемоглобина к O2 повышается. У больных развивается анемия с выраженным цианозом.
Таким образом, первичная структура белка определяет особенности его конформации, строения активного центра и функций. Изменение одной аминокислоты только в одном белке может быть причиной нарушений функций данного белка и развития наследственной патологии.