БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 8. ОБМЕН ЛИПИДОВ
IV. Обмен триацилглицеролов
Приём пищи человеком происходит иногда со значительными интервалами, поэтому в организме выработались механизмы депонирования источников энергии. Жиры — наиболее выгодная и основная форма депонирования энергии. Запасы гликогена в организме не превышают 300 г и обеспечивают организм энергией не более суток. Депонированный жир может обеспечивать организм энергией при голодании в течение длительного времени (до 7 — 8 нед). Синтез жиров активируется в абсорбтивный период и происходит в основном в жировой ткани и печени. Но если жировая ткань — место депонирования жира, то печень выполняет важную роль превращения части углеводов, поступающих с пищей, в жиры, которые затем секретируются в кровь в составе ЛПОНП и доставляются в другие ткани (в первую очередь, в жировую). Синтез жиров в печени и жировой ткани стимулируется инсулином. Мобилизация жира активируется в тех случаях, когда глюкозы недостаточно для обеспечения энергетических потребностей организма: в постабсорбтивный период, при голодании и физической работе под действием гормонов глюкагона, адреналина, соматотропина. Жирные кислоты поступают в кровь и используются тканями как источники энергии.
А. Синтез жиров в жировой ткани и печени
Синтез жиров происходит в абсорбтивный период в печени и жировой ткани. Непосредственными субстратами в синтезе жиров являются ацил-КоА и глицерол-3-фосфат. Метаболический путь синтеза жиров в печени и жировой ткани одинаков, за исключением разных путей образования глицерол-3-фосфата.
Образование глицерол-3-фосфата
Синтез жиров в печени и жировой ткани идёт через образование промежуточного продукта — фосфатидной кислоты (рис. 8-21).
Рис. 8-21. Синтез жиров в печени и жировой ткани.

Предшественник фосфатидной кислоты — глицерол-3-фосфат, образующийся в печени двумя путями:
✵ восстановлением дигидроксиацетонфосфата — промежуточного метаболита гликолиза;
✵ фосфорилированием глицеролкиназой свободного глицерола, поступающего в печень из крови (продукт действия ЛП-липазы на жиры ХМ и ЛПОНП).
В жировой ткани глицеролкиназа отсутствует, и восстановление дигидроксиацетонфосфата — единственный путь образования глицерол- 3-фосфата. Следовательно, синтез жиров в жировой ткани может происходить только в абсорбтивный период, когда глюкоза поступает в адипоциты с помощью белка-переносчика глюкозы ГЛЮТ-4, активного только в присутствии инсулина, и распадается по пути гликолиза.
Синтез жиров в жировой ткани
В жировой ткани для синтеза жиров используются в основном жирные кислоты, освободившиеся при гидролизе жиров ХМ и ЛПОНП (рис. 8-22). Жирные кислоты поступают в адипоциты, превращаются в производные КоА и взаимодействуют с глицерол-3-фосфатом, образуя сначала лизофосфатидную кислоту, а затем фосфатидную. Фосфатидная кислота после дефосфорилирования превращается в диацилглицерол, который ацилируется с образованием триацил- глицерола.
Кроме жирных кислот, поступающих в адипоциты из крови, в этих клетках идёт и синтез жирных кислот из продуктов распада глюкозы. В адипоцитах для обеспечения реакций синтеза жира распад глюкозы идёт по двум путям: гликолиз, обеспечивающий образование глицерол-3-фосфата и ацетил-КоА, и пентозофосфатный путь, окислительные реакции которого обеспечивают образование NADPH, служащего донором водорода в реакциях синтеза жирных кислот.
Рис. 8-22. Депонирование жира в адипоцитах в абсорбтивном периоде. После еды при повышении концентрации глюкозы в крови увеличивается секреция инсулина. Инсулин активирует транспорт глюкозы внутрь адипоцитов, действуя на ГЛЮТ-4, и синтез ЛП-липазы в адипоцитах и её экспонирование на поверхности стенки капилляров. ЛП-липаза, связанная с эндотелием сосудов, гидролизует жиры в составе ХМ и ЛПОНП. АпоС-II на поверхности ХМ и ЛПОНП активирует ЛП-липазу. Жирные кислоты проникают в адипоцит, а глицерол транспортируется в печень. Так как в адипоцитах нет фермента глицеролкиназы, то свободный глицерол не может использоваться для синтеза ТАГ в этой ткани. Активированные жирные кислоты взаимодействуют с глицерол- 3-фосфатом, образующимся из дигидроксиацетонфосфата, и через фосфатидную кислоту превращаются в ТАГ, которые депонируются в адипоцитах. Сокращения: ТАГ* — триацилглицеролы в составе ХМ и ЛПОНП; ДАФ — дигидроксиацетонфосфат.

Молекулы жиров в адипоцитах объединяются в крупные жировые капли, не содержащие воды, и поэтому являются наиболее компактной формой хранения топливных молекул. Подсчитано, что, если бы энергия, запасаемая в жирах, хранилась в форме сильно гидратированных молекул гликогена, то масса тела человека увеличилась бы на 14 — 15 кг.
Синтез ТАГ в печени. Образование ЛПОНП в печени и транспорт жиров в другие ткани
Печень — основной орган, где идёт синтез жирных кислот из продуктов гликолиза. В гладком ЭР гепатоцитов жирные кислоты активируются и сразу же используются для синтеза жиров, взаимодействуя с глицерол-3-фосфатом. Как и в жировой ткани, синтез жиров идёт через образование фосфатидной кислоты. Синтезированные в печени жиры упаковываются в ЛПОНП и секретируются в кровь (рис. 8-23).
Рис. 8-23. Синтез и секреция ЛПОНП в печени. Белки, синтезированные в шероховатом ЭР (1), в аппарате Гольджи (2), формируют комплекс с ТАГ, называемый ЛПОНП. ЛПОНП комплектуются в секреторных гранулах (3), транспортируются к клеточной мембране и секретируются в кровь.
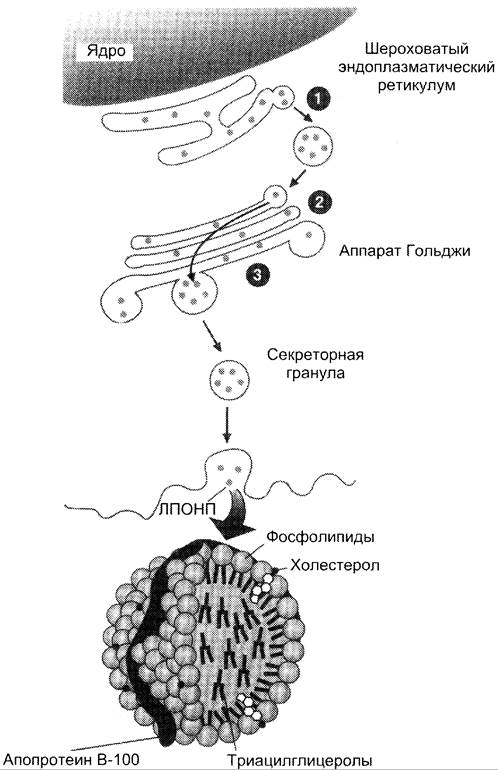
В состав ЛПОНП, кроме жиров, входят холестерол, фосфолипиды и белок — апоВ-100. Это очень «длинный» белок, содержащий 11 536 аминокислот. Одна молекула апоВ-100 покрывает поверхность всего липопротеина.
ЛПОНП из печени секретируются в кровь (рис. 8-23), где на них, как и на ХМ, действует ЛП-липаза. Жирные кислоты поступают в ткани, в частности в адипоциты, и используются для синтеза жиров. В процессе удаления жиров из ЛПОНП под действием ЛП-липазы ЛДОНП сначала превращаются в ЛППП, а затем в ЛПНП. В ЛПНП основными липидными компонентами служат холестерол и его эфиры, поэтому ЛПНП являются липопротеинами, доставляющими холестерол в периферические ткани. Глицерол, освободившийся из липопротеинов, кровью транспортируется в печень, где опять может использоваться для синтеза жиров.
Скорость синтеза жирных кислот и жиров в печени существенно зависит от состава пищи. Если в пище содержится более 10% жиров, то скорость синтеза жиров в печени резко снижается.
Б. Мобилизация жиров из жировой ткани
Адипоциты (место депонирования жиров) располагаются в основном под кожей, образуя подкожный жировой слой, и в брюшной полости, образуя большой и малый сальники. Мобилизация жиров, т. е. гидролиз до глицерола и жирных кислот, происходит в постабсорбтивный период, при голодании и активной физической работе. Гидролиз внутриклеточного жира осуществляется под действием фермента гормончувствительной липазы — ТАГ-липазы. Этот фермент отщепляет одну жирную кислоту у первого углеродного атома глицерола с образованием диацилглицерола, а затем другие липазы гидролизуют его до глицерола и жирных кислот, которые поступают в кровь. Глицерол как водорастворимое вещество транспортируется кровью в свободном виде, а жирные кислоты (гидрофобные молекулы) в комплексе с белком плазмы — альбумином.
В. Гормональная регуляция синтеза и мобилизации жиров
Какой процесс будет преобладать в организме — синтез жиров (липогенез) или их распад (липолиз), зависит от поступления пищи и физической активности. В абсорбтивном состоянии под действием инсулина происходит липогенез, в постабсорбтивном состоянии — липолиз, активируемый глюкагоном. Адреналин, секреция которого увеличивается при физической активности, также стимулирует липолиз.
Регуляция синтеза жиров. В абсорбтивный период при увеличении соотношения инсулин/глюкагон в печени активируется синтез жиров. В жировой ткани индуцируется синтез ЛП-липазы в адипоцитах и осуществляется её экспонирование на поверхность эндотелия; следовательно, в этот период увеличивается поступление жирных кислот в адипоциты. Одновременно инсулин активирует белки-переносчики глюкозы — ГЛЮТ-4. Поступление глюкозы в адипоциты и гликолиз также активируются. В результате образуются все необходимые компоненты для синтеза жиров: глицерол-3-фосфат и активные формы жирных кислот. В печени инсулин, действуя через различные механизмы, активирует ферменты путём дефосфорилирования и индуцирует их синтез. В результате увеличиваются активность и синтез ферментов, участвующих в превращении части глюкозы, поступающей с пищей, в жиры. Это — регуляторные ферменты гликолиза, пируватдегидрогеназный комплекс и ферменты, участвующие в синтезе жирных кислот из ацетил-КоА. Результат действия инсулина на обмен углеводов и жиров в печени — увеличение синтеза жиров и секреция их в кровь в составе ЛПОНП. ЛПОНП доставляют жиры в капилляры жировой ткани, где действие ЛП-липазы обеспечивает быстрое поступление жирных кислот в адипоциты, где они депонируются в составе триацилглицеринов.
Запасание жиров в жировой ткани — основная форма депонирования источников энергии в организме человека (табл. 8-6). Запасы жиров в организме человека массой 70 кг составляют 10 кг, но у многих людей количество жиров может быть значительно больше.
Таблица 8-6. Запасы энергии в организме человека (масса 70 кг)
Форма энергии |
Локализация |
Количество энергии, ккал |
Глюкоза и жирные кислоты |
Кровь |
100 |
Гликоген |
Печень/мышцы |
760 |
Жиры |
Жировая ткань |
110 000 |
Белки |
Скелетные мышцы |
25 000 |
Жиры образуют в адипоцитах жировые вакуоли. Жировые вакуоли иногда заполняют значительную часть цитоплазмы. Скорость синтеза и мобилизации подкожного жира происходит неравномерно в разных частях организма, что связано с неодинаковым распределением рецепторов гормонов на адипоцитах.
Регуляция мобилизации жиров. Мобилизация депонированных жиров стимулируется глюкагоном и адреналином и, в меньшей степени, некоторыми другими гормонами (соматотропным, кортизолом). В постабсорбтивный период и при голодании глюкагон, действуя на адипоциты через аденилатциклазную систему, активирует протеинкиназу А, которая фосфорилирует и, таким образом, активирует гормон- чувствительную липазу, что инициирует липолиз и выделение жирных кислот и глицерина в кровь. При физической активности увеличивается секреция адреналина, который действует через β-адренергические рецепторы адипоцитов, активирующие аденилатциклазную систему (рис. 8-24). В настоящее время обнаружено 3 типа β-рецепторов: β1, β2, β3, активация которых приводит к липолитическому действию. К наибольшему липолитическому действию приводит активация β3-рецепторов. Адреналин одновременно действует и на α2-рецепторы адипоцитов, связанные с ингибирующим G-белком, что инактивирует аденилатциклазную систему. Вероятно, действие адреналина двояко: при низких концентрациях в крови преобладает его антилиполитическое действие через α2- рецепторы, а при высокой — преобладает липолитическое действие через β-рецепторы.
Рис. 8-24. Гормональная регуляция мобилизации жиров в постабсорбтивном периоде, при голодании и физической работе. При голодании увеличивается секреция глюкагона, при физической работе — адреналина. Эти гормоны, действуя через аденилатциклазную систему, стимулируют мобилизацию жиров. *ТАГ-липаза имеет и другие названия: гормон чувствительная липаза, тканевая липаза.
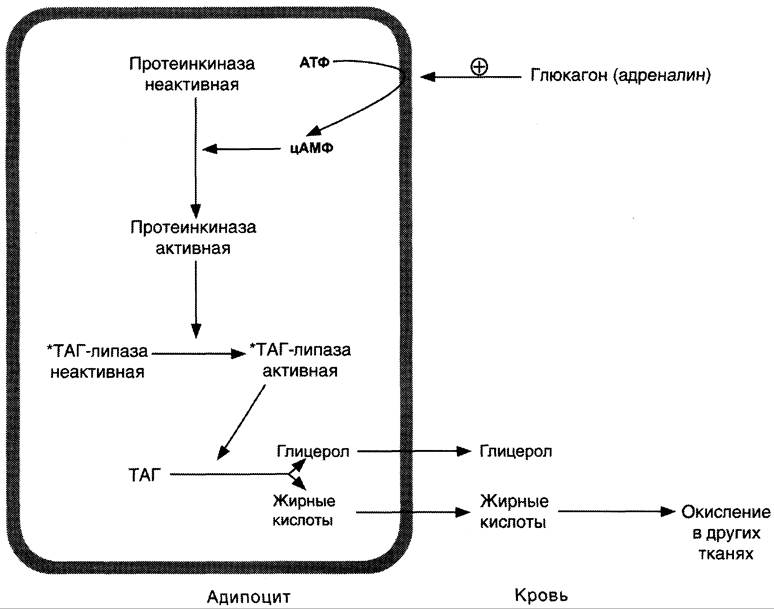
Для мышц, сердца, почек, печени при голодании или физической работе жирные кислоты становятся важным источником энергии. Печень перерабатывает часть жирных кислот в кетоновые тела, используемые мозгом, нервной тканью и некоторыми другими тканями как источники энергии.
В результате мобилизации жиров концентрация жирных кислот в крови увеличивается приблизительно в 2 раза (рис. 8-25), однако абсолютная концентрация жирных кислот в крови невелика даже в этот период. Т1/2 жирных кислот в крови тоже очень мал (менее 5 мин), что означает существование быстрого потока жирных кислот из жировой ткани к другим органам. Когда постабсорбтивный период сменяется абсорбтивным, инсулин активирует специфическую фосфатазу, которая дефосфорилирует гормончувствительную липазу, и распад жиров останавливается.
Рис. 8-25. Изменение концентрации жирных кислот, кетоновых тел и глюкозы в крови при голодании.

Г. Нарушения жирового обмена. Ожирение
Жировая ткань составляет 20 — 25% от общей массы тела у женщин и 15 — 20% у мужчин. Однако избыточное накопление жира в адипоцитах (ожирение) широко распространено. Среди взрослого населения некоторых стран около 50% людей страдает ожирением. Ожирение — важнейший фактор риска развития инфаркта миокарда, инсульта, сахарного диабета, артериальной гипертензии и желчнокаменной болезни.
Ожирением считают состояние, когда масса тела превышает 20% от «идеальной» для данного индивидуума. Образование адипоцитов происходит ещё во внутриутробном состоянии, начиная с последнего триместра беременности, и заканчивается в препубертатный период. После этого жировые клетки могут увеличиваться в размерах при ожирении или уменьшаться при похудании, но их количество не изменяется в течение жизни.
Первичное ожирение
Первичное ожирение характеризуется множеством гормональных и метаболических особенностей у лиц, страдающих этим заболеванием. В самом общем виде можно сказать, что первичное ожирение развивается в результате алиментарного дисбаланса — избыточной калорийности питания по сравнению с расходами энергии.
Суточные потребности организма в энергии складываются из:
✵ основного обмена — энергии, необходимой для поддержания жизни; основной обмен измеряют по поглощению кислорода или выделению тепла человеком в состоянии покоя утром, после 12-часового перерыва в еде;
✵ энергии, необходимой для физической активности.
Затраты энергии, необходимые для физической активности, разделяют на 3 уровня:
I — 30% энергии от основного обмена (у людей, ведущих сидячий образ жизни);
II — 60 — 70% от энергии основного обмена (у людей, которые 2 ч в день имеют умеренную физическую нагрузку);
III — 100% и более от энергии основного обмена (у людей, которые в течение нескольких часов в день занимаются тяжёлой физической работой).
В зависимости от интенсивности нагрузки и возраста суточная потребность в энергии колеблется у женщин от 2000 до 3000 ккал в день, а у мужчин — от 2300 до 4000 ккал.
Количество потребляемой пищи определяется многими факторами, в том числе и химическими регуляторами чувства голода и насыщения. Эти чувства определяются концентрацией в крови глюкозы и гормонов, которые инициируют чувство насыщения: холецистокинина, нейротензина, бомбезина, лептина.
Причины первичного ожирения:
✵ генетические нарушения (до 80% случаев ожирения — результат генетических нарушений);
✵ состав и количество потребляемой пищи, метод питания в семье;
✵ уровень физической активности;
✵ психологические факторы.
Генетические факторы в развитии ожирения. Метаболические различия между тучными и худыми людьми до настоящего времени не могут быть определены однозначно. Существует несколько теорий, объясняющих эти различия:
✵ генетически детерминированная разница в функционировании «бесполезных» циклов (субстратных циклов, раздел 7). Эти циклы состоят из пары метаболитов, превращаемых друг в друга с помощью двух ферментов. Одна из этих реакций идёт с затратой АТФ. Например,
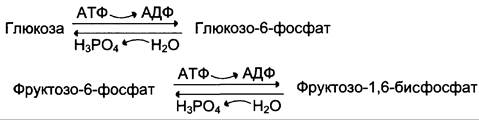
✵ если эти субстраты превращаются друг в друга с одинаковой скоростью, то происходит «бесполезный» расход АТФ и, соответственно, источников энергии, например, жиров;
✵ у людей, склонных к ожирению, вероятно, имеется более прочное сопряжение дыхания и окислительного фосфорилирования, т.е. более эффективный метаболизм;
✵ возможно, разное соотношение аэробного и анаэробного гликолиза. Анаэробный гликолиз (как менее эффективный) «сжигает» гораздо больше глюкозы, в результате снижается её переработка в жиры;
✵ у отдельных индивидуумов имеется различие в активности Na+/К+-АТФ-азы, работа которой требует до 30% энергии, потребляемой клетками.
Роль лептина в регуляции массы жировой ткани
У человека и животных имеется «ген ожирения» — obese gene (ob). Продуктом экспрессии этого гена служит белок лептин, состоящий из 167 аминокислот, который синтезируется и секретируется адипоцитами и взаимодействует с рецепторами гипоталамуса. В результате его действия снижается секреция нейропептида У. Нейропептид У стимулирует пищевое поведение, поиск и потребление пищи у животных. Другие пептиды, участвующие в регуляции чувства сытости, например, холецистокинин, также влияют на секрецию нейропептида Y. Таким опосредованным путём лептин выступает регулятором жировой массы, необходимой для роста и репродукции. Уровень лептина у больных ожирением может быть различным.
У 80% больных концентрация лептина в крови тучных людей больше в 4 раза, чем у людей с нормальной массой тела. В этих случаях имеется генетический дефект рецепторов лептина в гипоталамусе, поэтому, несмотря на продукцию лептина, центр голода в гипоталамусе продолжает секрецию нейропептида Y.
20% больных имеют изменения в первичной структуре лептина. К настоящему времени описаны 5 одиночных мутаций в гене лептина, которые приводят к развитию ожирения. У этих больных наблюдают повышение отложения жиров в жировой ткани, чрезмерное потребление пищи, низкую физическую активность и развитие сахарного диабета типа II. Патогенез ожирения при дефекте гена оb может быть следующим: низкий уровень лептина в крови служит сигналом недостаточного количества запаса жиров в организме; этот сигнал включает механизмы, приводящие к увеличению аппетита и в результате к увеличению массы тела.
Следовательно, можно сделать вывод о том, что первичное ожирение — не просто следствие переедания, а результат действия многих факторов, т. е. ожирение — полигенное заболевание.
Вторичное ожирение — ожирение, развивающееся в результате какого-либо основного заболевания, чаще всего эндокринного. Например, к развитию ожирения приводят гипотиреоз, синдром Иценко — Кушинга, гипогонадизм и многие другие заболевания (см. раздел 11).