БИОХИМИЯ УЧЕБНИК ДЛЯ ВУЗОВ - Е. С. Северина - 2004
РАЗДЕЛ 8. ОБМЕН ЛИПИДОВ
VI. Эйкозаноиды
Эйкозаноиды — биологически активные вещества, синтезируемые большинством клеток из полиеновых жирных кислот, содержащих 20 углеродных атомов (слово «эйкоза» погречески означает 20).
Эйкозаноиды, включающие в себя простагландины, тромбоксаны, лейкотриены и ряд других веществ, — высокоактивные регуляторы клеточных функций. Они имеют очень короткий Т1/2, поэтому оказывают эффекты как «гормоны местного действия», влияя на метаболизм продуцирующей их клетки по аутокринному механизму, и на окружающие клетки — по паракринному механизму. Эйкозаноиды участвуют во многих процессах: регулируют тонус ГМК и вследствие этого влияют на АД, состояние бронхов, кишечника, матки. Эйкозаноиды регулируют секрецию воды и натрия почками, влияют на образование тромбов. Разные типы эйкозаноидов участвуют в развитии воспалительного процесса, происходящего после повреждения тканей или инфекции. Такие признаки воспаления, как боль, отёк, лихорадка, в значительной мере обусловлены действием эйкозаноидов. Избыточная секреция эйкозаноидов приводит к ряду заболеваний, например, бронхиальной астме и аллергическим реакциям.
А. Субстраты для синтеза эйкозаноидов
Главный субстрат для синтеза эйкозаноидов у человека — арахидоновая кислота (20:4, ω-6), так как её содержание в организме человека значительно больше остальных полиеновых кислот-предшественников эйкозаноидов (см. выше табл. 8-1).
В меньшем количестве для синтеза эйкозаноидов используются эйкозапентаеновая (20:5, ω-3) и эйкозатриеновая (20:3, ω-6) жирные кислоты.
Полиеновые кислоты с 20 атомами углерода поступают в организм человека с пищей или образуются из незаменимых (эссенциальных) жирных кислот с 18 атомами углерода, также поступающими с пищей (рис. 8-44).
Рис. 8-44. Синтез полиеновых жирных кислот с 20 углеродными атомами в организме человека.
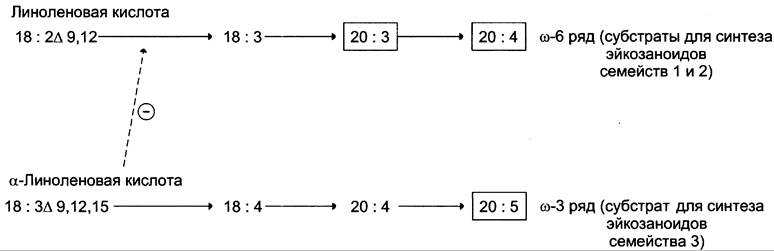
Полиеновые жирные кислоты, которые могут служить субстратами для синтеза эйкозаноидов, входят в состав глицерофосфолипидов мембран. Под действием ассоциированной с мембраной фосфолипазы А2 жирная кислота отщепляется от глицерофосфолипида и используется для синтеза эйкозаноидов.
Б. Структура, номенклатура и биосинтез простагландинов и тромбоксанов
Хотя субстраты для синтеза эйкозаноидов имеют довольно простую структуру (полиеновые жирные кислоты), из них образуется большая и разнообразная группа веществ. Наиболее распространены в организме человека простагландины, которые впервые были выделены из предстательной железы, откуда и получили свое название. Позже было показано, что и другие ткани организма синтезируют простагландины и другие эйкозаноиды.
1. Структура и номенклатура простагландинов и тромбоксанов
Простагландины (рис. 8-45) обозначают символами, например, РG А, где РG обозначает слово «простагландин», а буква А обозначает заместитель в пятичленном кольце в молекуле эйкозаноида.
Рис. 8-45. Семейства простагландинов.

Каждая из указанных групп простагландинов состоит из 3 типов молекул, отличающихся по числу двойных связей в боковых цепях. Число двойных связей обозначают нижним цифровым индексом, например, РG Е2.
Число двойных связей в боковых цепях простагландинов зависит от структуры предшественника — полиеновой кислоты, из которой образовались простагландины. Две двойные связи полиеновой кислоты используются при образовании кольца в молекуле простагландина, а количество оставшихся двойных связей в радикалах, связанных с кольцом, определяет серию простагландина: 1 — если одна двойная связь, 2 — если две двойные связи и 3 — если в радикалах имеются три двойных связи.
РG I — простациклины. Имеют 2 кольца в своей структуре: одно пятичленное, как и другие простагландины, а другое — с участием атома кислорода. Их также подразделяют в зависимости от количества двойных связей в радикалах (РG I2, РG I3).
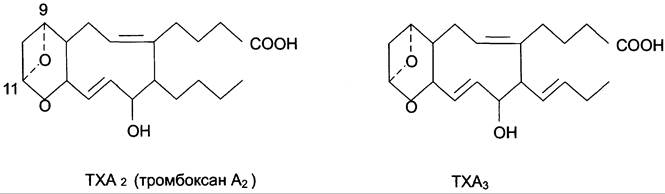
Тромбоксаны. В отличие от простагландинов, тромбоксаны синтезируются только в тромбоцитах, откуда и происходит их название, и стимулируют их агрегацию при образовании тромба.
Тромбоксаны имеют шестичленное кольцо, включающее атом кислорода (рис. 8-46). Так же, как и другие эйкозаноиды, тромбоксаны могут содержать различное число двойных связей в боковых цепях, образуя ТХ А2 или ТХ А3, отличающиеся по активности. ТХ В2 — продукт катаболизма ТХ A2 и активностью не обладает.
Рис. 8-46. Структура тромбоксанов. ТХ А2 синтезируется из арахидоновой кислоты; ТХ А3 синтезируется из эйкозапентаенозой кислоты.
2. Циклооксигеназный путь: синтез простагландинов и тромбоксанов
Активация фосфолипаз. Синтез простагландинов начинается только после отделения полиеновых кислот от фосфолипида мембраны под действием ферментов (рис. 8-47). Активация фосфолипаз, ассоциированных с мембранами, происходит под действием многих факторов: гормонов, гистамина, цитокинов, механического воздействия.
Рис. 8-47. Отделение арахидоновой кислоты от глицерофосфолипидов. МАГ — моноацилглицерол; ИФ3 — инозитолтрифосфат.

Связывание стимулирующего агента с рецептором может активировать или фосфолипазу A2 или фосфолипазу С. Это зависит от типа клетки и типа рецепторов.
После отделения арахидоновой кислоты от фосфолипида она выходит в цитозоль и в различных типах клеток превращается в разные эйкозаноиды. В клетках имеется 2 основных пути превращения арахидоновой кислоты: циклооксигеназный, приводящий к синтезу простагландинов, простациклинов и тромбоксанов, и липоксигеназный, заканчивающийся образованием лейкотриенов или других эйкозаноидов (рис. 8-48).
Рис. 8-48. Синтез эйкозаноидов из арахидоновой кислоты. Глюкокортикоиды ингибируют синтез всех типов эйкозаноидов, так как ингибируют фосфолипазу А2, и таким образом уменьшают количество субстрата для их синтеза. Аспирин и другие противовоспалительные препараты нестероидного действия ингибируют только циклооксигеназный путь.
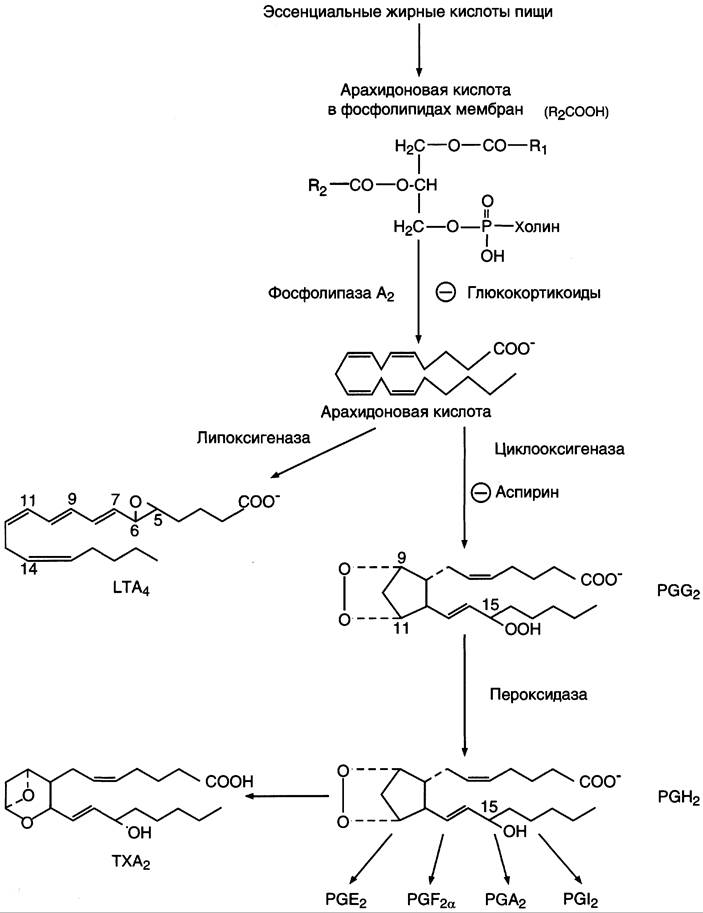
Синтез простагландинов. Фермент, катализирующий первый этап синтеза простагландинов, называется РG Н2 синтазой и имеет 2 каталитических центра. Один из них называют циклооксигеназой, другой — пероксидазой. Этот фермент представляет собой димер гликопротеинов, состоящий из идентичных полипептидных цепей. Фермент имеет гидрофобный домен, погружённый в липидный слой мембран ЭР, и каталитический домен, обращённый в полость ЭР. В активном центре циклооксигеназы находится тирозин (385), в активном центре пероксидазы — простетическая группа — гем. В организме имеются 2 типа циклооксигеназ (РG Н2 синтаз). Циклооксигеназа 1 — конститутивный фермент, синтезирующийся с постоянной скоростью. Синтез циклооксигеназы 2 увеличивается при воспалении и индуцируется соответствующими медиаторами — цитокинами.
Оба типа циклооксигеназ катализируют включение 4 атомов кислорода в арахидоновую кислоту и формирование пятичленного кольца. В результате образуется нестабильное гидропероксидпроизводное, называемое РG G2. Гидропероксид у 15-го атома углерода быстро восстанавливается до гидроксильной группы пероксидазой с образованием РGН2. До образования РG Н2 путь синтеза разных типов простагландинов одинаков. Дальнейшие превращения РG Н2 специфичны для каждого типа клеток.
Например, РG Н2 в клетках ГМК может быть восстановлен под действием РG Е синтазы с образованием РG Е2 или под действием РG D синтазы с образованием РG D2. В тромбоцитах содержится фермент тромбоксансинтаза, превращающий тот же исходный РG Н2 в ТХ A2 обладающий сильным сосудосуживающим действием. В клетках эндотелия под действием фермента простациклинсинтазы из РG Н2 синтезируется РG I2 (простациклин), имеющий сосудорасширяющее действие.
В. Структура и синтез лейкотриенов, ГЭТЕ, липоксинов
Лейкотриены также образуются из эйкозаноевых кислот, однако в их структуре отсутствуют циклы, как у простагландинов, и они имеют 3 сопряжённые двойные связи, хотя общее число двойных связей в молекуле больше (рис. 8-49). Лейкотриены С4, D4 и Е4 имеют заместители в виде трипептида глутатиона, дипептида глицил- цистеина или цистеина, соответственно.
Рис. 8-49. Липоксигеназный путь синтеза эйкозаноидов.
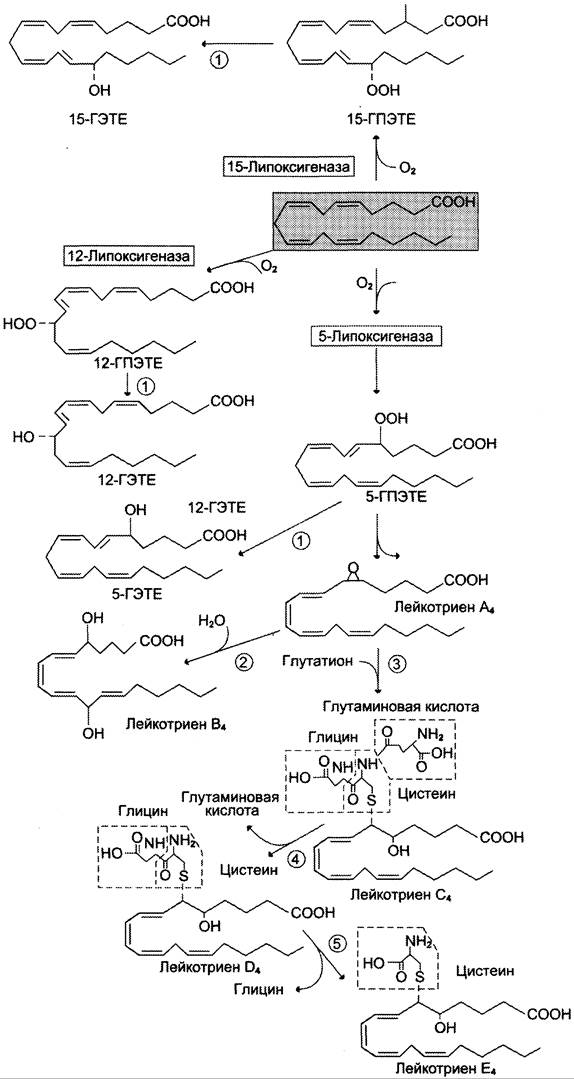
Липоксигеназный путь синтеза, приводящий к образованию большого количества разных эйкозаноидов, начинается с присоединения молекулы кислорода к одному из атомов углерода у двойной связи, с образованием гидропероксидов — гидропероксидэйкозатетраеноатов (ГПЭ- ТЕ). Далее гидропероксиды превращаются в соответствующие гидроксиэйкозатетроеноаты (ГЭТЕ).
Структура и синтез лейкотриенов и ГЭТЕ
Синтез лейкотриенов идёт по пути, отличному от пути синтеза простагландинов, и начинается с образования гидроксипероксидов — гидропероксидэйкозатетраеноатов (ГПЭТЕ). Эти вещества или восстанавливаются с образованием гидроксиэйкозатетроеноатов (ГЭТЕ) или превращаются в лейкотриены или липок- сины. ГЭТЕ отличаются по положению гидроксильной группы у 5-го, 12-го или 15-го атома углерода, например, 5-ГЭТЕ, 12-ГЭТЕ.
Липоксигеназы действуют в 5-й, 12-й или 15-й позиции арахидоновой кислоты в зависимости от типа ткани. Например, в ПЯЛ содержится в основном 5-липоксигеназа, в тромбоцитах — 12-липоксигеназа, в эозинофилах — 15-липоксигеназа.
В лейкоцитах и тучных клетках 5-ГПЭТЕ превращается в эпоксид-лейкотриен А4 (LТА4), где нижний индекс 4 обозначает общее количество двойных связей. Наличие 3 сопряжённых двойных связей обусловливает название «лейкотриен».
Другие типы лейкотриенов образуются из LТ А4, LТ В4 образуется под действием эпоксидгидролазы в лейкоцитах и клетках эпителия сосудов. Другой путь приводит к образованию группы лейкотриенов: LТ С4, LТ D4, LТ Е4. Их синтез начинается с присоединения трипепти- да глутатиона к 6-му атому углерода с образованием LТ С4 в реакции, катализируемой глутатион-S-трансферазой. В следующей реакции удаляется глутамат, и LТ D4 содержит дипептид глицилцистеин. На последней стадии отщепляется глицин, и LТ Е4 содержит только цистеин.
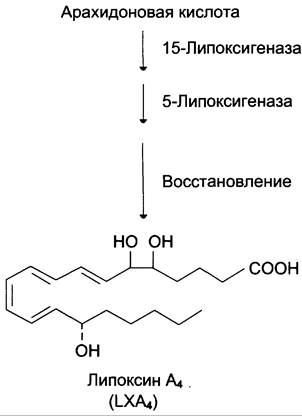
Липоксины (например, основной липоксин А4) включают 4 сопряжённых двойных связи и 3 гидроксильных группы.
Синтез липоксинов начинается с действия на арахидоновую кислоту 15-липоксигеназы, затем происходит ряд реакций, приводящих к образованию липоксина А4 (рис. 8-50).
Рис. 8-50. Строение и синтез липоксина А4.
Г. Механизмы действия эйкозаноидов, основные биологические эффекты
Эйкозаноиды — гормоны местного действия по ряду признаков:
✵ образуются в различных тканях и органах, а не только в эндокринных железах;
✵ действуют по аутокринному или паракринному механизмам;
✵ концентрация эйкозаноидов в крови меньше, чем необходимо, чтобы вызвать ответ в клетках-мишенях.
Только при некоторых патологических состояниях эйкозаноиды могут оказывать системное действие, если их концентрация в крови увеличивается до количеств, когда они могут оказать действие на ГМК всего органа, например, кишечника, лёгких, кровеносных сосудов.
Механизмы действия эйкозаноидов
Один и тот же тип эйкозаноида может действовать по паракринному и по аутокринному механизму. Например, ТХ A2, продуцируемый тромбоцитами при их активации, действует на сами тромбоциты, увеличивая их способность к агрегации, и в то же время действует на окружающие ГМК кровеносных сосудов, способствуя их сокращению. Таким образом создаются условия для образования тромба и предотвращения кровотечения в области повреждения сосудов.
Эйкозаноиды действуют на клетки через специальные рецепторы. Некоторые рецепторы эйкозаноидов связаны с аденилатциклазной системой и протеинкиназой А — это рецепторы РGЕ, РG D, РС I. РG F2α, ТХ A2, эндоперекиси (ГПЭТЕ) и лейкотриены действуют через механизмы, увеличивающие уровень кальция в цитозоле клеток-мишеней. Во многих клетках эйкозаноиды влияют на степень активации аденилатциклазной системы в ответ на действие других факторов, например, гормонов. В этих случаях эйкозаноиды влияют на конформацию G- белков в плазматической мембране клеток. Если эйкозаноид связывается со стимулирующими Gs- белками, то эффект основного стимулирующего агента увеличивается; если с Gi-ингибирующими — эффект снижается. Эйкозаноиды действуют на клетки почти всех тканей организма. Избыточная продукция эйкозаноидов наблюдается при многих заболеваниях.
Роль эйкозаноидов в развитии воспаления
Воспаление — реакция организма на повреждение или инфекцию, направленная на уничтожение инфекционного агента и восстановление повреждённых тканей. Продукция медиаторов воспаления — эйкозаноидов, гистамина, кининов (пептидных гормонов местного действия) — активируется каскадами реакций, запускающимися при внедрении инфекционных агентов или повреждении тканей. Фактором, лимитирующим скорость синтеза эйкозаноидов, служит освобождение жирной кислоты под действием фосфолипазы Фосфолипаза А2 связана с мембранами клеток и активируется многими факторами: гистамином, кининами, механическим воздействием на клетку, контактом комплекса антиген-антитело с поверхностью клетки. Активация фосфолипазы А2 приводит к увеличению синтеза эйкозаноидов.
Многие эйкозаноиды выполняют функцию медиаторов воспаления и действуют на всех этапах воспаления. В результате увеличивается проницаемость капилляров, транссудат и лейкоциты проходят через сосудистую стенку. Лейкотриен В4 и липоксин А4 являются мощными факторами хемотаксиса; взаимодействуя с рецепторами, стимулируют движение лейкоцитов в область воспаления и секрецию ими лизосомальных ферментов и фагоцитоз чужеродных частиц.
Симптомы воспаления — покраснение, жар, отёк и боль. Покраснение и жар вызываются факторами, увеличивающими приток крови к месту повреждения. Отёк — результат увеличения притока жидкости из капилляров и движения клеток белой крови в область воспаления. Боль вызывается химическими компонентами (продуктами распада тканей, протонами) и сдавлением нервных окончаний. В развитии этих признаков воспаления участвуют разные типы эйкозаноидов (табл. 8-8).
Таблица 8-8. Характеристика биологического действия основных типов эйкозаноидов
Эйкозаноид |
Основное место синтеза |
Основное биологическое действие |
РG E2 |
Большинство тканей, особенно почки |
Расслабляет гладкую мускулатуру, расширяет сосуды, инициирует родовую активность, подавляет миграцию лимфоцитов, пролиферацию Т-клеток. |
РG F2α |
Большинство тканей |
Сокращает гладкую мускулатуру, суживает сосуды, бронхи, стимулирует сокращения матки. |
РG D3 |
Клетки гладкой мускулатуры |
Вызывает расширение сосудов, снижает агрегацию тромбоцитов и лейкоцитов. |
РG I2 |
Сердце, клетки эндотелия сосудов |
Уменьшает агрегацию тромбоцитов, расширяет сосуды. В клетках-мишенях увеличивает образование цАМФ. |
TX A2 |
Тромбоциты |
Стимулирует агрегацию тромбоцитов, суживает сосуды и бронхи, в клетках уменьшает образование цАМФ. |
ТХ Аз |
Тромбоциты |
Обладает функциями, одинаковыми с ТХ А2, но значительно менее эффективен. |
LТ В4 |
Клетки белой крови, клетки эпителия |
Стимулирует хемотаксис и агрегацию лейкоцитов, освобождение лизосомальных ферментов лейкоцитов. Увеличивает проницаемость сосудов. |
Группа лейкотриенов |
Клетки белой крови, альвеолярные |
Стимулируют расширение сосудов, увеличивают их проницаемость. Вызывают сокращение бронхов. |
LT C4 —> LT D4 —> LT E4 —> |
макрофаги |
Основные компоненты «медленно реагирующей субстанции» анафилаксии. |
LX A4 |
Лейкоциты |
Активирует хемотаксис и стимулирует образование супероксид аниона в лейкоцитах. |
Роль эйкозаноидов в тромбообразовании
Свёртывание крови можно рассматривать как процесс, который поддерживается в состоянии равновесия противодействующими системами: свёртывания и противосвёртывания. В условиях патологии или при действии фармакологических средств это равновесие может смещаться в ту или другую сторону. В норме клетки эндотелия сосудов продуцируют простациклин I2, который препятствует агрегации тромбоцитов и сужению сосудов (рис. 8-51). При разрушении клеток эндотелия (например, в результате образования атеросклеротической бляшки) синтез РG I2 снижается. Тромбоциты контактируют с повреждённой стенкой сосуда, в результате чего активируется фосфолипаза А2. Это приводит к увеличению секреции ТХ А2, стимулирующего агрегацию тромбоцитов и образование тромба в области повреждения сосуда (рис. 8-52), что часто приводит к развитию инфаркта.
Рис. 8-51. Роль простациклинов в регуляции тонуса клеток гладкой мускулатуры стенок сосудов и агрегации тромбоцитов. В норме клетки эндотелия продуцируют РG I2, который вызывает релаксацию ГМК и ингибирует агрегацию тромбоцитов. Тромбоциты в неактивном состоянии не продуцируют тромбоксаны. NO (оксид азота) — вазодилататор.

Рис. 8-52. Нарушение синтеза эйкозаноидов в области повреждения эндотелия. В области повреждения стенки сосуда преобладает действие ТХ А2, стимулирующего агрегацию тромбоцитов и сокращение стенок сосуда. В результате на повреждённом участке образуется тромб, происходит резкое сужение просвета сосуда. В миокарде это может привести к развитию инфаркта миокарда.

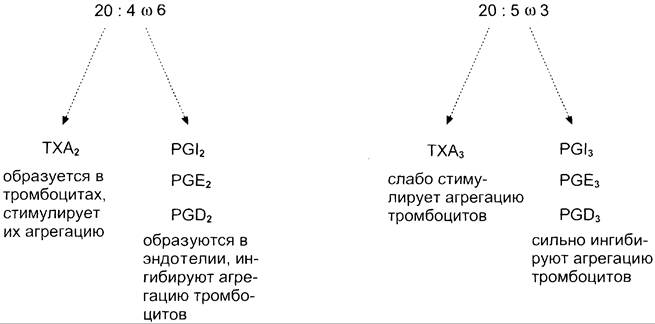
При изучении факторов риска инфаркта миокарда было показано, что люди, потребляющие большое количество рыбьего жира, значительно меньше подвержены этому заболеванию, так как у них реже образуются тромбы в сосудах сердца. Оказалось, что на семейства эйкозаноидов, синтезируемых в организме, влияет состав жирных кислот пищи (см. выше табл. 8- 3). Если с пищей поступает больше эйкозапентаеновой кислоты (20:5, ω-3), в большом количестве содержащейся в рыбьем жире, то эта кислота включается преимущественно в фосфолипиды мембран (вместо арахидоновой) и пос
ле действия фосфолипазы А2 служит основным субстратом для синтеза эйкозаноидов. Это имеет существенное влияние на свёртывание крови.
При обычной диете с преобладанием арахидоновой кислоты (20:4, ω-6) над эйкозапентаеновой действие ТХ А2 уравновешено действием РG I2 (рис. 8-53) и другими простагландинами. В случае диеты с преобладанием ω-3 кислот в клетках эндотелия образуются более сильные ингибиторы тромбообразован ия (РG I3, РG Е3, РG D3), что снижает риск образования тромба и развития инфаркта миокарда.
Рис. 8-53. Синтез тромбоксанов и простагландинов из арахидоновой и эйкозапентаеновой кислот.
Инактивация эйкозаноидов
Все типы эйкозаноидов быстро инактивируются. Т1/2 эйкозаноидов составляет от нескольких секунд до нескольких минут. Простагландины инактивируются путём окисления гидроксильной группы в положении 15, важнейшей для их активности, до кетогруппы. Двойная связь в положении 13 восстанавливается. Затем происходит β-окисление боковой цепи, а после него — ω-окисление. Конечные продукты (дикарбоновые кислоты) выделяются с мочой. Активный ТХ А2
быстро превращается в биологически неактивный ТХ В2 путём разрыва кислородного мостика между 9-м и 11-м атомами углерода с образованием гидроксильных групп.
Д. Лекарственные препараты — ингибиторы синтеза эйкозаноидов
Механизм действия аспирина и других противовоспалительных препаратов нестероидного действия
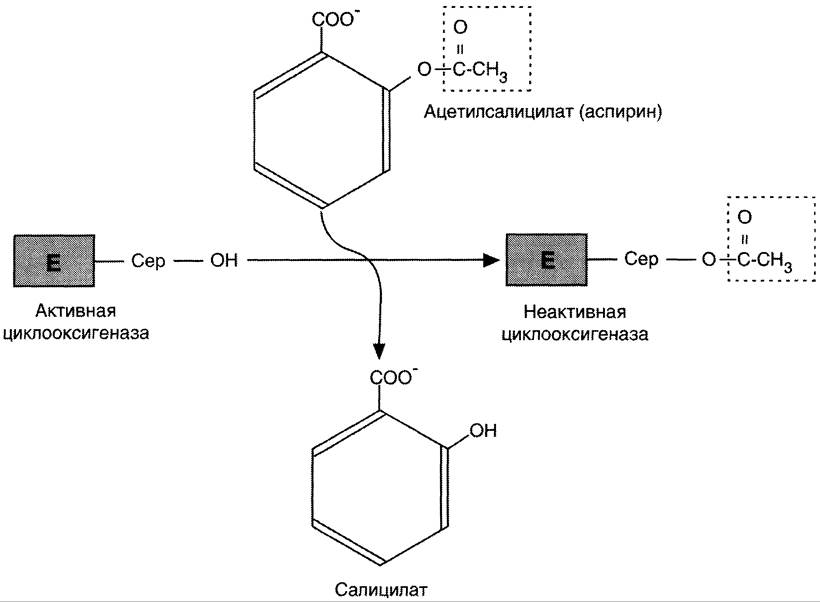
Аспирин — препарат, подавляющий основные признаки воспаления. Механизм противовоспалительного действия аспирина стал понятен, когда обнаружили, что он ингибирует циклооксигеназу. Следовательно, он уменьшает синтез медиаторов воспаления и, таким образом, уменьшает воспалительную реакцию. Циклооксигеназа необратимо ингибируется путём ацетилирования серина в положении 530 в активном центре (рис. 8-54). Однако эффект действия аспирина не очень продолжителен, так как экспрессия гена этого фермента не нарушается и продуцируются новые молекулы фермента. Другие нестероидные противовоспалительные препараты (например, ибупрофен и ацетаминофен) действуют по конкурентному механизму, связываясь в активном центре фермента, и также снижают синтез простагландинов.
Рис. 8-54. Механизм инактивации циклооксигеназы аспирином. Ацетильный остаток переносится с молекулы аспирина на ОН-группу фермента и необратимо ингибирует его.
Механизм действия стероидных противоспалительных препаратов на синтез эйкозаноидов
Стероидные препараты обладают гораздо более сильным противовоспалительным действием, чем препараты нестероидного ряда. Механизм их действия заключается в индукции синтеза белков — липокортинов (или макрокортинов), которые ингибируют активность фосфолипазы А2 и уменьшают синтез всех типов эйкозаноидов, так как препятствуют освобождению субстрата для синтеза эйкозаноидов — арахидоновой кислоты (или её аналога).
Использование стероидных противовоспалительных препаратов особенно важно для больных, страдающих бронхиальной астмой. Развитие симптомов этого заболевания (бронхоспазм и экссудация слизи в просвет бронхов) обусловлено, в частности, избыточной продукцией лейкотриенов тучными клетками, лейкоцитами и клетками эпителия бронхов. Приём аспирина у больных, имеющих изоформу липоксигеназы с высокой активностью, может вызвать приступ бронхиальной астмы. Причина «аспириновой» бронхиальной астмы заключается в том, что аспирин и другие нестероидные противовоспалительные препараты ингибируют только циклооксигеназный путь превращений арахидоновой кислоты и, таким образом, увеличивают доступность субстрата для действия липоксигеназы и, соответственно, синтеза лейкотриенов. Стероидные препараты ингибируют использование арахидоновой кислоты и по липоксигеназному и по циклооксигеназному пути, поэтому они не могут вызывать бронхоспазма.
Использование производных эйкозаноидов в качестве лекарств
Хотя действие всех типов эйкозаноидов до конца не изучено, имеются примеры успешного использования лекарств — аналогов эйкозаноидов для лечения различных заболеваний. Например, аналоги PG Е1 и PG Е2 подавляют секрецию соляной кислоты в желудке, блокируя гистаминовые рецепторы II типа в клетках слизистой оболочки желудка. Эти лекарства, известные как Н2-блокаторы, ускоряют заживление язв желудка и двенадцатиперстной кишки. Способность PG Е2 и PG F2α стимулировать сокращение мускулатуры матки используют для стимуляции родовой деятельности.